修回日期: 2013-10-29
接受日期: 2013-12-05
在线出版日期: 2014-01-28
目的: 探讨肥大细胞及蛋白酶激活受体-2(protease activated receptor-2, PAR-2)在肠易激综合征(irritable bowel syndrome, IBS)中的作用.
方法: 2012-01/2012-12自南京医科大学附属南京医院消化内科门诊随机选取腹泻型IBS患者60例及正常者30例, 采用免疫组织化学检测各组肥大细胞、PAR-2蛋白的表达强度; 采用Western blot检测各组Occludin的表达量.
结果: 免疫组织化学法结果显示IBS-D组与对照组相比, 肥大细胞表达明显增多(5.20±2.78 vs 1.40±0.55, P<0.05); PAR-2蛋白的表达明显增多(3.20±1.64 vs 1.20±0.45, P<0.05); Western blot结果示IBS-D组Occludin蛋白的表达明显低于正常组(2108.33±59.58 vs 3113.00±77.74, P<0.01).
结论: 本研究提示IBS-D患者肥大细胞过表达、激活后可刺激PAR-2活化, 从而进一步损伤细胞间紧密连接.
核心提示: 本研究提示腹泻型肠易激综合征(diarrhea-predominant irritable bowel syndrome, IBS-D)患者肥大细胞过表达、激活后可刺激蛋白酶激活受体-2(protease activated receptor-2, PAR-2)活化, 通过PAR-2进一步损伤细胞间紧密连接.
引文著录: 王军洁, 姜宗丹, 张振玉, 汪志兵, 王劲松, 黄文斌. 肥大细胞及蛋白酶激活受体-2在肠易激综合征中的作用. 世界华人消化杂志 2014; 22(3): 327-332
Revised: October 29, 2013
Accepted: December 5, 2013
Published online: January 28, 2014
AIM: To investigate the role of mast cells and protease activated receptor-2 (PAR-2) in irritable bowel syndrome (IBS).
METHODS: A total of 90 subjects were divided into a diarrhea-predominant irritable bowel syndrome (IBS-D) group (n = 60) and a normal control group (n = 30), all of them were selected from digestive outpatient department of Nanjing Hospital Affiliated to Nanjing Medical University from January 2012 to December 2012. The expression of mast cells and PAR-2 was detected by immunohistochemistry, and the expression of Occludin was detected by Western blot.
RESULTS: Immunohistochemistry analysis showed that compared with the normal control group, the expression of both mast cells and PAR-2 was significantly higher in the IBS-D group (5.20 ± 2.78 vs 1.40 ± 0.55, P < 0.05; 3.20 ± 1.64 vs 1.20 ± 0.45, P < 0.05). Western blot analysis indicated that the expression of Occludin decreased significantly in the IBS-D group compared with the normal control group (2108.33 ± 59.58 vs 3113.00 ± 77.74, P < 0.01).
CONCLUSION: Our study suggests that in IBS-D subjects, overexpressed and activated mast cells may stimulate PAR-2 and lead to the damage of intercellular tight junctions.
- Citation: Wang JJ, Jiang ZD, Zhang ZY, Wang ZB, Wang JS, Huang WB. Role of mast cells and protease activated receptor-2 in irritable bowel syndrome. Shijie Huaren Xiaohua Zazhi 2014; 22(3): 327-332
- URL: https://www.wjgnet.com/1009-3079/full/v22/i3/327.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i3.327
肠易激综合征(irritable bowel syndrome, IBS)是一种没有器质性疾病或生化异常可以解释的腹部不适或疼痛同时伴有排便紊乱[1], 其发病机制被认为与内脏感觉过敏和胃肠动力异常有关, 肥大细胞(mast cell, MC)可能在其中起一定的作用. 肠道内肥大细胞数量、活化增多, 分泌类胰蛋白酶等活性介质, 进而活化蛋白酶激活受体-2(protease activated receptor-2, PAR-2), PAR-2的激活可能引起细胞上皮细胞的紧密连接的骨架组织的重排, 可以导致肠道屏障的改变, 肠道黏膜的渗透性增加, 增加了液体甚至是微生物跨越肠黏膜的通道[2,3].
紧密连接蛋白(tight junction, TJ)是细胞间连接的一个重要形式, 是构成黏膜机械屏障最重要的结构, 由Claudin蛋白、Occludin蛋白、JAM、ZOs等结构蛋白及各类连接蛋白分子共同组成[4-6], Occludin是最先分离出来的TJ跨膜蛋白[7], 免疫电镜显示Occludin定位在TJ上[8-10], Occludin蛋白是TJ中最重要的结构蛋白, 他不仅能通过外环以拉链式结合进而产生严密的细胞旁封闭, 还能与不同的分子结合, 参与TJ形成的信号调节[11,12], Occludin形成紧密连接蛋白的基本结构, Occludin的功能广泛, 涉及细胞间黏附、移动、调节细胞通透性及细胞表型的改变[13]. 在低氧、炎性因子刺激等病理情况下可引起Occludin等分布异常、表达减少甚至融解, 导致TJ结构和功能的异常, 细胞间隙增宽, 进而使内皮层通透性升高[14].
本研究分析腹泻型肠易激综合征(diarrhea-predominant irritable bowel syndrome, IBS-D)患者的升结肠黏膜中MC、PAR2蛋白及Occludin蛋白表达的变化, 探讨MC、PAR2、Occludin与IBS-D关系, 为研究IBS-D的发病机制和临床治疗提供理论依据.
2012-01/2012-12自南京医科大学附属南京医院消化科门诊经排除炎症性肠病、结直肠肿瘤、先天性巨结肠、糖尿病以及甲亢等疾病. 诊断参照新近颁布的罗马Ⅲ诊断标准[15]. 选取腹泻型IBS患者60例, 男26例, 女34例, 年龄21-71岁(平均年龄49.7岁±3.1岁). 正常对照组30例, 为体检者, 男19例, 女11例, 年龄32-58岁(平均年龄47.5岁±2.8岁). 无消化系和神经系统症状和体征, 无免疫疾病史、感染病史, 无近期服药史. 两组性别、年龄构成比差异无显著性(P>0.05). PENTAX电子肠镜、JEM-1011型透射电子显微镜为日本JEOL公司产品, 由南京医科大学电镜室提供. 肥大细胞抗体、Occludin抗体、PAR2抗体均购自cell signal公司.
1.2.1 肠镜检查及标本制备: 所有研究对象均签署知情同意书并通过院内伦理委员会批准后, 肠镜检查研究对象并活检钳取肠道黏膜标本, 分别于回盲部和距肛门20-25 cm乙状结肠部位各取两块标本固定后制成石蜡切片. 4 μm连续切片, 进行免疫组织化学SP法染色(操作严格按试剂盒说明书进行).
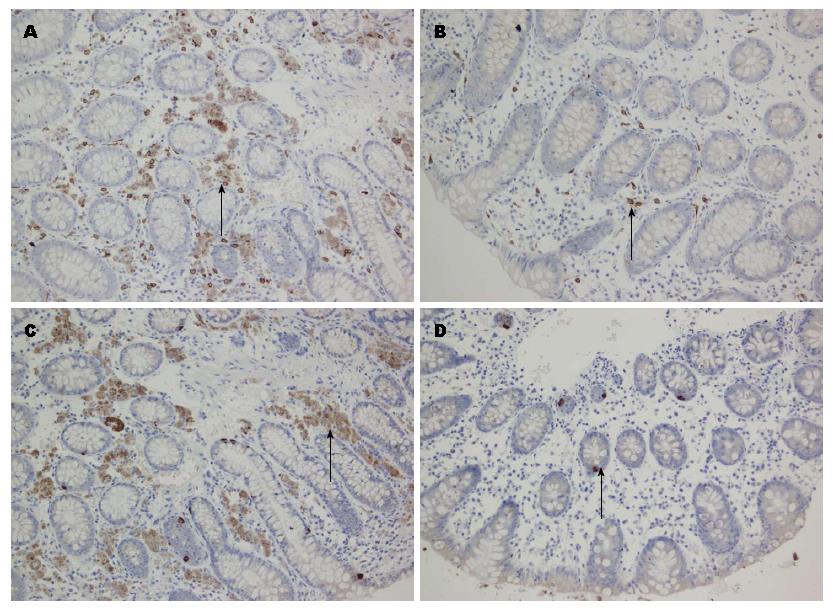
1.2.2 结果判定: 肥大细胞计数: 类胰蛋白酶是活化的MC释放的介质之一, 具有胰蛋白酶样活性, 在MC介导的多种反应中起重要作用, 常被作为MC活化的标志物[16]. 类胰蛋白酶阳性MC呈棕褐色. 于光学显微镜下(×200)选取阳性细胞密度最高的5个视野进行计数, 取均值. PAR-2蛋白、主要定位于细胞膜及细胞质, 分别选取5个视野对各实验组及对照组染色阳性细胞进行计数及统计学分析, 染色强度标准1: 按照胞膜及胞质染色着色深浅计分, 无色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分, 深褐色为4分. 标准2: 按照阳性细胞率计分, 阴性为0分, 0%-10%为1分, 11%-50%为2分, >50%为3分. 表达强度 = 标准1×标准2.
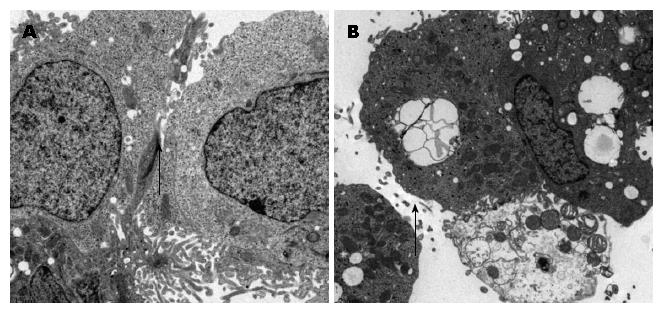
1.2.3 透射电镜观察细胞超微结构: 取肠黏膜组织标本置于2.5%戊二醛、pH7.4的固定液中(二甲砷酸钠缓冲液配制), 室温固定1 h后, 4 ℃保存. 经0.1 mmol/L的二甲砷酸钠缓冲液冲洗后, 用1%锇酸(osmium tetroxide, OSO4)固定2 h, 常规方法脱水, 定向包埋. 60-80 μm超薄切片经铀铅双染色后, 在JEM-1011透射电镜下观察.
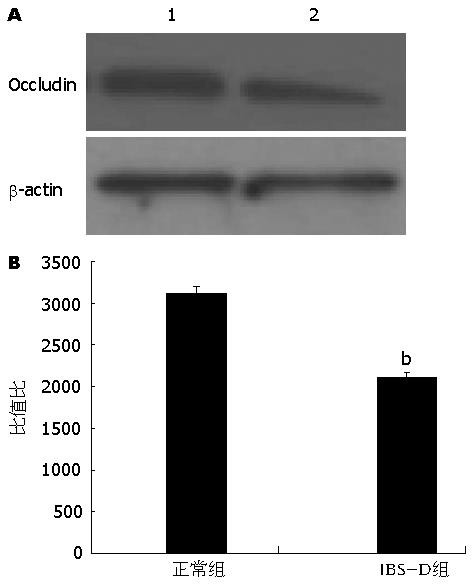
1.2.4 Western blot检测: 将标本组织研磨后加入蛋白裂解液, 4 ℃裂解, 12000 r/min离心5 min, 取上清为全蛋白提取物, BCA法进行蛋白浓度测定. 与蛋白上样缓冲液混合后, 煮沸5 min, 分装保存于-80 ℃冰箱. 进行SDS-PAGE凝胶电泳、转膜、用5%脱脂牛奶封闭1 h后, 分别加入一抗, 4 ℃过夜. TBST洗4次后加入辣根过氧化物酶标记的二抗, 室温作用2 h, 再次用TBST洗膜, 后使用ECL法显色, GIS凝胶图像分析系统照相并分析处理. 上述反应以β-actin作为内参照, 结果用AlphalmagerTM 2200图像分析系统对胶片扫描并进行平均密度值(average density values, ADV)测定, 以Occludin/ADV β-actin的比值作为各组产物相对吸光度值.
统计学处理 采用SPSS11.5软件进行分析. 计量资料采用t检验. 数据以mean±SD表示, P<0.05为差异有统计学意义.
肠黏膜上皮类胰蛋白酶免疫反应产物主要定位于MC胞质中, 少数MC胞质、胞核均着色. 分别选取5个视野对实验组及对照组中肥大细胞表达强度及统计学分析. PAR-2蛋白阳性染色表达定位于细胞膜及细胞质, 分别选取5个视野对实验组及对照组中PAR-2表达强度及统计学分析, 结果如表1及图1.
对照组可见细胞完好, 胞质丰富, 绒毛较多, 胞膜完整, 未见到细胞连接, 胞质内线粒体、溶酶体结构清晰, 胞核呈圆形, 染色质以异染色质为主, 核圆形或不规整, 核仁明显, 核膜结构完好(图2A). IBS-D组可见细胞明显受损, 胞质内细胞器空泡化明显, 部份胞质水肿, 绒毛脱落或有缺失, 内质网扩张, 细胞器有变性, 可见髓鞘样小体, 细胞间隙有增宽现象(图2B).
IBS-D组与正常对照组比较, Occludin蛋白减少明显, 差异有统计学意义(P<0.01)(图3).
肠易激综合征(irritable bowel syndrome, IBS)的病因和发病机制迄今还不完全清楚. 目前有文献认为IBS-D患者结肠黏膜存在低度炎症[17], 各种原因如遗传因素[18]、感染[19]、食物过敏[20]、肠道菌群紊乱[21]等均导致肠易激综合征, 黏膜组织内存在免疫细胞活化, 包括淋巴细胞、MC等, 特别是感染后IBS患者中MC增多表现更明显[22,23]. 肠道中的MC是既具有免疫活性, 又能分泌多种介质的重要的免疫细胞. MC位于黏膜血管、淋巴和神经附近, 是肠道主要的抗原感受器, 参与肠黏膜的免疫调节. 当某种抗原刺激机体免疫系统, 可引起感觉神经末梢兴奋以及信号传递, 并诱导机体产生IgE抗体, 抗原和抗体结合可引起MC活化、脱颗粒, 并释放多种生物活性介质如类胰蛋白酶、组胺、5-羟色胺等.
蛋白酶激活受体(protease activated receptors, PARs)属于与G蛋白相偶联, 有7个跨膜单位的受体家族, 目前发现的PARs家族成员共4个, 其中PAR-2为胰酶受体. PAR-2可被胰蛋白酶样蛋白水解酶剪切激活, 类胰蛋白酶是MC自分泌颗粒中的一种重要成分, 在MC被激活时释放出来, 肥大细胞分泌的类胰蛋白酶(tryptase)可激活PAR-2[24]. PAR-2激活后产生广泛促炎效应, 一方面, PAR-2的激活可以引起伤害感受神经元的过度兴奋, 释放兴奋性神经递质, 导致内脏敏感性的增加. 另一方面, PAR-2激活后可破坏结肠黏膜屏障的完整性, 肠黏膜对肠腔内细菌及各种蛋白酶通透性增加, 导致结肠炎症持续加重, 这种肠黏膜紧密连接的破坏依赖于肌球蛋白轻链激酶的活化[25]. 紧密连接蛋白主要位于细胞连接最顶端, 由多种紧密连接蛋白分子组成, 其中最重要的是跨膜蛋白Occludin. Occludin是最先分离出来的TJ跨膜蛋白, 免疫电镜显示Occludin定位在TJ上, 是TJ的主要功能蛋白, 对于屏障功能的维持和紧密连接的完整性具有重要作用.
何韶衡等[26,27]发现PAR-2激动剂可高效激活人结肠MC, 诱导其释放类胰蛋白酶和组胺, MC可通过其分泌的类胰蛋白酶激活自身或邻近 MC的PAR-2, 对脱颗粒信号进行自我放大, 从而放大炎症反应. Jacob等[28]的研究证实, 在应激和炎症状态下, MC释放的类胰蛋白酶可激活结肠细胞上的PAR-2, 从而增加细胞间隙通透性.
本研究结果显示: 免疫组织化学检测IBS-D组肥大细胞的表达明显高于正常组肥大细胞的表达, 且差异有统计学意义(P<0.05); 与Cenac等和Buhner等[29,30]的研究报道相似, 免疫组织化学检查显示IBS-D组PAR-2蛋白的表达明显高于正常组, 且差异有统计学意义(P<0.05). 透射电镜显示IBS-D组细胞间隙较正常组增宽. Western blot的结果显示IBS-D组Occludin蛋白的表达明显低于正常组, 且差异有统计学意义(P<0.05). 研究结果与研究思路一致.
故本研究提示IBS-D患者肥大细胞过表达、激活后可刺激PAR-2活化, 通过PAR-2进一步损伤细胞间紧密连接.
肠易激综合征是一种没有器质性疾病或生化异常可以解释的腹部不适或疼痛同时伴有排便紊乱, 其发病机制被认为与内脏感觉过敏和胃肠动力异常有关.
潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院干细胞与组织器官工程研究中心
肠易激综合征的发病机制尚未明确, 本研究重点关注腹泻型肠易激综合征的发病机制.
既往有研究发现蛋白酶激活受体-2(protease activated receptor-2, PAR-2)激动剂可高效激活人结肠肥大细胞(mast cell, MC), 诱导其释放类胰蛋白酶和组胺, MC可通过其分泌的类胰蛋白酶激活自身或邻近MC的PAR-2, 对脱颗粒信号进行自我放大, 从而放大炎症反应. 但他们都没有与肠易激综合征联系.
本文将肠易激综合征与MC的PAR-2及紧密连接蛋白想结合, 阐述肠易激综合征的发病机制.
本研究分析腹泻型肠易激综合征患者的升结肠黏膜中MC表达、PAR2蛋白及Occludin蛋白表达的变化, 探讨MC、PAR2、Occludin与IBS-D关系, 为研究IBS-D的发病机制和临床治疗提供理论依据.
本文将肠易激综合征与MC的PAR-2及紧密连接蛋白想结合, 简要阐述肠易激综合征的发病机制, 研究颇有新意.
编辑: 郭鹏 电编:鲁亚静
| 1. | Gulewitsch MD, Enck P, Schwille-Kiuntke J, Weimer K, Schlarb AA. Rome III criteria in parents' hands: pain-related functional gastrointestinal disorders in community children and associations with somatic complaints and mental health. Eur J Gastroenterol Hepatol. 2013;25:1223-1229. [PubMed] |
| 2. | Cenac N, Coelho AM, Nguyen C, Compton S, Andrade-Gordon P, MacNaughton WK, Wallace JL, Hollenberg MD, Bunnett NW, Garcia-Villar R. Induction of intestinal inflammation in mouse by activation of proteinase-activated receptor-2. Am J Pathol. 2002;161:1903-1915. [PubMed] [DOI] |
| 3. | Gecse K, Róka R, Ferrier L, Leveque M, Eutamene H, Cartier C, Ait-Belgnaoui A, Rosztóczy A, Izbéki F, Fioramonti J. Increased faecal serine protease activity in diarrhoeic IBS patients: a colonic lumenal factor impairing colonic permeability and sensitivity. Gut. 2008;57:591-599. [PubMed] [DOI] |
| 5. | Furuse M, Fujita K, Hiiragi T, Fujimoto K, Tsukita S. Claudin-1 and -2: novel integral membrane proteins localizing at tight junctions with no sequence similarity to occludin. J Cell Biol. 1998;141:1539-1550. [PubMed] [DOI] |
| 6. | Martìn-Padura I, Lostaglio S, Schneemann M, Williams L, Romano M, Fruscella P, Panzeri C, Stoppacciaro A, Ruco L, Villa A. Junctional adhesion molecule, a novel member of the immunoglobulin superfamily that distributes at intercellular junctions and modulates monocyte transmigration. J Cell Biol. 1998;142:117-127. [PubMed] [DOI] |
| 7. | Furuse M, Hirase T, Itoh M, Nagafuchi A, Yonemura S, Tsukita S, Tsukita S. Occludin: a novel integral membrane protein localizing at tight junctions. J Cell Biol. 1993;123:1777-1788. [PubMed] [DOI] |
| 8. | Hirase T, Staddon JM, Saitou M, Ando-Akatsuka Y, Itoh M, Furuse M, Fujimoto K, Tsukita S, Rubin LL. Occludin as a possible determinant of tight junction permeability in endothelial cells. J Cell Sci. 1997;110:1603-1613. [PubMed] |
| 9. | Saitou M, Ando-Akatsuka Y, Itoh M, Furuse M, Inazawa J, Fujimoto K, Tsukita S. Mammalian occludin in epithelial cells: its expression and subcellular distribution. Eur J Cell Biol. 1997;73:222-231. [PubMed] |
| 10. | Fujimoto K. Freeze-fracture replica electron microscopy combined with SDS digestion for cytochemical labeling of integral membrane proteins. Application to the immunogold labeling of intercellular junctional complexes. J Cell Sci. 1995;108:3443-3449. [PubMed] |
| 11. | Chen YH, Lu Q, Goodenough DA, Jeansonne B. Nonreceptor tyrosine kinase c-Yes interacts with occludin during tight junction formation in canine kidney epithelial cells. Mol Biol Cell. 2002;13:1227-1237. [PubMed] [DOI] |
| 12. | Nusrat A, Chen JA, Foley CS, Liang TW, Tom J, Cromwell M, Quan C, Mrsny RJ. The coiled-coil domain of occludin can act to organize structural and functional elements of the epithelial tight junction. J Biol Chem. 2000;275:29816-29822. [PubMed] [DOI] |
| 13. | 刘 理. 紧密连接的分子基础及其调控. 国外医学·生理病理科学与临床分册. 1999;19:75-78. |
| 14. | Berkes J, Viswanathan VK, Savkovic SD, Hecht G. Intestinal epithelial responses to enteric pathogens: effects on the tight junction barrier, ion transport, and inflammation. Gut. 2003;52:439-451. [PubMed] [DOI] |
| 15. | Longstreth GF, Thompson WG, Chey WD, Houghton LA, Mearin F, Spiller RC. Functional bowel disorders. Gastroenterology. 2006;130:1480-1491. [PubMed] [DOI] |
| 16. | Abraham WM. Tryptase: potential role in airway inflammation and remodeling. Am J Physiol Lung Cell Mol Physiol. 2002;282:L193-L196. [PubMed] |
| 17. | Chadwick VS, Chen W, Shu D, Paulus B, Bethwaite P, Tie A, Wilson I. Activation of the mucosal immune system in irritable bowel syndrome. Gastroenterology. 2002;122:1778-1783. [PubMed] [DOI] |
| 18. | Gonsalkorale WM, Perrey C, Pravica V, Whorwell PJ, Hutchinson IV. Interleukin 10 genotypes in irritable bowel syndrome: evidence for an inflammatory component? Gut. 2003;52:91-93. [PubMed] [DOI] |
| 19. | 鞠 辉, 张 小芳, 刘 希双, 魏 良洲. 感染后与非感染后肠易激综合征患者结肠黏膜SP与IL-2、IFN-γ表达的相关性. 世界华人消化杂志. 2006;14:3116-3120. [DOI] |
| 20. | Smout A, Azpiroz F, Coremans G, Dapoigny M, Collins S, Müller-Lissner S, Pace F, Stockbrügger R, Vatn M, Whorwell P. Potential pitfalls in the differential diagnosis of irritable bowel syndrome. Digestion. 2000;61:247-256. [PubMed] [DOI] |
| 21. | Barbara G, Corinaldesi R. Probiotics: could they turn out to be ineffective in irritable bowel syndrome? Dig Liver Dis. 2000;32:302-304. [PubMed] [DOI] |
| 22. | Bercik P, Verdu EF, Collins SM. Is irritable bowel syndrome a low-grade inflammatory bowel disease? Gastroenterol Clin North Am. 2005;34:235-245, vi-vii. [PubMed] [DOI] |
| 23. | Spiller RC. Inflammation as a basis for functional GI disorders. Best Pract Res Clin Gastroenterol. 2004;18:641-661. [PubMed] [DOI] |
| 25. | Cenac N, Garcia-Villar R, Ferrier L, Larauche M, Vergnolle N, Bunnett NW, Coelho AM, Fioramonti J, Bueno L. Proteinase-activated receptor-2-induced colonic inflammation in mice: possible involvement of afferent neurons, nitric oxide, and paracellular permeability. J Immunol. 2003;170:4296-4300. [PubMed] |
| 28. | Jacob C, Yang PC, Darmoul D, Amadesi S, Saito T, Cottrell GS, Coelho AM, Singh P, Grady EF, Perdue M. Mast cell tryptase controls paracellular permeability of the intestine. Role of protease-activated receptor 2 and beta-arrestins. J Biol Chem. 2005;280:31936-31948. [PubMed] [DOI] |
| 29. | Cenac N, Andrews CN, Holzhausen M, Chapman K, Cottrell G, Andrade-Gordon P, Steinhoff M, Barbara G, Beck P, Bunnett NW. Role for protease activity in visceral pain in irritable bowel syndrome. J Clin Invest. 2007;117:636-647. [PubMed] [DOI] |
| 30. | Buhner S, Li Q, Vignali S, Barbara G, De Giorgio R, Stanghellini V, Cremon C, Zeller F, Langer R, Daniel H. Activation of human enteric neurons by supernatants of colonic biopsy specimens from patients with irritable bowel syndrome. Gastroenterology. 2009;137:1425-1434. [PubMed] [DOI] |