修回日期: 2013-11-21
接受日期: 2013-12-05
在线出版日期: 2014-01-28
目的: 基于癌干细胞的耐药特性联合单细胞培养方法识别肝癌干细胞所在的克隆亚群.
方法: 以BEL-7404细胞系为研究对象, 裸鼠体内移植瘤形成实验, 并予阿霉素(adriamycin, ADM)8 mg/kg干预, 待肿瘤直径为1.5 cm时取移植瘤细胞做原代培养, 并在裸鼠体内连续传代4代, 并将第4代移植瘤细胞命名为"BEL-7404-ADM-P4", 根据成瘤时间检测肝癌干细胞富集情况. 联合单细胞培养, 取BEL-7404及BEL-7404-ADM-P4所形成的克隆根据克隆形态分为全克隆、部分克隆、旁克隆, 检测BEL-7404及BEL-7404-ADM-P4单克隆中全克隆、部分克隆、旁克隆的癌干特性, 即增殖能力、克隆形成率及悬浮球形成率; 取其全克隆、部分克隆、旁克隆做hoechst33342染色, 并在共聚焦显微镜下观察其染色情况; 根据BEL-7404及BEL-7404-ADM-P4单克隆中全克隆、部分克隆、旁克隆的增殖能力、克隆形成率及悬浮球形成率以及hoechst33342染色情况识别癌干细胞所在的克隆亚群.
结果: 裸鼠体内低剂量阿霉素干预, 在体内连续成瘤传代过程中, 裸鼠皮下移植瘤成瘤率均为100%, 且成瘤时间从第一代到第四代均有所缩短, 以此达到了肝癌干细胞的初步富集; 增殖能力: 全克隆增殖速度最快, 细胞量最大, 部分克隆次之, 旁克隆增殖速度最慢, 并于第10天开始出现细胞皱缩死亡; 克隆形成率: BEL-7404-ADM-P4-H高于BEL-7404及BEL-7404-ADM-P4-M, 差异有统计学意义(P<0.05); 悬浮球形成率: 仅BEL-7404-H及BEL-7404-ADM-P4-H可形成悬浮球, 其余细胞系不形成悬浮球, 而BEL-7404-H及BEL-7404-ADM-P4-H悬浮球形成率比较, 无统计学意义(P>0.05); BEL-7404及BEL-7404-ADM-P4单克隆中全克隆、部分克隆、旁克隆hoechst33342染色情况: BEL-7404及BEL-7404-ADM-P4单克隆中全克隆都有极少数不染和低染的细胞存在, 但部分克隆、旁克隆全染, 且BEL-7404单克隆中全克隆、部分克隆、旁克隆hoechst33342荧光强度均强于BEL-7404-ADM-P4单克隆中全克隆、部分克隆、旁克隆.
结论: 基于癌干细胞的耐药特性联合单细胞培养方法所形成的克隆亚群中, 全克隆含有更高比例的肝癌干细胞.
核心提示: 近几年, 研究者们通过单细胞克隆培养法分离癌干细胞, 研究者们认为全克隆细胞群富含癌干细胞, 本文首次将癌干细胞的耐药特性和单细胞克隆方法相结合, 以识别富含肝癌干细胞的克隆亚群, 以期为临床针对肝癌干细胞的治疗提供坚实的实验基础.
引文著录: 陈娟, 区泳芳, 蔡捷, 陶璐, 陈相宜, 邝晓聪. 基于耐药特性联合单细胞培养识别肝癌干细胞克隆亚群. 世界华人消化杂志 2014; 22(3): 319-326
Revised: November 21, 2013
Accepted: December 5, 2013
Published online: January 28, 2014
AIM: To identify liver cancer stem cells-containing cell subgroups based on resistance characteristics and unicellular culture.
METHODS: The BEL-7404 cell line was inoculated subcutaneously in nude mice to induce tumor formation, and adriamycin (8 mg/kg) intervention was given. When the tumor diameter was 1.5 cm, tumor tissues were collected for primary culture. The cells were inoculated subcutaneously in nude mice again. After four consecutive generations in nude mice, the tumor cells were named "BEL-7404-ADM-P4". Based on the tumor forming time, the enrichment of liver cancer stem cells was tested. Using unicellular culture, clones from BEL-7404 and BEL-7404-ADM-P4 cells were divided into holoclones, meroclones and pareclones to test the cancer stem cell characteristics (renewal ability, clone formation and sphere formation). Holoclones, meroclones and pareclones were stained with hoechst33342 and observed under a confocal microscope. Based on the renewal ability, clone formation rate and sphere formation rate and hoechst33342 staining properties, cancer stem cells subpopulations were identified.
RESULTS: The tumor formation rate was 100%, and tumor formation time was shortened from the first generation to the fourth generation, which suggested the preliminary enrichment of liver cancer stem cells. Holoclones showed the fastest growth and the largest cell volume, followed by meroclones and pareclones. On the 10th day, pareclones started to shrivel and die. The clone formation rate of BEL-7404-ADM-P4-H cells was significantly higher than those of BEL-7404 and BEL-7404-ADM-P4-M cells (P < 0.05). Only BEL-7404-H and BEL-7404-ADM-P4-H cells could form spheres, and there was no significant difference in sphere formation rate between BEL-7404-H and BEL-7404-ADM-P4-H cells. In BEL-7404 and BEL-7404-ADM-P4 monoclones and holoclones, there were a small number of lowly hoechst33342 stained or non-stained cells, but cells in meroclones and pareclone cells were all stained. The hoechst33342 fluorescence intensity of BEL-7404 holoclones, meroclones and pareclones was stronger than that of BEL-7404-ADM-P4 clones.
CONCLUSION: Based on resistance characteristics and unicellular culture, we found that holoclones contain a higher proportion of liver cancer stem cells.
- Citation: Chen J, Ou YF, Cai J, Tao L, Chen XY, Kuang XC. Identification of liver cancer stem cells-containing cell subgroups based on resistance characteristics and unicellular culture. Shijie Huaren Xiaohua Zazhi 2014; 22(3): 319-326
- URL: https://www.wjgnet.com/1009-3079/full/v22/i3/319.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i3.319
肝癌是世界上最常见恶性肿瘤之一, 我国肝癌死亡人数占世界肝癌总死亡人数的45%左右, 但目前肝癌发生的机制仍不十分明确[1]. 肝癌目前主要治疗手段是外科手术切除、辅以肝移植和化疗, 但所有治疗方式后有高复发率, 为了解释这种高复发率, 研究者们提出了癌干学说. 该学说认为, 肿瘤的发生、发展、转移以及复发依赖于肿瘤起始细胞, 这些细胞具有自我更新、无限增殖能力、高耐药性和肿瘤启蒙作用, 把这样的细胞称为癌干细胞(cancer stem cells, CSCs)[2,3]. CSCs理论在十年前被提出, 大量实验已对癌干细胞的存在提供了依据, 如乳腺癌[4]、前列腺癌[5]、胰腺癌[6]、卵巢癌[7]、肝细胞性肝癌[8]等. 大量实验已证实, CSCs在体外无血清干细胞培养条件下可形成悬浮球, 有限稀释条件下可形成单细胞克隆, 在非肥胖型糖尿病及重症联合免疫缺陷病(non-obese diabetic-severe combined immunodeficiency disease, NOD-SCID)体内低数量级便可形成皮下肿瘤及具有外排荧光染料hoechst33342的特性[9,10]. 近几年, 研究者们通过单细胞克隆培养法分离癌干细胞, 根据单细胞克隆形态可将克隆分为3种类型, 即全克隆(holoclone, H)、部分克隆(meroclone, M)和旁克隆(pareclone, P), 研究者们认为全克隆细胞群富含癌干细胞, 前列腺癌[11]、胶质瘤[12]、黑色素瘤[13]、胰腺癌[14]等的相关实验已证实全克隆富含癌干细胞. 因此, 从肝癌细胞中分离出肝癌干细胞(liver cancer stem cells, HCSCs), 是根治肝癌的前提. 本文以BEL-7404细胞系为研究对象, 以单细胞培养为手段, 以识别富含HCSCs的克隆亚群为目的进行了以下实验, 以期为临床针对肝癌干细胞的治疗提供坚实的实验基础.
人肝癌细胞系BEL-7404购自中山大学细胞库, 用含10%胎牛血清(加拿大WISENT公司)的RPMI 1640培养液(加拿大WISENT公司), 置于37 ℃、50 mL/L CO2培养箱中培养.
1.2.1 BEL-7404-ADM-P4细胞系的建立: 取对数生长期BEL-7404细胞调整细胞密度为5×107/mL, 800 r/min离心5 min, 弃掉上清, 用RPMI 1640培养基1 mL重悬, 用1 mL注射器吸取细胞悬液, 注射至10只裸鼠两侧腋窝皮下(0.2 mL/侧, 即每侧注射细胞数为1×106), 并予阿霉素(深圳万乐药业有限公司)8 mg/kg干预, 待肿瘤直径为1.5 cm时取移植瘤细胞做原代培养, 并在裸鼠体内连续传代4代, 并将第四代移植瘤细胞命名为"BEL-7404-ADM-P4", 并用含10%FBS的RPMI 1640培养液, 置于37 ℃、50 mL/L CO2培养箱中培养.
1.2.2 单细胞培养: 取对数生长期BEL-7404、BEL-7404-ADM-P4细胞, 胰酶消化, 胎牛血清终止消化后制作成单细胞悬液, 调整细胞浓度为1250个/mL; 取80 μL细胞悬液, 用含10%胎牛血清的RPMI 1640培养基稀释至10 mL, 按每孔100 μL接种入96孔板, 平均每孔1个细胞, 置于37 ℃、50 mL/L CO2培养箱中, 2 h观察并记录每孔含有1个细胞的孔, 并记录接种的细胞总数; 每天用倒置显微镜观察细胞生长情况, 记录细胞数量; 2 wk后观察单个细胞克隆形成情况, 根据单细胞克隆形态分类, 将克隆分为3类: H、M和P, 做好标记及记录; 计算克隆形成率: 克隆形成率 = 克隆总数/接种细胞数×100%.
1.2.3 BEL-7404、BEL-7404-ADM-P4单克隆细胞中H、M、P的连续传代培养: 根据形态分类, 取BEL-7404、BEL-7404-ADM-P4单克隆细胞中H、M、P, 胰酶消化成单个细胞, 胎牛血清终止消化, 移液器移入1.5 mL的eppendorf 管中, 离心2次, 加含10%胎牛血清的RPMI 1640培养基重悬, 调整细胞浓度为1250个/mL; 取80 μL细胞悬液, 用含10%胎牛血清的RPMI 1640培养基稀释至10 mL, 按每孔100 μL接种入96孔板, 平均每孔1个细胞, 置于37 ℃、50 mL/L CO2培养箱中, 2 h计数接种细胞数; 2 wk观察单个细胞克隆形成情况, 计算克隆形成率: 克隆形成率 = 克隆总数/接种细胞数×100%.
1.2.4 BEL-7404、BEL-7404-ADM-P4及其H、M、P的无血清悬浮球培养: 取对数生长期的BEL-7404、BEL-7404-ADM-P4及其H、M、P, 胰酶消化成单个细胞后, 用配制好mTeSRTM1人胚胎干细胞完全培养基重悬细胞, 2000 r/min离心2次, 调整细胞密度为2000个/mL, 接种于低黏附的96孔板, 200个细胞每孔, 每一种细胞设10个副孔, 2 h后记录每孔的接种细胞数. 每天观察细胞生长情况, 10 d后计算≥100个细胞的"球囊"数, 计算悬浮球形成率: 悬浮球形成率 = 球囊数/接种细胞数×100%.
1.2.5 BEL-7404、BEL-7404-ADM-P4单克隆细胞中H、M、P的hoechst33342[15]染色及共聚焦检测: 根据形态分类, 取种于96孔板的BEL-7404、BEL-7404-ADM-P4单克隆细胞中H、M、P, 弃原培养液, 用PBS液冲洗2遍, 重新添加含终浓度为5 μg/mL hoechst33342的RPMI 1640培养液100 μL, 置于37 ℃孵箱中避光孵育30 min; 吸去含hoechst33342的RPMI 1640培养液, 用PBS液清洗2遍, 重新加入含10%FBS的RPMI 1640培养液; 共聚焦荧光显微镜下观察BEL-7404、BEL-7404-ADM-P4单克隆细胞中H、M、P荧光特性.
统计学处理 克隆形成实验和悬浮球形成实验重复3次, 采用SPSS16统计分析软件, 率的比较, χ2检验. 数据资料采用mean±SD表示, P<0.05为差异有统计学意义.
在体内连续成瘤传代过程中, 裸鼠皮下移植瘤成瘤率均为100%, 且成瘤时间从第一代到第4代均有所缩短, BEL-7404-ADM-P4细胞系成功建立.
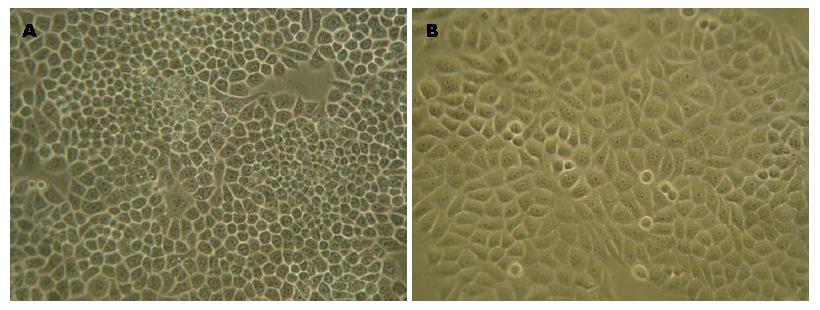
BEL-7404、BEL-7404-ADM-P4细胞系在倒置显微镜下观察, 细胞形态无明显差异, 均呈上皮样单层排列铺路石状贴壁生长, 细胞大小均等, 呈椭圆形或不规则形, 边界清晰, 增殖迅速(图1).
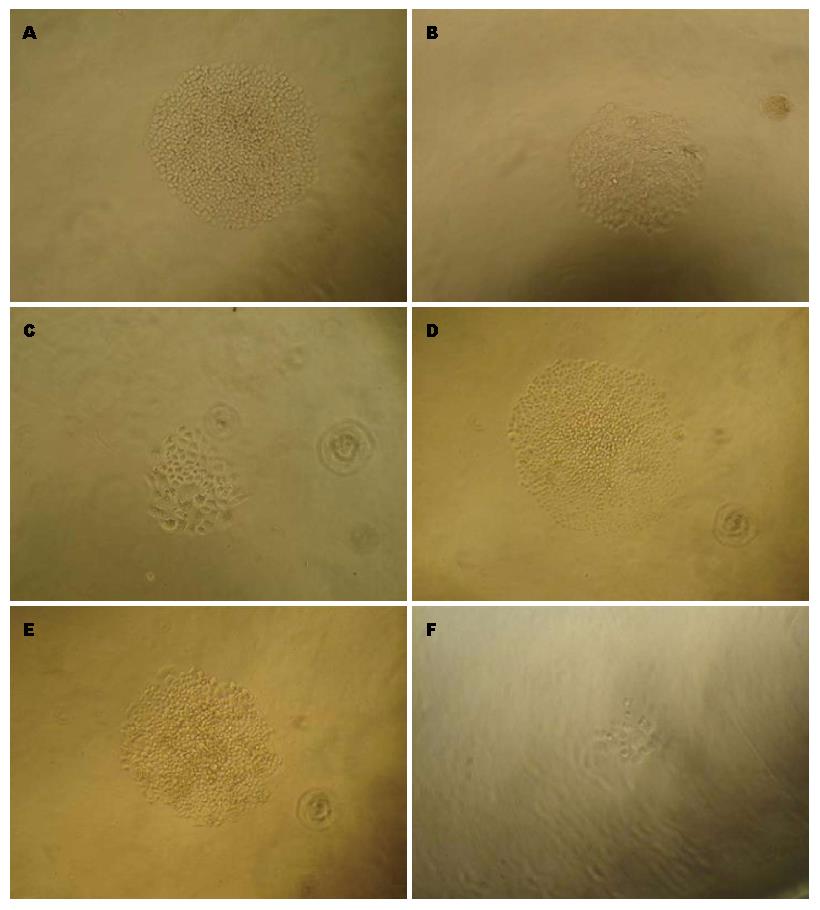
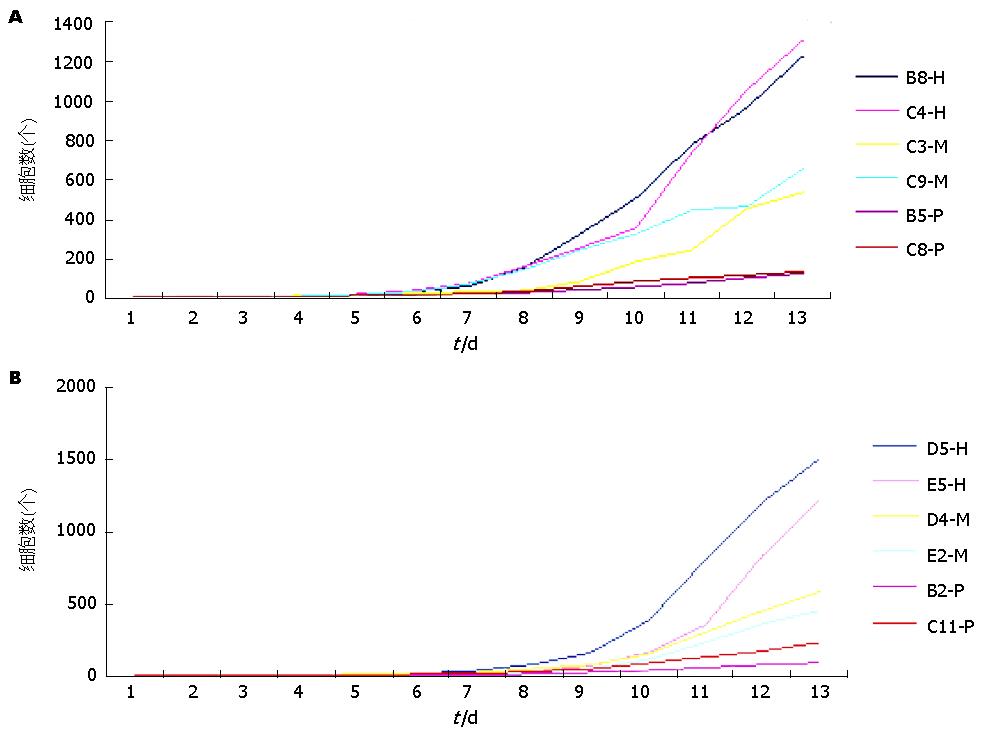
BEL-7404、BEL-7404-ADM-P4细胞系单细胞培养均可形成3种细胞形态, 即H、M、P(图2). 为了了解3种克隆形态细胞的增殖情况, 我们做了3种克隆细胞的生长曲线(图3). 从生长曲线可以看出, BEL-7404、BEL-7404-ADM-P4细胞系中, 从第6天开始, H增殖速度最快, 细胞量最大; M次之; P增殖速度最慢, 并于第10天开始出现细胞皱缩死亡; 且BEL-7404-ADM-P4-H细胞数大于BEL-7404-H.
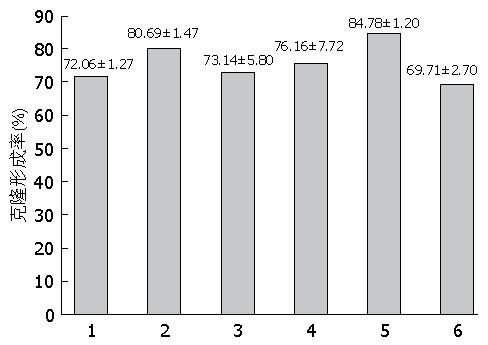
由表1可知, BEL-7404-ADM-P4-H的克隆形成率高于BEL-7404及BEL-7404-ADM-P4-M(P<0.05), 有统计学意义(表1, 图4).
| 对比组 | χ2值 | P值 |
| BEL-7404与BEL-7404-H | 2.253 | 0.133 |
| BEL-7404与BEL-7404-M | 0.025 | 0.874 |
| BEL-7404与BEL-7404-ADM-P4 | 0.416 | 0.519 |
| BEL-7404与BEL-7404-ADM-P4-H | 5.007 | 0.025 |
| BEL-7404与BEL-7404-ADM-P4-M | 0.097 | 0.755 |
| BEL-7404-H与BEL-7404-M | 1.807 | 0.179 |
| BEL-7404-H与BEL-7404-ADM-P4 | 0.741 | 0.389 |
| BEL-7404-H与BEL-7404-ADM-P4-H | 0.567 | 0.451 |
| BEL-7404-H与BEL-7404-ADM-P4-M | 3.271 | 0.071 |
| BEL-7404-M与BEL-7404-ADM-P4 | 0.237 | 0.626 |
| BEL-7404-M与BEL-7404-ADM-P4-H | 0.702 | 0.402 |
| BEL-7404-M与BEL-7404-ADM-P4-M | 0.221 | 0.638 |
| BEL-7404-ADM-P4与BEL-7404-ADM-P4-H | 2.580 | 0.108 |
| BEL-7404-ADM-P4与BEL-7404-ADM-P4-M | 0.913 | 0.339 |
| BEL-7404-ADM-P4-H与BEL-7404-ADM-P4-M | 6.452 | 0.011 |
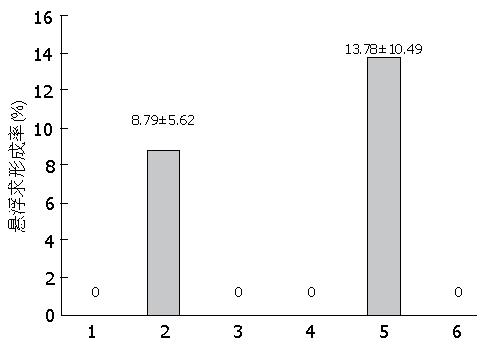
悬浮球形成实验, 只有BEL-7404-ADM-P4-H及BEL-7404-H有悬浮球形成, 其余细胞系不形成悬浮球, 均于第3天开始逐渐皱缩死亡. 而BEL-7404-ADM-P4-H及BEL-7404-H悬浮球形成率无统计学意义(χ2 = 1.228, P = 0.268>0.05, 图5).
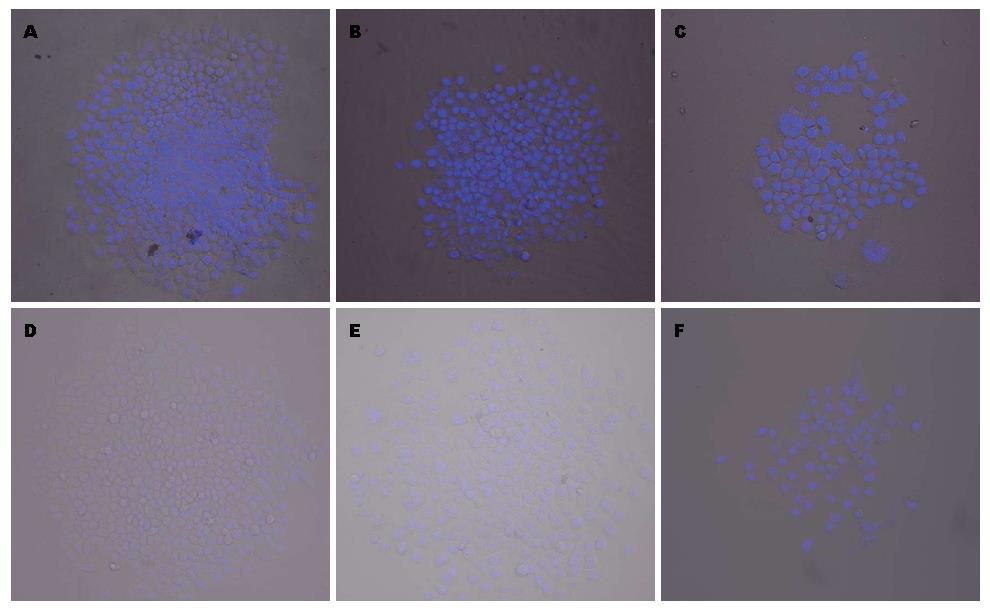
BEL-7404及BEL-7404-ADM-P4单克隆中H都有极少数不染和低染的细胞存在, 但M、P全染, 且BEL-7404单克隆中H、M、P的hoechst33342荧光强度均强于BEL-7404-ADM-P4单克隆中H、M、P(图6).
CSCs已经成为目前肿瘤研究的热点, 为肿瘤的治疗提供了新的思路. CSCs理论提出, 肿瘤的发生、发展、临床耐药以及高复发率、高转移性依赖于肿瘤细胞中的极少部分的癌干细胞; 癌干细胞具有无限增殖能力、肿瘤耐药性及高致瘤性[16]. 目前, CSCs的富集主要通过CSCs的克隆形成实验[17]、悬浮球形成实验[18]以及CSCs的耐药性[19], 近几年有相关文献报道, 采用单细胞培养法[11-14], 根据细胞克隆形态可将单细胞克隆分为H、M、P, 其中H被证实富含CSCs; CSCs的分离纯化主要依靠其表面标志物进行免疫磁珠分选[20](magnetic activated cell sorting, MACS)和荧光免疫分选[21](fluorescence activated cell sorting, FACS)以及SP细胞[22](side population, SP)结合流式分选法. 而SP细胞结合流式分选法[23]是利用高表达ABCG2[24,25]的癌干细胞能将荧光染料hoechst33342排出胞外的特性, 用流式细胞仪[26]将hoechst33342低染或不染的SP细胞分离出来, 研究者们认为SP具有癌干细胞特性. 但是肝癌干细胞缺乏特异性表面标志物, 因此, 在目前的肝癌干细胞研究中, 没有必要过度苛求发现其特异性的表面标志物, 关注和识别癌干细胞所在的细胞亚群更为重要.
本实验组基于肿瘤的耐药性, 裸鼠体内低剂量阿霉素干预, 在体内连续成瘤传代过程中, 裸鼠皮下移植瘤成瘤率均为100%, 且成瘤时间从第一代到第四代均有所缩短, 以此达到了CSCs的初步富集. 从BEL-7404、BEL-7404-ADM-P4及其单克隆细胞中H、M、P的生长情况来看, BEL-7404-H和BEL-7404-ADM-P4-H生长速度最快, 同等时间内细胞量最大, 提示全克隆增殖能力最强, 这可能与其含有较高比例的CSCs有关. 从BEL-7404、BEL-7404-H、BEL-7404-M、BEL-7404-ADM-P4、BEL-7404-ADM-P4-H、BEL-7404-ADM-P4-M的克隆形成率来看, BEL-7404-ADM-P4-H克隆形成率高于亲本细胞BEL-7404, 同样说明与亲本细胞BEL-7404相比, BEL-7404-ADM-P4-H具有更强的自我更新和增殖能力, 具有更高的癌干细胞特性, 这提示BEL-7404-ADM-P4-H中可能含有更高比例的癌干细胞.
无血清悬浮球培养[18], 不仅是一种癌干细胞的富集手段, 也是鉴定癌干细胞特性的指标之一[27]. 在无血清培养条件下癌干细胞能够悬浮生长, 而非癌干细胞则不能[28]. 在悬浮球形成实验中, 只有BEL-7404-ADM-P4-H及BEL-7404-H有悬浮球形成, 而其余细胞不形成悬浮球, 这也充分说明了全克隆具有更强的癌干细胞特性, 但是BEL-7404-ADM-P4-H与BEL-7404-H悬浮球形成率差异无统计学意义, 通过无血清悬浮球培养, 并不能说明BEL-7404-ADM-P4-H癌干细胞特性强于BEL-7404-H.
Zhou等[29]和Fiegel等[30]实验证明CSCs具有较强的耐药特性, 其胞膜表面高表达耐药蛋白ABCG2, 可以将荧光染料hoechst33342排出胞外, 使细胞不着色或低染. 根据这一特性, 本实验组以BEL-7404亲本细胞形成的3种类型克隆为对照, 通过在共聚焦荧光显微镜下直接观察BEL-7404-ADM-P4细胞形成的3种类型克隆的hoechst33342的染色情况, 结果发现BEL-7404-H和BEL-7404-ADM-P4-H都有极少数不染和低染的细胞存在, 但M、P均着色, 且BEL-7404单克隆中H、M、P的hoechst33342荧光强度均强于BEL-7404-ADM-P4单克隆中H、M、P, 这也提示BEL-7404-ADM-P4-H可能富含肝癌干细胞, 具有较强的耐药特性, 能够将荧光染料hoechst33342泵出胞外.
总之, 经裸鼠体内阿霉素干预富集的第四代肝癌细胞, 通过体外单细胞克隆培养法, 形成的全克隆细胞亚群表现出较强的癌干特性: 具有较强的自我更新增殖能力、克隆形成能力及耐药特性. 因此我们认为体内阿霉素干预联合体外单细胞培养所形成的全克隆细胞亚群含有更高比例的肝癌干细胞样细胞. 但是, 由于癌干细胞缺乏特异性的标志物, 目前在研究领域癌干细胞的筛选遇到了瓶颈, 所以癌干细胞的筛选和寻找有待研究者们继续努力, 寻找到癌干细胞, 并进行靶向治疗, 为临床根治肿瘤打下坚实的基础.
肝癌是世界上最常见恶性肿瘤之一, 研究者们认为全克隆细胞群富含癌干细胞, 从肝癌细胞中分离出肝癌干细胞是根治肝癌重要前提.
高润平, 教授, 吉林大学第一医院肝胆胰内科
癌干细胞是当前的研究热点, 也是干细胞的研究重点, 癌干细胞理论更新了当前的临床治疗策略, 但癌干细胞由于缺乏特异性标志物而使癌干细胞的分选成为干细胞研究领域的难点.
当前很多研究者从事癌干细胞的研究, 已有研究者证实在乳腺癌、前列腺癌、黑色素瘤中存在癌干细胞, 并有相关文献报道癌细胞中全克隆含有较高比例的癌干细胞, 本文结合癌干细胞的特性和单细胞培养方法以期待证实肝癌细胞中全克隆表现出更强的癌干细胞特性.
本文首次将癌干细胞的耐药特性和单细胞克隆方法相结合, 检测肝癌干细胞的特性.
癌干细胞具有耐药特性, 不易被化疗药物杀死而可以长期存在, 这就要求我们临床医师更新治疗策略, 研究出能特异性杀灭癌干细胞的药物是当前医疗研究领域的重大责任.
本文作者采用阿霉素干预裸鼠体内肝癌移植瘤, 收集其第4代肝癌细胞, 继而体外单细胞克隆培养, 经筛选初步确认全克隆细胞亚群(BEL-7404-ADM-P4-H)具有增殖力和耐药性强的癌干细胞特点.
编辑: 郭鹏 电编:鲁亚静
| 1. | Chen X, Cheung ST, So S, Fan ST, Barry C, Higgins J, Lai KM, Ji J, Dudoit S, Ng IO. Gene expression patterns in human liver cancers. Mol Biol Cell. 2002;13:1929-1939. [PubMed] [DOI] |
| 2. | Ko CH, Cheng CF, Lai CP, Tzu TH, Chiu CW, Lin MW, Wu SY, Sun CY, Tseng HW, Wang CC. Differential proteomic analysis of cancer stem cell properties in hepatocellular carcinomas by isobaric tag labeling and mass spectrometry. J Proteome Res. 2013;12:3573-3585. [PubMed] [DOI] |
| 3. | Winquist RJ, Boucher DM, Wood M, Furey BF. Targeting cancer stem cells for more effective therapies: Taking out cancer's locomotive engine. Biochem Pharmacol. 2009;78:326-334. [PubMed] [DOI] |
| 4. | Al-Hajj M, Wicha MS, Benito-Hernandez A, Morrison SJ, Clarke MF. Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci U S A. 2003;100:3983-3988. [PubMed] [DOI] |
| 5. | Collins AT, Berry PA, Hyde C, Stower MJ, Maitland NJ. Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res. 2005;65:10946-10951. [PubMed] [DOI] |
| 6. | Li C, Heidt DG, Dalerba P, Burant CF, Zhang L, Adsay V, Wicha M, Clarke MF, Simeone DM. Identification of pancreatic cancer stem cells. Cancer Res. 2007;67:1030-1037. [PubMed] [DOI] |
| 7. | Zhang S, Balch C, Chan MW, Lai HC, Matei D, Schilder JM, Yan PS, Huang TH, Nephew KP. Identification and characterization of ovarian cancer-initiating cells from primary human tumors. Cancer Res. 2008;68:4311-4320. [PubMed] [DOI] |
| 8. | Yamashita T, Ji J, Budhu A, Forgues M, Yang W, Wang HY, Jia H, Ye Q, Qin LX, Wauthier E. EpCAM-positive hepatocellular carcinoma cells are tumor-initiating cells with stem/progenitor cell features. Gastroenterology. 2009;136:1012-1024. [PubMed] [DOI] |
| 9. | 周 志华, 王 卫兵, 张 健东. 全克隆与肿瘤干细胞. 国际病理科学与临床杂志. 2011;31:420-423. |
| 10. | Zucchi I, Sanzone S, Astigiano S, Pelucchi P, Scotti M, Valsecchi V, Barbieri O, Bertoli G, Albertini A, Reinbold RA. The properties of a mammary gland cancer stem cell. Proc Natl Acad Sci U S A. 2007;104:10476-10481. [PubMed] [DOI] |
| 11. | Li H, Chen X, Calhoun-Davis T, Claypool K, Tang DG. PC3 human prostate carcinoma cell holoclones contain self-renewing tumor-initiating cells. Cancer Res. 2008;68:1820-1825. [PubMed] [DOI] |
| 12. | Zhou ZH, Ping YF, Yu SC, Yi L, Yao XH, Chen JH, Cui YH, Bian XW. A novel approach to the identification and enrichment of cancer stem cells from a cultured human glioma cell line. Cancer Lett. 2009;281:92-99. [PubMed] [DOI] |
| 13. | Kalirai H, Damato BE, Coupland SE. Uveal melanoma cell lines contain stem-like cells that self-renew, produce differentiated progeny, and survive chemotherapy. Invest Ophthalmol Vis Sci. 2011;52:8458-8466. [PubMed] [DOI] |
| 14. | Tan L, Sui X, Deng H, Ding M. Holoclone forming cells from pancreatic cancer cells enrich tumor initiating cells and represent a novel model for study of cancer stem cells. PLoS One. 2011;6:e23383. [PubMed] [DOI] |
| 15. | Singh S, Dwarakanath BS, Lazar Mathew T. Role of topoisomerases in cytotoxicity induced by DNA ligand Hoechst-33342 and UV-C in a glioma cell line. Indian J Exp Biol. 2005;43:313-323. [PubMed] |
| 17. | Dou J, Pan M, Wen P, Li Y, Tang Q, Chu L, Zhao F, Jiang C, Hu W, Hu K. Isolation and identification of cancer stem-like cells from murine melanoma cell lines. Cell Mol Immunol. 2007;4:467-472. [PubMed] |
| 18. | Reynolds BA, Weiss S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 1992;255:1707-1710. [PubMed] [DOI] |
| 19. | Zhang Q, Shi S, Yen Y, Brown J, Ta JQ, Le AD. A subpopulation of CD133(+) cancer stem-like cells characterized in human oral squamous cell carcinoma confer resistance to chemotherapy. Cancer Lett. 2010;289:151-160. [PubMed] [DOI] |
| 23. | Seigel GM, Campbell LM, Narayan M, Gonzalez-Fernandez F. Cancer stem cell characteristics in retinoblastoma. Mol Vis. 2005;11:729-737. [PubMed] |
| 24. | Doyle L, Ross DD. Multidrug resistance mediated by the breast cancer resistance protein BCRP (ABCG2). Oncogene. 2003;22:7340-7358. [PubMed] [DOI] |
| 25. | Huss WJ, Gray DR, Greenberg NM, Mohler JL, Smith GJ. Breast cancer resistance protein-mediated efflux of androgen in putative benign and malignant prostate stem cells. Cancer Res. 2005;65:6640-6650. [PubMed] [DOI] |
| 26. | Maeda S, Shinchi H, Kurahara H, Mataki Y, Maemura K, Sato M, Natsugoe S, Aikou T, Takao S. CD133 expression is correlated with lymph node metastasis and vascular endothelial growth factor-C expression in pancreatic cancer. Br J Cancer. 2008;98:1389-1397. [PubMed] [DOI] |
| 28. | 胡 以平. 关于肿瘤干细胞问题的一些思考. 中国肿瘤生物治疗杂志. 2008;15:201-204. |
| 29. | Zhou S, Schuetz JD, Bunting KD, Colapietro AM, Sampath J, Morris JJ, Lagutina I, Grosveld GC, Osawa M, Nakauchi H. The ABC transporter Bcrp1/ABCG2 is expressed in a wide variety of stem cells and is a molecular determinant of the side-population phenotype. Nat Med. 2001;7:1028-1034. [PubMed] [DOI] |
| 30. | Fiegel HC, Glüer S, Roth B, Rischewski J, von Schweinitz D, Ure B, Lambrecht W, Kluth D. Stem-like cells in human hepatoblastoma. J Histochem Cytochem. 2004;52:1495-1501. [PubMed] [DOI] |