修回日期: 2014-08-13
接受日期: 2014-08-26
在线出版日期: 2014-10-18
目的: γ-氨基丁酸B受体1(γ-aminobutyric acid B receptor 1, GABBR1)是GABA的B型受体, 他有多个亚型, 本研究试图了解GABA处理对肝纤维化大鼠模型中GABBR1表达的影响.
方法: 使用四氯化碳(carbon tetrachloride, CCl4)腹腔注射法诱导(建立)肝纤维化动物模型, 将SD大鼠分为3组, 对照组、模型组和GABA处理组. Western blot和PCR方法分别检测GABBR1的表达. 测序用于验证PCR产物.
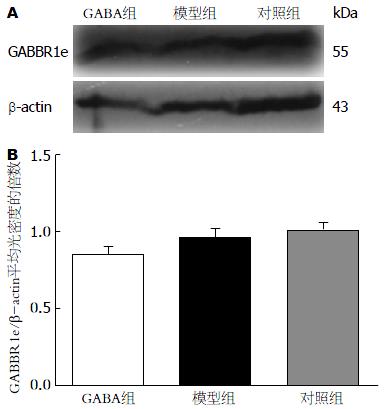
结果: 经多次Western blot结果显示, 发现截短形式的GABBR1, 经PCR扩增, 发现GABBR1e的存在. 后经测序、序列比对结果证实, 该PCR扩增片段即为GABBR1e. PCR结果显示模型组GABBR1e表达水平明显高于GABA处理组和对照组, 而在蛋白表达水平上并无差异.
结论: 截短形式的GABBR1, 即GABBR1e在大鼠肝组织中的表达, 为我们课题组首次报道, 但其在肝纤维化中的作用, 以及更广泛的生物学意义还有待于进一步的研究.
核心提示: γ-氨基丁酸(γ-aminobutyric acid, GABA)为中枢神经系统最重要的抑制性神经递质之一, 他在外周组织中的生物学意义尚未可知, 我们在前期研究中发现GABA与肝纤维化的相关性, 本研究意外发现截断型GABA(B)受体GABBR1e在大鼠肝组织中表达, 为国内外首次报道.
引文著录: 樊文梅, 马锡慧, 肖漓, 陈莉萍, 何秀云, 石炳毅. 截短型γ-氨基丁酸B受体在肝纤维化大鼠中的表达. 世界华人消化杂志 2014; 22(29): 4456-4460
Revised: August 13, 2014
Accepted: August 26, 2014
Published online: October 18, 2014
AIM: To investigate the expression of truncated γ-aminobutyric acid B receptor 1 (GABBR1) in liver fibrosis in rats.
METHODS: Sprague-Dawley rats were divided into three groups: a normal control group, a model group and a treatment group. Liver fibrosis was induced with carbon tetrachloride (CCl4) in rats of the model group and treatment group, and the normal control group was given olive oil. The treatment group was additionally given GABA. Western blot analysis and PCR were performed to detect the expression of GABBR1 protein and mRNA.
RESULTS: Both Western blot and PCR analyses indicated the presence of a truncated GABBR1 in rats of the three groups. DNA sequencing and NCBI blast sequence analysis confirmed that the protein is GABBR1e. PCR results showed that the mRNA expression level of GABBR1e in the model group was higher than those in the GABA group and the control group. However, there was no significant difference in the protein expression level of GABBR1e among the three groups.
CONCLUSION: Our findings suggest the expression of GABBR1e in liver tissue. The role of GABBR1e in liver fibrosis and its biological significance still need further research.
- Citation: Fan WM, Ma XH, Xiao L, Chen LP, He XY, Shi BY. Expression of truncated γ-aminobutyric acid B receptor in liver fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2014; 22(29): 4456-4460
- URL: https://www.wjgnet.com/1009-3079/full/v22/i29/4456.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i29.4456
γ-氨基丁酸(γ-aminobutyric acid, GABA)是中枢神经系统主要的抑制性神经递质, 他通过离子型A和代谢型B受体发挥作用[1], 在神经系统中GABBR1对神经元细胞有保护作用[2]. 他的亚型主要是1a和1b, 其次还有多种不同亚型, GABBR1e是截短形式的GABBR1a, 在人和大鼠中皆有表达. 在中枢神经系统表达较少, 但在外周组织中含量丰富, 他依然保持与GABBR2形成二聚体的功能, 但不能活化内向整流钾离子通道, 也不能抑制腺苷酸环化酶的活性[3]. 本研究在检测GABA对肝纤维化大鼠GABBR1蛋白表达的时候, 总是发现有一条分子量在64 kDa左右的蛋白, 后经查阅文献, 认为可能是GABBR1e, 随之设计引物扩增GABBR1e, 扩增结果与预期大小相符, 将PCR产物测序, 经序列比对证实, 该序列即为截短型GABBR1a.
SD大鼠(♀, 体质量200-220 g, 清洁级), 由北京维通利化实验动物技术有限公司提供, 普通饲料喂养, 自由进食进饮, 实验前禁食12 h. GABA购自美国Sigma公司, GABBR1抗体购自美国Abcam公司. RIPA蛋白提取试剂盒购自北京百泰克公司, 电泳相关生化试剂均购自北京化学试剂公司. 二抗及ECL发光液均购自北京中杉金桥生物公司. 引物合成在上海生物工程公司, cDNA反转录试剂盒和PCR试剂盒均购自美国Invitrogen公司.
1.2.1 肝纤维化动物模型: 能自由饮水的体质量200-220 g的♀SD大鼠, 通过腹腔注射四氯化碳(carbon tetrachloride, CCl4)(CCl4:橄榄油 = 1:1混合)诱导肝纤维化模型[4], 24只大鼠分为3组(每组8只): GABA处理组、模型组和对照组, 分别以0.2 mL/100 g CCl4、CCl4和橄榄油腹腔注射, 2次/wk, 诱导肝纤维化6 wk后, 模型组和对照组继续注射CCl4和橄榄油, GABA(2.5 μg/100 g)处理组则除了CCl4处理外, 进行GABA处理, 2次/wk, 共处理2 wk, 随后处死大鼠, 取肝组织标本进行下一步实验.
1.2.2 Western blot检测: 称取大鼠肝组织标本100 mg置于匀浆器中, 加入百泰克的RIPA强效蛋白裂解液, 将匀浆器迅速置于冰上, 研磨成匀浆后, 吸入1.5 mL Eppendorf管中, 12000 r/min, 4 ℃, 离心5 min, 上清转移到新的Eppendorf管中, 加入2×loading buffer, 100 ℃煮沸5 min, 加入10%的SDS-PAGE胶中, 跑胶结束后, 转膜1.5 h, 一抗GABBR1(1:500) 4 ℃孵育过夜, TBST洗涤3次; 二抗(1:2000)常温孵育1 h, TBST洗涤3次, ECL显影、定影.
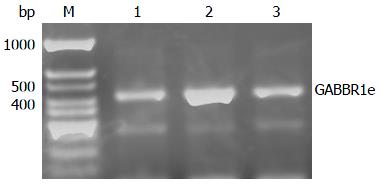
1.2.3 RNA提取、PCR和琼脂糖凝胶电泳鉴定: 肝组织取100 mg, 加入1 mL TRIzol迅速在液氮中研磨, 裂解5 min后, 用酚氯仿法提取RNA, 将1 μg RNA进行逆转录, 对GABBR1e进行PCR扩增, 引物序列参照文献[3]进行. 琼脂糖凝胶电泳鉴定, GABBR1e大小为420 bp, GABBR1a为570 bp.
1.2.4 PCR产物测序: 取PCR产物20 μL, 送上海生物工程公司, 用ABI3700进行测序.
如图1A所示, 我们在分析GABA处理对肝纤维化大鼠肝组织中GABBR1时发现, 在GABBR1下方, 总有一条截短形式的蛋白条带, 引起了我们极大的兴趣. 但各组间GABBR1e蛋白的表达水平没有显著性差异(图1B).
为了进一步确认GABBR1e在大鼠肝组织中的表达, 我们提取各组大鼠肝组织RNA, 经PCR扩增, 琼脂糖凝胶电泳鉴定, 发现大小为420 bp大小的条带, 与预期GABBR1e大小相符, 未出现570 bp大小的片段, 如图2所示. 该结果提示GABBR1e是肝组织中GABA受体1的主要形式. 模型组GABBR1e表达水平明显高于GABA处理组和对照组.
GABA为中枢神经系统最重要的神经递质之一, 其受体广泛分布于外周组织, 但在外周组织中的功能尚未可知. GABAB受体是GABA的受体之一, 他可以与G蛋白偶联调控细胞内的效应系统[5], 还与体内的钙离子、钾离子、腺苷酸环化酶相偶联从而调控体内多种生物学效应[6-8]. 和其他G蛋白偶联受体一样, 具有7次跨膜结构域, 但他亦有独特的细胞外结构域, 其大小几乎与该蛋白其余部分相同.
本研究在对GABA对肝纤维化作用研究中发现, 在肝组织中表达一种截短形式的GABBR1, 更换抗体后, 依然存在这一截短形式的GABBR1, 查阅相关文献后, 在外周组织中确实存在一种截短形式的GABBR1, 该学者检测了大鼠外周组织心、肺、肾、甲状腺和睾丸组织中GABBR1e的表达, 但并未检测大鼠肝脏组织中GABBR1e的表达[3]. 本课题在研究GABA与肝纤维化关系时, 意外发现截短形式的GABBR1, 后经PCR扩增、测序、结果比对, 发现该截短形式的蛋白即为GABBR1e. 这一发现, 为肝纤维化机制研究开启了新的思路.
GABBR1e为截短形式的GABBR1a, 在结构上含有配体结合部位, 但缺乏7次跨膜结构域、卷曲结构域以及内质网滞留信号[3], 即只有GABBR1a的胞外结构部分. 结构上的不同可能会导致功能上的差异. 在两种形式的受体均存在的情况下, GABBR1e可以和GABBR1a竞争性结合GABBR2, 因而可以负调控GABBR1a的表达[3]; 在GABBR1e不存在的情况下, 全长型的GABBR1a与GABBR2结合形成二聚体后, 可有效地活化内向整流钾离子通道[9-11], 抑制腺苷酸环化酶活性[12-15], 但截短形式的GABBR1e与GABBR2结合后, 失去了以上效应. 本研究首次在大鼠肝组织中报道了GABBR1e的表达, 但GABBR1e的功能与肝纤维化之间的关系及其参与肝纤维化的机制, 还需要更深入的研究.
研究显示模型组GABBR1e mRNA水平明显高于GABA处理组和对照组, 而其蛋白表达水平3组间并无明显差异. 截短型GABBR1e虽然是一种G蛋白偶联受体, 但缺失了胞内G蛋白的结合位点和胞内的磷酸化位点, 可能会导致虽有配体和受体的结合, 但不能活化内向整流钾离子通道[3]. 这可能是GABBR1e蛋白表达水平没有差异的原因. GABBR1e在蛋白水平上的恒定表达, 其相应的生物学意义还有待于进一步的研究.
总之, 本研究首次报道了截短型GABBR1e在大鼠肝组织中的表达, 他在组织内的恒定表达, 其确切的生物学意义还有待于深入研究, 随着对其功能的进一步揭示, 可能会为肝纤维化的发生机制提供新的视角.
γ-氨基丁酸(γ-am-ino-butyric acid, GABA)是中枢神经系统最主要的抑制性神经递质, 在外周组织中亦有表达, 我们在前期研究中发现GABA刺激的肝星状细胞增殖促进和凋亡抑制相关的基因表达上调, 所以推测GABA在肝纤维化中有重要作用.
吴江锋, 教授, 三峡大学医学院形态学部
肝纤维化是所有慢性肝病的共同病理学基础, 但目前尚无有效逆转肝纤维化的药物. 因此, 深入阐明肝纤维化的发生发展机制是解决一切慢性肝病的根本所在.
截短型GABBR1e首先由美国加州大学圣地亚哥分校的Schwarz报道, 他们用RT-PCR方法检测了GABBR1e在外周组织中的分布, 结果并未明确显示人肝组织中有GABBR1e表达, 大鼠肝组织中未作检测.
GABA在外周组织中广泛分布, 但其功能尚未可知. 我们在前期研究中发现GABA在肝纤维化中具有重要作用. 在此基础上, 我们意外发现GABBR1e在肝组织中的表达, 为国内外首次报道.
本研究首次报道截短形式的GABBR1e在肝组织中表达, 其具体的生物学意义尚未可知, 进一步了解GABBR1e在肝脏疾病中的作用, 今后可为开发治疗肝纤维化以及末期肝病提供新的思路.
G蛋白偶联受体(G protein-coupled receptor, GPCR): 是一大类膜蛋白受体的统称. 这类受体的共同点是其立体结构中都有7个跨膜α螺旋, 且其肽链的C端和第5和第6个跨膜螺旋的胞内环上都有G蛋白的结合位点. 大约40%的现代药物都以G蛋白偶联受体作为靶点.
GABA及其受体与肝纤维化之间可能具有相关性, 而目前的资料尚未显示肝组织中存在GABA的受体. 作者在肝组织中发现GABBR1e的表达, 为GABA或者GABBR1e与肝纤维化发生之间的关系研究奠定了实验基础. 有一定的创新性和科学价值.
编辑: 郭鹏 电编:都珍珍
| 1. | Bettler B, Kaupmann K, Mosbacher J, Gassmann M. Molecular structure and physiological functions of GABA(B) receptors. Physiol Rev. 2004;84:835-867. [PubMed] [DOI] |
| 2. | Tu H, Xu C, Zhang W, Liu Q, Rondard P, Pin JP, Liu J. GABAB receptor activation protects neurons from apoptosis via IGF-1 receptor transactivation. J Neurosci. 2010;30:749-759. [PubMed] [DOI] |
| 3. | Schwarz DA, Barry G, Eliasof SD, Petroski RE, Conlon PJ, Maki RA. Characterization of gamma-aminobutyric acid receptor GABAB(1e), a GABAB(1) splice variant encoding a truncated receptor. J Biol Chem. 2000;275:32174-32181. [PubMed] [DOI] |
| 5. | Hill DR, Bowery NG, Hudson AL. Inhibition of GABAB receptor binding by guanyl nucleotides. J Neurochem. 1984;42:652-657. [PubMed] [DOI] |
| 6. | Chalifoux JR, Carter AG. GABAB receptor modulation of voltage-sensitive calcium channels in spines and dendrites. J Neurosci. 2011;31:4221-4232. [PubMed] [DOI] |
| 7. | Ciruela F, Fernández-Dueñas V, Sahlholm K, Fernández-Alacid L, Nicolau JC, Watanabe M, Luján R. Evidence for oligomerization between GABAB receptors and GIRK channels containing the GIRK1 and GIRK3 subunits. Eur J Neurosci. 2010;32:1265-1277. [PubMed] [DOI] |
| 8. | Onali P, Mascia FM, Olianas MC. Positive regulation of GABA(B) receptors dually coupled to cyclic AMP by the allosteric agent CGP7930. Eur J Pharmacol. 2003;471:77-84. [PubMed] [DOI] |
| 9. | Padgett CL, Slesinger PA. GABAB receptor coupling to G-proteins and ion channels. Adv Pharmacol. 2010;58:123-147. [PubMed] [DOI] |
| 10. | Kuner R, Köhr G, Grünewald S, Eisenhardt G, Bach A, Kornau HC. Role of heteromer formation in GABAB receptor function. Science. 1999;283:74-77. [PubMed] [DOI] |
| 11. | Chalifoux JR, Carter AG. GABAB receptor modulation of synaptic function. Curr Opin Neurobiol. 2011;21:339-344. [PubMed] [DOI] |
| 12. | Bowery NG, Bettler B, Froestl W, Gallagher JP, Marshall F, Raiteri M, Bonner TI, Enna SJ. International Union of Pharmacology. XXXIII. Mammalian gamma-aminobutyric acid(B) receptors: structure and function. Pharmacol Rev. 2002;54:247-264. [PubMed] [DOI] |
| 13. | Kaupmann K, Huggel K, Heid J, Flor PJ, Bischoff S, Mickel SJ, McMaster G, Angst C, Bittiger H, Froestl W. Expression cloning of GABA(B) receptors uncovers similarity to metabotropic glutamate receptors. Nature. 1997;386:239-246. [PubMed] [DOI] |
| 14. | Xu J, Wojcik WJ. Gamma aminobutyric acid B receptor-mediated inhibition of adenylate cyclase in cultured cerebellar granule cells: blockade by islet-activating protein. J Pharmacol Exp Ther. 1986;239:568-573. [PubMed] |
| 15. | Martin SC, Russek SJ, Farb DH. Molecular identification of the human GABABR2: cell surface expression and coupling to adenylyl cyclase in the absence of GABABR1. Mol Cell Neurosci. 1999;13:180-191. [PubMed] [DOI] |