修回日期: 2014-08-25
接受日期: 2014-09-03
在线出版日期: 2014-10-18
目的: 通过检测血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)及血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2, VEGFR2)在胃癌患者组织中的差异性表达, 探讨VEGF和VEGFR2在胃癌发生、进展、转移及预后中的作用.
方法: 收集石河子大学医学院73例胃癌及其63例癌旁石蜡包埋组织, 制作组织芯片. 采用免疫组织化学Envision两步法检测组织中VEGF及VEGFR2的表达水平. 对73例胃癌患者进行了121 mo(10年)的随访, 并结合患者的临床病理及随访资料进行了分析.
结果: (1)VEGFR2在胃癌组织中的表达高于癌旁组织(P = 0.025), 而VEGF在胃癌及癌旁组织中的表达差异不显著(P = 0.275); 在胃癌组织中, VEGF和VEGFR2的表达呈正相关(r = 0.455); (2)VEGF的高表达与患者的淋巴结转移(P = 0.004)、远处转移(P = 0.019)及较高的临床分期(P = 0.003)相关; VEGFR2的表达则与患者的性别(P = 0.049)、淋巴结转移(P<0.001)、远处转移(P = 0.007)和较高的临床分期(P<0.001)相关; (3)VEGF和VEGFR2的高表达与胃癌患者的生存均呈负相关(分别为P = 0.043和P = 0.016); (4)Cox多因素回归模型分析提示临床分期是影响胃癌患者生存预后的独立危险因素(P = 0.001).
结论: 胃癌中VEGF及VEGFR2的高表达提示可能为晚期胃癌、患者可能有癌转移以及预后不良. 在调控胃癌血管生成的作用上, 本研究提示VEGFR2受体可能比VEGF更为重要.
核心提示: 胃癌中血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)、血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2, VEGFR2)及相关的信号通路以及预后的整体的研究较少, 本研究发现VEGFR2在胃癌组织中的表达比VEGF更具有特异性, 提示VEGFR2受体可能比VEGF更为重要, 该发现将为临床靶向药物的使用提供更好的选择依据.
引文著录: 李一鑫, 张楠, 陶林, 杨兰, 赵瑾, 张文杰. 胃癌患者VEGF、VEGFR2高表达的临床病理学意义及其在胃癌进展与生存预后中的作用. 世界华人消化杂志 2014; 22(29): 4406-4414
Revised: August 25, 2014
Accepted: September 3, 2014
Published online: October 18, 2014
AIM: To investigate the differential expression of vascular endothelial growth factor (VEGF) and vascular endothelial growth factor receptor 2 (VEGFR2) in gastric cancer to understand possible roles that VEGF and VEGFR2 receptor play in the carcinogenesis, progression and prognosis of gastric cancer.
METHODS: The expression of VEGF and VEGFR2 was examined using immunohistochemistry on paraffin embedded tissue chips derived from 73 patients with gastric cancer (GC) and 63 adjacent normal tissues (ANT) from the same patients. Expression data were analyzed against patients' clinicopathological features and follow-up information.
RESULTS: The level of VEGFR2 in GC tissues was significantly higher than that in ANT (P = 0.025), but no significant difference was detected in the level of VEGF between GC and ANT (P = 0.275). In GC tissues, a positive correlation was found between expression levels of VEGF and VEGFR2 (r = 0.455). High expression of VEGF was significantly associated with lymph node metastasis (P = 0.004), distant metastasis (P = 0.019) and advanced clinical stage (P = 0.003). High expression of VEGFR2 was associated with sex (P = 0.049), lymph node metastasis (P < 0.001), distant metastasis (P = 0.007) and advanced clinical stage (P < 0.001). High levels of both VEGF and VEGFR2 were linked to poor prognosis in GC patients (P = 0.043 and P = 0.016, respectively). Cox multi-factor regression analyses demonstrated that clinical stage was an independent factor predicting overall survival of GC patients (P = 0.001).
CONCLUSION: Overexpression of VEGF and VEGFR2 may suggest late stage, metastasis, and poor prognosis in gastric cancer patients. VEGFR2 may play a role more important than VEGF in the regulation of angiogenesis in gastric cancer.
- Citation: Li YX, Zhang N, Tao L, Yang L, Zhao J, Zhang WJ. Clinicopathological and prognostic significance of overexpression of VEGF and VEGFR2 in gastric cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(29): 4406-4414
- URL: https://www.wjgnet.com/1009-3079/full/v22/i29/4406.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i29.4406
在生理或病理情况下, 血管生成可以为组织生长提供营养物质, 因而在肿瘤的生长和转移中发挥着重要作用. 肿瘤血管内皮细胞的增殖、迁移主要由血管内皮生长因子(vascular endothelial growth factor, VEGF)及其主要受体血管内皮生长因子受体2(vascular endothelial growth factor receptor 2, VEGFR2)调控, 过量表达VEGF与多种肿瘤的发生、发展和恶性预后有关, 包括结肠癌、乳腺癌、前列腺癌、肺癌及黑色素瘤. 在肿瘤组织中存在VEGF调控的信号通路, 并且这条通路作用于肿瘤发生的主要方面, 包括肿瘤的发生及肿瘤干细胞的功能[1]. 由于VEGF/VEGFR2途径在肿瘤血管生成中的中心作用, 他们表达高低与患者预后的关系非常密切, 同时以VEGF及VEGFR2为靶点的抗肿瘤治疗受到越来越多的关注. VEGF、VEGFR2成为近年来肿瘤学领域基础研究和分子靶向药物研发的热点.
选用石河子大学第一附院2003-01/2007-12手术切除的胃癌石蜡组织73例, 其中男46例, 女27例, 年龄27-81岁, 平均年龄59.1岁±12.8岁, 有淋巴结转移39例, 无淋巴结转移者34例, 发生远处转移12例. 根据世界卫生组织(World Health Organization, WHO)(2000)病理组织学分类: 高分化管状腺癌2例, 中分化管状腺癌20例, 低分化管状腺癌40例, 黏液腺癌4例, 印戒细胞癌7例. 截止到2014-04-01, 随访到患者生存期平均随访时间为40.7 mo±38.7 mo(0-121 mo). 选取63例胃癌患者的癌旁组织(切缘距离癌组织5 cm以外的非癌组织)作为对照组. 全部病例术前均未行放疗和化疗, 资料完整, 胃癌组织分期参照美国癌症联合委员会(American Joint Committee on Cancer, AJCC)2010年修订第七版的TNM分期标准[2]. 一抗鼠抗人VEGF单克隆抗体(美国Abcam公司, 产品号ab68334, 稀释度1:100); 鼠抗人VEGFR2单克隆抗体(美国Abcam公司, ab51873, 稀释度1:25). 其余试剂均来自北京中杉金桥生物有限公司.
1.2.1 制作组织芯片及免疫组织化学染色: 所有标本均置于40 g/L甲醛中固定, 石蜡包埋组织, 制作组织芯片, 4 μm厚连续切片, 采用免疫组织化学Envision两步法进行染色. 用肝癌患者阳性切片作为阳性对照, 用PBS液代替一抗作为阴性对照.
1.2.2 结果判定: 由两名高年资病理医师采用双盲法独立阅片. VEGF免疫组织化学阳性结果为细胞质呈浅黄至棕褐色颗粒, VEGFR2免疫组织化学阳性结果为细胞质呈浅黄至棕黄色颗粒. 免疫组织化学得分与已报道的文献相似[3]为阳性着色细胞占细胞总数的百分比计分与染色强度计分的乘积. 阳性着色细胞数的百分比计分: <5%为0分; 6%-25%为1分; 26%-50%为2分; 51%-75%为3分; 76%-100%为4分. 染色强度计分: 无着色为0分; 浅棕黄色为1分; 棕黄色为2分; 棕褐色为3分. 两项结果相乘: 0-1分为(-), 2-4分为(1+), 5-8分为(2+), 9-12分为(3+); (-)为阴性, (1+)为弱阳性, (2+-3+)为强阳性.
统计学处理 本研究数据采用SPSS17.0软件系统进行统计分析. VEGF或VEGFR2在癌与非癌间表达差异的比较采用Kruskal-Wallis H检验; VEGF和VEGFR2表达与患者临床病理资料间的关系采用Kruskal-Wallis H检验; 两指标之间表达的相关性采用Spearman等级相关分析; 采用Kaplan-Meier法对生存曲线和生存期进行描述; 采用Cox比例风险回归模型进行单因素及多因素生存分析. P<0.05为差异具有统计学意义.
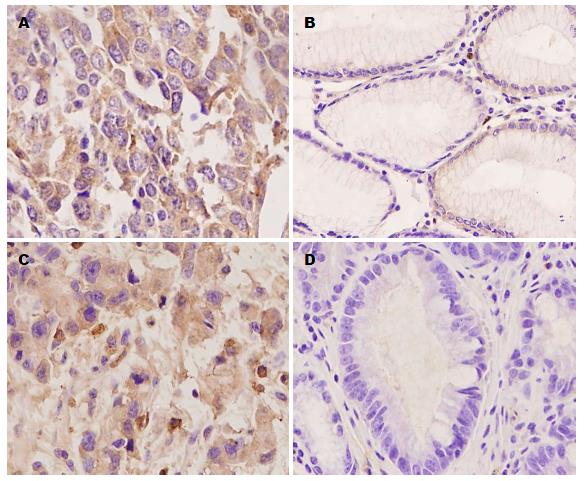
73例胃癌组织及63例癌旁组织VEGF和VEGFR2免疫组织化学结果(图1): VEGF和VEGFR2在胃癌组织(图1A, C)中阳性表达均为胞浆着色. 统计分析显示(表1): VEGFR2在胃癌组织中的表达高于(60.3% vs 46.0%)癌旁(图1C, D)(P = 0.025)组织, 而VEGF在胃癌及癌旁组织中的表达没有观察到有差异(P = 0.275). 另外, 在阅片过程中同时观察到VEGF和VEGFR2在血管内皮细胞胞浆表达也是阳性的.
| 分组 | n | VEGF | χ2值 | P值 | VEGFR2 | χ2值 | P值 | ||||
| - | 1+ | 2+ | - | 1+ | 2+ | ||||||
| 胃癌 | 73 | 18(24.7) | 38(52.0) | 17(23.3) | 1.2 | 0.275 | 29(39.7) | 35(48.0) | 9(12.3) | 5.0 | 0.025 |
| 癌旁 | 63 | 7(11.1) | 42(66.7) | 14(22.2) | 34(54.0) | 29(46.0) | 0(0.0) | ||||
在胃癌组织中有55例(75.3%)VEGF阳性表达(表2), 而VEGFR2表达阳性者为44例(60.3%), 胃癌组织中VEGF和VEGFR2的表达有差异(χ2 = 5.1, P = 0.024), 相关性分析显示, 二者在胃癌组织中表达相关, 相关系数r = 0.455.
| 蛋白 | - | 1+ | 2+ | χ2值 | P值 | r值 | P值 |
| VEGF | 18(24.7) | 38(52.0) | 17(23.3) | 5.1 | 0.024 | 0.455 | <0.001 |
| VEGFR2 | 29(39.7) | 35(48.0) | 9(12.3) |
胃癌组织中VEGF的高表达与患者的淋巴结转移(P = 0.004)、远处转移(P = 0.019)及较高的临床分期(P = 0.003)相关(表3); 临床分期Ⅲ期及Ⅳ期的胃癌患者VEGF阳性表达率分别为90.9%, 100%, 明显高于临床分期为Ⅰ期和Ⅱ期的表达率(52.9%, 57.9%). VEGFR2与患者的性别(P = 0.049)、淋巴结转移(P<0.001)、远处转移(P = 0.007)和较高的临床分期(P<0.001)相关; Ⅲ期和Ⅳ期胃癌患者的VEGFR2表达率明显高于Ⅰ期和Ⅱ期的胃癌患者(81.8%、86.6% vs 29.4%、42.1%).
| 病理资料 | n | VEGF | χ2值 | P值 | VEGFR2 | χ2值 | P值 | ||||
| - | + | ++ | - | + | ++ | ||||||
| 年龄(岁) | 0.04 | 0.852 | 1.2 | 0.273 | |||||||
| <60 | 32 | 8(25.0) | 17(53.1) | 7(21.9) | 15(46.9) | 14(43.7) | 3(9.4) | ||||
| ≥60 | 40 | 10(25.0) | 20(50.0) | 10(25.0) | 14(35.0) | 20(50.0) | 6(15.0) | ||||
| 性别 | 0.85 | 0.357 | 3.9 | 0.049 | |||||||
| 男 | 46 | 9(19.6) | 26(56.5) | 11(23.9) | 15(32.6) | 23(50.0) | 8(17.4) | ||||
| 女 | 27 | 9(33.3) | 12(44.4) | 6(22.2) | 14(51.8) | 12(44.4) | 1(3.7) | ||||
| WHO分型 | 4.39 | 0.356 | 7.1 | 0.132 | |||||||
| 高分化 | 2 | 1(50.0) | 1(50.0) | 0(0.0) | 0(0.0) | 2(100.0) | 0(0.0) | ||||
| 中分化 | 20 | 4(20.0) | 13(65.0) | 3(15) | 11(55.0) | 7(35.0) | 2(10.0) | ||||
| 低分化 | 40 | 10(25.0) | 19(47.5) | 11(27.5) | 13(32.5) | 22(55.0) | 5(12.5) | ||||
| 黏液腺癌 | 4 | 0(0.0) | 2(50.0) | 2(50.0) | 0(0.0) | 3(75.0) | 1(25.0) | ||||
| 印戒细胞癌 | 7 | 3(42.8) | 3(42.9) | 1(14.3) | 5(71.4) | 1(14.3) | 1(14.3) | ||||
| 浸润深度 | 2.70 | 0.259 | 3.4 | 0.182 | |||||||
| T1 | 9 | 4(44.4) | 3(33.3) | 2(22.2) | 6(66.7) | 2(22.2) | 1(11.1) | ||||
| T2 | 17 | 6(35.3) | 8(47.1) | 3(17.6) | 7(41.2) | 10(58.8) | 0(0.0) | ||||
| T3 | 47 | 8(17.0) | 27(57.4) | 12(25.6) | 16(34.0) | 23(48.9) | 8(17.0) | ||||
| 淋巴结转移 | 8.30 | 0.004 | 13.2 | <0.001 | |||||||
| 无 | 34 | 14(41.2) | 15(44.1) | 5(14.7) | 22(64.7) | 9(26.5) | 3(8.8) | ||||
| 有 | 39 | 4(10.3) | 23(60.0) | 12(30.7) | 7(17.9) | 26(66.7) | 6(16.4) | ||||
| 远处转移 | 5.49 | 0.019 | 7.40 | 0.007 | |||||||
| 无 | 61 | 18(29.5) | 31(50.8) | 12(19.7) | 27(44.3) | 30(49.2) | 4(6.5) | ||||
| 有 | 12 | 0(0.0) | 7(58.3) | 5(41.7) | 2(16.6) | 5(41.7) | 5(41.7) | ||||
| 临床分期 | 14.10 | 0.003 | 21.8 | <0.001 | |||||||
| 0+Ⅰ | 17 | 8(47.1) | 8(47.1) | 1(5.8) | 12(70.6) | 5(29.4) | 0(0.0) | ||||
| Ⅱ | 19 | 8(42.1) | 7(36.8) | 4(21.1) | 11(57.9) | 8(42.1) | 0(0.0) | ||||
| Ⅲ | 22 | 2(9.1) | 14(63.6) | 6(27.3) | 4(18.2) | 14(63.6) | 4(18.2) | ||||
| Ⅳ | 15 | 0(0.0) | 9(60.0) | 6(40.0) | 2 (13.3) | 8(53.3) | 5(33.3) | ||||
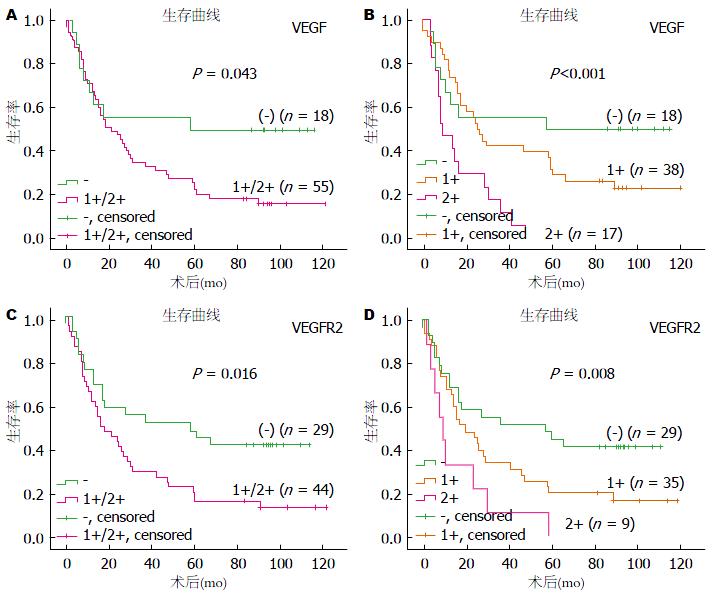
73例胃癌患者的随访结果有18例存活, 55例死亡; 存活时间最长的为121.0 mo; 总中位生存期为21.0 mo. VEGF阳性患者的中位生存时间为21.0 mo, VEGF阴性患者的中位生存时间为72.5 mo; VEGFR2阳性患者的中位生存时间为17.0 mo, VEGFR2阴性患者的中位生存时间为58.0 mo. Kaplan-Meier法进行生存分析结果显示(图2): VEGF、VEGFR2的表达与胃癌患者的生存均呈负相关(P = 0.043, P = 0.016)(图2A, C), 且患者VEGF、VEGFR2表达量越高, 预后越差(P<0.001, P = 0.008)(图2B, D).
对73例胃癌患者的临床病理资料进行Cox单因素回归模型分析(表4), 结果显示: 胃癌患者的总生存期与其浸润深度(P = 0.003)、远处转移(P = 0.02)、临床分期(P<0.001)、VEGF(P = 0.049)及VEGFR2(P = 0.019)的表达呈负相关, Cox多因素回归模型分析, 结果显示: 胃癌患者的总生存期仅与临床分期相关(P = 0.001), 高临床分期可以显著增加胃癌患者的死亡风险; Ⅲ期、Ⅳ期胃癌患者比Ⅰ期、Ⅱ期的死亡风险增加了5倍(HR = 5.48, 95%CI: 2.00-15.03).
| 变量 | 单因素分析 | 多因素分析 | ||
| HR(95%CI) | P值 | HR(95%CI) | P值 | |
| 性别(女 vs 男) | 0.95(0.54-1.68) | 0.866 | 0.75(0.40-1.39) | 0.360 |
| 年龄(<60岁 vs ≥60岁) | 0.86(0.51-1.48) | 0.591 | 0.88(0.49-1.59) | 0.679 |
| 分化(低 vs 高-中分化) | 1.76(0.96-3.24) | 0.070 | 1.32(0.67-2.60) | 0.420 |
| 浸润深度(T2/T3 vs T1) | 2.52(1.36-4.68) | 0.003 | 0.97(0.42-2.25) | 0.951 |
| 淋巴结转移(N1/N3 vs N0) | 1.29(0.74-2.25) | 0.366 | 1.43(0.81-2.54) | 0.216 |
| 远处转移(M0 vs M1) | 0.46(0.24-0.89) | 0.020 | 1.05(0.50-2.18) | 0.905 |
| 临床分期(Ⅲ/Ⅳ vs Ⅰ/Ⅱ) | 4.87(2.64-9.00) | <0.001 | 5.48(2.00-15.03) | 0.001 |
| VEGF表达(1+/2+ vs -) | 2.063(1.00-4.24) | 0.049 | 0.98(0.41-2.37) | 0.966 |
| VEGFR2表达(1+/2+ vs -) | 1.997(1.12-3.56) | 0.019 | 0.92(0.42-2.01) | 0.830 |
据WHO下属国际癌症研究组织(International Agency for Research on Cancer, IARC)估计[4], 2012年全球胃癌有大约952000例新发病例, 占全部癌症的6.8%, 发病率在所有癌症中位居第5位; 全球大约723000例新死亡病例, 死亡率8.8%, 居第3位. 在中国, 2012年胃癌新发病例405000例, 占全部癌症的13.2%, 居第2位; 死亡325000例, 占全部癌症死亡的14.7%, 居第3位[4]. 我国胃癌无论发病率还是死亡率都远远高于世界水平(接近世界水平的两倍), 在胃癌组织中的相关基础与临床研究, 越发表现出其重要性.
VEGF已经被证实为内皮细胞特异性的促分裂原, 能够刺激病理和生理状态下的血管生成[5,6]. 现在, 普遍意义上认为的VEGF指的是VEGFA, 此外, VEGF家族还包括VEGFB、VEGFC、VEGFD和胎盘生长因子PLGF, 尽管他们的功能及作用机制不尽相同, 传统意义上认为VEGF家族主要与血管生成、淋巴管生成及血管通透性的增加有关. 肿瘤细胞中VEGF的受体信号受VEGF受体酪氨酸激酶(VEGF receptor tyrosine kinases, RTKs)和neuropilins(NRPs)的调节, 研究[1]提示胃癌中VEGF受体主要是RTKs, VEGFR2是主要的RTK, 在内皮细胞中调控VEGF信号并且促进VEGF调节的血管生成[7].
肿瘤细胞表达VEGF结合于血管内皮细胞VEGFR2上, 促进血管生成[8], 这种从形成血管前的细胞增生, 到形成高度血管化的肿瘤细胞, 就是所说的血管形成的开关. 肿瘤组织中存在一种自分泌的前馈环路: 肿瘤细胞分泌产生的VEGF可以通过依赖VEGFR2活化的雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)刺激VEGF的分泌, 从而放大促进血管生成的信号[9]. 本研究中观察到胃癌组织中VEGFR2的表达高于癌旁组织, 并且随着临床分期的增加VEGFR2的表达水平越来越高, 说明VEGFR2对胃癌组织的生长和转移至关重要. 虽然VEGF在胃癌和癌旁组织中的表达没有观察到有意义的差异, 但是其在癌组织中的差异性表达是存在的(表3), 胃癌患者在不同临床分期中VEGF的表达有差异, 并且临床分期越高, VEGF的表达水平越高, 可以说明, VEGF在癌组织中的差异性表达是有迹可循的. 因此, VEGF在胃癌和癌旁组织中的表达没有观察到差异, 可能的原因有两个: 一方面在胃癌和临近的癌旁组织中VEGF的表达水平可能同时升高, 癌旁组织中高表达的VEGF水平可以为肿瘤组织的生长、转移提供更好的条件; 另一方面作为胃癌和癌旁组织中很大的区别为VEGFR2的表达水平, 尽管癌旁组织中VEGF的表达水平与胃癌组织相当, 但癌旁组织中VEGFR2的表达水平明显低于胃癌组织, 在癌旁组织中VEGF缺乏相应的受体, 因而也无法发挥其促进血管生成、肿瘤组织生长、转移的作用. 本研究提示VEGFR2在对胃癌患者转移、预后的影响方面可能比VEGF要关键. 有体内、外研究提示[9], 用化学中断VEGFR2或敲除VEGFR2基因, 会导致肿瘤细胞内VEGF表达水平的大大降低. Cox多因素回归模型分析显示临床分期是影响患者预后的独立危险因素, 因此胃癌患者的早期诊断对患者的预后至关重要.
核因子-κB(nuclear factor-kappa B, NF-κB)和信号转导和转录激活因子3(signal transducers and activators of transcription 3, STAT3)信号通路是肿瘤发生中最重要的两条炎性信号通路, 尽管作用方式不同, 但二者协同促进多种肿瘤的发展, 如: 肠癌、胃癌以及肝癌[10]. 幽门螺杆菌(Helicobacter pylori, H. pylori)慢性感染导致的炎症刺激与胃癌的发生密切相关, 在胃癌中H. pylori感染可能通过CagA触发STAT3的磷酸化, 激活STAT3炎性信号通路, 进而参与胃癌的发生、发展及预后[11]. 白介素-6(interleukin-6, IL-6)、IL-17等细胞因子可以激活STAT3进而导致VEGF表达增高[12], IL-17A能够差异调节角膜VEGFA和sVEGFR1表达, 促进角膜血管新生[13]. 本课题组前期在大肠癌中的研究观察到IL-6/STAT3信号通路在大肠癌的发生、发展中发挥重要的作用[14], 在胃癌中, 我们也同样观察到IL-6/STAT3信号通路相关因子的高表达. 有研究提示慢性炎症会导致肠上皮细胞VEGFR2表达上调, 在STAT3突变型小鼠模型体内VEGFR2信号通路依赖STAT3的调控, 控制上皮细胞的增殖和肿瘤细胞的生长[15]. 肿瘤微环境中的低氧状态与肿瘤的生长密切相关[16], STAT3通过诱导低氧条件下缺氧诱导因子1α(hypoxia inducible factor-1α, HIF-1α)的表达刺激低氧条件下VEGF的转录, 间接调控VEGF[17-19]. 在胃癌组织中, 我们观察到VEGF的表达与VEGFR2的表达存在很强的相关性, 相关系数r = 0.455, 这与之前提到的肿瘤组织中的VEGF, VEGFR2自分泌前馈通路[9,20]相吻合. 然而, 在胃癌中STAT3与VEGF、VEGFR2之间先后相互作用的靶点及分子作用机制仍不明确, 但本研究提示VEGFR2对胃癌患者转移、预后的影响比VEGF要关键.
研究发现, VEGF也可以影响存在于肿瘤微环境中的免疫细胞的功能[21], 影响个体对IL-6/STAT3信号通路的应答, 此外, VEGF受体可以调控肿瘤基质中成纤维细胞的功能调节肿瘤细胞的入侵和扩散[22].
STAT3抑制剂可以在不同的水平阻断VEGF的表达从而发挥抑制血管生成的作用[17]. 利用可溶性诱骗受体阻断VEGF的功能, 可以抑制肿瘤细胞的生长、增殖以及血管生成[15]. VEGF靶向药在临床上单药或联合化疗药物的使用在治疗恶性肿瘤晚期患者已取得一定的疗效[23,24]. 针对VEGF或VEGFR2的分子靶向药物也在临床试验应用阶段, 但近来人们关注的热点更多的是VEGF的受体, 尤其是VEGFR2. 本研究发现在胃癌患者中VEGF或VEGFR2高表达的患者与不良预后相关, 在调控胃癌血管生成的作用上, 本研究提示VEGFR2受体可能比VEGF更为重要. 针对血管生成前蛋白VEGFR2的药物治疗方案的选择成为类癌中抗肿瘤的重要焦点[25-27]. 在多种非上皮源性细胞包括: 造血细胞、巨核细胞、胰管细胞、周细胞, 甚至不同的肿瘤细胞中VEGFR2的研究和分析也从未间断[27-31]. 有研究[32]提示VEGFR2基因拷贝数的增加与肺癌患者的化疗药物抵抗及不良预后相关. Fuchs等[33]的最近研究证实, 在高分化胃癌患者中, VEGFR2信号通路是重要的的药物作用靶点, 而抗VEGFR2的分子靶向药物能明显改善胃癌患者预后.
我国胃癌无论发病率还是死亡率都远远高于世界水平(接近世界水平的两倍). 在过去的数十年中, 发生率、检查诊断和治疗选择已经发生了很大的变化, 由于胃癌发生、发展及转移的相关分子机制仍不明确及缺乏有效实验研究支撑的临床试验, 胃癌患者预后令人失望, 特别是晚期患者.
刘占举, 教授, 同济大学附属上海市第十人民医院
现有一线化疗方案与生物靶向制剂(包括: 单克隆抗体、酪氨酸激酶抑制剂及哺乳动物雷帕霉素蛋白抑制剂)的联合有望取得显著进展, 许多相应的临床试验目前正在进行之中, 从胃癌发生的分子机制上为靶向药物的研发及临床应用提供数据支撑, 本研究是胃癌研究的热点之一.
Fuchs的最近研究证实, 在高分化胃癌患者中, 血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2, VEGFR2)信号通路是重要的药物作用靶点, 而抗VEGFR2的分子靶向药物能明显改善胃癌患者预后.
针对肿瘤组织中存在血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)调控的信号通路及其受体VEGFR2进行研究, 经过收集患者临床病理信息、随访及分析, 观察VEGF/VEGFR2对胃癌患者预后的影响; 同时对VEGF/VEGFR2的研究可以为胃癌靶向药物的研究和选用提供实验数据.
VEGF/VEGFR2作为独立又相关的靶点, 相应的生物靶向制剂(贝伐珠单抗、ramucirumab)也在临床试验中, 分子机制研究指导下的重要分子的有效靶向药物的选择, 能够明显改善患者的生活质量及预后.
本文通过检测胃癌组织内VEGF和VEGFR的原位表达, 分析了他们与患者的生物学行为关系, 通过长期临床随访, 发现他们与患者的生存期有重要关系, 有重要的临床指导价值.
编辑: 郭鹏 电编:都珍珍
| 1. | Goel HL, Mercurio AM. VEGF targets the tumour cell. Nat Rev Cancer. 2013;13:871-882. [PubMed] [DOI] |
| 3. | Couto JP, Daly L, Almeida A, Knauf JA, Fagin JA, Sobrinho- Simões M, Lima J, Máximo V, Soares P, Lyden D. STAT3 negatively regulates thyroid tumorigenesis. Proc Natl Acad Sci U S A. 2012;109:E2361-E2370. [PubMed] [DOI] |
| 4. | Ferlay J, Soerjomataram I, Ervik M, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D, Bray . GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 11 [Internet]. Lyon, France: International Agency for Research on Cancer; 2013; Available from: http://globocan.iarc.fr. |
| 5. | Leung DW, Cachianes G, Kuang WJ, Goeddel DV, Ferrara N. Vascular endothelial growth factor is a secreted angiogenic mitogen. Science. 1989;246:1306-1309. [PubMed] |
| 6. | Tischer E, Gospodarowicz D, Mitchell R, Silva M, Schilling J, Lau K, Crisp T, Fiddes JC, Abraham JA. Vascular endothelial growth factor: a new member of the platelet-derived growth factor gene family. Biochem Biophys Res Commun. 1989;165:1198-1206. [PubMed] |
| 7. | Kowanetz M, Ferrara N. Vascular endothelial growth factor signaling pathways: therapeutic perspective. Clin Cancer Res. 2006;12:5018-5022. [PubMed] |
| 8. | Baeriswyl V, Christofori G. The angiogenic switch in carcinogenesis. Semin Cancer Biol. 2009;19:329-337. [PubMed] [DOI] |
| 9. | Chatterjee S, Heukamp LC, Siobal M, Schöttle J, Wieczorek C, Peifer M, Frasca D, Koker M, König K, Meder L. Tumor VEGF: VEGFR2 autocrine feed-forward loop triggers angiogenesis in lung cancer. J Clin Invest. 2013;123:1732-1740. [PubMed] |
| 10. | Grivennikov SI, Karin M. Dangerous liaisons: STAT3 and NF-kappaB collaboration and crosstalk in cancer. Cytokine Growth Factor Rev. 2010;21:11-19. [PubMed] [DOI] |
| 11. | Bronte-Tinkew DM, Terebiznik M, Franco A, Ang M, Ahn D, Mimuro H, Sasakawa C, Ropeleski MJ, Peek RM, Jones NL. Helicobacter pylori cytotoxin-associated gene A activates the signal transducer and activator of transcription 3 pathway in vitro and in vivo. Cancer Res. 2009;69:632-639. [PubMed] [DOI] |
| 12. | Tartour E, Pere H, Maillere B, Terme M, Merillon N, Taieb J, Sandoval F, Quintin-Colonna F, Lacerda K, Karadimou A. Angiogenesis and immunity: a bidirectional link potentially relevant for the monitoring of antiangiogenic therapy and the development of novel therapeutic combination with immunotherapy. Cancer Metastasis Rev. 2011;30:83-95. [PubMed] [DOI] |
| 13. | Suryawanshi A, Veiga-Parga T, Reddy PB, Rajasagi NK, Rouse BT. IL-17A differentially regulates corneal vascular endothelial growth factor (VEGF)-A and soluble VEGF receptor 1 expression and promotes corneal angiogenesis after herpes simplex virus infection. J Immunol. 2012;188:3434-3446. [PubMed] [DOI] |
| 14. | Li BH, Xu SB, Li F, Zou XG, Saimaiti A, Simayi D, Wang YH, Zhang Y, Yuan J, Zhang WJ. Stat6 activity-related Th2 cytokine profile and tumor growth advantage of human colorectal cancer cells in vitro and in vivo. Cell Signal. 2012;24:718-725. [PubMed] [DOI] |
| 15. | Waldner MJ, Wirtz S, Jefremow A, Warntjen M, Neufert C, Atreya R, Becker C, Weigmann B, Vieth M, Rose-John S. VEGF receptor signaling links inflammation and tumorigenesis in colitis-associated cancer. J Exp Med. 2010;207:2855-2868. [PubMed] [DOI] |
| 16. | Albini A, Tosetti F, Li VW, Noonan DM, Li WW. Cancer prevention by targeting angiogenesis. Nat Rev Clin Oncol. 2012;9:498-509. [PubMed] [DOI] |
| 17. | Siveen KS, Sikka S, Surana R, Dai X, Zhang J, Kumar AP, Tan BK, Sethi G, Bishayee A. Targeting the STAT3 signaling pathway in cancer: role of synthetic and natural inhibitors. Biochim Biophys Acta. 2014;1845:136-154. [PubMed] [DOI] |
| 18. | Wang M, Tan J, Coffey A, Fehrenbacher J, Weil BR, Meldrum DR. Signal transducer and activator of transcription 3-stimulated hypoxia inducible factor-1alpha mediates estrogen receptor-alpha-induced mesenchymal stem cell vascular endothelial growth factor production. J Thorac Cardiovasc Surg. 2009;138:163-71, 171.e1. [PubMed] [DOI] |
| 19. | Carbajo-Pescador S, Ordoñez R, Benet M, Jover R, García-Palomo A, Mauriz JL, González-Gallego J. Inhibition of VEGF expression through blockade of Hif1α and STAT3 signalling mediates the anti-angiogenic effect of melatonin in HepG2 liver cancer cells. Br J Cancer. 2013;109:83-91. [PubMed] [DOI] |
| 20. | Adamcic U, Skowronski K, Peters C, Morrison J, Coomber BL. The effect of bevacizumab on human malignant melanoma cells with functional VEGF/VEGFR2 autocrine and intracrine signaling loops. Neoplasia. 2012;14:612-623. [PubMed] |
| 21. | Wang Z, Si X, Xu A, Meng X, Gao S, Qi Y, Zhu L, Li T, Li W, Dong L. Activation of STAT3 in human gastric cancer cells via interleukin (IL)-6-type cytokine signaling correlates with clinical implications. PLoS One. 2013;8:e75788. [PubMed] [DOI] |
| 22. | Yaqoob U, Cao S, Shergill U, Jagavelu K, Geng Z, Yin M, de Assuncao TM, Cao Y, Szabolcs A, Thorgeirsson S. Neuropilin-1 stimulates tumor growth by increasing fibronectin fibril assembly in the tumor microenvironment. Cancer Res. 2012;72:4047-4059. [PubMed] [DOI] |
| 23. | Ellis LM, Hicklin DJ. VEGF-targeted therapy: mechanisms of anti-tumour activity. Nat Rev Cancer. 2008;8:579-591. [PubMed] |
| 24. | Lu KV, Chang JP, Parachoniak CA, Pandika MM, Aghi MK, Meyronet D, Isachenko N, Fouse SD, Phillips JJ, Cheresh DA. VEGF inhibits tumor cell invasion and mesenchymal transition through a MET/VEGFR2 complex. Cancer Cell. 2012;22:21-35. [PubMed] [DOI] |
| 25. | Kulke MH, Lenz HJ, Meropol NJ, Posey J, Ryan DP, Picus J, Bergsland E, Stuart K, Tye L, Huang X. Activity of sunitinib in patients with advanced neuroendocrine tumors. J Clin Oncol. 2008;26:3403-3410. [PubMed] [DOI] |
| 26. | Yao JC, Phan A, Hoff PM, Chen HX, Charnsangavej C, Yeung SC, Hess K, Ng C, Abbruzzese JL, Ajani JA. Targeting vascular endothelial growth factor in advanced carcinoid tumor: a random assignment phase II study of depot octreotide with bevacizumab and pegylated interferon alpha-2b. J Clin Oncol. 2008;26:1316-1323. [PubMed] [DOI] |
| 27. | Silva SR, Bowen KA, Rychahou PG, Jackson LN, Weiss HL, Lee EY, Townsend CM, Evers BM. VEGFR-2 expression in carcinoid cancer cells and its role in tumor growth and metastasis. Int J Cancer. 2011;128:1045-1056. [PubMed] [DOI] |
| 28. | Dallas NA, Fan F, Gray MJ, Van Buren G, Lim SJ, Xia L, Ellis LM. Functional significance of vascular endothelial growth factor receptors on gastrointestinal cancer cells. Cancer Metastasis Rev. 2007;26:433-441. [PubMed] |
| 29. | Greenberg JI, Shields DJ, Barillas SG, Acevedo LM, Murphy E, Huang J, Scheppke L, Stockmann C, Johnson RS, Angle N. A role for VEGF as a negative regulator of pericyte function and vessel maturation. Nature. 2008;456:809-813. [PubMed] [DOI] |
| 30. | Hamerlik P, Lathia JD, Rasmussen R, Wu Q, Bartkova J, Lee M, Moudry P, Bartek J, Fischer W, Lukas J. Autocrine VEGF-VEGFR2-Neuropilin-1 signaling promotes glioma stem-like cell viability and tumor growth. J Exp Med. 2012;209:507-520. [PubMed] [DOI] |
| 31. | Matsumoto T, Claesson-Welsh L. VEGF receptor signal transduction. Sci STKE. 2001;2001:re21. [PubMed] |
| 32. | Yang F, Tang X, Riquelme E, Behrens C, Nilsson MB, Giri U, Varella-Garcia M, Byers LA, Lin HY, Wang J. Increased VEGFR-2 gene copy is associated with chemoresistance and shorter survival in patients with non-small-cell lung carcinoma who receive adjuvant chemotherapy. Cancer Res. 2011;71:5512-5521. [PubMed] [DOI] |
| 33. | Fuchs CS, Tomasek J, Yong CJ, Dumitru F, Passalacqua R, Goswami C, Safran H, dos Santos LV, Aprile G, Ferry DR. Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet. 2014;383:31-39. [PubMed] [DOI] |