修回日期: 2014-08-20
接受日期: 2014-09-03
在线出版日期: 2014-10-18
目的: 观察糖尿病胃轻瘫(diabetic gastro-paresis, DGP)模型大鼠中Cajal间质细胞(interstitial cells of Cajal, ICC)和缝隙连接蛋白43(connexin43, Cx43)在胃窦分布的变化及胰岛素的干预作用.
方法: SD大鼠随机分为糖尿病模型组、正常对照组和胰岛素干预组, 用腹腔注射链脲佐菌素建立糖尿病大鼠模型, 于成模后10 wk时分别处死各组大鼠, 测定大鼠胃内色素残留率, 用免疫组织化学法分析胃窦ICC及Cx43的表达, 透射电镜(transmission electron microscope, TEM)观察ICC及缝隙连接的结构变化.
结果: 糖尿病组大鼠出现血糖明显升高和体质量减轻, 胃内色素残留率显著增加, 免疫组织化学显示环纵肌层内ICC分布减少, 环形肌内Cx43的表达下降, TEM可见ICC细胞器变性、胞质溶解和缝隙连接松散等改变. 胰岛素治疗可使DGP大鼠胃残留率减少, 增加ICC、Cx43的数量, 逆转其超微结构变化.
结论: ICC和Cx43数量减少、结构破坏可能是DGP发病基础之一, 而补充胰岛素可逆转糖尿病大鼠的ICC、Cx43病变从而改善胃动力障碍.
核心提示: 本实验建立糖尿病胃轻瘫(diabetic gastroparesis, DGP)大鼠模型, 对胃排空功能和胃窦Cajal间质细胞(interstitial cells of Cajal, ICC)数量、超微结构及平滑肌细胞缝隙连接蛋白43(connexin43, Cx43)表达进行体内研究, 发现DGP大鼠胃窦ICC减少, 环形肌Cx43表达下降, 胰岛素对DGP的ICC及平滑肌Cx43的形态学改变有一定治疗效果.
引文著录: 吴泉霞, 赵劢, 谭至柔, 秦荔荣, 黄雪, 张慧洁. 糖尿病胃轻瘫大鼠胃窦Cajal间质细胞和缝隙连接蛋白43的变化及胰岛素的干预作用. 世界华人消化杂志 2014; 22(29): 4399-4405
Revised: August 20, 2014
Accepted: September 3, 2014
Published online: October 18, 2014
AIM: To observe the alterations of interstitial cells of Cajal (ICC) and connexin 43 (Cx43) in gastric antrum tissue of a rat model of diabetic gastroparesis (DGP) and assess the interventional effect of insulin.
METHODS: Sprague-Dawley rats were randomly divided into a diabetic model group, a normal control group and an insulin intervention group. Diabetes was induced by intra-peritoneal injection of streptozotocin. Gastric emptying was measured, and the expression of ICC and Cx43 in the gastric antrum was analyzed by immunohistochemistry. The alterations of the ultrastructure of ICC and gap junction were observed by transmission electron microscopy (TEM) at the 10th week after modeling.
RESULTS: Blood glucose and body weight in the diabetic model group were significantly different from those in other groups. The gastric pigment remnant rate was significantly increased in the diabetic model group. Immunohistochemical staining showed that in diabetic rats, the number of ICC in the circular and longitudinal muscle layers decreased and Cx43 was lowly expressed in circular muscle layers. TEM showed organelle degeneration, cytoplasm dissolution and loosening of the structure of gap junction. Insulin could decrease the gastric pigment remnant rate, increase the number of ICC and Cx43 expression, and reverse ultrastructural changes.
CONCLUSION: The decrease of ICC expression and Cx43 expression might be one of the mechanisms responsible for DGP. Insulin can increase the expression of ICC and Cx43 and thus improve gastrointestinal disorders.
- Citation: Wu QX, Zhao M, Tan ZR, Qin LR, Huang X, Zhang HJ. Changes of interstitial cells of Cajal and connexin 43 expression in the gastric antrum of rats with diabetic gastroparesis: Implications for interventional effect of insulin. Shijie Huaren Xiaohua Zazhi 2014; 22(29): 4399-4405
- URL: https://www.wjgnet.com/1009-3079/full/v22/i29/4399.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i29.4399
糖尿病胃轻瘫(diabetic gastroparesis, DGP)是糖尿病常见慢性并发症之一, 常常表现为胃动力障碍、胃排空延迟, 可影响口服降糖药的疗效, 降低了患者的生活质量. DGP发病机制复杂, 目前研究发现Cajal间质细胞(interstitial cells of Cajal, ICC)缺失是该病的主要发病基础[1,2]. 缝隙连接蛋白43(connexin43, Cx43)是维持细胞通讯连接、电信号传导和正常节律收缩的主要连接蛋白[3]. 本研究主要探讨ICC和Cx43在DGP发生发展中的作用及相互关系.
SPF级SD大鼠34只, 体质量160-180 g, 雌雄各半, 由广西医科大学动物实验中心提供(许可证号: scxk桂2009-0002). 链脲佐菌素(streptozotocin, STZ)(Sigma公司); c-Kit抗体(sc-168, 兔多克隆抗体, 武汉博士德公司); Cx43抗体(兔多克隆抗体, 武汉博士德公司); SP试剂盒(北京中杉金桥生物公司, SP-9000); DAB显色试剂盒(北京中杉金桥生物公司, ZLI-9031); 德国罗氏活力型血糖仪(配套试纸).
1.2.1 糖尿病大鼠动物模型建立: 造模前将SD大鼠分为正常对照组10只、造模组24只. 造模前禁食不禁水12 h, 糖尿病组一次性腹腔注STZ 60 mg/kg[4-6](用0.1 mmol/L、pH 4.4柠檬酸缓冲液配制而成), 对照组予以注射等量柠檬酸钠缓冲液. 72 h后尾静脉采血, 测得血糖≥16.7 mmol/L(300 mg/dL)且能维持1 wk以上者为造模成功. 24只大鼠全部造模成功, 5只中途死亡, 最后纳入实验19只, 其中糖尿病组9只, 胰岛素干预组10只. 胰岛素干预组于成模6 wk时每天皮下注射甘精胰岛素(8 U/kg), 将血糖控制在6-12 mmol/L, 持续4 wk.
1.2.2 一般指标观察: 造模后监测并记录大鼠的精神状况、活动状况、皮毛情况、进食量、饮水量、尿量、大便的量及性状和死亡情况等, 每周测一次体质量, 取材前再次记录大鼠体质量.
1.2.3 血糖测定: 在造模后第3天、第1周采尾血测随机血糖, 取材前再测大鼠空腹尾血血糖.
1.2.4 大鼠胃内色素残留率: 大鼠禁食16 h后, 将0.01%的美蓝溶液2 mL胃内灌注, 30 min后脱臼处死大鼠, 迅速开腹, 结扎胃贲门和幽门, 取出全胃, 沿胃大弯侧剪开胃, 将胃内残留物用8 mL蒸馏水冲洗并收集, 3500 r/min离心15 min, 取上清液用分光光度计在640 nm波长下测定吸光度(A)值. 大鼠胃内色素残留率 = 实测美蓝吸光度/标准美蓝吸光度×100%. 胃内残留色素率越高说明胃排空功能越差.
1.2.5 免疫组织化学(Streptavidin-Perosidase法)分析ICC、Cx43的表达情况: 取大鼠胃窦组织(距幽门0.5 cm)用PBS冲洗、4%多聚甲醛固定, 常规脱水、包埋、切片, 经过脱蜡、抗原修复、过氧化氢灭活、血清封闭. 滴加c-Kit(1:
50)、Cx43(1:100)50 μL后4 ℃过夜, 先后滴加生物素标记的二抗及辣根过氧化酶各50 μL, 室温孵育15 min, DAB显色1-10 min, 苏木素衬染细胞核, 冲洗、封片, 显微镜观察. 胞膜上或胞质内出现棕黄色片状或颗粒状物为阳性反应. 每张切片选择3个高倍镜视野(×200), 应用Image-Pro Plus 6.0图像分析软件计算累积光密度值(IA).
1.2.6 电镜观察: 取小块胃窦组织清洗吸干后, 立即放入50 g/L戊二醛中固定. 经前固定、漂洗、后固定、漂洗、块染、脱水、浸渍后包埋成块, 60 ℃恒温箱36 h, 光镜下半薄切片用亚甲蓝染色定位, 确定组织分层后, LKB-Ⅱ超薄切片机切片, 保留环形肌、纵形肌及部分黏膜层, 用日立透射电子显微镜H7650观察、照相.
统计学处理 结果以mean±SD表示, 用SPSS16.0统计软件对数据进行分析, 数据统计采用成组t检验, P<0.05为差异具有统计学意义.
对照组大鼠一般状况良好, 皮毛光滑, 活动正常, 进食量、饮水量、尿量、大便量及性状无明显改变, 体质量逐渐增加, 中途无死亡. 糖尿病模型组大鼠于造模后第3天开始出现多饮、多食、多尿, 此后一直持续, 体质量未见增长; 4 wk后部分大鼠食量开始减少仍有多饮、多尿外, 大便稀便与干结便均可见; 6 wk时绝大部分大鼠有多饮多尿, 异常消瘦、精神萎靡、反应迟钝、皮毛疏松无光泽、背部的毛发部分脱落, 大便干稀不定.
造模3 d后, 糖尿病组大鼠血糖维持在16.7 mmol/L以上, 实验结束时检测糖尿病组大鼠平均血糖明显高于正常对照组(P<0.01), 干预组大鼠血糖介于糖尿病组和对照组之间, 与两组相比差异均有统计学意义(P<0.01)(表1).
糖尿病组大鼠胃内色素残留率较正常对照组明显升高(P<0.01), 干预组较糖尿病组显著改善(P<0.05)(表1).
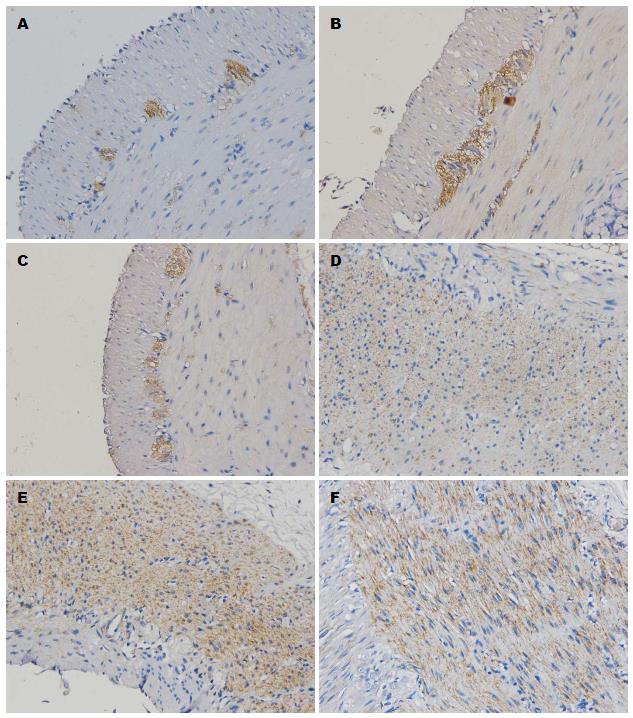
ICC主要分布在环形肌与纵肌层之间, Cx43阳性细胞分布在环形肌内, 糖尿病组胃窦组织ICC、Cx43阳性细胞较干预组、对照组均明显减少(P<0.01)(表1, 图1).
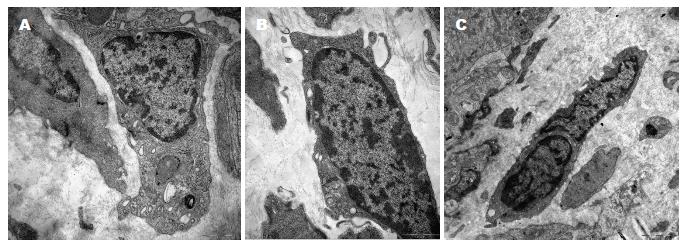
对照组大鼠胃窦ICC主要分布在环形肌层之间以及环形肌层与纵形肌层之间的肠神经丛周围, 呈纺锤体状, 基膜较完整, 异染色质较多, 核大, 占细胞大部分, 形状多不规则, 核周胞浆较少, 有丰富的滑面内质网、线粒体和高尔基体, 与平滑肌细胞间有大量缝隙连接. 糖尿病组大鼠胃窦ICC与平滑肌细胞、神经细胞、ICC之间的细胞连接结构破坏, 连接松散, 缝隙连接明显减少; 部分基膜与细胞膜分离, 形成空洞, 线粒体肿胀、空泡样变, 粗面内质网扩张, 部分脱颗粒, 核膜皱缩. 干预组ICC、缝隙连接病变改善明显(图2).
DGP这个概念在1958年由Kassander首次提出, 指的是继发于糖尿病的由胃自主神经功能紊乱而引起的胃动力低下为特点的糖尿病慢性并发症. 国外流行病学调查显示胃轻瘫10年累积比例在1、2型糖尿病分别为5.2%和1.0%, 约0.2%发生在健康人群中[7]. 最新指南明确了胃轻瘫的诊断标准: (1)胃轻瘫症状; (2)排除幽门部器质性病变导致的出口梗阻; (3)确诊胃排空延迟. 尽管胃轻瘫的病因很多, 但糖尿病是普遍公认的病因, 而美国一项研究显示, DGP患者以胃排空延迟和胃容受功能受损为主要特征, 表现为恶心、呕吐、早饱等一系列消化系症状[8], 影响患者口服降糖药的疗效, 导致血糖控制不佳. DGP的发病机制尚不明确, 目前认为, DGP是多因素导致的疾病, 自主神经病变、肠道神经病变、ICC异常、血糖急性波动、肠促胰素类药物以及心理因素, 都可以引发胃动力障碍[9].
ICC是一种特殊类型的间质细胞, 广泛分布于食管、胃肠道及消化系括约肌, 是胃肠道的起搏细胞, 研究已证实ICC产生并传播慢波电位, 同时介导平滑肌细胞和神经细胞间的信号传递, 与肠神经、平滑肌共同形成胃肠动力的基本单位[10-12]. 目前发现ICC与多种胃肠功能紊乱的疾病发生有关, 主要表现为慢波节律与收缩功能的变化, 如贲门失弛缓、慢传输型便秘、先天性巨结肠等[13-15]. ICC特异性表达酪氨酸激酶膜受体c-kit, 因此利用c-kit免疫反应性可在光镜下观察到ICC改变. 在本实验中发现糖尿病组ICC较对照组数量减少, 在电镜下可见ICC胞质内空洞形成, 线粒体嵴溶解, 部分呈空泡样改变, 可能导致ICC活动所需能量合成减少, 使其慢波起搏功能受到影响; 同时内质网、高尔基体等细胞器减少, 粗面内质网扩张, 部分脱颗粒, 说明ICC合成功能减弱, 各类递质合成减少, 细胞间信号传递受到影响; 核膜皱缩, 核间隙增宽, 细胞间的缝隙连接减少, 提示其作为平滑肌细胞和神经细胞间的中介功能下降. ICC数量减少及超微结构改变, 引起慢波产生及传播障碍, 使平滑肌收缩运动减少, 影响了胃排空, 导致出现胃轻瘫症状.
缝隙连接(gap junction, GJ)是相邻细胞间的膜通道结构, 以GJ为途径进行细胞间信息交流, 称为缝隙连接细胞间通讯(gap junction inter-cellular communication, GJIC), GJ由相邻细胞膜的2个连接子组成, 每个连接子包含6个缝隙连接蛋白(connexin, Cx), Cx是构成GJ的基本结构和功能蛋白, 已知的Cx有20多种, 其中Cx43是人类GJ组成的主要连接蛋白, 广泛分布在心脏、中枢神经系统、肺组织和胃肠道内, 调节细胞的生长、分化及凋亡, 参与细胞间物质交换和电信号传递, 协调细胞间活动的一致性, 在维持细胞的连接通讯、电信号传导和正常的节律性收缩中起重要作用[3,16]. 研究证实, 在不同疾病中Cx43的表达和调控均发生改变, 如心脏Cx43表达缺失, 心肌梗死发生率明显增加[17]. Cx43调节的GJ通讯功能是急性肺损伤时肺组织促炎反应的基础[18]. 在中枢系统内Cx43的表达量影响血脑屏障通透性, 研究发现阻断Cx43表达可减低缺血创伤后脑水肿[19]. Cx43在机体多种器官的平滑肌细胞表达, 其表达量的高低与其功能紧密相关[20,21]. 在胃肠道内, 肠神经-ICC-平滑肌构成的网络结构是胃肠动力的基本功能单位, 他们之间存在丰富的GJ, 研究发现Cx43与胃肠运动密切相关[22], 而且Cx43的减少导致细胞间信号传递障碍, 可能是先天性巨结肠肠动力障碍的发病机制之一[23-25]. 但ICC与Cx43在DGP中关系及改变文献报道较少. 在本实验中观察到DGP模型中Cx43与ICC变化趋势相同, 数量较对照组明显减少, 电镜下可见缝隙连接结构松散、不连贯, 推测Cx43的异常致GJIC破坏, 引起平滑肌细胞、神经细胞及ICC间的物质交换不畅和信号传递障碍, 导致动作电位传导受阻, 最终影响了胃的舒缩活动, 可能为DGP病理生理学基础之一.
Horváth等[26]认为ICC缺失可能与糖尿病时胰岛素或胰岛素样生长因子(insulin-like growth factor-1, IGF-1)减少有关, 实验发现在离体培养胃组织时添加胰岛素或IGF-1可以避免ICC网络的破坏和减少, 推测胰岛素或IGF-1可能通过某种信号通路转导间接调节ICC的合成. 在本实验中对干预组大鼠予以胰岛素治疗, 将血糖控制在6-12 mmol/L, 实验结束时测定胃排空, 发现干预组大鼠胃内色素残留率低于糖尿病组. 免疫组织化学和电镜下可观察到ICC、Cx43部分恢复, 超微结构损害得到改善. 有研究发现[27]胃肠道平滑肌细胞胞膜上有胰岛素、IGF-1受体表达, 此外平滑肌细胞还可生成干细胞因子(stem cell factor, SCF), SCF在ICC的分化、增殖和表型维持中起重要作用[28], 推测糖尿病时胰岛素/IGF-1减少, 平滑肌细胞萎缩导致SCF表达减少可能是ICC缺失的重要原因. 袁玉丰等[29]发现给糖尿病大鼠补充IGF-1可诱导结肠平滑肌细胞表达SCF. 已有研究[30]证实IGF-1可通过浓度和时间依赖性方式, 调节胃平滑肌细胞中SCF的表达, IGF-1与胃平滑肌胞膜上IGF-1Rα结合, 促进SCF合成, 该作用受到MAPK/ERK信号通路的调控. 但胰岛素或IGF-1怎样调控Cx43表达尚未清楚, DGP时Cx43与ICC的改变是否还存在其他影响因素, 都有待进一步的研究.
糖尿病胃轻瘫(diabetic gastroparesis, DGP)是糖尿病常见慢性并发症之一, 常常表现为胃动力障碍、胃排空延迟, 可影响口服降糖药的疗效, 严重影响患者生活质量, DGP的发病机制尚不明确, 目前临床上也缺乏有效的治疗方法.
宁钧宇, 副研究员, 北京市疾病预防控制中心卫生毒理所
Cajal间质细胞(interstitial cells of Cajal, ICC)是胃肠道起搏细胞, 与多种胃肠动力性疾病相关, 是近年的研究热点, 缝隙连接蛋白43(connexin43, Cx43)是ICC网络结构的重要组成部分, 具有广阔的研究前景.
Ordog等用NOD小鼠研究ICC缺乏在糖尿病胃轻瘫的作用, 发现NOD小鼠胃排空率、环肌层胃电活动明显低于对照组, 电镜下ICC细胞结构破坏明显. 该研究提示ICC网络样结构破坏可能是DGP的重要原因.
本实验通过建立DGP大鼠模型, 观察ICC、Cx43在胃窦分布及超微结构的变化和胰岛素干预对胃动力障碍和ICC、Cx43的影响, 探讨两者在该病的相互关系及胰岛素的调控作用, 在国内较少报道.
以Cx43作为切入点探讨ICC调节胃肠动力的机制, 外源性补充胰岛素可逆转ICC、Cx43的病变, 将为阐明DGP的病因及治疗提供新的思路.
干细胞因子(stem cell factor, SCF): 是ICC的特异性标志物Kit受体的天然配基, 是一种多种能细胞生长因子, 参与机体发育中的多种细胞生长, 在细胞增殖、分化和迁移过程中发挥重要的调控作用.
我国成人糖尿病发病率接近10%, 本文选题有一定创新性, 研究方法科学, 结果可靠, 对糖尿病及其并发症的发病与治疗具有重要理论及实践意义.
编辑: 韦元涛 电编:都珍珍
| 1. | Ordög T. Interstitial cells of Cajal in diabetic gastroenteropathy. Neurogastroenterol Motil. 2008;20:8-18. [PubMed] [DOI] |
| 2. | Kim SJ, Park JH, Song DK, Park KS, Lee JE, Kim ES, Cho KB, Jang BK, Chung WJ, Hwang JS. Alterations of colonic contractility in long-term diabetic rat model. J Neurogastroenterol Motil. 2011;17:372-380. [PubMed] [DOI] |
| 3. | Márquez-Rosado L, Solan JL, Dunn CA, Norris RP, Lampe PD. Connexin43 phosphorylation in brain, cardiac, endothelial and epithelial tissues. Biochim Biophys Acta. 2012;1818:1985-1992. [PubMed] [DOI] |
| 6. | Wang Y, Xu XY, Tang YR, Yang WW, Yuan YF, Ning YJ, Yu YJ, Lin L. Effect of endogenous insulin-like growth factor and stem cell factor on diabetic colonic dysmotility. World J Gastroenterol. 2013;19:3324-3331. [PubMed] [DOI] |
| 7. | Choung RS, Locke GR, Schleck CD, Zinsmeister AR, Melton LJ, Talley NJ. Risk of gastroparesis in subjects with type 1 and 2 diabetes in the general population. Am J Gastroenterol. 2012;107:82-88. [PubMed] [DOI] |
| 8. | Camilleri M, Parkman HP, Shafi MA, Abell TL, Gerson L. Clinical guideline: management of gastroparesis. Am J Gastroenterol. 2013;108:18-37; quiz 38. [PubMed] [DOI] |
| 9. | Kashyap P, Farrugia G. Diabetic gastroparesis: what we have learned and had to unlearn in the past 5 years. Gut. 2010;59:1716-1726. [PubMed] [DOI] |
| 10. | Hennig GW, Spencer NJ, Jokela-Willis S, Bayguinov PO, Lee HT, Ritchie LA, Ward SM, Smith TK, Sanders KM. ICC-MY coordinate smooth muscle electrical and mechanical activity in the murine small intestine. Neurogastroenterol Motil. 2010;22:e138-e151. [PubMed] [DOI] |
| 11. | Al-Shboul OA. The importance of interstitial cells of cajal in the gastrointestinal tract. Saudi J Gastroenterol. 2013;19:3-15. [PubMed] [DOI] |
| 12. | Huizinga JD, Chen JH. Interstitial cells of Cajal: update on basic and clinical science. Curr Gastroenterol Rep. 2014;16:363. [PubMed] [DOI] |
| 13. | Gockel I, Bohl JR, Eckardt VF, Junginger T. Reduction of interstitial cells of Cajal (ICC) associated with neuronal nitric oxide synthase (n-NOS) in patients with achalasia. Am J Gastroenterol. 2008;103:856-864. [PubMed] [DOI] |
| 14. | Lyford GL, He CL, Soffer E, Hull TL, Strong SA, Senagore AJ, Burgart LJ, Young-Fadok T, Szurszewski JH, Farrugia G. Pan-colonic decrease in interstitial cells of Cajal in patients with slow transit constipation. Gut. 2002;51:496-501. [PubMed] |
| 15. | Nemeth L, Maddur S, Puri P. Immunolocalization of the gap junction protein Connexin43 in the interstitial cells of Cajal in the normal and Hirschsprung's disease bowel. J Pediatr Surg. 2000;35:823-828. [PubMed] [DOI] |
| 16. | Cone AC, Cavin G, Ambrosi C, Hakozaki H, Wu-Zhang AX, Kunkel MT, Newton AC, Sosinsky GE. Protein kinase Cδ-mediated phosphorylation of Connexin43 gap junction channels causes movement within gap junctions followed by vesicle internalization and protein degradation. J Biol Chem. 2014;289:8781-8798. [PubMed] [DOI] |
| 17. | Roell W, Lewalter T, Sasse P, Tallini YN, Choi BR, Breitbach M, Doran R, Becher UM, Hwang SM, Bostani T. Engraftment of connexin 43-expressing cells prevents post-infarct arrhythmia. Nature. 2007;450:819-824. [PubMed] [DOI] |
| 18. | Westphalen K, Gusarova GA, Islam MN, Subramanian M, Cohen TS, Prince AS, Bhattacharya J. Sessile alveolar macrophages communicate with alveolar epithelium to modulate immunity. Nature. 2014;506:503-506. [PubMed] [DOI] |
| 19. | 吴 中亮, 廖 春华, 任 宁. 缝隙连接蛋白43与创伤后脑水肿相关性研究. 中华神经外科疾病研究杂志. 2008;7:201-204. |
| 20. | Khanam T, Burnstock G. Changes in expression of P2X1 receptors and connexin 43 in the rat myometrium during pregnancy. Fertil Steril. 2007;88:1174-1179. [PubMed] [DOI] |
| 21. | Negoro H, Kanematsu A, Imamura M, Kimura Y, Matsuoka R, Tanaka M, Tabata Y, Ogawa O. Regulation of connexin 43 by basic fibroblast growth factor in the bladder: transcriptional and behavioral implications. J Urol. 2011;185:2398-2404. [PubMed] [DOI] |
| 22. | McClain JL, Grubišić V, Fried D, Gomez-Suarez RA, Leinninger GM, Sévigny J, Parpura V, Gulbransen BD. Ca2+ responses in enteric glia are mediated by connexin-43 hemichannels and modulate colonic transit in mice. Gastroenterology. 2014;146:497-507.e1. [PubMed] [DOI] |
| 25. | Wang J, Mou Y, Zhang Q, Zhang F, Yang H, Zhang W, Li A. Expression and significance of neuroligins in myenteric cells of Cajal in Hirschsprung's disease. PLoS One. 2013;8:e67205. [PubMed] [DOI] |
| 26. | Horváth VJ, Vittal H, Ordög T. Reduced insulin and IGF-I signaling, not hyperglycemia, underlies the diabetes-associated depletion of interstitial cells of Cajal in the murine stomach. Diabetes. 2005;54:1528-1533. [PubMed] |
| 27. | Horváth VJ, Vittal H, Lörincz A, Chen H, Almeida-Porada G, Redelman D, Ordög T. Reduced stem cell factor links smooth myopathy and loss of interstitial cells of cajal in murine diabetic gastroparesis. Gastroenterology. 2006;130:759-770. [PubMed] [DOI] |
| 28. | Lin L, Xu LM, Zhang W, Ge YB, Tang YR, Zhang HJ, Li XL, Chen JD. Roles of stem cell factor on the depletion of interstitial cells of Cajal in the colon of diabetic mice. Am J Physiol Gastrointest Liver Physiol. 2010;298:G241-G247. [PubMed] [DOI] |