修回日期: 2014-08-27
接受日期: 2014-09-03
在线出版日期: 2014-10-18
目的: 建立乳鼠结肠组织器官培养体系, 分析转化生长因子β1(transforming growth factor-β1, TGF-β1)对组织上皮细胞表面极性特征的影响.
方法: 在乳鼠结肠组织器官培养过程中添加10 ng/mL TGF-β1干预48 h后, 采用免疫组织化学、RT-PCR技术检测培养组(无添加TGF-β1)和干预组结肠组织中Crumbs3、E-cadherin、α-平滑肌肌动蛋白(alpha smooth muscle actin, α-SMA)的表达分布变化.
结果: 贴壁培养48 h后, 可见培养组(无添加TGF-β1)组织块周围有铺路石样细胞爬满培养板, Crumbs3主要表达在上皮细胞顶端膜位置(P<0.01), E-cadherin主要表达在结肠组织黏膜上皮层, α-SMA沿隐窝轴单层表达和少量表达在平滑肌层. 而添加TGF-β1干预后的结肠组织周边细胞形态大小不一, E-cadherin主要表达在细胞质, 并呈低表达(P<0.05), α-SMA则大量表达在活化态的肌成纤维细胞和间充质中(P<0.01). 培养组E-cadherin、Crumbs3的mRNA的表达量在48 h后明显低于干预组(P<0.05), 而干预组中α-SMA的mRNA表达高于培养组(P<0.01).
结论: TGF-β1可诱导乳鼠结肠上皮细胞极性蛋白Crumbs3的表达下降并导致肠上皮细胞表型的改变.
核心提示: 转化生长因子β1(transforming growth factor-β1, TGF-β1)参与调节细胞的增殖、分化、发育和凋亡. 是肿瘤微环境中重要的生长因子. TGF-β1抑制极性蛋白的表达和诱导上皮细胞表型转换, 通过这一潜在的作用机制修饰和改造间充质微环境.
引文著录: 付道时, 文彬, 张凌杭, 李茹柳. 乳鼠结肠组织体外培养过程中TGF-β1对上皮细胞极性特征的影响. 世界华人消化杂志 2014; 22(29): 4386-4392
Revised: August 27, 2014
Accepted: September 3, 2014
Published online: October 18, 2014
AIM: To establish a neonatal rat colon tissue culture system and to analyze the effect of transforming growth factor-β1 (TGF-β1) on polarity characteristics of epithelial cells.
METHODS: Forty-eight hours after 10 ng/mL TGF-β1 was added during the process of culture of colon tissues from neonatal rats, the expression changes of Crumbs3, E-cadherin and alpha smooth muscle actin (α-SMA) in the control group (without TGF-β1) and intervention group (with TGF-β1) were detected by IHC and RT-PCR.
RESULTS: Pavement-like cells could be seen around tissues in the control group after 48 h; Crumbs3 was mainly located at the apical membrane of epithelial cells (P < 0.01); a single layer of α-SMA-positive myofibroblasts along the crypt axis was visible, and α-SMA was lowly expressed in the smooth muscle. However, cells in the intervention group showed different morphology and size; E-cadherin was mainly present in the cytoplasm, and E-cadherin expression was lower than that in the control group (P < 0.05); α-SMA was abundantly expressed in activated fibroblasts (P < 0.01). The mRNA expression of E-cadherin and Crumbs3 in the control group was significantly lower than that in the intervention group (P < 0.05), while the mRNA expression of α-SMA in the intervention group was significantly higher than that in the control group (P < 0.01).
CONCLUSION: TGF-β1 induced down-regulation of Crumbs3 and then dramatically changed the phenotype of epithelial cells.
- Citation: Fu DS, Wen B, Zhang LH, Li RL. TGF-β1 influences polarity characteristics of epithelial cells during process of culture of colon tissues from neonatal rats in vitro. Shijie Huaren Xiaohua Zazhi 2014; 22(29): 4386-4392
- URL: https://www.wjgnet.com/1009-3079/full/v22/i29/4386.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i29.4386
微环境与肿瘤之间是密不可分的功能整体, 这一概念与100多年前Paget提出的"种子-土壤"学说不谋而合[1]. 肿瘤微环境(tumor microenvironment, TEM)是指肿瘤发生发展过程中所处的内环境. 由肿瘤细胞本身、间质细胞、微血管、细胞外基质等构成. 同时也充满着各种细胞因子、生长因子和趋化因子. 比如肿瘤坏死因子、转化生长因子β1(transforming growth factor-β1, TGF-β1)、血管内皮生长因子、白介素等[2-4]. 因此TEM影响肿瘤的发生发展、预后转移. 同时, 肿瘤细胞通过直接(释放各种因子)或间接(诱导组织缺氧、坏死)的各种手段, 引诱或者激活非肿瘤细胞如上皮细胞, 来修饰肿瘤微环境[5,6]. 作为肿瘤微环境中重要的生长因子之一, TGF-β1是被广泛研究和认可诱导上皮细胞表型转化的信号分子. TGF-β1通过对细胞周期的异常调节, 促进上皮细胞间叶化, 诱导血管生成, 增加蛋白酶以及细胞外基质沉积物的表达, 减低免疫监视等, 从而修饰改造肿瘤微环境而促进癌症的发生[7-9]. 我们通过在乳鼠结肠组织器官培养过程中添加TGF-β1, 探讨TGF-β1与组织细胞极性和细胞表型的关系, 研究TGF-β1在微环境中的潜在作用机制.
出生3 d的SD大鼠, 购自广东省实验动物中心, 许可证号: SCXK(粤)2013-0002, 每次培养取5只新生乳鼠, 雌雄均可. DMEM高糖培养基(Gibco), 重组人表皮生长因子(PeproTech), 牛垂体提取物(Gibco), TGF-β1(PeproTech), 青链霉素(Gibco), 氢化可的松(MPBIO), 谷氨酰胺(GlutaMAX-Ⅰ Gibco), 3110 Series Ⅱ CO2培养箱(Nthermo), TH4-200型荧光倒置显微镜(日本OLYMPUS).
1.2.1 完全培养基配制: DMEM高糖培养基添10 g/L重组人表皮生长因子, 青、链霉素混合液(青霉素100 U/mL, 链霉素100 μg/mL), 5 mg/L牛垂体提取物, 谷氨酰胺10 mL/L[10-12], TGF-β1 10 ng/mL, 氢化可的松3 μg/mL. 混匀后4 ℃保存.
1.2.2 组织块器官培养: 取3 d龄乳鼠置于750 mL/L乙醇10 min消毒处死后无菌条件下取出结肠组织. 去除肠系膜, 血管, 内容物. 用4 ℃ PBS(添加青链霉素200000 U/L)冲洗至澄清. 纵向剪开, 剪碎成1-3 mm3. 将组织贴壁于100 μm的细胞滤膜上(BD Falcon cell strainer), 然后放置于六孔培养板中. 待贴壁成功, 添加1-3 mL培养液至刚好覆盖组织块, 构成气液平面. 放置于37 ℃ CO2培养箱. 每天更换培养液.
1.2.3 免疫组织化学检测: 所有标本均经4%多聚甲醛固定, 常规石蜡包埋, 采用4 μm厚连续切片. 常规脱蜡水化, PBS冲洗, 3%H2O2灭活内源性过氧化物酶, 微波修复15 min, 加入α-平滑肌肌动蛋白(alpha smooth muscle actin, α-SMA)(ab124964 抗体稀释浓度1:1000)、E-cadherin(ab15148 抗体稀释浓度为1:50)、Crumbs3(ab180835 抗体稀释度为1:100)、CK18(bs1339r 抗体稀释浓度为1:100)4 ℃过夜, PBS冲洗3次, 滴加相应二抗Goat Anti-Rabbit lgG(HRP)(ab136817抗体稀释浓度1:1000)37 ℃温箱孵育30 min, 具体步骤按试剂盒说明书操作. DAB显色, 苏木精复染, 常规乙醇脱水, 二甲苯透明, 中性树胶封片, 显微镜下观察结果. 每例标本均用PBS代替一抗作阴性对照. 应用IPP6.0病理图象分析软件测定各组免疫阳性产物的光密度(A)值. 每张切片随机测定6个视野, 同时测定同一张切片上组织的A值作为背景, 免疫反应产物的A值减去背景A值得到校正的A值(CA值), 即为各阳性产物的实际吸光度值, 然后求平均值作为该样本的CA值. 用CA值进行分析和比较, 以避免染色过程中的非特异性染色等导致的误差.
1.2.4 采用反转录酶-聚合酶链锁反应技术进行各蛋白mRNA检测: 收集乳鼠结肠组织, 弃去培养液, D-hanks液洗涤组织2遍, 按照TRIzol试剂(美国Invitrogen公司)说明书提供的方法从组织中提取总RNA, 逆转录合成cDNA第一链. 采用Primer premier 6.0软件设计引物, 引物序列及引物长度如表1. 内参照为甘油醛-3-磷酸脱氢酶(GAPDH). 取2 μL cDNA作为模板, 2×SYBR Premix Ex Taq 10 μL, 上下游引物终浓度为0.4 μmol/L, 加灭菌蒸馏水至总体积20 μL. 每样本3管复孔, 放入实时定量PCR仪(CFX96: Bio-Rad)中进行RT-PCR反应. 2步法PCR扩增程序: 95 ℃预变性1 min, 95 ℃变性6 s, 60 ℃退火20 s, 40个循环. 反应结束后确认RT-PCR扩增曲线和熔解曲线, 采用2-△△Ct法对数据进行相对定量分析.
| 基因 | 引物序列(5'-3') | 扩增长度(bp) |
| Crumbs3 | 上游: cttgtcctcagaggccatcgtg | 101 |
| 下游: ctcgaagttttctcattagcagg | ||
| E-cadherin | 上游: gaggtctacaccttcctggtg | 137 |
| 下游: tctgtagacactttgaatcgg | ||
| α-SMA | 上游: catcacgaactgggatgacatg | 133 |
| 下游: catcttctccctgttggctttag | ||
| GAPDH(内对照) | 上游: ggtcggtgtgaacggatttgg | 121 |
| 下游: ggtcggtgtgaacggatttgg |
统计学处理 各组实验数据以mean±SE表示, 采用SPSS16.0统计软件, 计量资料进行均数间比较采用t检验. P<0.05为差异具有统计学意义.
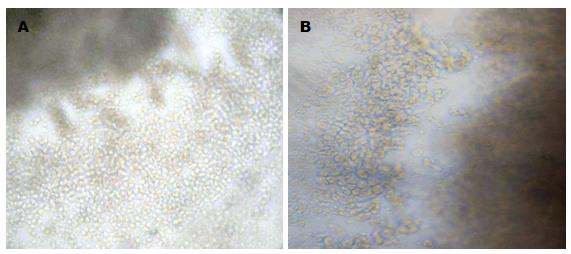
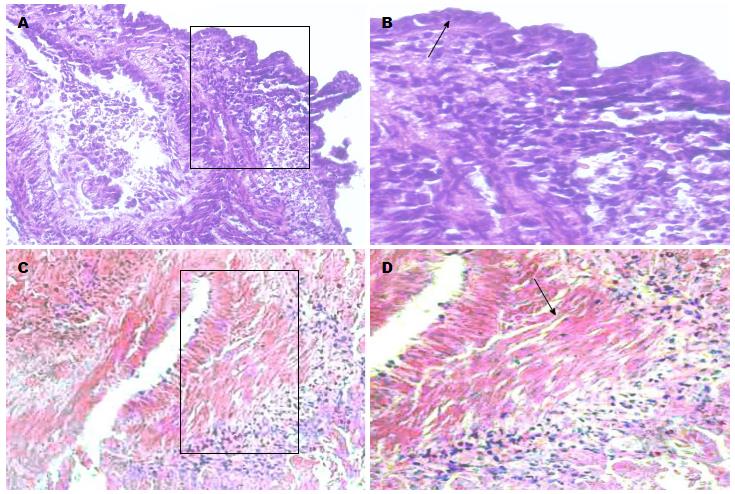
乳鼠结肠组织完全培养基培养48 h后可见铺路石样紧密排列的单层上皮细胞(图1A), 乳鼠结肠组织HE染色结果显示培养组的乳鼠结肠组织仍然维持黏膜上皮层结构, 可见紧密排列的上皮细胞(图2B箭头所示), 细胞核含染色质较多, HE着色一般很深. 细胞角蛋白是上皮组织的特征性抗原成分, 本实验选用CK18(bs1339r)抗体来鉴定乳鼠结肠上皮细胞, 培养组乳鼠结肠组织整个黏膜上皮层可见棕褐色染色(图3G). 而TGF-β1干预后的结肠组织周边的细胞大小形态不一, 间隙较大(图1B), HE染色结果显示上皮细胞排列疏散, 表型出现改变, 整个结肠组织以大量细长的成纤维细胞为主(图2D), 并且成纤维细胞的标志物α-SMA呈高表达(图3C).
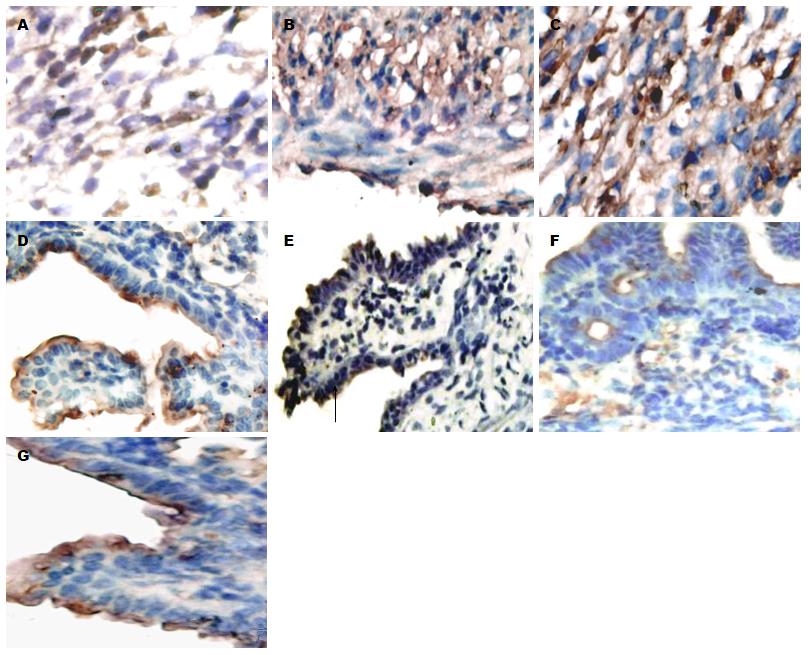
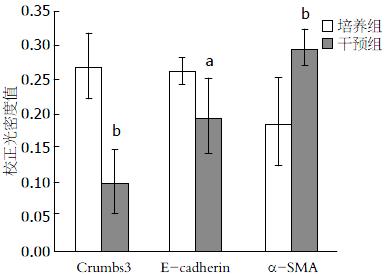
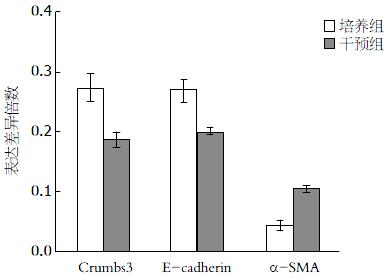
在培养组(无添加TGF-β1)的结肠组织中, Crumbs3主要表达在上皮细胞顶端膜位置(图3D), E-cadherin主要表达在结肠组织黏膜上皮层, 且分化越明显的地方棕褐色染色颜色更深(图3E箭头所示), α-SMA沿隐窝轴单层表达和少量表达在平滑肌层(图3F). 而添加TGF-β1干预后的结肠组织中, E-cadherin、Crumbs3主要表达在细胞质(图3A, B), α-SMA则大量表达在活化态的肌成纤维细胞和间充质中(图3C). 各蛋白不仅在定位有变化, 48 h后培养组中Crumbs3的光密度值显著高于干预组(0.2706±0.0484 vs 0.1005±0.0488, P<0.01). E-cadherin在培养组和干预组的光密度值分别为0.2643±0.0192、0.1967±0.0541, P<0.05. α-SMA在实验组和干预组的光密度值分别为0.1867±0.0633、0.2957±0.0249, P<0.01(图4). E-cadherin在TGF-β1干预后开始表达下降而α-SMA则表达增高.
48 h后培养组Crumbs3的mRNA的表达量显著高于干预组(0.2735±0.0208 vs 0.1859±0.0128, P<0.05). E-cadherin在培养组和干预组的mRNA的表达量分别为0.2681±0.0210、0.1983±0.0086, P<0.05. α-SMA在实验组和干预组的mRNA的表达量分别为0.0431±0.0084、0.1056±0.0041, P<0.01(图5). E-cadherin的mRNA在TGF-β1干预后开始表达下降而α-SMA的mRNA则表达增高.
20世纪60年代, Browning等[13]在体外成功地培养人结肠黏膜组织, 并维持其正常形态和组织功能达24 h. 这一重大突破(之前的培养对象仅限于胚胎组织)为生长因子和细胞因子对肠道增殖和分化的影响、肿瘤发生发展过程的研究提供了科学的可行手段[14,15]. Dame等[16]用无血清器官培养方法培养正常和息肉结肠组织48 h, 获得了典型的组织特征. 同时明确强调胎牛血清无益于人结肠组织的培养. 这一结果与我们前期的人大肠癌癌旁组织体外培养研究结果一致. 我们发现血清的存在不利于隐窝结构的维持, 血清浓度越高肠隐窝微架构丧失越快[17]. 目前原代培养结肠组织的困难比较大而且复杂. 然而器官培养模型更接近人体内环境[18], 符合微环境理论要求, 值得深入探索. 我们以Dame的培养方法为基础, 在参考国内外文献的基础上优化培养基的配制, 在无TGF-β1的干预下, 乳鼠结肠组织仍维持黏膜上皮层结构(图2B, 3G). 这一实验体系的初步建立为我们后期研究结肠生理病理垫定了基础.
上皮组织(肠、肾、肝、肺、乳房、前列腺等)具有高度极性的特征. 从组织水平来说, 上皮细胞形成多细胞结构进而构成两极分化的组织. 从而维持组织的完整结构和其正常生理功能. 从细胞水平来说, 上皮细胞利用其不对称分布的胞质和跨膜蛋白来维持细胞结构和调控细胞转换信号[19-21]. 然而, 肿瘤病理学家发现在肿瘤启动的早期, 组织和细胞极性就已经开始丧失[22,23]. Crumbs极性蛋白家族由Pals1、PATJ和Crumbs构成. 最初是在果蝇上皮细胞研究中得到确认, 主要负责上皮细胞顶端区域的形成[24,25]. 在对Crumbs的功能研究上, 最新的研究表明Crumbs3通过黏合Expanded蛋白来调控Hippo信号通路, 从而起到肿瘤抑制作用[26]. 我们在结肠组织培养过程中, 添加TGF-β1干预48 h后, 极性蛋白Crumbs3的表达显著下降. 作为上皮细胞和分化的标志物E-cadherin也显著丢失, 而只在活化态的成纤维细胞中表达的α-SMA则高表达. 这有可能是转化生子因子直接靶向极性蛋白分子, 抑制Crumbs3的表达, 从而破坏上皮细胞紧密连接功能和组织完整性, 进而为上皮细胞表型的恶性转换提供了基础. 而上皮细胞恶性表型的主要表现为上皮细胞间充质样转变、上皮细胞间的黏附功能消失、迁移运动性增强、甚至抵抗凋亡[27-29]. 在我们的实验研究中发现, 添加TGF-β1干预后, 上皮细胞标志物E-cadherin不仅表达下降, 而且由胞膜转向胞质表达-恶性表型的标志, 而作为间充质细胞的标志物α-SMA呈高表达, 形成肌动蛋白骨架、分泌大量生长因子加速细胞表型的恶性转换, 进一步活化间充质微环境, 为肿瘤的启动甚至转移营造更为有利的微环境.
TGF-β1在结肠肿瘤中所扮演的角色复杂而矛盾[30], 然而其抑制极性蛋白Crumbs3的表达并使得肠上皮细胞出现恶性表型的转换. 对这一修饰改造间充质微环境的作用的研究可能为临床结肠肿瘤启动早期诊断和治疗带来新思路. 但极性蛋白与细胞表型转换的具体相关机制也有待进一步研究.
微环境与肿瘤细胞之间是密不可分的功能整体. 人们开始越加关注肿瘤细胞赖以生存和生长的微环境. 转化生长因子β1(transforming growth factor-β1, TGF-β1)是肿瘤微环境的生长因子之一, TGF-β1近年来成为广泛研究和认可诱导上皮细胞表型转化的信号分子, 对其功能和作用机制研究具有重要意义.
周晓武, 副主任医师, 中国人民解放军空军总医院普外科; 顾国利, 副主任医师, 中国人民解放军空军总医院普通外科
TGF-β1诱导上皮间充质转化, 使得上皮细胞的结构改变和出现恶性表型, 而维持整个组织完整性的极性蛋白则很有可能对这一巨大改变负关键责任. 探讨极性蛋白Crumbs3与细胞表型的关系有利于深入理解TGF-β1的作用机制.
闵飞在人大肠癌癌旁组织体外培养的研究中强调血清的存在不利于隐窝结构的维持, 血清浓度越高肠隐窝微架构丧失越快. 因此我们在乳鼠结肠组织体外培养过程中采用无血清培养基.
摒弃永生化细胞系培养模型, 摸索结肠组织器官培养方法, 更能体现出细胞与细胞之间的联系、细胞与组织的关系. 同时也从整个组织水平上提供更接近人体内环境的研究模型.
TGF-β1抑制极性蛋白的表达和诱导上皮细胞恶性表型转换, 这一间充质微环境的早期改变对肿瘤的早期诊断与治疗都有重要意义.
上皮细胞极性: 上皮细胞极性是指其不对称细胞形状和上皮细胞中不对称分布的极性蛋白. 而极性蛋白对于维持整个组织的完整性和内稳态都具有关键意义. 上皮细胞极性的丢失被广泛认可为肿瘤发生的前提和标志.
研究本身具有重要意义, 采用方法和结果可信.
编辑: 郭鹏 电编:都珍珍
| 1. | Seretis F, Seretis C, Youssef H, Chapman M. Colorectal cancer: seed and soil hypothesis revisited. Anticancer Res. 2014;34:2087-2094. [PubMed] |
| 2. | Chung HW, Lim JB. Role of the tumor microenvironment in the pathogenesis of gastric carcinoma. World J Gastroenterol. 2014;20:1667-1680. [PubMed] [DOI] |
| 3. | Hede K. Environmental protection: studies highlight importance of tumor microenvironment. J Natl Cancer Inst. 2004;96:1120-1121. [PubMed] |
| 4. | Pickup M, Novitskiy S, Moses HL. The roles of TGFβ in the tumour microenvironment. Nat Rev Cancer. 2013;13:788-799. [PubMed] [DOI] |
| 5. | Joshi A, Cao D. TGF-beta signaling, tumor microenvironment and tumor progression: the butterfly effect. Front Biosci (Landmark Ed). 2010;15:180-194. [PubMed] |
| 8. | Derynck R, Miyazono K. The TGF-beta family. New York: Cold Spring Harbor Monograph Series 2007; 50, Ⅱ. |
| 9. | Taylor MA, Lee YH, Schiemann WP. Role of TGF-β and the tumor microenvironment during mammary tumorigenesis. Gene Expr. 2011;15:117-132. [PubMed] |
| 10. | Resau JH, Sakamoto K, Cottrell JR, Hudson EA, Meltzer SJ. Explant organ culture: a review. Cytotechnology. 1991;7:137-149. [PubMed] |
| 11. | Dame MK, Veerapaneni I, Bhagavathula N, Naik M, Varani J. Human colon tissue in organ culture: calcium and multi-mineral-induced mucosal differentiation. In Vitro Cell Dev Biol Anim. 2011;47:32-38. [PubMed] [DOI] |
| 12. | Autrup H, Stoner GD, Jackson F, Harris CC, Shamsuddin AK, Barrett LA, Trump BF. Explant culture of rat colon: a model system for studying metabolism of chemical carcinogens. In Vitro. 1978;14:868-877. [PubMed] |
| 13. | Browning TH, Trier JS. Organ culture of mucosal biopsies of human small intestine. J Clin Invest. 1969;48:1423-1432. [PubMed] |
| 14. | Randall KJ, Turton J, Foster JR. Explant culture of gastrointestinal tissue: a review of methods and applications. Cell Biol Toxicol. 2011;27:267-284. [PubMed] [DOI] |
| 15. | Di Sabatino A, Pickard KM, Rampton D, Kruidenier L, Rovedatti L, Leakey NA, Corazza GR, Monteleone G, MacDonald TT. Blockade of transforming growth factor beta upregulates T-box transcription factor T-bet, and increases T helper cell type 1 cytokine and matrix metalloproteinase-3 production in the human gut mucosa. Gut. 2008;57:605-612. [PubMed] [DOI] |
| 16. | Dame MK, Bhagavathula N, Mankey C, DaSilva M, Paruchuri T, Aslam MN, Varani J. Human colon tissue in organ culture: preservation of normal and neoplastic characteristics. In Vitro Cell Dev Biol Anim. 2010;46:114-122. [PubMed] [DOI] |
| 18. | Lawrenson K, Notaridou M, Lee N, Benjamin E, Jacobs IJ, Jones C, Gayther SA. In vitro three-dimensional modeling of fallopian tube secretory epithelial cells. BMC Cell Biol. 2013;14:43. [PubMed] [DOI] |
| 19. | Huang L, Muthuswamy SK. Polarity protein alterations in carcinoma: a focus on emerging roles for polarity regulators. Curr Opin Genet Dev. 2010;20:41-50. [PubMed] [DOI] |
| 20. | Macara IG, McCaffrey L. Cell polarity in morphogenesis and metastasis. Philos Trans R Soc Lond B Biol Sci. 2013;368:20130012. [PubMed] [DOI] |
| 21. | Axelrod JD, Bergmann DC. Coordinating cell polarity: heading in the right direction? Development. 2014;141:3298-3302. [PubMed] |
| 22. | Kumar V, Abbsa A, Fausto N. Basis of Disease. 7th Edition. Saunders: Elsevier 1999; 623-628. |
| 23. | Royer C, Lu X. Epithelial cell polarity: a major gatekeeper against cancer? Cell Death Differ. 2011;18:1470-1477. [PubMed] [DOI] |
| 24. | Tepass U, Theres C, Knust E. crumbs encodes an EGF-like protein expressed on apical membranes of Drosophila epithelial cells and required for organization of epithelia. Cell. 1990;61:787-799. [PubMed] |
| 25. | Karp CM, Tan TT, Mathew R, Nelson D, Mukherjee C, Degenhardt K, Karantza-Wadsworth V, White E. Role of the polarity determinant crumbs in suppressing mammalian epithelial tumor progression. Cancer Res. 2008;68:4105-4115. [PubMed] [DOI] |
| 26. | Ling C, Zheng Y, Yin F, Yu J, Huang J, Hong Y, Wu S, Pan D. The apical transmembrane protein Crumbs functions as a tumor suppressor that regulates Hippo signaling by binding to Expanded. Proc Natl Acad Sci U S A. 2010;107:10532-10537. [PubMed] [DOI] |
| 27. | Sheng H, Shao J, O'Mahony CA, Lamps L, Albo D, Isakson PC, Berger DH, DuBois RN, Beauchamp RD. Transformation of intestinal epithelial cells by chronic TGF-beta1 treatment results in downregulation of the type II TGF-beta receptor and induction of cyclooxygenase-2. Oncogene. 1999;18:855-867. [PubMed] |
| 28. | Morrison CD, Parvani JG, Schiemann WP. The relevance of the TGF-β Paradox to EMT-MET programs. Cancer Lett. 2013;341:30-40. [PubMed] [DOI] |
| 29. | De Craene B, Berx G. Regulatory networks defining EMT during cancer initiation and progression. Nat Rev Cancer. 2013;13:97-110. [PubMed] [DOI] |
| 30. | Ramamoorthi G, Sivalingam N. Molecular mechanism of TGF-β signaling pathway in colon carcinogenesis and status of curcumin as chemopreventive strategy. Tumour Biol. 2014; Mar 26. [Epub ahead of print]. [PubMed] [DOI] |