修回日期: 2014-08-22
接受日期: 2014-09-03
在线出版日期: 2014-10-18
目的: 成功构建携带分泌型卷曲相关蛋白(secreted frizzled related protein, SFRP)基因的腺病毒载体, 并探讨SFRP对实验性小鼠肝纤维化(hepatic fibrosis, HF)的抑制作用.
方法: 用脂质体转染法将重组腺病毒pAd-Track-PPARγ2-CMV和SFRP5基因共转染CCl4诱导小鼠HF模型肝细胞, 成功构建的重组腺病毒Ad-SFRP5感染HF细胞. 采用Western blot、免疫荧光显微镜及激光共聚焦定位分析观察Ad-SFRP5抑制HF作用.
结果: 感染的重组腺病毒载体在小鼠HF细胞中有较高的SFRP5蛋白的稳定表达. 免疫双荧光显示Ad-SFRP5抑制HF小鼠肝细胞α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)和成纤维细胞特异蛋白-1(fibroblast-specific protein-1, FSP-1)的表达. 病理检测支持Ad-SFRP5抑制HF小鼠肝细胞上皮-间质转换(epithelial-mesenchymal transitions, EMT)的发生(SFRP5处理组与正常对照组相比, P<0.05).
结论: 我们成功构建含有小鼠SFRP5基因的重组腺病毒, 他可有效提高小鼠HF细胞中SFRP5基因的表达水平, 并可抑制EMT程序, 从而抑制HF.
核心提示: 本实验利用pAd-Easy腺病毒载体系统, 通过PCR扩增分泌型卷曲相关蛋白(secreted frizzled related protein, SFRP)基因, 克隆到腺病毒载体pAd-Easy共转染肝病纤维化(hepatic fibrosis, HF)细胞, 构建携带SFRP5基因的重组腺病毒, 在体外感染小鼠HF细胞, 以观察SFRP5基因表达情况及对HF的抑制现象.
引文著录: 毕婉蓉, 杨长青, 邢海林. 分泌型卷曲相关蛋白重组腺病毒载体对小鼠肝纤维化的抑制作用. 世界华人消化杂志 2014; 22(29): 4379-4385
Revised: August 22, 2014
Accepted: September 3, 2014
Published online: October 18, 2014
AIM: To construct a recombinant adenovirus vector expressing secreted frizzled related protein (SFRP), and to assess the inhibitory effect of SFRP overexpression on experimental hepatic fibrosis (HF) in mice.
METHODS: Liposome-mediated transfection was used to introduce recombinant adenovirus pAd-Track-PPARγ2-CMV carrying the SFRP5 gene into liver cells from mice with CCl4 induced HF to obtain recombinant adenovirus infected HF cells. Western blot, immunofluorescence microscopy and confocal laser microscopy were used to analyze the inhibitory effect of SFRP overexpression on experimental HF.
RESULTS: Cells infected with the recombinant adenovirus vector had higher expression of SFRP5 protein. Double immunofluorescence showed SFRP5 over expression inhibited the expression of α-smooth muscle actin (α-SMA) and fibroblast-specific protein-1 (FSP-1) in liver cells. Pathological examination revealed that SFRP5 over expression significantly reduced the occurrence of epithelial-mesenchymal transition (EMT) in liver cells (SFRP group vs control group, P < 0.05).
CONCLUSION: We have successfully constructed a recombinant adenovirus containing the SFRP5 gene, and it can effectively increase the expression of SFRP5 gene in mouse HF cells, thereby inhibiting the occurrence of EMT and HF.
- Citation: Bi WR, Yang CQ, Xing HL. Transfection with recombinant adenovirus vector expressing secreted frizzled related protein inhibits liver fibrosis in mice. Shijie Huaren Xiaohua Zazhi 2014; 22(29): 4379-4385
- URL: https://www.wjgnet.com/1009-3079/full/v22/i29/4379.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i29.4379
分泌型卷曲相关蛋白(secreted frizzled related protein, SFRP)家族成员陆续在非洲爪蟾或其他个体如小鼠、人和鸡等物种中被发现和分离出来, 分别命名为SFRP1-5[1], 也被定义为凋亡相关蛋白(secreted apoptosis-related proteins, SARPs)[2], 1997年首次克隆获得人的SARP1、SARP2、SARP3基因[3]. 我国目前对上皮-间质转换(epithelial-mesenchymal transitions, EMT)诱导慢性肝纤维化(hepatic fibrosis, HF)发病机制进行了较多研究, 但是否SFRP参与EMT, 以及与HF是否相关, 国内外尚无报道. 本实验利用pAd-Easy腺病毒载体系统[4], 通过PCR扩增SFRP5基因, 克隆到腺病毒载体pAd-Easy共转染HF细胞, 构建携带SFRP5基因的重组腺病毒, 在体外感染小鼠HF细胞, 以观察SFRP5基因表达情况及对HF的抑制现象. 这将对于我们了解HF生理病理过程的发生机制, 为该病诊断治疗提供策略和思路具有重要意义.
SPF级健康SD♂小鼠50只, 体质量90 g±10 g. 购自及饲养于同济大学动物实验中心. 动物合格证号: SCXK(粤)2004A084; pGBKT-SFRP5质粒(Takara公司, 美国)感受态菌株; RPMI-1640培养基胎牛血清(Haclon公司, 美国); 限制性核酸内切酶、T4 DNA连接酶、T4 DNA聚合酶、pMD18-T载体、DNA Marker DL2000、DNA Marker DL15000(Takara公司, 美国); Lipofectamine2000、TRIzol及RT-PCR试剂(Invitrogen公司, 美国); 逆转录试剂盒(Fermentas公司, 美国); 兔抗人SFRP5多克隆抗体(CST公司, 美国).
1.2.1 肝细胞分离与培养: 分离制备SD小鼠原代肝细胞, 参照改良的Seglen胶原酶灌注法[5], 并在分离方法上进一步改进: 用0.05%胶原酶Ⅳ液灌注, 完整切下肝脏并置其于37 ℃恒温箱内消化至肝脏表面出现裂隙, 加入一定量的4 ℃高糖及胰岛素混合的DMEM液, 将获得的肝细胞用含10%胎牛血清的新鲜F12培养液制成肝细胞悬液, 用0.4%台盼兰染色计算细胞产量和存活率. 传一代肝细胞按2×105/cm2接种, 培养7 d后, 用鼠抗α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)单克隆抗体, SABC法免疫细胞化学染色检测细胞纯度. 肝细胞按l×105/cm2接种在100 mL培养瓶中, 采用含10%FCS、100 U/mL青霉素、100 U/mL链霉素的DMEM培养液, 在37 ℃、50 mL/L CO2、饱和湿度的恒温培养箱中培养.
1.2.2 SFRP5编码序列的扩增: 采用Primer6.0软件设计扩增小鼠SFRP5基因氨基酸区域编码序列的特异性引物, 并在引物5'端引入保护性碱基和限制性酶切位点, 上游引物序列为: 5'-AAGATCTTGCTGCAGGGCCCTG-3', 下游引物序列为: 5'-TGTCGACTAGCACTGCAGCTTGCGGA-3', 以pGBKT-SFRP5质粒为模板进行PCR扩增.
1.2.3 SFRP5重组腺病毒表达载体的构建: 将扩增SFRP5产物克隆入pMD19-T载体, BglⅡ和SalⅠ双酶切和PCR鉴定确认获得阳性重组克隆, 进而将SFRP5片段亚克隆至pAdTrack-CMV载体, BglⅡ和SalⅠ双酶切鉴定并经测序确认获得阳性重组克隆, 10 mg pAdTrack-CMV-SFRP5重组质粒与0.1 mg骨架质粒pAd-Easy-1在感受态细胞BJ5183菌中进行同源重组, PacⅠ酶切鉴定阳性重组子, 再转化DH5α菌中扩增, 命名为Ad-SFRP5.
1.2.4 SFRP5重组腺病毒的包装与制备: 按照Lipofectamine2000试剂盒说明书, 取10 mg PacⅠ酶切线性化的Ad-SFRP5转染HF细胞, 免疫荧光显微镜观察, 根据绿色荧光蛋白(green fluorescent protein, GFP)细胞病变效应判断病毒产生, 扩增腺病毒, 按组织半数感染量(tissue culture infective dose, TCID)法测定病毒滴度.
1.2.5 SFRP5重组腺病毒感染HF细胞: HF细胞在150 mL/L DMEM中培养24 h, 将Ad-SFRP5纯化病毒按其TCID50值加入到细胞培养基中, 每15 min轻摇1次, 共4次, 4 h后换液.
1.2.6 免疫荧光染色: 膜通透处理: 0.1%Triton X-100/PBS室温5 min; 5%-10%的山羊/驴血清及5%BSA封闭; 一抗孵育, 将组织标本同时用将兔抗FSP-1的Ab和小鼠抗α-SMA的Ab混合在一起加到切片上, 覆盖, 4 ℃过夜; 二抗孵育, 加入生物素化的羊抗兔IgG. 所用LSCM型号为Bio-Rad MRC-1024, FITC的激发波长为488 nm. 用于图象采集的显微镜物镜为Plan-Neofluar 40×油浸镜, 数值孔径(numerical aperture, NA)为1.3, 扫描所用的激发值依据样本的不同可以在共聚焦系统提供的梯级值中选择.
统计学处理 全部调查结果及实验数据输入Excel数据库, 应用SPSS17.0软件, 计量资料以mean±SD表示, 均数比较两组间采用t检验、多组间比较采用方差分析; 计数资料组间频率比较用Fisher双侧确切检验; 频率变化趋势用χ2检验. P<0.05为差异有统计学意义.
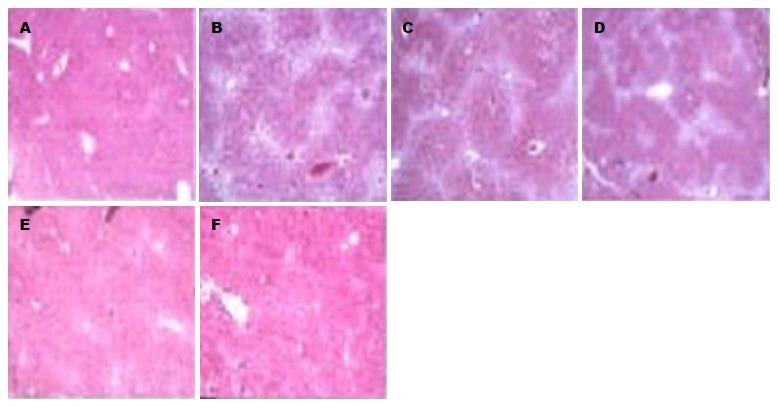
用脂质体转染HF细胞有大量GFP表达, 并可见细胞变圆呈串珠样聚集, 裂解粗提物中提取重组病毒DNA, 病理Massion染色鉴定证实重组质粒在HF细胞转染成功(图1).
Massion染色显示CCl4诱导的HF小鼠0、8、12、16 wk时具有典型的HF病理分级表现. 体外Ad-SFRP5干扰时, 在12、16 wk时出现抑制HF病理表现(图1).
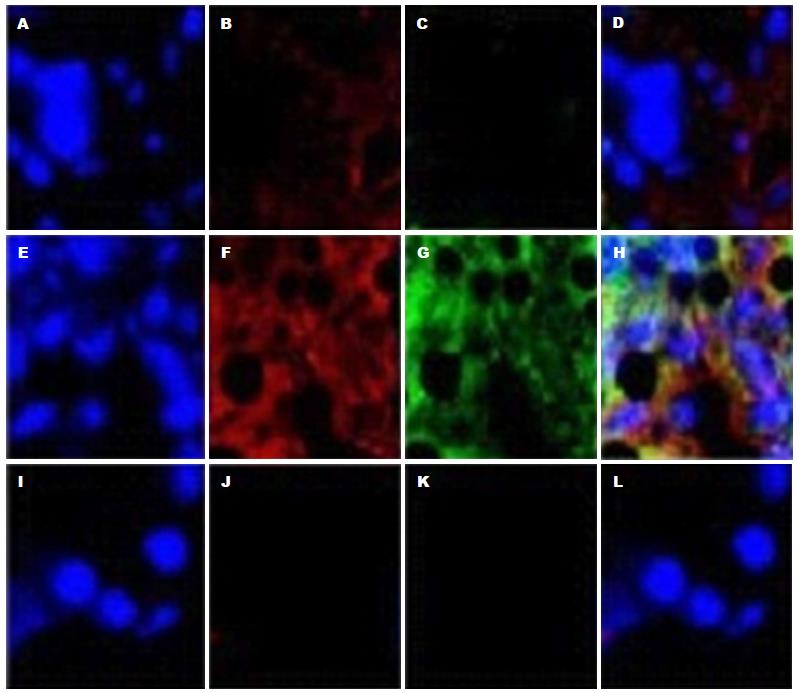
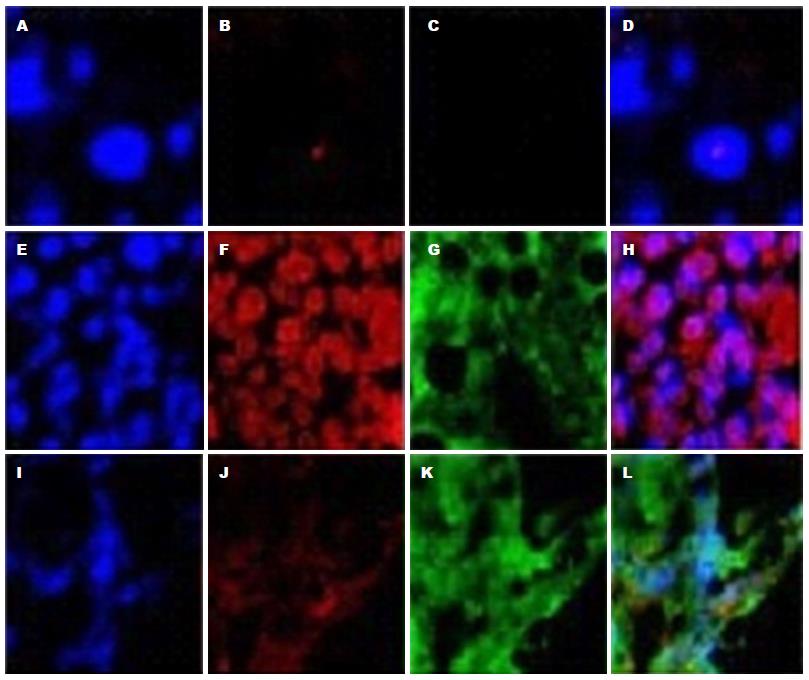
免疫双荧光检测对照组、HF组及Ad-SFRP5组α-SMA及FSP-1的表达显示HF组α-SMA及FSP-1(EMT的标志物)表达增加, 而Ad-SFRP5组α-SMA及FSP-1的表达明显减少, 半定量分析有统计学意义(图2). 同时免疫双荧光检测Ad-SFRP5在CCl4诱导的HF小鼠8、16 wk时Ad-SFRP5对α-SMA有明显抑制, 半定量分析有统计学意义(图3).
我国是一个肝脏疾病的高发国家, 每年因HF以致发展成肝硬化给社会带来巨大的损失[6], 目前仍缺乏有效的防治措施. HF是肝脏对慢性损伤的一种修复反应, 以细胞外基质(extracellular matrix, ECM)在肝内过多沉积为特征[7]. HF为一动态过程, 属可逆性病变[8]. 因此阻断、抑制或逆转HF是治疗慢性肝病的一个重要目标[9]. 随着对实验动物模型的观察越来越深入, 发现EMT在HF中有重要作用[10], 阻断甚至逆转EMT可为HF的治疗提供新的思路. SFRP是否参与HF时EMT逆转为本课题研究内容之一.
对Wnt信号与其他信号在EMT过程中的相互作用研究让我们更加全面了解EMT复杂性的同时还发现有些信号分子可以作为靶点来调节Wnt信号[11]. 本课题组对有关Wnt拮抗剂SFRP及其与HF关系的研究有了新的思路. SFRP类和DKK类是Wnt两大拮抗剂[12]. 前者包含SFRPs家族、WIF-1和Cerberus[13], 可直接连接在Wnt蛋白上, 从而改变Wnt连接Wnt受体复合物的能力[14]; 后者包含某些DKK家族蛋白[15], 可结合Wnt受体复合物上的LRP5/6, 从而阻止Wnt信号的转导[16]. SFRPs家族成员的结构虽然基本相似, 但所起的作用可能具有极大的差异性[17], SFRPs家族成员不总是Wnt的拮抗剂[18]. 最近的研究发现, 低密度脂蛋白和WIF-1可与SFRPs协同作用而共同调控Wnt信号通路[19], 这提示SFRPs家族对Wnt的调控活动并非单独存在, 其作用机制可能非常复杂. 同时SFRPs之间的相反效应也可能影响Wnt表达[20]. 因此, 研究的重点在于不同SFRPs对Wnt信号的影响, 对HF时EMT有否相关性, 以及不同浓度下的双向反应及可能存在的剂量关系, 从而寻找抗HF的新措施.
SFRPs家族根据序列同源性分为3个亚群, 第1亚群[21]: SFRP1(Frza、Frp、SARP2), SFRP2(SDF5、SARP1), SFRP5(SARP3); 第2亚群[22]: SFRP3(Fz、Frzb、Frtiz)和SFRP4; 第3亚群[23]: Sizzled、Sizzled2和Crescent. 最近研究[24]表明SFRP5是一种脂肪细胞因子, 前体脂肪细胞分化成熟过程中被强烈诱导表达; 其也可通过阻断脂肪组织Wnt信号通路, 促进脂肪细胞分化, 增加饮食诱导的肥胖[25], SFRP5表达水平与肥胖和糖尿病相关[26], 通过减弱非经典Wnt信号转导通路而减轻机体胰岛素抵抗[27]. 但SFRP5与HF之间的相互作用, 未见报道. 故深入研究SFRP5的生物学功能, 将为治疗慢性肝脏疾病提供新的机会.
SFRP5可能通过结构上有同源性的CRD与Wnt信号的特异性受体Fz竞争性结合, 发挥调控Wnt信号通路的作用[28]. 当SFRP5启动子发生甲基化进而诱导SFRP5基因沉默, 将导致Wnt信号异常表达[29]. 本课题组前期实验已经证明了Wnt信号传导机制参与了肝细胞EMT的诱导过程, 是HF发生EMT时的主要诱因之一. 由于EMT在HF的发展过程中扮演重要角色[30], 阻断甚至逆转EMT可为HF的治疗提供新的思路, 通过SFRP5调节Wnt信号通路, 可能成为抗HF的新方法. 而且SFRP5有调控细胞凋亡的功能, 可能通过抑制Wnt3A信号通路调控细胞凋亡[31].
本研究构建SFRP5重组腺病毒载体, 在HF细胞中表达包装纯化病毒后成功构建了携带SFRP5重组腺病毒并且初步研究结果表明该重组病毒在体外能有效感染小鼠HF细胞, 受感染细胞能高效稳定的表达重组蛋白, 免疫双荧光显示Ad-SFRP5抑制HF小鼠肝细胞α-SMA和FSP-1的表达, 从而逆转EMT, 抑制HF. 病理检测支持Ad-SFRP5抑制HF小鼠肝细胞EMT的发生. 本研究说明SFRP5可能作为Wnt信号通路的抑制剂, 可通过调控Wnt信号转导通路参与EMT的逆转过程, 进一步抑制HF.
本课题组对有关Wnt拮抗剂SFRP5及其与HF关系的研究有了新的思路. 探讨SFRP5对HF肝细胞凋亡、增殖及分化的调节作用, 及对HF肝细胞功能的影响和机制的研究, 并对SFRP5参与调控HF过程中EMT的Wnt信号途径进行验证. 希望能够初步明确SFRP5在HF肝细胞表达的作用及相关机制, 为HF的形成和防治提供新的思路.
分泌型卷曲相关蛋白(secreted frizzled related protein, SFRP)家族成员陆续在非洲爪蟾或其他个体如小鼠, 人和鸡等物种中被发现和分离出来, 分别命名为SFRP1-5, 也被定义为凋亡相关蛋白(secreted apoptosis-related proteins, SARPs), 1997年首次克隆获得人的SARP1、SARP2、SARP3基因. 我国目前对上皮-间质转换(epithelial-mesenchymal transitions, EMT)诱导慢性肝病肝纤维化(hepatic fibrosis, HF)发病机制进行了较多研究, 但是否SFRP参与EMT, 以及与HF是否相关, 国内外尚无报道.
高润平, 教授, 吉林大学第一医院肝胆胰内科
随着对实验动物模型的观察越来越深入, 发现EMT在HF中有重要作用, 阻断甚至逆转EMT可为HF的治疗提供新的思路. SFRP是否参与HF时EMT逆转为本课题研究内容之一.
SFRP5与HF之间的相互作用, 未见报道. 故深入研究SFRP5的生物学功能, 将为治疗慢性肝脏疾病提供新的机会.
研究的重点在于不同SFRPs对Wnt信号的影响, 对HF时EMT有否相关性, 以及不同浓度下的双向反应及可能存在的剂量关系, 从而寻找抗HF的新措施.
本研究设计合理, 方法科学, 结果可靠, 具有较强的学术价值.
编辑: 郭鹏 电编:都珍珍
| 1. | Ehrlund A, Mejhert N, Lorente-Cebrián S, Aström G, Dahlman I, Laurencikiene J, Rydén M. Characterization of the Wnt inhibitors secreted frizzled-related proteins (SFRPs) in human adipose tissue. J Clin Endocrinol Metab. 2013;98:E503-E508. [PubMed] [DOI] |
| 2. | Kim BK, Yoon SK. Expression of sfrp2 is increased in catagen of hair follicles and inhibits keratinocyte proliferation. Ann Dermatol. 2014;26:79-87. [PubMed] [DOI] |
| 3. | Mastri M, Shah Z, Hsieh K, Wang X, Wooldridge B, Martin S, Suzuki G, Lee T. Secreted Frizzled-related protein 2 as a target in antifibrotic therapeutic intervention. Am J Physiol Cell Physiol. 2014;306:C531-C539. [PubMed] [DOI] |
| 4. | Zeisberg M, Yang C, Martino M, Duncan MB, Rieder F, Tanjore H, Kalluri R. Fibroblasts derive from hepatocytes in liver fibrosis via epithelial to mesenchymal transition. J Biol Chem. 2007;282:23337-23347. [PubMed] [DOI] |
| 5. | Firrincieli D, Boissan M, Chignard N. Epithelial-mesenchymal transition in the liver. Gastroenterol Clin Biol. 2010;34:523-528. [PubMed] [DOI] |
| 6. | Varatharajalu R, Garige M, Leckey LC, Arellanes-Robledo J, Reyes-Gordillo K, Shah R, Lakshman MR. Adverse signaling of scavenger receptor class B1 and PGC1s in alcoholic hepatosteatosis and steatohepatitis and protection by betaine in rat. Am J Pathol. 2014;184:2035-2044. [PubMed] [DOI] |
| 7. | Kmieć Z. Cooperation of liver cells in health and disease. Adv Anat Embryol Cell Biol. 2001;161:III-XIII, 1-151. [PubMed] |
| 8. | Flehmig G, Scholz M, Klöting N, Fasshauer M, Tönjes A, Stumvoll M, Youn BS, Blüher M. Identification of adipokine clusters related to parameters of fat mass, insulin sensitivity and inflammation. PLoS One. 2014;9:e99785. [PubMed] [DOI] |
| 9. | Catalán V, Gómez-Ambrosi J, Rodríguez A, Pérez-Hernández AI, Gurbindo J, Ramírez B, Méndez-Giménez L, Rotellar F, Valentí V, Moncada R. Activation of Noncanonical Wnt Signaling Through WNT5A in Visceral Adipose Tissue of Obese Subjects Is Related to Inflammation. J Clin Endocrinol Metab. 2014;99:E1407-E1417. [PubMed] [DOI] |
| 10. | Gerdes S, Laudes M, Neumann K, Baurecht H, Mrowietz U. Wnt5a--a potential factor linking psoriasis to metabolic complications. Exp Dermatol. 2014;23:438-440. [PubMed] [DOI] |
| 11. | Ge WS, Wang YJ, Wu JX, Fan JG, Chen YW, Zhu L. β-catenin is overexpressed in hepatic fibrosis and blockage of Wnt/β-catenin signaling inhibits hepatic stellate cell activation. Mol Med Rep. 2014;9:2145-2151. [PubMed] [DOI] |
| 12. | MadanKumar P, NaveenKumar P, Manikandan S, Devaraj H, NiranjaliDevaraj S. Morin ameliorates chemically induced liver fibrosis in vivo and inhibits stellate cell proliferation in vitro by suppressing Wnt/β-catenin signaling. Toxicol Appl Pharmacol. 2014;277:210-220. [PubMed] [DOI] |
| 13. | Jian YC, Wang JJ, Dong S, Hu JW, Hu LJ, Yang GM, Zheng YX, Xiong WJ. Wnt-induced secreted protein 1/CCN4 in liver fibrosis both in vitro and in vivo. Clin Lab. 2014;60:29-35. [PubMed] |
| 14. | Sun X, He Y, Ma TT, Huang C, Zhang L, Li J. Participation of miR-200a in TGF-β1-mediated hepatic stellate cell activation. Mol Cell Biochem. 2014;388:11-23. [PubMed] |
| 15. | Miao CG, Yang YY, He X, Huang C, Huang Y, Zhang L, Lv XW, Jin Y, Li J. Wnt signaling in liver fibrosis: progress, challenges and potential directions. Biochimie. 2013;95:2326-2335. [PubMed] |
| 16. | Arellanes-Robledo J, Reyes-Gordillo K, Shah R, Domínguez-Rosales JA, Hernández-Nazara ZH, Ramirez F, Rojkind M, Lakshman MR. Fibrogenic actions of acetaldehyde are β-catenin dependent but Wingless independent: a critical role of nucleoredoxin and reactive oxygen species in human hepatic stellate cells. Free Radic Biol Med. 2013;65:1487-1496. [PubMed] |
| 17. | Shih YL, Hsieh CB, Yan MD, Tsao CM, Hsieh TY, Liu CH, Lin YW. Frequent concomitant epigenetic silencing of SOX1 and secreted frizzled-related proteins (SFRPs) in human hepatocellular carcinoma. J Gastroenterol Hepatol. 2013;28:551-559. [PubMed] [DOI] |
| 18. | Reyes-Gordillo K, Shah R, Arellanes-Robledo J, Hernández-Nazara Z, Rincón-Sánchez AR, Inagaki Y, Rojkind M, Lakshman MR. Mechanisms of action of acetaldehyde in the up-regulation of the human α2(I) collagen gene in hepatic stellate cells: key roles of Ski, SMAD3, SMAD4, and SMAD7. Am J Pathol. 2014;184:1458-1467. [PubMed] [DOI] |
| 19. | Shah R, Reyes-Gordillo K, Arellanes-Robledo J, Lechuga CG, Hernández-Nazara Z, Cotty A, Rojkind M, Lakshman MR. TGF-β1 up-regulates the expression of PDGF-β receptor mRNA and induces a delayed PI3K-, AKT-, and p70(S6K) -dependent proliferative response in activated hepatic stellate cells. Alcohol Clin Exp Res. 2013;37:1838-1848. [PubMed] [DOI] |
| 20. | Awuah PK, Rhieu BH, Singh S, Misse A, Monga SP. β-Catenin loss in hepatocytes promotes hepatocellular cancer after diethylnitrosamine and phenobarbital administration to mice. PLoS One. 2012;7:e39771. [PubMed] [DOI] |
| 21. | Fontenot E, Rossi E, Mumper R, Snyder S, Siamakpour-Reihani S, Ma P, Hilliard E, Bone B, Ketelsen D, Santos C. A novel monoclonal antibody to secreted frizzled-related protein 2 inhibits tumor growth. Mol Cancer Ther. 2013;12:685-695. [PubMed] [DOI] |
| 22. | Xavier CP, Melikova M, Chuman Y, Üren A, Baljinnyam B, Rubin JS. Secreted Frizzled-related protein potentiation versus inhibition of Wnt3a/β-catenin signaling. Cell Signal. 2014;26:94-101. [PubMed] [DOI] |
| 23. | Saito T, Mitomi H, Imamhasan A, Hayashi T, Mitani K, Takahashi M, Kajiyama Y, Yao T. Downregulation of sFRP-2 by epigenetic silencing activates the β-catenin/Wnt signaling pathway in esophageal basaloid squamous cell carcinoma. Virchows Arch. 2014;464:135-143. [PubMed] [DOI] |
| 24. | Li X, Lu P, Li B, Zhang W, Luo K. Effects of iodine-125 seeds on the methylation of SFRP2 and P16 in colorectal cancer. Exp Ther Med. 2013;6:1225-1228. [PubMed] |
| 25. | Lee DO, Kim H, Ku SY, Kim SH, Kim JG. Association between polymorphisms in sclerostin, dickkopfs and secreted frizzled-related protein genes and bone mineral density in postmenopausal Korean women. Gynecol Obstet Invest. 2014;77:186-193. [PubMed] [DOI] |
| 26. | Lopez-Mejia IC, de Toledo M, Chavey C, Lapasset L, Cavelier P, Lopez-Herrera C, Chebli K, Fort P, Beranger G, Fajas L. Antagonistic functions of LMNA isoforms in energy expenditure and lifespan. EMBO Rep. 2014;15:529-539. [PubMed] [DOI] |
| 27. | Prats-Puig A, Soriano-Rodríguez P, Carreras-Badosa G, Riera-Pérez E, Ros-Miquel M, Gomila-Borja A, de Zegher F, Ibáñez L, Bassols J, López-Bermejo A. Balanced duo of anti-inflammatory SFRP5 and proinflammatory WNT5A in children. Pediatr Res. 2014;75:793-797. [PubMed] [DOI] |
| 28. | Chu DT, Malinowska E, Gawronska-Kozak B, Kozak LP. Expression of adipocyte biomarkers in a primary cell culture models reflects preweaning adipobiology. J Biol Chem. 2014;289:18478-18488. [PubMed] [DOI] |
| 29. | Kwon YJ, Lee SW, Park YB, Lee SK, Park MC. Secreted frizzled-related protein 5 suppresses inflammatory response in rheumatoid arthritis fibroblast-like synoviocytes through down-regulation of c-Jun N-terminal kinase. Rheumatology (Oxford). 2014;53:1704-1711. [PubMed] [DOI] |
| 30. | Bi WR, Yang CQ, Shi Q. Transforming growth factor-β1 induced epithelial-mesenchymal transition in hepatic fibrosis. Hepatogastroenterology. 2012;59:1960-1963. [PubMed] [DOI] |
| 31. | Peng C, Xiao X, Kang B, He S, Li J. Serum secreted frizzled-related protein 5 levels differentially decrease in patients with hepatitis B virus-associated chronic infection and hepatocellular carcinoma. Oncol Lett. 2014;8:1340-1344. [PubMed] [DOI] |