修回日期: 2014-08-16
接受日期: 2014-08-26
在线出版日期: 2014-10-08
目的: 研究旨在研究人类原发性胃癌及正常胃黏膜组织中, 各种不同亚型的生长抑素受体(somatostatin receptor subtypes, SSTRs)亚型(SSTR1、SSTR2、SSTR3、SSTR4和SSTR5)的表达. 以期研究SSTRs和胃癌症的临床病理学特征之间的关系, 这可能为胃癌的诊断、治疗和预后提供一定的理论基础.
方法: 收集到2004-01/2014-01的胃癌患者58例, 另设相同数量的正常胃组织做对照, 免疫组织化学染色对病理确诊的58例胃癌组织及癌旁正常胃组织标本检测其生长抑素受体的表达情况. 特定受体蛋白的免疫反应的强度是通过描述性的半定量的方法进行标定的: 强染色(+++)、适度染色(++)、弱染色(+)和淡染色(-). 另外对SSTR亚型蛋白在细胞中的分布进行确认(细胞质或者细胞核). 为了避免分析切片病理染色结果产生误差, 所有的切片染色结果由两位不同的病理学家进行确认. SSTRs表达和临床病理参数之间的差异通过χ2检验进行分析, P<0.05为差异有统计学意义.
结果: 5种亚型SSTR在胃癌症组织及正常胃黏膜组织中都具有表达, 其中SSTR3表达量在两组中最高, 而SSTR2的表达最低. 其中胃癌组织中SSTR5的表达与正常胃黏膜组织相比明显增加, 具有统计学上的显著性差异(P<0.05). SSTR4的表达水平在淋巴结转移的胃癌症组织中要低于没有淋巴结转移灶的胃癌症(P<0.05). SSTR3在高分化和中等分化胃肿瘤组织中的表达明显高于低分化胃癌症(P<0.05). SSTR2在各组中的表达均较低; SSTR1在正常胃组织中的表达高于SSTR5, 而在胃癌组织中的表达与此相反.
结论: 这些结果表明SSTR3、SSTR4、SSRT5在胃癌形成和发展过程中发挥重要作用.
核心提示: 生长抑素受体亚型(somatostatin receptor subtypes, SSTRs)表达可能在胃癌发展过程中发挥重要作用. 生长抑素(somatostatin)存在于人类的内分泌系统和外分泌系统, 具有多种生物学效应. 本文的研究结果表明表明SSTR3、SSTR4、SSTR5在胃癌形成和发展过程中发挥重要作用.
引文著录: 杨晓莉, 李小京. 不同亚型的生长抑素受体在胃癌组织中的表达变化及临床诊断意义. 世界华人消化杂志 2014; 22(28): 4306-4311
Revised: August 16, 2014
Accepted: August 26, 2014
Published online: October 8, 2014
AIM: To examine the expression of somatostatin receptor subtypes (SSTRs), including SSTR1, SSTR2, SSTR3, SSTR4 and SSTR5, in gastric cancer and to analyze their relationship with clinical and pathological characteristics.
METHODS: The expression of SSTRs in 58 gastric cancer specimens and adjacent normal stomach tissue specimens were examined by immunohistochemical staining. Correlations between SSTR expression and clinical and pathological parameters were analyzed by the chi-square test.
RESULTS: All five SSTR subtypes were expressed in gastric cancer tissues, with SSTR3 having the highest expression. SSTR5 expression increased significantly in gastric cancer compared with that in normal gastric tissue (P < 0.05). SSTR4 expression was significantly lower in gastric cancer with lymph node metastasis than in gastric cancer without lymph node metastasis (P < 0.05). SSTR3 expression in highly and moderately differentiated gastric cancer was significantly higher than that in poorly differentiated gastric cancer (P < 0.05). SSTR2 was lowly expressed in each group; SSTR1 expression was higher than SSTR5 expression in normal stomach tissue, but was lower in gastric cancer tissue.
CONCLUSION: Our results indicated that SSRT5, SSTR3 and SSTR4 may play important roles in the development of gastric cancer.
- Citation: Yang XL, Li XJ. Differential expression of somatostatin receptor subtypes in gastric cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(28): 4306-4311
- URL: https://www.wjgnet.com/1009-3079/full/v22/i28/4306.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i28.4306
胃癌是常见的消化系恶性肿瘤之一, 严重威胁着人类健康. 胃癌症具有早期症状不典型, 发展迅速, 误诊率高、低预后和术后生存率等特点[1,2]. 生长抑素(somatostatin, SST)是由大脑分泌的, 可以抑制垂体释放生长抑素[3]. SST存在于人类的内分泌系统和外分泌系统, 具有多种生物学效应. SST分子有两种形式: 14肽的生长抑素(somatostatin 214, SS214)和28肽的生长抑素(somatostatin 228, SS228), 两者具有相似的结构和生物活性, 包括抑制内分泌和外分泌细胞的功能, 调节胆道、胃肠道的蠕动并作为神经介质参与大脑的识别功能的调节[4,5]. SST在调节细胞增殖和分化中起着重要的作用, 抑制多种细胞增殖, 包括肿瘤细胞[6]. 先前的研究[7-9]表明, 生长抑素受体(somatostatin receptor, SSTR)表达与多个肿瘤疾病的发生密切相关, 包括乳腺癌、肺神经内分泌肿瘤和葡萄膜黑色素瘤. 然而, SSTR如何参与胃癌发生发展的研究则报道的较少.
收集2004-01/2014-01江西省抚州市抚州医学院普外科58例住院手术治疗的胃癌患者. 这些患者病例都拥有完整的临床病理学的历史记录, 术前未行放疗、化疗或激素治疗. 另收集58例正常胃组织(胃炎、胃结石患者), 对58例胃癌组织和相近部位的58例正常胃黏膜组织进行免疫组织化学染色,所有样本的采集均获得患者的知情权并得到所在医院伦理委员会的批注.
1.2.1 免疫组织化学染色: 胃组织样本用40 g/L甲醛进行固定并行石蜡包埋, 然后用切片机切成4 μm厚度. 切片在二甲苯中脱蜡20 min, 重复3次; 然后用梯度乙醇水化, 依次为1000 mL/L-1000 mL/L-950 mL/L-950 mL/L-750 mL/L每个梯度脱水5 min. 切片用过氧化氢孵育5 min后用蒸馏水洗5 min. SSTR2、SSTR3、SSTR4、SSTR5行抗原修复步骤, SSTR1无需抗原修复步骤; 修复时, 切片于EDTA修复液中行抗原修复(修复液配方0.5 mol/L Tris-HCl 20 mL, 0.5 mpl/L EDTA 8.02 mL, 加800 mL蒸馏水, 混均, 用氢氧化钠调节至pH 7.8-8.0, 再用蒸馏水补至1000 mL), 期间, 微波10 min后, 取出冷却20 min. 切片用牛血清白蛋白封闭10-15 min, 封闭非特异性结合, 然后加入一抗, 于室温下孵育1.5-2.0 h. 孵育的一抗抗体主要包括anti-SSTR1、anti-SSTR2、anti-SSTR3(1:10稀释, 武汉博士德生物工程有限公司, 中国武汉), anti-SSTR4和anti-SSTR5(1:2500稀释, 上海美锦生物科技公司, 中国上海). 然后切片用缓冲液冲洗并加入山羊来源的二抗, 在室温下孵育30 min. 孵育完毕后用TBST冲洗并进行DAB显示, 并对染色结果进行可视化处理[9,10].
1.2.2 免疫组织化学结果判定: 特定受体蛋白的免疫反应的强度是通过描述性的半定量的方法进行标定的: 强染色(+++)、适度染色(++)、弱染色(+)和淡染色(-). 另外对SSTR亚型蛋白在细胞中的分布进行确认(细胞质或者细胞核). 为了避免分析切片病理染色结果产生误差, 所有的切片染色结果由两位不同的病理学家进行确认.
统计学处理 数据采用SPSS11.0进行分析. SSTRs差异表达与临床病理参数通过χ2检验进行分析. P<0.05为差异具有统计学意义.
肿瘤标本临床统计如下, 其中<55岁20例(34.5%), ≥55岁38例(65.5%). 组织学类型均为腺癌. 所有标本均经病理学检查确诊. 具体资料如表1.
| 临床特征 | n |
| 患者年龄(岁) | |
| <55 | 20 |
| ≥55 | 38 |
| 性别 | |
| 男 | 20 |
| 女 | 38 |
| 组织学类型 | |
| 管状腺癌及乳头状腺癌 | 28 |
| 黏液腺癌及绒毛状腺癌 | 26 |
| 低分化癌及其他 | 4 |
| 分化程度 | |
| 低 | 10 |
| 中 | 30 |
| 高 | 18 |
| 淋巴结转移 | |
| 有 | 22 |
| 无 | 36 |
| 浸润深度 | |
| 全层 | 24 |
| 浆膜下层 | 34 |
| 临床分期 | |
| Ⅰ期 | 22 |
| Ⅱ期 | 24 |
| Ⅲ期 | 8 |
| Ⅳ期 | 4 |
| 肝转移 | |
| 有 | 10 |
| 无 | 48 |
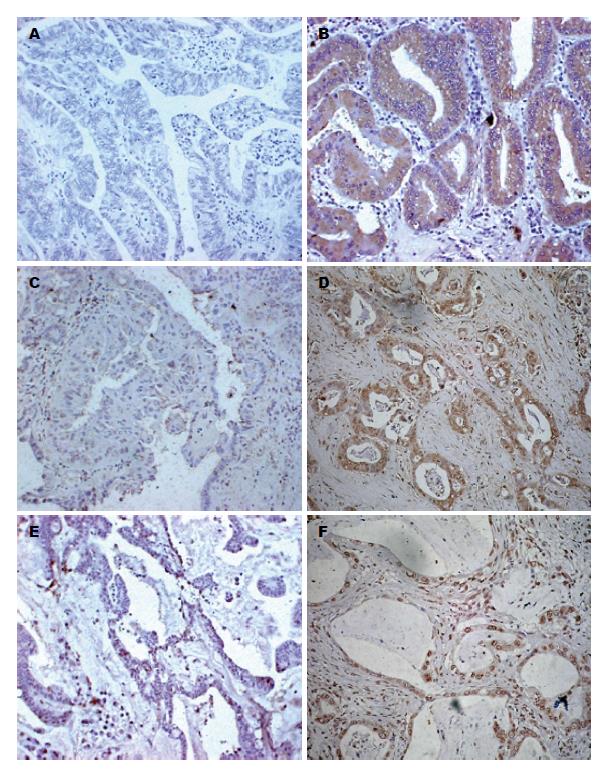
免疫组织化学结果显示, 5种亚型SSTRs在胃癌组织和正常胃组织中的表达主要分布于细胞质和细胞膜, 棕色颗粒物表示阳性结果(图1). 我们的研究结果表明: SSTR 1-5亚型受体蛋白在胃癌症组织的分布为62.1%、13.8%、82.6%、24.1%和69.0%. 在胃癌组织样本中, SSTR3的阳性表达最高(82.6%), SSTR2在胃癌组织标本中的表达最低(13.8%)(表2). 与此相对应的, 在正常胃组织样本中, SSTR1-5亚型受体蛋白的表达量分别为44%、12%、64%、16%和24%. SSTR3在正常胃组织中的表达水平最高, 说明SSTR3与胃癌的发生发展密切相关. SSTR1在胃正常组织中的表达高于SSTR5, 与此相反, SSTR1在胃癌组织中表达低于SSTR5(表2). 因此, SSTR5上调与胃癌的发生呈正相关(P = 0.045), 这表明SSTR5可能在胃癌症的发生发展中其关键性的调控作用.
| SSTR亚型 | - | + | ++ | +++ | 总阳性(率) |
| 胃癌 | |||||
| SSTR1 | 22(37.9) | 6(10.3) | 12(20.7) | 18(31.0) | 36(62.1) |
| SSTR2 | 50(86.2) | 4(6.9) | 2(3.4) | 2(3.4) | 8(13.8) |
| SSTR3 | 10(17.2) | 2(13.8) | 12(20.7) | 28(48.2) | 44(82.8) |
| SSTR4 | 44(75.9) | 6(10.3) | 8(13.8) | 0(0) | 14(24.1) |
| SSTR5 | 18(31.0) | 6(10.3) | 14(24.1) | 20(34.5) | 40(69.0)a |
| 正常胃组织 | |||||
| SSTR1 | 28(56) | 4(8) | 8(16) | 10(20) | 22(44.0) |
| SSTR2 | 44(88) | 2(4) | 4(8) | 0(0) | 6(12.0) |
| SSTR3 | 18(36) | 8(16) | 10(20) | 14(28) | 32(64.0) |
| SSTR4 | 42(84) | 2(4) | 6(12) | 0(0) | 8(16.0) |
| SSTR5 | 38(76) | 2(4) | 6(12) | 4(8) | 12(24.0) |
如表3所示, SSTR3的表达在低分化胃癌组织中与高分化和中等分化胃癌组织相比, 具有明显的下调(P<0.05). SSTR3的表达与胃癌组织标本的分化等级和恶性程度相关. 此外, SSTR4的表达水平在具有淋巴结转移灶的胃癌组织标本中, 与无转移灶的胃癌组织标本相比具有明显的下调(P<0.05), 表明这两种亚型的SSTR可能胃癌症的发生和发展发挥着关键作用. SSTRs表达水平与患者的年龄、肿瘤组织学类型、浸润深度或肝转移无显著性差异.
| 分组 | SSTR1 | SSTR2 | SSTR3 | SSTR4 | SSTR5 | P值 |
| 年龄(岁) | >0.05 | |||||
| <55 | 5 | 2 | 8 | 1 | 7 | |
| ≥55 | 13 | 2 | 16 | 6 | 13 | |
| 性别 | >0.05 | |||||
| 男 | 7 | 3 | 7 | 3 | 8 | |
| 女 | 11 | 1 | 17 | 4 | 12 | |
| 组织学类型 | <0.05 | |||||
| 管状腺癌及乳头状腺癌 | 10 | 2 | 13 | 2 | 11 | |
| 黏液腺癌及绒毛状腺癌 | 6 | 2 | 10 | 4 | 8 | |
| 低分化癌及其他 | 2 | 0 | 1 | 1 | 1 | |
| 分化程度 | <0.05 | |||||
| 低 | 1 | 0 | 0 | 1 | 2 | |
| 中 | 11 | 3 | 15 | 5 | 12 | |
| 高 | 6 | 1 | 9 | 1 | 6 | |
| 淋巴结转移 | <0.05 | |||||
| 阳性 | 6 | 0 | 8 | 0 | 6 | |
| 阴性 | 12 | 4 | 16 | 7 | 14 | |
| 浸润深度 | <0.05 | |||||
| 全层 | 8 | 1 | 9 | 2 | 8 | |
| 浆膜下层 | 10 | 3 | 15 | 5 | 12 | |
| 肝转移有无 | <0.05 | |||||
| 有 | 3 | 1 | 4 | 1 | 3 | |
| 无 | 15 | 3 | 20 | 6 | 17 | |
| 诊断 | <0.05 | |||||
| 康复 | 9 | 2 | 12 | 5 | 13 | |
| 改善 | 7 | 2 | 10 | 2 | 6 | |
| 死亡 | 2 | 0 | 2 | 0 | 1 |
SST是一种环状的多肽类, 于1973年首次发现, 从下丘脑中分泌并具有抑制生长素的功能, 因为得名生长抑素, 其广泛存在于人体的内分泌和外分泌系统中, 具有广泛的生物学效应[11,12]. SST的主要生物学功能是抑制垂体激素的分泌包括垂体生长抑素、促甲状腺激素、促肾上腺皮质激素. 另外, SST也可以抑制多种内分泌和外分泌细胞的分泌, 抑制胆汁和胃肠道的蠕动, 调控运动和智力的大脑神经递质功能[13,14]. 此外, SST还具有抑制肿瘤细胞增殖和诱导肿瘤细胞凋亡的功能[13,15]. 最近的研究表明, SST可以抑制胃癌细胞系GBC-SD的增殖和诱导胃癌细胞系GBC-SD的凋亡[14,15]. SST的合成类似物也已经在临床上广泛应用于抑制肿瘤细胞的增殖.
SST及其合成类似物的生物学功能是通过介导靶向细胞膜上的特异性受体来发挥功能的. 目前一发现的SSTR亚型共有5种, 即SSTR1-5, 所有的SSTRs都属于G-蛋白耦合受体家族[16], 受腺苷酸环化酶所调控并由5个不同染色体位置上的基因编码. SSTR的5个亚型参与不同的生物学功能并通过与SSTR2、SSTR3和SSTR5的结合发挥其他生物学效应[17]. SSTRs受体介导的生物学效应取决于SSTRs与SST亲和力或者SSTRs的表达水平. SSTR2和SSTR3诱导细胞凋亡, SSTR1、SSTR5与细胞周期、细胞增殖和分化密切相关[18]. 研究表明, SSTR5与肿瘤的侵袭相关且其在胰岛瘤中的表达水平明显低于正常组织[19]. 因而, 在选择治疗药物时需参考SSTRs在胃肿瘤组织的表达情况. 然而, SSTRs并不是在所有胃癌组织中都有表达. 因而根据不同胃肿瘤组织中SSTRs表达的不同, 确定SST类似物用于治疗胃癌患者. 通过SSTRs表达的差异选择药物, 可以改善胃癌患者的治疗效果.
目前, 对与胃癌组织中SSTRs的表达类型和表达水平的研究尚无报道. 我们的研究旨在通过免疫组织化学, 检测SSTRs蛋白在原发性胃癌患者中的表达情况, 发现的不同的胃癌组织中SSTR蛋白亚型的具有差异. 染色结果显示, SSTR3在胃癌组织中表达最高(82.8%)(表2), 其次是SSTR1(62.1%)和SSTR5(69.0%), SSTR2表达最少(13.8%). 鉴于SSTR2和SSTR3可以促进细胞凋亡[20], SSTR2和SSTR3可以作为临床用药的一个重要作用靶点, 判定胃癌症患者是否需要接受SST或SST类似物治疗.
此外, 我们的研究结果表明. SSTR5在胃肿瘤组织的表达与正常胃组织相比, 具有显著差异(表2), 说明SSTR5是胃癌症诊断的一个潜在靶点. 同时, 肿瘤的淋巴转移、分化程度和侵入程度是评价肿瘤恶性程度的重要指标. 因此, 我们比较SSTRs表达水平与胃癌患者组织样本的分化程度的关系, 并发现SSTR3表达与分化程度呈现正相关(表3). 然而, SSTR4的表达与淋巴结转移呈负相关, 表明SSTR3和SSTR4与胃癌的发展密切相关. 此外, 各种SSTR亚型的表达与患者的年龄、肿瘤的组织学类型、侵入程度和肝脏转移等无相关性. 考虑的临床病例在我们的研究中数量比较少, 在进一步研究中, 我们会收集更多的胃癌症患者对SSTR参与胃癌症发生发展的机制进行深入的研究.
胃癌是胆道系统常见的恶性肿瘤, 起病隐匿, 症状体征不典型, 早期常无特殊症状, 发展快, 误诊率高, 手术切除率很低, 恶性程度较高, 预后差. 生长抑素(somatostatin, SST)是一种生长激素释放抑制激素, 通过结合细胞表面的生长抑素受体(somatostatin receptor subtypes, SSTRs)而发挥作用的.
卢宁, 副主任医师, 中国人民解放军兰州军区乌鲁木齐总医院肿瘤科
SSTR在胃癌中是否表达, 何种受体高表达, 不得而知. SST在调节细胞增殖和分化中起着重要的作用, 抑制多种细胞增殖, 包括肿瘤细胞. 先前的研究表明, SSTR表达与多个肿瘤疾病的发生密切相关, 包括乳腺癌、肺神经内分泌肿瘤和葡萄膜黑色素瘤. 然而, SSTR如何参与胃癌发生发展的研究则报道的较少.
先前的研究表明, SSTR表达与多个肿瘤疾病的发生密切相关, 包括乳腺癌、肺神经内分泌肿瘤和葡萄膜黑色素瘤. 此外研究表明, SST及其同源体可以抑制正常细胞或肿瘤细胞在体内和体外的增殖, 由于SST可以通过释放激素或细胞因子, 抑制肿瘤血管的形成, 阻断肿瘤细胞周期和诱导肿瘤细胞凋亡, 进而抑制肿瘤的生长.
本文通过对58例原发性例胃癌采用免疫组织化学法进行生长抑素受体亚型的蛋白表达检测, 发现在胃癌组织中SSTR各亚型均有不同程度的表达. 在胃癌组织中的优势表达亚型为SSTR3.
目前为止, 胃癌仍是医学界难以攻克的"壁垒", 大多数胃癌患者确诊已属晚期, 手术及化疗效果均很差, 探寻新的治疗方法显得尤为重要. 我们的研究发现, 胃癌组织表达各种SSTR亚型, 这位今后人们应用与各亚型有高亲和力、更特异、更专一的SSA来诊断和治疗胃癌提供了理论依据. 也为胃癌早期的诊断提供了帮助.
生长抑制素受体(SSTR): 作为一种G蛋白耦合的受体, 由7个特定的跨膜结构域组成, 并在多种人类原发性肿瘤中表达, SSTR有5个亚型: SSTR1-5.
本文内容客观, 实验方法成熟, 观点新颖, 具有一定的科学意义.
编辑: 郭鹏 电编: 闫晋利
| 1. | de Aretxabala X, Losada H, Mora J, Roa I, Burgos L, Yáñez E, Quijada I, Roa JC. [Neoadjuvant chemoradiotherapy in gallbladder cancer]. Rev Med Chil. 2004;132:51-57. [PubMed] |
| 2. | Kim K, Chie EK, Jang JY, Kim SW, Han SW, Oh DY, Im SA, Kim TY, Bang YJ, Ha SW. Postoperative chemoradiotherapy for gallbladder cancer. Strahlenther Onkol. 2012;188:388-392. [PubMed] [DOI] |
| 3. | Patel YC. Somatostatin and its receptor family. Front Neuroendocrinol. 1999;20:157-198. [PubMed] [DOI] |
| 4. | Reubi JC, Schaer JC, Markwalder R, Waser B, Horisberger U, Laissue J. Distribution of somatostatin receptors in normal and neoplastic human tissues: recent advances and potential relevance. Yale J Biol Med. 1997;70:471-479. [PubMed] |
| 5. | Hofsli E. [The somatostatin receptor family--a window against new diagnosis and therapy of cancer]. Tidsskr Nor Laegeforen. 2002;122:487-491. [PubMed] |
| 6. | Peverelli E, Busnelli M, Vitali E, Giardino E, Galés C, Lania AG, Beck-Peccoz P, Chini B, Mantovani G, Spada A. Specific roles of G(i) protein family members revealed by dissecting SST5 coupling in human pituitary cells. J Cell Sci. 2013;126:638-644. [PubMed] [DOI] |
| 7. | Seitz S, Buchholz S, Schally AV, Jayakumar AR, Weber F, Papadia A, Rick FG, Szalontay L, Treszl A, Köster F. Targeting triple-negative breast cancer through the somatostatin receptor with the new cytotoxic somatostatin analogue AN-162 [AEZS-124]. Anticancer Drugs. 2013;24:150-157. [PubMed] [DOI] |
| 8. | Treglia G, Lococo F, Petrone G, Inzani F, Perotti G, Porziella V, Granone P, Rindi G, Giordano A, Rufini V. Pulmonary neuroendocrine tumor incidentally detected by (18)F-CH PET/CT. Clin Nucl Med. 2013;38:e196-e199. [PubMed] [DOI] |
| 9. | Valsecchi ME, Coronel M, Intenzo CM, Kim SM, Witkiewicz AK, Sato T. Somatostatin receptor scintigraphy in patients with metastatic uveal melanoma. Melanoma Res. 2013;23:33-39. [PubMed] [DOI] |
| 10. | Pisarek H, Pawlikowski M, Kunert-Radek J, Radek M. Expression of somatostatin receptor subtypes in human pituitary adenomas -- immunohistochemical studies. Endokrynol Pol. 2009;60:240-251. [PubMed] |
| 11. | Yen SS, Siler TM, DeVane GW. Effect of somatostatin in patients with acromegaly: suppression of growth hormone, prolactin, insulin and glucose levels. N Engl J Med. 1974;290:935-938. [PubMed] [DOI] |
| 12. | Comi RJ, Gesundheit N, Murray L, Gorden P, Weintraub BD. Response of thyrotropin-secreting pituitary adenomas to a long-acting somatostatin analogue. N Engl J Med. 1987;317:12-17. [PubMed] [DOI] |
| 13. | Olias G, Viollet C, Kusserow H, Epelbaum J, Meyerhof W. Regulation and function of somatostatin receptors. J Neurochem. 2004;89:1057-1091. [PubMed] [DOI] |
| 14. | Gong W, Qin YY, Li SG, Quan ZW, Li JY, Zhuang PY, Wan ZW. [Somatostatin enhanced anti-tumor effect of doxorubicin on gallbladder cancer cells through the regulation of intracellular drug concentration]. Zhonghua Yixue Zazhi. 2010;90:2718-2722. [PubMed] |
| 15. | Quan ZW, Yang Y, Li JY, Gong W, Qin YY, Li SG. The mechanisms of somatostatin induced enhanced chemosensitivity of gallbladder cancer cell line to doxorubicin: cell cycle modulation plus target enzyme up-regulation. Biomed Pharmacother. 2010;64:451-457. [PubMed] [DOI] |
| 16. | Patel YC, Greenwood M, Kent G, Panetta R, Srikant CB. Multiple gene transcripts of the somatostatin receptor SSTR2: tissue selective distribution and cAMP regulation. Biochem Biophys Res Commun. 1993;192:288-294. [PubMed] |
| 17. | Kailey B, van de Bunt M, Cheley S, Johnson PR, MacDonald PE, Gloyn AL, Rorsman P, Braun M. SSTR2 is the functionally dominant somatostatin receptor in human pancreatic β- and α-cells. Am J Physiol Endocrinol Metab. 2012;303:E1107-E1116. [PubMed] [DOI] |
| 18. | Lamberts SW, van der Lely AJ, Hofland LJ. New somatostatin analogs: will they fulfil old promises? Eur J Endocrinol. 2002;146:701-705. [PubMed] |
| 19. | de Sá SV, Corrêa-Giannella ML, Machado MC, de Souza JJ, Pereira MA, Patzina RA, Siqueira SA, Machado MC, Giannella-Neto D. Somatostatin receptor subtype 5 (SSTR5) mRNA expression is related to histopathological features of cell proliferation in insulinomas. Endocr Relat Cancer. 2006;13:69-78. [PubMed] [DOI] |