修回日期: 2014-08-01
接受日期: 2014-08-07
在线出版日期: 2014-09-28
目的: 分析肝癌患者血清胰岛素样生长因子Ⅱ mRNA结合蛋白3(insulin-like growth factor Ⅱ mRNA binding protein 3, IMP3)水平, 并揭示其用于肝癌早期诊断和评价肝癌进展的临床价值.
方法: 选择2011-12/2013-11确诊为肝癌的患者120例为观察组, 同时纳入30例健康志愿者作为对照组. 按照肝癌的严重程度将观察组分成Ⅰ期、Ⅱ期和Ⅲ期. 采用RT-PCR检测观察组、对照组、Ⅰ期、Ⅱ期和Ⅲ期组IMP3的mRNA转录量, 使用ELISA检测方法检测观察组、对照组、Ⅰ期、Ⅱ期和Ⅲ期组患者血清IMP3浓度.
结果: Ⅰ期组IMP3 mRNA转录量显著高于对照组(t = 19.72, P = 0.000), Ⅱ期组IMP3 mRNA转录量显著高于Ⅰ期组(t = 9.67, P = 0.000), Ⅲ期组IMP3 mRNA转录量显著高于Ⅱ期组(t = 23.34, P = 0.000). 观察组血清IMP3平均浓度为134.25 ng/mL±19.33 ng/mL, 显著高于对照组(9.37 ng/mL± 1.23 ng/mL)(t = 70.22, P = 0.000).Ⅰ期组血清IMP3平均浓度为48.35 ng/mL±12.03 ng/mL, 显著高于对照组(t = 19.84, P = 0.000). Ⅱ期组血清IMP3平均浓度为95.36 ng/mL±9.25 ng/mL, 显著高于Ⅰ期组(t = 19.67, P = 0.000). Ⅲ期组血清IMP3平均浓度为214.23 ng/mL±23.64 ng/mL, 显著高于Ⅱ期组(t = 28.83, P = 0.000).
结论: 随着肝癌的进展血清IMP3浓度显著上升, 血清IMP3检测具有肝癌早期诊断和肝癌进展评价的潜在价值.
核心提示: 本研究从2011-12/2013-11来南京医科大学第一附属医院进行肝癌诊断且确诊为肝癌的患者中按照纳入和排除原则纳入了120例患者, 并且根据肝癌严重程度分成Ⅰ期、Ⅱ期和Ⅲ期组. 首先抽取所有患者血液中所有细胞的总RNA, 反转录成cDNA, 然后用PCR方法检测不同组胰岛素样生长因子Ⅱ mRNA结合蛋白3(insulin-like growth factor Ⅱ mRNA binding protein 3, IMP3) mRNA相对于GAPDH mRNA的转录量, 结果发现疾病严重程度增加血清中IMP3 mRNA转录量逐渐增加. 同时使用ELISA 试剂盒检测所有患者血清IMP3的浓度, 结果得出, 观察组120例患者血清IMP3浓度显著高于对照组的健康人群, 说明IMP3可能与肝癌的发生相关.
引文著录: 武正山, 黄新立, 高园园, 吴金道, 邵文雨, 韩国勇, 丁文周. 肝癌患者血清胰岛素样生长因子Ⅱ mRNA结合蛋白3的表达水平及其意义. 世界华人消化杂志 2014; 22(27): 4151-4155
Revised: August 1, 2014
Accepted: August 7, 2014
Published online: September 28, 2014
AIM: To determine serum insulin-like growth factor Ⅱ mRNA binding protein 3 (IMP3) level in patients with hepatocellular carcinoma, and to assess its value in early diagnosis and evaluation of progression of hepatocellular carcinoma.
METHODS: One hundred and twenty patients who were diagnosed with hepatocellular carcinoma from December 2011 to November 2013 were selected and served as an observation group, and 30 healthy volunteers were used as a control group. According to the severity of the disease, the observation group was further divided into three subgroups: Ⅰ, Ⅱ and Ⅲ. RT-PCR was performed to detect IMP3 mRNA levels, and ELISA assays were used to measure serum IMP3 concentrations.
RESULTS: IMP3 mRNA level was significantly higher in subgroup Ⅰ than in the control group (t = 19.72, P = 0.000), in subgroup Ⅱ than in subgroup Ⅰ (t = 9.67, P = 0.000), and in subgroup Ⅲ than in subgroup Ⅱ (t = 23.34, P = 0.000). Mean serum IMP3 concentration was significantly higher in the observation group than in the control group (134.25 ng/mL ± 19.33 ng/mL vs 9.37 ng/mL ± 1.23 ng/mL, t = 70.22, P = 0.000), in subgroup Ⅰ (48.35 ng/mL± 12.03 ng/mL) than in the control group ( t = 19.84, P = 0.000), in subgroup Ⅱ (95.36 ng/mL ± 9.25 ng/mL) than in subgroup Ⅰ (t = 19.67, P = 0.000), and in subgroup Ⅲ (214.23 ng/mL ± 23.64 ng/mL) than in subgroup Ⅱ (t = 28.83, P = 0.000).
CONCLUSION: With the progression of hepatocellular carcinoma, serum IMP3 concentration increases significantly. Serum IMP3 detection has potential value in early diagnosis and evaluation of progression of hepatocellular carcinoma.
- Citation: Wu ZS, Huang XL, Gao YY, Wu JD, Shao WY, Han GY, Ding WZ. Significance of serum insulin-like growth factor Ⅱ mRNA binding protein 3 level in patients with hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(27): 4151-4155
- URL: https://www.wjgnet.com/1009-3079/full/v22/i27/4151.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i27.4151
原发性肝癌是对人类构成严重威胁的疾病之一, 其全球发病率逐年增长, 在肿瘤相关死亡中位居第2位. 目前原发性肝癌的确诊有赖于病理检查和影像学检查, 近年来学者们将重点集中于血清学检测, 即肿瘤标志物的检测. 相比病理和影像学等检查手段, 肿瘤标志物具有简便、快速、非介入性、便于动态检测等优点. 而随着分子生物学技术的不断发展, 肿瘤标志物种类日益繁多.
胰岛素样生长因子Ⅱ(insulin-like growth factor Ⅱ, IGFⅡ)是一种调控细胞增殖的因子, 可促进细胞分化、增殖、胚胎生长发育, 特别是肿瘤细胞的增殖[1]. 人U3小核糖核蛋白胰岛素样生长因子Ⅱ mRNA结合蛋白3(insulin-like growth factor Ⅱ mRNA binding protein 3, IMP3)是一类可结合血清IGFⅡ mRNA的蛋白, 主要参与了血清IGFⅡ转录以及表达, 从而间接影响血清IGFⅡ的细胞增殖, 也可能会成为控制肿瘤细胞增殖的潜在靶点[2,3]. 肝癌的早期诊断和进展评价缺乏特异性指标, 甲胎蛋白可用于诊断肝癌, 但在早期诊断和进展评价中应用性较差[4]. 所以有关肝癌早期诊断和进展评价一直是我们研究的重点. 我们在研究中发现肝癌患者血清IMP3水平显著高于健康患者, 且不同期的肝癌患者血清IMP3浓度也有显著差异, 因此IMP3与肝癌的关系成为我们关注的焦点. 现报道如下.
选择2011-12/2013-11确诊为肝癌的患者120例为观察组, 男性65例, 女性55例, 平均年龄为37.8岁±11.3岁; 同时纳入30例健康志愿者作为对照组, 男性20例, 女性10例, 平均年龄为36.5岁±12.1岁. 同时按照肝癌的严重程度将肝癌分成Ⅰ期(n = 38)、Ⅱ期(n = 45)和Ⅲ期(n = 37).Ⅰ期组男性21例, 女性17例, 平均年龄36.2岁±12.2岁; Ⅱ期组男性25例, 女性20例, 平均年龄34.9岁±15.3岁; Ⅲ期组男性21例, 女性16例, 平均年龄38.6岁±11.7岁. 纳入和排除标准: (1)年龄在25-50岁之间; (2)经肝功能试验、酶学检查等和活组织检查确诊为原发性肝癌; (3)甲胎蛋白(α-fetoprotein, AFP)浓度>25 μg/L, 并且持续增高; (4)伴发其他器官的癌变疾病的患者除外; (5)传染病、糖尿病、消化系统疾病患者除外.
1.2.1 荧光定量PCR: 取患者1 mL血清样品离心取细胞, 加入1 mL的TRIzol后反复混匀, 然后用氯仿抽提蛋白, 异丙醇沉淀总RNA. 使用Fermentas的RevertAid First Strand cDNA Synthesis Kit合成第一条cDNA链. 然后加入等体积的cDNA进行PCR, IMP3上游引物: 5'-ccacgagcagaagctgctgaagcagg-3', IMP3下游引物: 5'-catacagcttgtccagcagcagcgcgg-3', GAPDH上游引物: 5'-agaaggctggggctcatttg-3', GAPDH下游引物: 5'-aggggccatccacagtcttc-3'进行扩增, 扩增参数如下: 94 ℃ 4 min; 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 30 s, 30个循环. 然后取5 μL的PCR产物, 混入1 μL的6×Loading Buffer, 用1%的琼脂糖电泳, 然后用Bio-rad的凝胶成像仪拍照, 用Image J软件进行分析, 比较每个样品中目的基因IMP3相对于GAPDH的表达情况.
1.2.2 ELISA检测: 取所有患者血液500 μL, 加入EP管中(不加抗凝试剂), 37 ℃孵育至血液最大化凝血, 然后经2500 r/min, 离心20 min, 取上清液进行保存. 使用人U3小核糖核蛋白IMP3 ELISA kit (Cat No. CSB-EL011692HU)进行检测, 按照操作说明书进行检测. 记录每个样品的血清中IMP3的浓度, 结果用ng/mL表示.
统计学处理 采用SPSS17.0软件进行统计学分析. 所有计量资料均采用t检验, 数据用mean±SD表示, 结果用t值和P值表示; 所有计数资料均采用χ2检验, 结果用χ2和P值表示. P<0.05为差异有统计学意义.
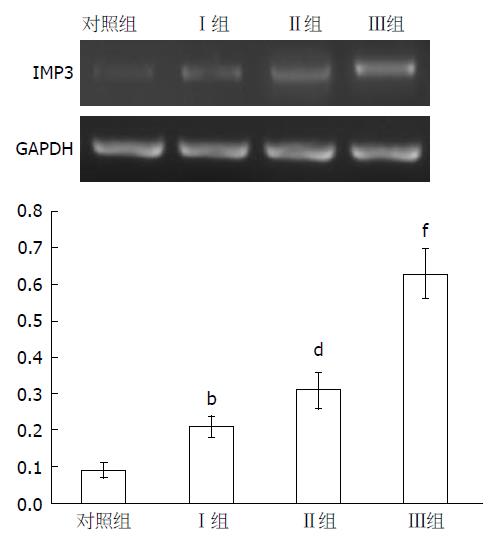
各组患者血清IMP3 mRNA的转录水平比较结果如图1, 从结果可知,Ⅰ期组IMP3 mRNA转录量显著高于对照组(t = 19.72, P = 0.000), Ⅱ期组IMP3 mRNA转录量显著高于Ⅰ期组(t = 9.67, P = 0.000), Ⅲ期组IMP3 mRNA转录量显著高于Ⅱ期组(t = 23.34, P = 0.000).
ELISA检测结果得出, 观察组血清IMP3平均浓度为134.25 ng/mL±19.33 ng/mL, 显著高于对照组(9.37 ng/mL±1.23 ng/mL)(t = 70.22, P = 0.000).Ⅰ期组血清IMP3平均浓度为48.35 ng/mL±12.03 ng/mL, 显著高于对照组(t = 19.84, P = 0.000). Ⅱ期组血清IMP3平均浓度为95.36 ng/mL±9.25 ng/mL, 显著高于Ⅰ期组(t = 19.67, P = 0.000). Ⅲ期组血清IMP3平均浓度为214.23 ng/mL±23.64 ng/mL, 显著高于Ⅱ期组(t = 28.83, P = 0.000).
本文从2011-12/2013-11来南京医科大学第一附属医院进行肝癌诊断且确诊为肝癌的患者中按照纳入和排除原则纳入了120例患者, 并且根据肝癌严重程度分成Ⅰ期、Ⅱ期和Ⅲ期组. 首先抽取所有患者血液中所有细胞的总RNA, 反转录成cDNA, 然后用PCR方法检测不同组IMP3 mRNA相对于GAPDH mRNA的转录量, 结果发现疾病严重程度增加血清中IMP3 mRNA转录量逐渐增加. 同时使用ELISA试剂盒检测所有患者血清IMP3的浓度, 结果得出, 观察组120例患者血清IMP3浓度显著高于对照组的健康人群, 说明IMP3可能与肝癌的发生相关. 另外对不同严重程度的肝癌患者血清IMP3检测结果发现随着疾病严重程度增加血清IMP3浓度显著增加, 说明血清IMP3检测具有肝癌严重程度评价的潜在价值. 并且Ⅰ期的IMP3浓度显著高于健康人群, 说明血清IMP3检测具有潜在的肝癌早期诊断价值.
为了提高肝癌的临床治疗效果, 减少其给身体所带来的伤害, 早期诊断就显得尤为重要. 肝癌的不同发病阶段可以分为Ⅰ期、Ⅱ期和Ⅲ期3个阶段, 不同期的临床症状不同[5].Ⅰ期临床表现不明显, 主要是表现为食欲不振、腹痛、乏力等, 往往会与其他疾病例如消化系统疾病、炎症等混淆, 因此不被人重视. Ⅱ期临床会明显, 持续性发热、消瘦明显、全身衰弱明显等, 而也会与其他疾病混淆, 例如感冒等. Ⅲ期临床会表现为转移至肺可引起咳嗽、咯血; 胸膜转移可引起胸痛和血性胸水; 癌栓阻塞肺动脉或发枝可引发肺梗塞, 使患者出现严重的呼吸困难和胸痛; 癌栓阻塞下腔静脉可引发下肢严重水肿. 往往达到Ⅲ期才会引起重视, 但已经属于肝癌晚期. 此时再采取治疗措施, 治疗痊愈的几率大大降低. 因此对于肝癌进展的快速评价方法显得更加重要.
血清检测是肝癌诊断的重要方向. 有关肝癌的早期诊断和进展评价血清检测方法报道很多. 肝癌的常见的血清检测指标有: 同工铁蛋白(acidic isoferritin, AIF)、AFP、醛缩酶同工酶A(aldolase A, ALD-A)、血清岩藻糖苷酶(α-L-fucosidase, AFU)等, 通常这些项目检测还要结合其他诊断方法例如影像学、病理学检测. 为了丰富肝癌血清诊断的检测指标, 本文我们重点研究了IMP3与肝癌发生和进展的关系. 近几年IMP3与癌症的关系成为研究的热点, Wachter等[6]发现52.5%的肝癌患者的IMP3阳性, 说明IMP3表达检测具有潜在的诊断肝癌的临床价值. Hu等[7]在原发性肝细胞癌患者中发现IMP3与原发性肝细胞上的CD44呈正相关性, IMP3和CD44的联合检测可应用于肝细胞癌. 可见IMP3可能与肝癌的发生的相关. 不仅如此, IMP3与还与前列腺癌[8]、肺癌[9]、喉癌[2]、肝内胆管细胞[10]、宫颈鳞癌[11]、Barrett食管炎[12]等发生相关, 且具有诊断上述疾病的潜在价值. 本文检测了肝癌患者血清IMP3浓度, 结果发现其与肝癌的发生相关. 刘纪昀[13]在综述中明确指出, 近几年的研究报道都表明IMP3参与了癌症的进展, 说明IMP3与癌症进展相关, 与本文的研究结果一致.
IGFⅡ基因是最早发现的内源性印迹基因, 其表达、调控不遵循孟德尔遗传规律. IGFⅡ是一种多功能细胞增殖调控因子, 在细胞的分化, 增殖、胚胎的生长发育以及肿瘤细胞增殖中具有重要的促进作用[14]. IMP3作为IGFⅡ mRNA结合蛋白, 参与促进IGFⅡ mRNA的翻译调控. 因此作为可促进与细胞增殖相关的IGFⅡ基因 mRNA翻译调控的蛋白, 也参与调控细胞增殖, 特别是肿瘤细胞增殖. 因此下一步研究的重点将是在细胞水平揭示IMP3是通过何种机制参与肝癌细胞的增殖, 以明确IMP3与肝癌发生和进展的关系.
目前原发性肝癌的确诊有赖于病理检查和影像学检查, 近年来学者们将重点集中于血清学检测, 即肿瘤标志物的检测. 相比病理和影像学等检查手段, 肿瘤标志物具有简便、快速、非介入性、便于动态检测等优点. 而随着分子生物学技术的不断发展, 肿瘤标志物种类日益繁多. 胰岛素样生长因子Ⅱ(insulin-like growth factor Ⅱ, IGFⅡ)是一种调控细胞增殖的因子, 可促进细胞分化、增殖、胚胎生长发育, 特别可促进肿瘤细胞的增殖. 人U3小核糖核蛋白IMP3是一类可结合血清IGFⅡ mRNA的蛋白, 主要参与了血清IGFⅡ转录以及表达, 从而间接影响血清IGFⅡ的细胞增殖, 也可能会成为控制肿瘤细胞增殖的潜在靶点.
荚卫东, 教授, 安徽省立院肝脏外科
肝癌的早期诊断和进展评价缺乏特异性指标, 甲胎蛋白可用于诊断肝癌, 但在早期诊断和进展评价中应用性较差. 所以有关肝癌早期诊断和进展评价一直是我们研究的重点.
Wachter等52.5%的肝癌患者的IMP3阳性, IMP3表达检测具有潜在的诊断肝癌的临床价值. Hu等在原发性肝细胞癌患者上IMP3与原发性肝细胞上的CD44呈正相关性, IMP3和CD44的联合检测可应用于肝癌细胞癌.
为了提高肝癌的临床治疗效果, 减少其给身体所带来的伤害, 早期诊断就显得尤为重要. 肝癌的不同发病阶段可以分为Ⅰ期、Ⅱ期和Ⅲ期3个阶段, 不同期的临床症状不同.
本研究设计合理, 结果可靠, 有一定的学术价值.
编辑: 田滢 电编: 都珍珍
| 1. | Conover CA, Khosla S. Role of extracellular matrix in insulin-like growth factor (IGF) binding protein-2 regulation of IGF-II action in normal human osteoblasts. Growth Horm IGF Res. 2003;13:328-335. [PubMed] [DOI] |
| 2. | Chen K, Cornejo KM, Ye W, Wu Q, Liang J, Jiang Z. Oncofetal protein IMP3: a new diagnostic biomarker for laryngeal carcinoma. Hum Pathol. 2013;44:2126-2131. [PubMed] [DOI] |
| 3. | Lu D, Yang X, Jiang NY, Woda BA, Liu Q, Dresser K, Mercurio AM, Rock KL, Jiang Z. IMP3, a new biomarker to predict progression of cervical intraepithelial neoplasia into invasive cancer. Am J Surg Pathol. 2011;35:1638-1645. [PubMed] [DOI] |
| 4. | El-Serag HB, Marrero JA, Rudolph L, Reddy KR. Diagnosis and treatment of hepatocellular carcinoma. Gastroenterology. 2008;134:1752-1763. [PubMed] [DOI] |
| 5. | Roncalli M, Park YN, Di Tommaso L. Histopathological classification of hepatocellular carcinoma. Dig Liver Dis. 2010;42 Suppl 3:S228-S234. [PubMed] [DOI] |
| 6. | Wachter DL, Kristiansen G, Soll C, Hellerbrand C, Breuhahn K, Fritzsche F, Agaimy A, Hartmann A, Riener MO. Insulin-like growth factor II mRNA-binding protein 3 (IMP3) expression in hepatocellular carcinoma. A clinicopathological analysis with emphasis on diagnostic value. Histopathology. 2012;60:278-286. [PubMed] [DOI] |
| 7. | Hu S, Wu X, Zhou B, Xu Z, Qin J, Lu H, Lv L, Gao Y, Deng L, Yin J. IMP3 combined with CD44s, a novel predictor for prognosis of patients with hepatocellular carcinoma. J Cancer Res Clin Oncol. 2014;140:883-893. [PubMed] [DOI] |
| 8. | Tosun Yildirim H, Sentürk N. Analysis of IMP3 expression in prostate adenocarcinomas. Turk Patoloji Derg. 2012;28:128-133. [PubMed] [DOI] |
| 9. | Beljan Perak R, Durdov MG, Capkun V, Ivcevic V, Pavlovic A, Soljic V, Peric M. IMP3 can predict aggressive behaviour of lung adenocarcinoma. Diagn Pathol. 2012;7:165. [PubMed] [DOI] |
| 10. | Gao Y, Yang M, Jiang Z, Woda BA, Mercurio AM, Qin J, Huang X, Zhang F. IMP3 expression is associated with poor outcome and epigenetic deregulation in intrahepatic cholangiocarcinoma. Hum Pathol. 2014;45:1184-1191. [PubMed] [DOI] |