修回日期: 2014-07-13
接受日期: 2014-07-31
在线出版日期: 2014-09-18
目的: 动态观察乙型肝炎e抗原(hepatitis B e antigen, HBeAg)阳性慢性乙型肝炎(chronic hepatitis B, CHB)患者聚乙二醇化干扰素α-2b(pegylated interferon α-2b, PEG-IFNα-2b)治疗过程中外周血CD8+记忆T细胞亚群的变化及其临床意义.
方法: 30例HBeAg阳性CHB患者PEG-IFNα-2b治疗24 wk, 在治疗前、治疗12和24 wk, 分别以流式细胞术检测患者外周血CD8+记忆T细胞亚群百分比, 全自动生化分析仪检测谷丙转氨酶(alanine aminotransferase, ALT)水平, 荧光定量PCR检测血清HBV DNA水平, 酶联免疫吸附法检测HBV标志物.
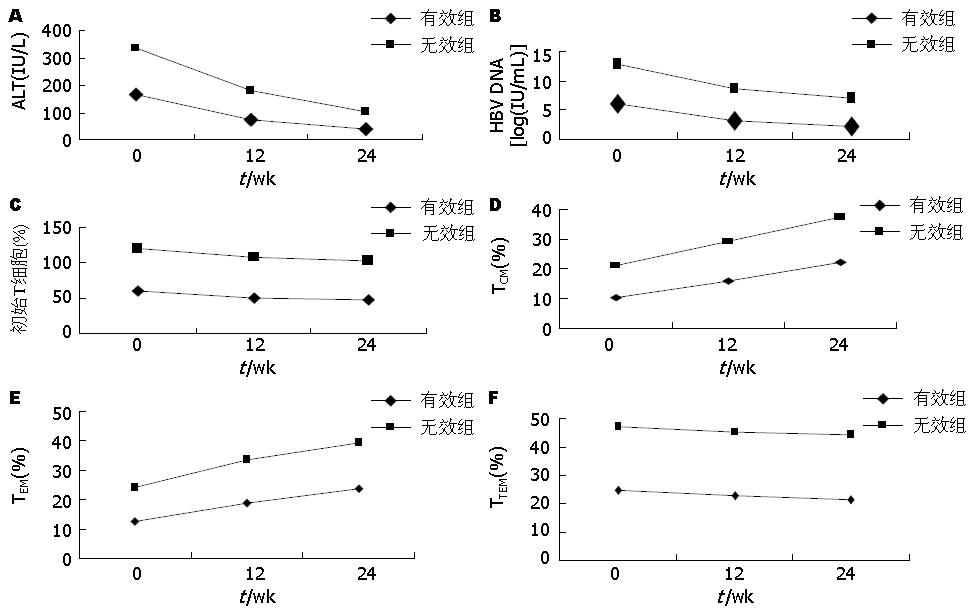
结果: PEG-IFNα-2b治疗24 wk后有效率为36.7%, E抗原血清学转换率6.7%, HBV DNA较低时使用效果较好. 患者ALT随治疗时间延长逐渐下降(P<0.05), 治疗12 wk时初始T细胞(naïve T cell, Tnaive)百分率、HBV DNA滴度较治疗前下降明显(54.8±7.28 vs 60.73±6.67, 4.57±1.41 vs 6.46±0.74, P<0.05), 但治疗12 wk与24 wk相比皆下降不明显(54.8±7.28 vs 52.07±6.09, 4.57±1.41 vs 3.93±1.51, P>0.05). 中心记忆T细胞(central memory T cell, TCM), 效应记忆T细胞(effector memory T cell, TEM)细胞分布频率随治疗时间延长逐渐增加(P<0.05). 3个时间段终末分化效应细胞(terminal effector memory, TTEM)变化不明显. 有效组治疗12 wk和24 wk的ALT, HBV DNA、T naive都较无效组下降(P<0.05); 有效组TEM细胞频率在各时间点都较无效组增加; 治疗12 wk有效组TCM跟无效组差别不大(15.91±5.07 vs 13.42±3.40, P>0.05), 但24 wk时有效组明显增加(22.27±3.58 vs 15.21±3.38, P<0.01). 两组TTEM细胞不同时间段变化不大.
结论: PEG-IFNα-2b治疗CHB致患者初始T细胞下降, TCM、TEM细胞频率升高, 可获得持续性病毒学及生化学应答的概率高, 抗病毒效果好.
核心提示: 聚乙二醇化干扰素α-2b(pegylated interferon α-2b, PEG-IFNα-2b)治疗慢性乙型肝炎(chronic hepatitis B, CHB)患者能通过促进初始T细胞分化为杀伤能力强(效应)和增殖能力强(中心)的记忆细胞, 从而重建CHB的细胞免疫达到抗病毒的效果.
引文著录: 熊清芳, 黄平, 赵磊, 杨永峰, 冯晓宁, 赵红, 王华利. PEG-IFN对HBeAg阳性慢性乙型肝炎患者CD8+记忆T细胞的影响. 世界华人消化杂志 2014; 22(26): 3980-3985
Revised: July 13, 2014
Accepted: July 31, 2014
Published online: September 18, 2014
AIM: To investigate the change of peripheral CD8+ memory T lymphocyte subsets in hepatitis B e antigen positive patients with chronic hepatitis B (CHB) during peginterferon-alph 2b (PEG-IFNα-2b) treatment.
METHODS: Thirty hepatitis B e antigen positive patients with CHB were recruited and received PEG-IFNα-2b treatment for 24 wk. Before and at the 12th and 24th wk of treatment, flow cytometry was used to detect the peripheral CD8+ memory T lymphocyte subsets. Real-time PCR was used to detect the level of HBV DNA. Markers of hepatitis B virus infection were detected by ELISA assay, and serum level of alanine aminotransferase (ALT) was measured using an automatic biochemical analyzer.
RESULTS: Treatment for 24 wk with PEG-IFN-2b resulted in HBeAg seroconversion to negative in 6.7% patients, and the response rate was 36.7%. The response rate was significantly higher in patients with lower viral load (VL). At weeks 12 and 24, serum ALT levels in patients with CHB were significantly lower than pretreatment values. The level of HBV DNA and the percentage of naïve lymphocytes (T naïve) in patients with CHB at week 12 were significantly lower than pretreatment values, but there were no significant differences between at weeks 24 and 12. The percentages of central memory T cells (TCM) and effector memory T cells (TEM) increased gradually during PEG-IFNα-2b treatment. The levels of ALT and HBV DNA and the proportion of naïve T cells significantly decreased in the responders at 12 and 24 wk (P < 0.05), and the proportion of TEM significantly increased at 12 and 24 wk (P < 0.05). The proportion of TCM had no significant difference between the responders and non-responders at 12 wk (P > 0.05), but significantly increased in the responders at 24 wk (P < 0.05). TTEM had no significant changes at different time points and in the responders.
CONCLUSION: PEG-IFNα-2b treatment enhances recovery of memory T cell subset in CHB patients by down-regulating naïve T cells and up-regulating effector cells. CD8+ memory T lymphocyte subsets may be used as biomarkers for predicting the outcome of treatment.
- Citation: Xiong QF, Huang P, Zhao L, Yang YF, Feng XN, Zhao H, Wang HL. Pegylated interferon α enhances recovery of memory T cells in hepatitis B e antigen positive chronic hepatitis B patients. Shijie Huaren Xiaohua Zazhi 2014; 22(26): 3980-3985
- URL: https://www.wjgnet.com/1009-3079/full/v22/i26/3980.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i26.3980
乙型肝炎病毒(hepatitis B virus, HBV)感染可发展为慢性肝炎、肝硬化和肝癌. 细胞免疫参与乙型病毒性肝炎的发病机制, 随着免疫学的发展, 根据不同的细胞表面分子, 界定CD8+记忆T细胞的不同功能亚群, 结合趋化因子受体(chemokine receptor 7, CCR7)以及CD45RA可以将CD8+ T细胞分为初始T细胞(CD27+CD45RA+CCR7+), 中心记忆T细胞(CD27+CD45RA-CCR7+), 效应记忆T细胞(CD27-CD45RA-CCR7-)和终末分化效应细胞(CD45RA+CD27-CCR7-)[1-3]. 有文献报道[4]以及我们前期的工作表明慢性乙型肝炎(chronic hepatitis B, CHB)CD8+记忆T细胞主要为初始T淋巴细胞; 这将影响CD8+ T细胞进一步分化为效应T细胞, 也就是导致其杀伤病毒, 抑制病原体对外周组织的入侵作用下降; 从而导致慢性化过程[4]. PEG-IFNα-2b是目前治疗CHB较为有效的药物, 他能调节细胞免疫功能, 还能诱导HBcAg特异性T淋巴细胞增殖和强烈的肝内CD8+ T淋巴细胞反应[5-8], 减轻肝组织炎性反应及纤维化, 有利于清除病毒, 但是否也能通过恢复CHB CD8+记忆T细胞亚群的分化正常, 从而清除病毒, 尚不清楚, 本文通过观察HBeAg阳性CHB患者PEG-IFNα-2b治疗24 wk时CD8+记忆T亚群的变化, 探讨CHB干扰素治疗的疗效及其与细胞免疫的关系.
2011-01/2014-04南京市第二医院收治的30例HBeAg阳性CHB患者. 诊断、排除标准参照2010年中华医学会肝病学分会、感染病学分会联合修订的《慢性乙型肝炎防治指南》[9]. 本研究方案通过南京市第二医院伦理委员会审批, 所有患者受检前签署知情同意书. 入选患者HBsAg(+)>6 mo, HBeAg(+), 抗-HBc (+), 血清HBV DNA载量≥105 IU/mL, 3 mo内血清谷丙转氨酶(alanine aminotransferase, ALT)≥2倍正常值上限并在入组前停用所用降酶药至少2 wk. 所有病例近3 mo未接受过抗病毒或影响机体免疫的药物治疗, 并排除肝硬化、肝癌及重叠其他病毒性肝炎或自身免疫性肝病, 无酗酒史、非孕妇者, 无骨髓抑制者, 无明显的心、脑、肾、神经、精神病和不稳定糖尿病患者. 美国BD FACS Aria型流式细胞仪. 荧光标记小鼠抗人单克隆抗体CD3-APC/cy7, CD8-PerCP; CD45RA-FITC, CCR7-PE和biotinylated anti-CD27, 红细胞裂解液购自美国BD PHarMingen公司; 流式洗涤液为含5 g/L BSA, l g/L NaN3的PBS. 肝功能由日本Olympus生化分析仪检测. HBV血清标志物ELISA检测试剂盒购自上海科华科技有限公司. HBV DNA检测用试剂盒购自Roche公司.
1.2.1 治疗和疗效观察: 予PEG-IFNα-2b 80 µg皮下注射, 1次/wk, 共24 wk. 在治疗前及治疗后12、24 wk详细记录患者的症状、体征; 同时进行血常规、肝功能、乙型肝炎血清标志物和HBV DNA以及CD8+记忆T细胞各亚群的检测.
1.2.2 疗效判断标准: PEG-IFNα-2b治疗有效: 治疗24 wk后HBV DNA定量转阴或下降≥3log10 IU/mL, HBeAg阴性或阳性, ALT下降; 无效: HBV DNA定量下降<3log10 IU/mL或无改变, HBeAg阳性, ALT无改善. 6 mo时治疗仍无应答者作无效病例停药.
1.2.3 细胞表面分子染色流式细胞仪分析: 肝素抗凝的全血200 µL加2 mL PBS洗涤, 1000 r/min离心5 min; 用吸头小心移弃上清液; 加入10 pentarner, 37 ℃避光孵育15 min; 流式洗涤液洗涤2次; 通过CD8、CD27、CCR7、CD45RA抗体共染色, 并设置同型对照, 混匀; 冰上避光孵育30 min; 洗涤1次; 加红细胞裂解液, 37 ℃孵育10 min; 待细胞悬液变成真性溶液后洗涤2次; 10 g/L多聚甲醛200 µL重悬固定, FACS Aria流式细胞仪检测.
统计学处理 采用SPSS15.0统计软件储存和分析数据. 常规进行方差齐性检验和正态性检验, 计量资料数据以mean±SD表示. 多组资料之间的比较采用One-way ANOVA模块进行F检验, 两组之间比较采用独立样本t检验, P<0.05为差异有统计学意义.
共入组患者35例, 30例患者完成24 wk的疗程, 有5例因疗效欠佳, 在完成12 wk后自行停药并失去随访. 其中男18例, 女12例, 平均年龄28.83岁±6.28岁(19-42岁). PEG-IFNα-2b治疗24 wk后有效11例(36.7%), 无应答者19例(63.3%). 24 wk共2例出现E抗原血清学转换(6.7%). 有效组, 无效组性别、年龄、ALT、 HBV DNA等基线时情况比较显示: 有效组HBV DNA较无效组低, 两者有统计学意义, 余各项指标无统计学意义(表1).
| 疗效 | n | 年龄(岁) | ALT(IU/L) | HBV DNA[log (IU/mL)] | Tnaive | TCM | TEM | TTEM |
| 有效 | 11 | 29.55±7.50 | 166.95±44.19 | 6.11±0.56 | 59.00±5.18 | 10.45±2.98 | 12.63±3.41 | 24.72±3.13 |
| 无效 | 19 | 28.42±5.64 | 168.47±44.23 | 6.66±0.77 | 61.73±7.34 | 10.57±3.00 | 11.42±3.47 | 22.57±4.01 |
| t值 | 0.46 | 0.09 | 2.20 | 1.09 | 0.11 | 0.93 | 1.52 | |
| P值 | 0.64 | 0.92 | 0.03 | 0.28 | 0.91 | 0.36 | 0.14 |
PEG-IFNα-2b治疗12及24 wk, 随治疗时间延长患者ALT逐渐下降, 皆有统计学意义, 治疗12 wk时原始T细胞、HBV DNA滴度较治疗前下降明显, 有统计学意义, 但治疗12与24 wk两者下降不明显, 无统计学意义(t = 1.57, P = 0.12; t = 1.68, P = 0.09). 而中心记忆T细胞(central memory T cell, TCM), 效应记忆T细胞(effector memory T cell, TEM)细胞亚群分布频率随治疗时间延长逐渐增加, 有统计学意义(P<0.001), 3个时间段终末分化效应细胞(terminal effector memory, TTEM)变化不明显, 无统计学意义(表2).
| 时间 | ALT(IU/L) | HBV DNA[log (IU/mL)] | Tnaive | TCM | TEM | TTEM |
| 治疗前 | 167.92±43.45 | 6.46±0.74 | 60.73±6.67 | 10.53±2.94 | 11.87±3.44 | 23.37±3.81 |
| 治疗12 wk | 93.00±44.22 | 4.57±1.41 | 54.80±7.28 | 14.33±4.19 | 16.13±4.79 | 22.43±3.20 |
| 治疗24 wk | 55.17±29.66 | 3.93±1.51 | 52.07±6.09 | 17.80±4.85 | 18.67±5.51 | 22.50±2.98 |
| F值 | 62.79 | 32.43 | 13.11 | 23.93 | 16.31 | 0.73 |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | 0.49 |
PEG-IFNα-2b治疗12 wk, 有效组ALT、HBV DNA、初始T细胞分别较无效组下降幅度大, 有统计学意义(t = 2.11, P = 0.04; t = 5.36, P<0.001; t = 2.40, P = 0.02); 有效组TEM较无效组增加幅度大, 两组有统计学意义(t = 2.34, P = 0.02); 有效组TCM、TTEM较无效组增加或减少幅度不大; 无统计学意义(t = 1.61, P = 0.12; t = 0.61, P = 0.55); 治疗24 wk时; 有效组ALT、HBV DNA、 初始T细胞较无效组下降幅度大, 有统计学意义(t = 2.28, P = 0.03; t = 10.89, P<0.001; t = 3.79, P = 0.001); 有效组TEM、TCM较无效组增加幅度大, 两组有统计学意义(t = 4.81, P<0.001; t = 5.40, P<0.001); 有效祖TTEM较无效组增加或减少幅度不大; 无统计学意义(t = 1.78, P = 0.08)(图1).
HBV是非细胞毒性嗜肝DNA病毒, 他自身并不引起肝细胞损害, 所造成的肝脏炎症严重程度与肝内持续的HBV特异性T淋巴细胞及其活化后招募的非特异性淋巴细胞有关[10]. HBV特异性T细胞免疫应答是双刃剑, 过强的免疫应答引起机体病理损害, 免疫应答低下又不能完全清除病毒感染, 导致感染慢性化. 近年来逐步发现慢性病毒感染能改变记忆T细胞的分化状态, 或者阻碍记忆T细胞的分化进程, 从而影响记忆T细胞的效应功能. 在我们前期的工作中, 发现慢性HBV感染者初始T细胞明显增加, TCM、TEM明显减少, 表明病毒特异性T淋巴细胞没有完全分化, 这可能致机体对乙型肝炎病毒清除能力下降[4], 从而导致慢性化过程. 如何消除HBV这种感染后免疫耐受状态, 重建中间有效T细胞免疫, 是治疗CHB的关键.
INF有直接抑制HBV复制并可通过激活抗原呈递细胞, T细胞等发挥免疫调节功能而增强抑制HBV复制及清除HBV的能力[11]. 尤其是近年来应用的PEG-INF, 观察其疗效及影响其疗效的因素更是值得深入探讨的课题. 我们对30例接受PEG-IFNα-2b治疗的E抗原阳性CHB患者12 wk、24 wk的CD8+记忆T细胞进行了分析, 结果显示: 治疗24 wk时有效率36.7%, HBV DNA较低时使用效果较好, 与文献报道的治疗前病毒含量<1×107 copies/mL的患者IFN疗效较好, 而>1×107 copies/mL IFN疗效差一致[11,12]. 随PEG-IFNα-2b治疗时间延长患者ALT逐渐下降, 也就是炎症反应逐渐改善, 治疗12 wk时初始T细胞、HBV DNA滴度较治疗前下降明显, 但治疗12与24 wk相比两者下降不明显. 说明治疗12 wk已经有明显初始T细胞逐渐下降, 而TCM、TEM细胞亚群分布频率随治疗时间延长逐渐增加, 也就是PEG-IFNα-2b治疗CHB患者能通过促进初始T细胞分化为TEM和TCM的记忆细胞, 从而重建CHB的细胞免疫达到抗病毒的效果. 初始T细胞与HBV DNA的下降保持一致, 文献报道12 wk时HBV DNA滴度能预测IFN疗效[13], 这意味着初始T细胞频率也可作为IFN疗效的预测指标.
我们进一步根据疗效不同, 观察CD8+记忆T细胞亚群的变化, 发现PEG-IFNα-2b治疗12、24 wk有效组ALT、HBV DNA、初始T细胞都较无效组下降幅度大; 并且有效组TEM细胞亚群分布频率都较无效组增加幅度大; 说明治疗效果跟CD8+初始T细胞向效应记忆T细胞分化, 效应记忆T细胞发挥杀伤功能, 抑制病原体对外周组织的入侵, 清除病毒能力增加有关. 治疗12 wk有效组TCM跟无效组差别不大, 但24 wk时, 有效组明显增加, 说明在治疗前期, 起效的主要是初始T细胞向效应记忆T细胞分化, 发挥直接的杀病毒作用, 但随着时间的延长, 效应记忆T细胞逐渐消耗, 这个时候具有较强的增殖能力, 并再次接触相同抗原时能分化成效应记忆T细胞的中心记忆T细胞能得到及时补充[14,15], 是保证抗病毒能力从而达到干扰素的治疗效果的保证. 无论是观察治疗时间还是疗效终末效应T细胞细胞分布频率都无明显改变, 是否与治疗时间较短有关, 尚需要进一步观察其治疗时间更长时变化.
总之, 抗病毒治疗的选择主要参照肝组织炎性反应程度及病毒复制情况来决定, 而检测记忆T淋巴细胞亚群动态变化, 将有助于进一步认识影响干扰素疗效的因素, 为临床选择合适的患者及评判抗病毒疗效提供进一步的指导.
机体的免疫应答特别是细胞免疫应答在乙型肝炎病毒(hepatitis B virus, HBV)感染的发病过程中发挥着重要作用, 而且这种免疫应答状态也与HBV感染的抗病毒疗效密切相关.
刘正稳, 教授, 西安交通大学医学院第一附属医院
有文献报道慢性乙型肝炎(chronic hepatitis B, CHB)患者CD8+ T记忆T细胞主要为初始T淋巴细胞; 具有杀伤作用的效应T细胞减少, 从而导致其抑制病原体对外周组织的入侵作用下降; 从而导致慢性化过程.
聚乙二醇化干扰素α-2b(pegylated interferon α-2b, PEG-IFNα-2b)是目前治疗CHB较为有效的药物, 但是否能通过恢复CHB CD8+记忆T细胞亚群的分化正常, 从而清除病毒, 暂不清楚, 本文观察HBeAg阳性CHB患者PEG-IFNα-2b治疗24 wk时CD8+记忆T亚群的变化及其与疗效的关系.
PEG-IFNα-2b治疗CHB患者能通过促进初始T细胞分化为杀伤能力强(效应)和增殖能力强(中心)的记忆细胞, 从而重建CHB的细胞免疫达到抗病毒的效果.
本研究对理解慢性HBV感染的免疫学发病机制和探讨提高治疗应答率和预测疗效的免疫学指标均具有一定意义.
PEG-IFNα-2b通过促进HBeAg阳性CHB患者初始T细分化为中心记忆T细胞和效应记忆T细胞发挥抗病毒效应, 对理解慢性HBV感染的免疫学发病机制和探讨提高治疗应答率和预测疗效的免疫学指标均具有一定意义.
编辑: 郭鹏 电编:闫晋利
| 1. | Gehring AJ, Xue SA, Ho ZZ, Teoh D, Ruedl C, Chia A, Koh S, Lim SG, Maini MK, Stauss H. Engineering virus-specific T cells that target HBV infected hepatocytes and hepatocellular carcinoma cell lines. J Hepatol. 2011;55:103-110. [PubMed] [DOI] |
| 2. | Zhang EY, Parker BL, Yankee TM. Gads regulates the expansion phase of CD8+ T cell-mediated immunity. J Immunol. 2011;186:4579-4589. [PubMed] [DOI] |
| 3. | Grenningloh R, Tai TS, Frahm N, Hongo TC, Chicoine AT, Brander C, Kaufmann DE, Ho IC. Ets-1 maintains IL-7 receptor expression in peripheral T cells. J Immunol. 2011;186:969-976. [PubMed] [DOI] |
| 4. | Carotenuto P, Artsen A, Osterhaus AD, Pontesilli O. Reciprocal changes of naïve and effector/memory CD8+ T lymphocytes in chronic hepatitis B virus infection. Viral Immunol. 2011;24:27-33. [PubMed] [DOI] |
| 5. | Sonneveld MJ, Rijckborst V, Zeuzem S, Heathcote EJ, Simon K, Senturk H, Pas SD, Hansen BE, Janssen HL. Presence of precore and core promoter mutants limits the probability of response to peginterferon in hepatitis B e antigen-positive chronic hepatitis B. Hepatology. 2012;56:67-75. [PubMed] [DOI] |
| 6. | Asselah T, Lada O, Boyer N, Martinot M, Marcellin P. [Treatment of chronic hepatitis B]. Gastroenterol Clin Biol. 2008;32:749-768. [PubMed] [DOI] |
| 7. | Lan P, Zhang C, Han Q, Zhang J, Tian Z. Therapeutic recovery of hepatitis B virus (HBV)-induced hepatocyte-intrinsic immune defect reverses systemic adaptive immune tolerance. Hepatology. 2013;58:73-85. [PubMed] [DOI] |
| 8. | Boni C, Laccabue D, Lampertico P, Giuberti T, Viganò M, Schivazappa S, Alfieri A, Pesci M, Gaeta GB, Brancaccio G. Restored function of HBV-specific T cells after long-term effective therapy with nucleos(t)ide analogues. Gastroenterology. 2012;143:963-73.e9. [PubMed] [DOI] |
| 10. | Bertoletti A, Maini M, Williams R. Role of hepatitis B virus specific cytotoxic T cells in liver damage and viral control. Antiviral Res. 2003;60:61-66. [PubMed] [DOI] |
| 11. | Wang YD, Zhao CY, Wang W, Shen C, Lu HZ, Zhang L, Yu WY, Zhou JY, Yan WZ. Improved efficacy by individualized combination therapy with Peg IFN-a 2a and ADV in HBeAg positive chronic hepatitis B patients. Hepatogastroenterology. 2012;59:680-686. [PubMed] [DOI] |
| 12. | Liaw YF. Impact of therapy on the outcome of chronic hepatitis B. Liver Int. 2013;33 Suppl 1:111-115. [PubMed] [DOI] |
| 13. | European Association For The Study Of The Liver. EASL clinical practice guidelines: Management of chronic hepatitis B virus infection. J Hepatol. 2012;57:167-185. [PubMed] [DOI] |
| 14. | Sallusto F, Geginat J, Lanzavecchia A. Central memory and effector memory T cell subsets: function, generation, and maintenance. Annu Rev Immunol. 2004;22:745-763. [PubMed] [DOI] |