修回日期: 2014-08-14
接受日期: 2014-08-26
在线出版日期: 2014-09-18
目的: 探讨肌球蛋白轻链激酶(myosin light chain kinase, MLCK)在重症急性胰腺炎(severe acute pancreatitis, SAP)大鼠胰腺组织的表达和作用.
方法: 56只♂SD大鼠, 随机分为对照组(C组)和实验组(S组). 以4%牛磺胆酸钠胰胆管逆行注射建立SAP大鼠模型, 于造模后6、12、24、48 h分批解剖大鼠. 动态测定各时点血清淀粉酶(amylase, AMY)水平; 光镜下观察胰腺大体及组织学表现; 电镜下观察胰腺组织超微结构及紧密连接(tight junction, TJ); 免疫组织化学法测定胰腺组织MLCK定位和表达; ELISA法测定血清肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)含量.
结果: 与对照组相比, S组AMY浓度显著升高(P<0.05); S组胰腺病理学评分显著升高(P<0.05); S组胰腺超微结构破坏明显; TJ显著增宽; S组胰腺MLCK阳性表达于胞浆内, 平均光密度显著升高(P<0.05); S组血清TNF-α浓度显著升高(P<0.05); 胰腺MLCK平均光密度与病理评分、血清TNF-α的Pearson相关分析分别为: r1 = 0.804, r2 = 0.796, 均P<0.05.
结论: SAP大鼠胰腺组织MLCK蛋白、血清TNF-α表达上调, 可能通过其调节细胞紧密连接完整性, 其可能与疾病严重程度相关, 参与急性胰腺炎发病机制.
核心提示: 国内尚无肌球蛋白轻链激酶(myosin light chain kinase, MLCK)在重症急性胰腺炎(severe acute pancreatitis, SAP)胰腺组织的表达及其对胰腺细胞超微结构及细胞间紧密连接(tight junction, TJ)调节的相关研究报道. 初步探讨MLCK在SAP中对胰腺细胞间TJ的调节作用, 这可能为MLCK在急性胰腺炎的发病机制及临床诊疗等研究提供实验理论基础及新思路.
引文著录: 石慧荣, 唐国都, 覃蒙斌, 何家萍. MLCK在重症急性胰腺炎大鼠胰腺的表达及作用. 世界华人消化杂志 2014; 22(26): 3904-3910
Revised: August 14, 2014
Accepted: August 26, 2014
Published online: September 18, 2014
AIM: To investigate the expression of myosin light chain kinase (MLCK) in pancreatic tissue of severe acute pancreatitis (SAP) rats.
METHODS: Fifty-six male SD rats were randomly and equally assigned into a normal control group (C) and a SAP group (S). SAP was reproduced in rats of group S by retrograde injection of 4% sodium taurocholate into the biliopancreatic duct, while group C underwent a sham operation. The rats were killed at 6, 12, 24 and 48 h after SAP induction. Serum amylase (AMY) was measured dynamically. The gross and pathological changes in the pancreas were observed under a light microscope. The ultrastructure and tight junction (TJ) changes in the pancreas were observed with an electron microscope. The localization and expression of MLCK in pancreatic tissue were investigated by immunohistochemical method. The concentration of serum tumor necrosis factor α (TNF-α) was determined by ELISA.
RESULTS: Compared to group C, the AMY concentration and pancreatic pathology score were significantly higher (P < 0.05); pancreatic ultrastructure damage was more obvious and TJ widened significantly; MLCK was positively expressed in the cytoplasm of cells in the pancreas, and the mean density was elevated more significantly (P < 0.05); and serum TNF-α concentration significantly increased in group S (P < 0.05). The mean density of MLCK in the pancreas was positively correlated with pathological score and serum TNF-α concentration (r = 0.804, 0.796, P < 0.05 for both).
CONCLUSION: Up-regulated expression of MLCK protein in the pancreas and elevated serum TNF-α concentration may regulate the integrity of intercellular tight junctions, which may be associated with the severity of SAP and play a role in the pathogenesis of acute pancreatitis.
- Citation: Shi HR, Tang GD, Qin MB, He JP. Expression of MLCK in severe acute pancreatitis in rats. Shijie Huaren Xiaohua Zazhi 2014; 22(26): 3904-3910
- URL: https://www.wjgnet.com/1009-3079/full/v22/i26/3904.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i26.3904
重症急性胰腺炎(severe acute pancreatitis, SAP)为临床常见急危重症之一, 伴全身炎症反应和多器官功能衰竭, 病程发展快, 病死率高. 但其发病机制尚未完全清楚. 肌球蛋白轻链激酶(myosin light chain kinase, MLCK)基因属于免疫球蛋白基因超家族的一员, 是调节白细胞渗出、凋亡和血管生成的多重效应因子[1]. 研究表明, MLCK通过使肌球蛋白轻链(myosin light chain, MLC)磷酸化, 使MLC空间构象改变, 介导平滑肌和非平滑肌收缩, 开放细胞间紧密连接(tight junction, TJ), 使细胞间隙增宽[2]. 然而, MLCK在SAP胰腺组织的表达及其对胰腺细胞超微结构及细胞间TJ的调节, 国内尚无相关研究报道. 本实验通过建立SAP大鼠模型, 探讨SAP时胰腺MLCK蛋白表达, 胰腺细胞间TJ结构改变, 其与胰腺病理评分及血清肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)含量的关系, 初步探讨MLCK在SAP中对胰腺细胞间TJ的调节作用及其在SAP发病机制中的作用.
♂SD大鼠(广西医科大学实验动物中心); 牛磺胆酸钠(日本TCI公司); 兔抗大鼠MLCK多克隆抗体(Sigma公司); 即用型SP-9000免疫组织化学检测试剂盒、DAB Kit(北京中杉金桥公司); Rat TNF-α ELISA Kit(欣博盛生物公司).
1.2.1 分组: 56只♂SD大鼠, 随机分为对照组(C组)和实验组(S组)两组. 于造模后6、12、24、48 h分批解剖大鼠, 每个时点7只.
1.2.2 造模: 大鼠适应性饲养1 wk, 术前禁食12 h, 自由饮水. 用10%水合氯醛腹腔注射麻醉后固定, 取上腹正中线切口, 手术视野剪毛, 碘伏消毒, 手术剪依次剪开进入腹腔. 实验组: 暴露胰腺、胰管及十二指肠, 沿十二指肠内侧找到胰胆管开口, 在开口对侧肠壁用钝头4.5号静脉留置针穿破十二指肠壁, 并斜行从胰胆管开口处探入胰胆管, 随后用无损伤血管夹分别夹住胰胆管远端与近端, 以0.1 mL/min于胆胰管逆行注入4%牛磺胆酸钠(1 mL/kg), 注射完毕后夹闭胰胆管远端约2 min, 取出穿刺针及血管夹, 确认腹腔无活动性出血后将十二指肠、胰腺还纳原位, 逐层关腹. 假手术组: 开腹后镊子轻翻动十二指肠及胰腺后还纳原位, 逐层关腹, 术后均于皮下注生理盐水(10 mL/kg).
1.2.3 标本采集: C、S两组大鼠分别于造模后6、12、24、48 h剖腹, 观察胰腺大体情况, 右心房采血, 离心取上清存于-80 ℃冰箱备用, 剪取胰腺组织置于甲醛溶液中固定.
1.2.4 血清淀粉酶(amylase, AMY)检测: 全自动生化检测仪.
1.2.5 胰腺组织病理学评分: 制作胰腺组织HE石蜡切片, 在病理老师指导下看片, 参考Schwarz等[3]标准从水肿、炎性细胞浸润、出血及坏死4个方面评分.
1.2.6 血清TNF-α含量检测: 取动物血清, 按ELISA试剂盒说明书操作, 以标准品浓度及其A450值制作标准曲线, 据样品A450值计算其浓度.
1.2.7 电子显微镜观察胰腺组织超微结构及细胞TJ: 制备透射电镜胰腺超薄切片, 电镜老师操作, 超高倍镜(50000倍)下观察胰腺细胞超微结构及TJ.
1.2.8 免疫组织化学法检测胰腺组织MLCK表达: 石蜡切片脱蜡, H2O2室温孵育, 枸橼酸钠缓冲液抗原修复, 正常血清封闭, 滴加MLCK多克隆抗体(1:200), 4 ℃过夜, 加入生物素标记山羊抗兔IgG二抗, 滴加辣根酶标记链霉卵白素工作液覆盖, DAB显色, 镜检. 用PBS代替一抗为阴性对照. 若为阳性, 棕黄色表达于细胞浆内, 细胞核为蓝色; 若为阴性, 细胞核和细胞浆均为蓝色. 使用美国Imagepro plus 6.0专业图像分析软件分析, 各个时点每张切片高倍镜下(400倍)随机取5个视野, 取平均光密度值为结果做半定量分析.
统计学处理 应用SPSS16.0统计软件对数据进行统计学处理. 实验数据以mean±SD表示, 计量资料组间比较采用完全随机设计两样本均数比较的t检验; 相关性用Pearson相关性分析, P<0.05表示差异有统计学意义.
与C组对比, S组各时点AMY浓度均高于C组(P<0.05), 于造模后明显上升, 6 h达峰值, 并持续处于高水平(表1).
| 时间 | 分组 | 血清AMY(U/L) | 胰腺病理评分 | TNF-α(U/L) |
| 6 h | C组 | 1841.33±181.24 | 3.90±1.144 | 11.259±2.76 |
| S组 | 6015.17±1212.57a | 8.80±1.08a | 29.43±5.83a | |
| 12 h | C组 | 1176.33±123.52 | 4.68±0.35 | 17.24±1.99 |
| S组 | 4978.17±1573.60a | 12.20±1.80a | 47.88±15.85a | |
| 24 h | C组 | 1359.50±277.70 | 4.43±0.53 | 9.19±3.98 |
| S组 | 4224.60±646.50a | 10.83±0.85a | 47.69±21.11a | |
| 48 h | C组 | 1147.83±91.35 | 4.00±0.52 | 12.45±3.52 |
| S组 | 2124.80±804.92a | 10.60±1.14a | 24.53±6.59a |
C组胰腺大体病理无改变, 光镜下胰腺小叶完整, 细胞形态正常, 未见明显出血、坏死, 偶有轻度水肿及少量炎性细胞浸润; S组胰腺明显水肿, 有暗红色出血样改变及胶冻样坏死改变, 光镜下胰腺间质增宽, 腺小叶结构破坏, 腺泡细胞空泡样变, 炎性细胞浸润, 局灶或大片出血坏死. 与C组对比, S组各时点胰腺病理评分均显著升高(P<0.05), 12 h达峰值, 并持续处于高水平(表1).
与C组对比, S组各时点血清TNF-α浓度均显著升高(P<0.05), 且于造模后即上升, 12 h达峰值, 并持续处于高水平(表1).
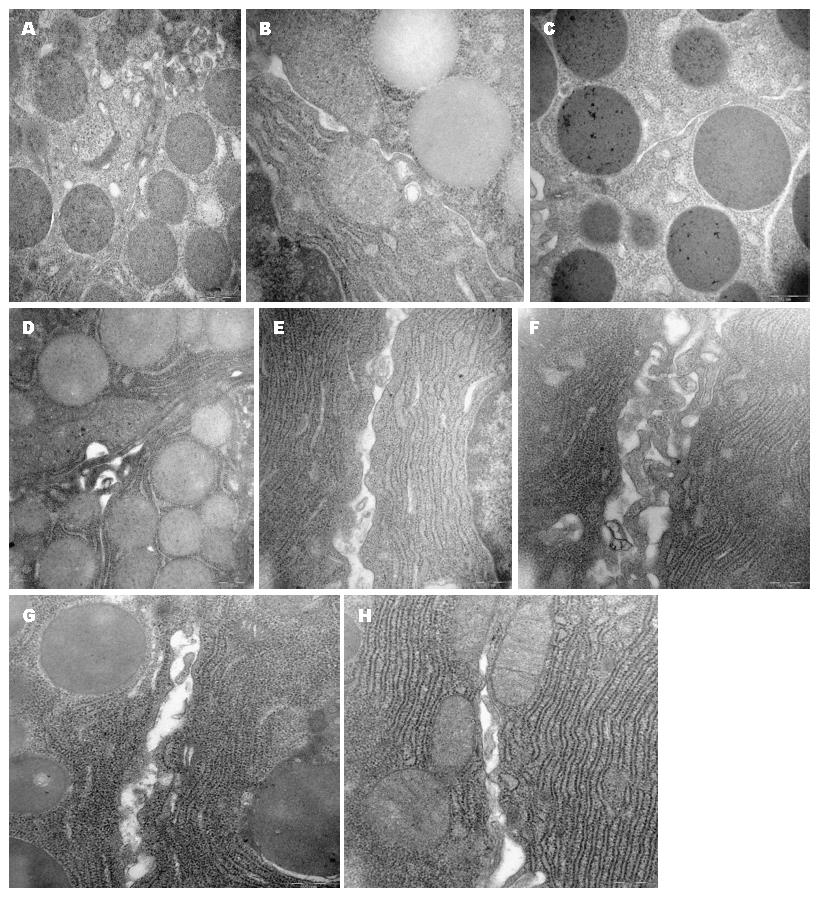
如图1所示, C组可见大量酶原颗粒, 腺泡胞细胞质内细胞器丰富, 线粒体、内质网等结构未见异常质, 细胞间紧密连接可见, 宽度未见明显改变; S组见酶原颗粒数量减少, 线粒体肿胀, 嵴减少, 内质网扩张, 细胞质内空泡形成; 与C组对比, S组各时点细胞TJ均显著增宽, 12 h时增宽最明显.
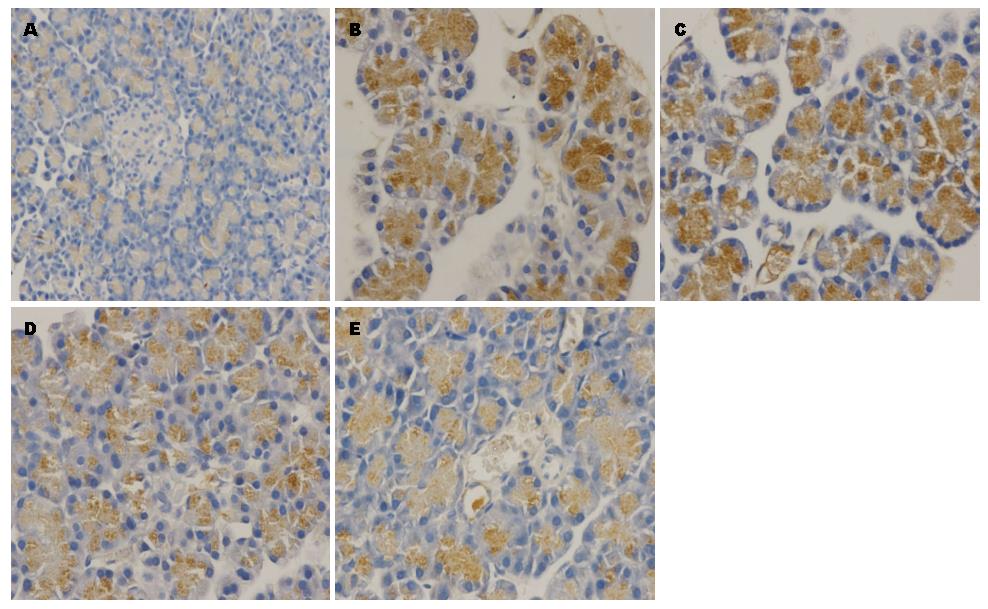
免疫组织化学染色显示, C组胰腺组织MLCK不表达或弱阳性表达, S组可见免疫阳性细胞, 免疫阳性物质呈棕褐色, 主要表达于细胞浆. 与C组相比, S组各时点胰腺MLCK平均光密度显著升高(P<0.05), 于造模后即上升, 12 h达峰值, 并持续处于高水平(表2, 图2). 胰腺MLCK平均光密度与病理评分、血清TNF-α的Pearson相关分析分别为: r = 0.804, r = 0.796, 均P<0.05, 提示胰腺MLCK平均光密度与病理评分、血清TNF-α呈正相关性.
MLCK基因属于丝氨酸/苏氨酸(Ser/Thr)蛋白激酶家族成员, 在骨骼肌细胞和平滑肌细胞收缩的启动及调节中发挥关键作用; 而MLCK在非肌肉细胞中的作用目前仍不清楚. 有研究表明, MLCK广泛存在于各种真核细胞及非肌肉性细胞中, 分为3种亚型, 分别由不同基因编码, 由4个区域组成: N端肌动蛋白结合区、中心激酶区、钙调蛋白结合区及C端肌球蛋白结合区[4], MLCK通过对MLC磷酸化和去磷酸化调节, 影响MLC活性. Zhu等[5]研究提示在非肌肉细胞中MLCK活性、MLC磷酸化及细胞质内Ca2+浓度变化在生命活动中具有重要作用. 此外, 在很多非肌细胞中, 纤维状肌动蛋白和肌球蛋白都参与调节复杂的囊泡转运, 调控主细胞酶原颗粒分泌活动[6], 使用肌动蛋白抑制剂和MLCK抑制剂, 可导致分泌囊泡与胞膜融合孔隙关闭, 表明MLCK在主细胞分泌过程中发挥极为重要的作用, 由此可推测MLCK可能参与了胰腺导管上皮细胞的分泌过程[7,8].
胰腺相邻细胞间连接有TJ、桥粒、黏附连接和缝隙连接等, TJ是最主要的连接方式. 细胞TJ位于上皮细胞膜外侧顶部, 相邻细胞互相包裹, 形成融合点或吻合点, 在超薄切片电镜下表现为一狭窄带状结构, 是一个多蛋白结构复合体. TJ主要功能是只允许离子及小分子可溶性物质通过, 而不允许毒性大分子及微生物通过, 这种特殊生理功能在SAP发病过程中, 能防止炎症介质侵入胰腺组织, 在SAP的起病及病程中有举足轻重的作用. 本研究提示, SAP大鼠胰腺组织出现酶原颗粒数量减少, 线粒体肿胀, 嵴减少, 内质网扩张, 细胞质内空泡形成等超微结构破坏; 各时点细胞间TJ均增宽, 完整性受破坏. 此外, 以上改变与胰腺组织病理学改变趋势一致. 提示胰腺细胞间TJ的改变可能参与了SAP发生、发展. 细胞间TJ的调节可能受MLCK及Occludin蛋白的磷酸化与去磷酸化、Ca2+途径、Ga12/Src酪氨酸激酶、蛋白激酶C、Rho-GTP酶等信号途径的调节[9,10].
MLCK属于Ca2+/钙调蛋白(calmodulin, CaM)依赖的蛋白激酶家族, 在Ca2+和CaM存在下, 形成Ca2+/CaM复合体, 其为调控MLCK活性的中心元件[11], Ca2+/CaM复合体与MLCK结合后能导致MLCK天然抑制物解离[12], 激活MLCK, 形成MLCK前体. MLCK激活后使MLC的Ser19和Thr18发生磷酸化, 且MLC磷酸化程度取决于MLCK的活性[13], 使MLC空间构象发生改变[14], 并促进肌球蛋白与肌动蛋白丝相互作用[15], 诱导连接周围的肌动蛋白和肌球蛋白丝收缩, 对TJ和细胞表面产生张力, 开放TJ[16], 继而调节细胞骨架结构, MLC的磷酸化在细胞骨架与细胞收缩等功能的调控中具有重要作用[17,18]. Wang等[19]研究表明肌球蛋白调控的轻链的磷酸化引起的细胞骨架收缩是TJ破坏的必要因素, 使用肌动蛋白解聚剂能开放细胞间TJ. 研究[20]表明在人类和啮齿动物的小肠细胞实验模型中, 均提示TJ的开放是通过MLC磷酸化的启动, 而MLC磷酸化又依赖于MLCK的激活. 且越来越多研究[21]证实, MLCK对于维持TJ的完整性起着重要作用, 通过建立胞膜持续高表达MLCK的体外细胞模型, 可观察到TJ的损伤. 研究者[22,23]还观察到, 敲除MLCK基因和利用特异性MLCK抑制剂均能减轻TJ损伤, 均提示MLCK在TJ的损伤及修复调节中起着重要作用. 本实验结果表明MLCK在SAP大鼠胰腺组织胞浆强阳性表达, 其动态变化与TJ结构破坏趋势一致, 与胰腺病理损伤呈正相关, 结合血清淀粉酶改变可知, 随病程延长, 胰腺组织损伤程度增加, 胰腺MLCK表达增加, 提示了MLCK可能通过调节TJ, 破坏了胰腺细胞间TJ结构, 参与SAP疾病的发生发展, 可能与SAP的严重程度相关.
TNF-α由单核巨噬细胞分泌, 是重要的促炎症因子和免疫调节因子, 与SAP早期炎症发生、病情严重程度密切相关[24]. TNF-α可增加MLC磷酸酶转录和激活MLCK活性, 上调MLCK蛋白表达, 引起MLC磷酸化增加及TJ相关蛋白重新分布, 改变TJ结构及完整性, 同时对其进行动态调控[25-28]此外, 韩亮[29]研究结果表明使用抗TNF-α抗体可降低小肠黏膜中MLCK活性和表达, 表明抗TNF-α抗体通过拮抗TNF-α, 恢复上皮细胞间TJ破坏. 本实验发现SAP组大鼠各时点TNF-α表达水平均显著升高, 且与对应胰腺MLCK表达成正相关, 提示在SAP大鼠模型中, TNF-α与MLCK活性及表达密切相关, 可能参与胰腺细胞TJ的调节和胰腺病理损伤的发生.
总之, 本研究结果表明在SAP大鼠中, 胰腺组织MLCK表达与起病理损伤及TNF-α含量成正相关, 机制可能与其调节胰腺细胞间TJ相关. 这可能为MLCK在急性胰腺炎的发病机制及临床诊疗等研究提供实验理论基础及新思路.
肌球蛋白轻链激酶(myosin light chain kinase, MLCK)基因属于免疫球蛋白基因超家族的一员, 广泛存在于各种真核细胞及非肌肉性细胞中, 是调节白细胞渗出、凋亡和血管生成的多重效应因子. 其对细胞间紧密连接及细胞骨架的调节其关键作用. 其对急性胰腺炎发病的作用及影响有待研究.
黄颖秋, 教授, 本溪钢铁(集团)总医院消化内科
本实验通过建立重症急性胰腺炎(severe acute pancreatitis, SAP)大鼠模型, 探讨SAP时胰腺MLCK蛋白表达, 胰腺细胞间紧密连接(tight junction, TJ)结构改变, 其与胰腺病理评分及血清肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)含量的关系, 初步探讨MLCK在SAP中对胰腺细胞间TJ的调节作用, 及其在SAP发病机制中的作用.
MLCK在SAP胰腺组织的表达及其对胰腺细胞超微结构及细胞间TJ的调节, 国内尚无相关研究报道.
本文研究了MLCK在SAP大鼠胰腺组织中的表达情况, 初步探讨了MLCK在急性胰腺炎发病机制中的作用, 为该领域的进一步研究提供了实验依据.
本研究结果表明在SAP大鼠中, 胰腺组织MLCK表达与起病理损伤及TNF-α含量成正相关, 机制可能与其调节胰腺细胞间TJ相关. 这可能为MLCK在急性胰腺炎的发病机制及临床诊疗等研究提供实验理论基础及新思路.
本文选题较新颖, 实验设计合理, 研究方法科学, 结论客观. 本文研究了MLCK在SAP大鼠胰腺组织中的表达情况, 初步探讨了MLCK在急性胰腺炎发病机制中的作用, 为该领域的进一步研究提供了实验依据.
编辑: 郭鹏 电编:闫晋利
| 1. | Bettler B, Kaupmann K, Mosbacher J, Gassmann M. Molecular structure and physiological functions of GABA(B) receptors. Physiol Rev. 2004;84:835-867. [PubMed] [DOI] |
| 2. | Tu H, Xu C, Zhang W, Liu Q, Rondard P, Pin JP, Liu J. GABAB receptor activation protects neurons from apoptosis via IGF-1 receptor transactivation. J Neurosci. 2010;30:749-759. [PubMed] [DOI] |
| 3. | Schwarz DA, Barry G, Eliasof SD, Petroski RE, Conlon PJ, Maki RA. Characterization of gamma-aminobutyric acid receptor GABAB(1e), a GABAB(1) splice variant encoding a truncated receptor. J Biol Chem. 2000;275:32174-32181. [PubMed] [DOI] |
| 4. | Nakamura A, Xie C, Zhang Y, Gao Y, Wang HH, Ye LH, Kishi H, Okagaki T, Yoshiyama S, Hayakawa K. Role of non-kinase activity of myosin light-chain kinase in regulating smooth muscle contraction, a review dedicated to Dr. Setsuro Ebashi. Biochem Biophys Res Commun. 2008;369:135-143. [PubMed] [DOI] |
| 5. | Zhu HQ, Wang Y, Hu RL, Ren B, Zhou Q, Jiang ZK, Gui SY. Distribution and expression of non-muscle myosin light chain kinase in rabbit livers. World J Gastroenterol. 2003;9:2715-2719. [PubMed] |
| 6. | Thorn P. New insights into the control of secretion. Commun Integr Biol. 2009;2:315-317. [PubMed] |
| 7. | Jung SR, Kim MH, Hille B, Koh DS. Control of granule mobility and exocytosis by Ca2+ -dependent formation of F-actin in pancreatic duct epithelial cells. Traffic. 2009;10:392-410. [PubMed] [DOI] |
| 8. | Doreian BW, Fulop TG, Meklemburg RL, Smith CB. Cortical F-actin, the exocytic mode, and neuropeptide release in mouse chromaffin cells is regulated by myristoylated alanine-rich C-kinase substrate and myosin II. Mol Biol Cell. 2009;20:3142-3154. [PubMed] [DOI] |
| 9. | Camilleri M, Madsen K, Spiller R, Greenwood-Van Meerveld B, Verne GN. Intestinal barrier function in health and gastrointestinal disease. Neurogastroenterol Motil. 2012;24:503-512. [PubMed] [DOI] |
| 10. | Kuner R, Köhr G, Grünewald S, Eisenhardt G, Bach A, Kornau HC. Role of heteromer formation in GABAB receptor function. Science. 1999;283:74-77. [PubMed] [DOI] |
| 11. | Kamm KE, Stull JT. Dedicated myosin light chain kinases with diverse cellular functions. J Biol Chem. 2001;276:4527-4530. [PubMed] [DOI] |
| 12. | Hong F, Haldeman BD, Jackson D, Carter M, Baker JE, Cremo CR. Biochemistry of smooth muscle myosin light chain kinase. Arch Biochem Biophys. 2011;510:135-146. [PubMed] [DOI] |
| 13. | Hong F, Haldeman BD, John OA, Brewer PD, Wu YY, Ni S, Wilson DP, Walsh MP, Baker JE, Cremo CR. Characterization of tightly associated smooth muscle myosin-myosin light-chain kinase-calmodulin complexes. J Mol Biol. 2009;390:879-892. [PubMed] [DOI] |
| 14. | Herring BP, El-Mounayri O, Gallagher PJ, Yin F, Zhou J. Regulation of myosin light chain kinase and telokin expression in smooth muscle tissues. Am J Physiol Cell Physiol. 2006;291:C817-C827. [PubMed] [DOI] |
| 15. | Ohlmann P, Tesse A, Loichot C, Ralay Ranaivo H, Roul G, Philippe C, Watterson DM, Haiech J, Andriantsitohaina R. Deletion of MLCK210 induces subtle changes in vascular reactivity but does not affect cardiac function. Am J Physiol Heart Circ Physiol. 2005;289:H2342-H2349. [PubMed] [DOI] |
| 16. | Fazal F, Gu L, Ihnatovych I, Han Y, Hu W, Antic N, Carreira F, Blomquist JF, Hope TJ, Ucker DS. Inhibiting myosin light chain kinase induces apoptosis in vitro and in vivo. Mol Cell Biol. 2005;25:6259-6266. [PubMed] [DOI] |
| 17. | Matsumura F, Hartshorne DJ. Myosin phosphatase target subunit: Many roles in cell function. Biochem Biophys Res Commun. 2008;369:149-156. [PubMed] [DOI] |
| 18. | Goeckeler ZM, Bridgman PC, Wysolmerski RB. Nonmuscle myosin II is responsible for maintaining endothelial cell basal tone and stress fiber integrity. Am J Physiol Cell Physiol. 2008;295:C994-C1006. [PubMed] [DOI] |
| 19. | Wang F, Schwarz BT, Graham WV, Wang Y, Su L, Clayburgh DR, Abraham C, Turner JR. IFN-gamma-induced TNFR2 expression is required for TNF-dependent intestinal epithelial barrier dysfunction. Gastroenterology. 2006;131:1153-1163. [PubMed] [DOI] |
| 20. | Zolotarevsky Y, Hecht G, Koutsouris A, Gonzalez DE, Quan C, Tom J, Mrsny RJ, Turner JR. A membrane-permeant peptide that inhibits MLC kinase restores barrier function in in vitro models of intestinal disease. Gastroenterology. 2002;123:163-172. [PubMed] |
| 21. | Shen L, Black ED, Witkowski ED, Lencer WI, Guerriero V, Schneeberger EE, Turner JR. Myosin light chain phosphorylation regulates barrier function by remodeling tight junction structure. J Cell Sci. 2006;119:2095-2106. [PubMed] [DOI] |
| 22. | Clayburgh DR, Barrett TA, Tang Y, Meddings JB, Van Eldik LJ, Watterson DM, Clarke LL, Mrsny RJ, Turner JR. Epithelial myosin light chain kinase-dependent barrier dysfunction mediates T cell activation-induced diarrhea in vivo. J Clin Invest. 2005;115:2702-2715. [PubMed] [DOI] |
| 23. | Moriez R, Salvador-Cartier C, Theodorou V, Fioramonti J, Eutamene H, Bueno L. Myosin light chain kinase is involved in lipopolysaccharide-induced disruption of colonic epithelial barrier and bacterial translocation in rats. Am J Pathol. 2005;167:1071-1079. [PubMed] [DOI] |
| 24. | Papachristou GI. Prediction of severe acute pancreatitis: current knowledge and novel insights. World J Gastroenterol. 2008;14:6273-6275. [PubMed] |
| 25. | Xavier RJ, Podolsky DK. Unravelling the pathogenesis of inflammatory bowel disease. Nature. 2007;448:427-434. [PubMed] [DOI] |
| 26. | Ye D, Ma TY. Cellular and molecular mechanisms that mediate basal and tumour necrosis factor-alpha-induced regulation of myosin light chain kinase gene activity. J Cell Mol Med. 2008;12:1331-1346. [PubMed] [DOI] |
| 27. | Liu H, Li M, Wang P, Wang F. Blockade of hypoxia-inducible factor-1α by YC-1 attenuates interferon-γ and tumor necrosis factor-α-induced intestinal epithelial barrier dysfunction. Cytokine. 2011;56:581-588. [PubMed] [DOI] |
| 28. | Gilbert S, Zhang R, Denson L, Moriggl R, Steinbrecher K, Shroyer N, Lin J, Han X. Enterocyte STAT5 promotes mucosal wound healing via suppression of myosin light chain kinase-mediated loss of barrier function and inflammation. EMBO Mol Med. 2012;4:109-124. [PubMed] [DOI] |
| 29. | 韩 亮. 抗TNF-α抗体对DSS结肠炎小鼠肠黏膜通透性的影响及机制研究. 合肥: 安徽医科大学 2012; . |