修回日期: 2014-07-16
接受日期: 2014-07-31
在线出版日期: 2014-09-18
目的: 探讨姜黄素对胆管癌增殖和凋亡的影响, 并在体内实验中明确姜黄素能否延长胆管癌荷瘤小鼠生存时间.
方法: 采用CCK-8法检测姜黄素对胆管癌细胞株QBC939、RBE、TFK-1的增殖抑制作用; 采用流式细胞术检测姜黄素对胆管癌细胞株凋亡率的影响; 构建胆管癌裸鼠原位移植模型, 检测姜黄素对小鼠体质量增长曲线和生存曲线的影响.
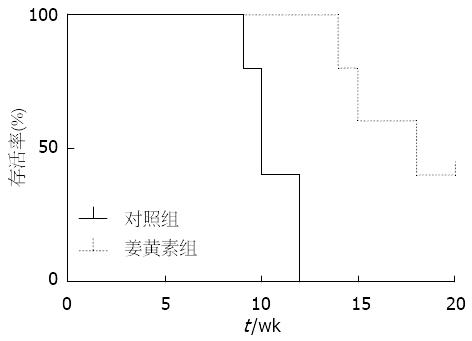
结果: 姜黄素对胆管癌细胞株QBC939、RBE、TFK-1的增殖都具有明显抑制作用(P<0.05), 并且这种抑制作用呈浓度和时间依赖性. 姜黄素对胆管癌细胞株TFK-1有明显的诱导凋亡的作用. 姜黄素浓度分别为0、0.1、1、5、10 μmol/L; 对应的凋亡率分别为8.41%±1.22%、21.49%±2.58%、48.53%±2.41%、69.75%±1.46%、87.59%±3.25%(P<0.05). 体内实验结果表明, 姜黄素能显著延长荷瘤小鼠的生存时间(P<0.05), 并显著改善荷瘤小鼠生存状态(P<0.05).
结论: 姜黄素在体外实验中能抑制胆管癌细胞株的增殖, 诱导胆管癌细胞株的凋亡; 在体内实验中, 姜黄素能延长荷瘤小鼠生存时间, 改善生存状态.
核心提示: 本研究发现, 在体外实验中, 姜黄素可以抑制胆管癌细胞的增殖, 而且这种效应呈时间依赖性和浓度依赖性; 姜黄素还可以诱导胆管癌的凋亡; 在体内实验中, 姜黄素明显改善胆管癌荷瘤小鼠生存状态, 延长生存时间.
引文著录: 郭兴军, 王敏, 江建新, 石程剑, 秦仁义. 姜黄素对胆管癌增殖和凋亡的影响. 世界华人消化杂志 2014; 22(26): 3898-3903
Revised: July 16, 2014
Accepted: July 31, 2014
Published online: September 18, 2014
AIM: To investigate the effect of curcumin on proliferation and apoptosis of cholangiocarcinoma cells and whether curcumin shows a therapeutic effect on cholangicarcinoma in vivo.
METHODS: CCK-8 assay was employed to investigate the effect of curcumin on cell proliferation in cholangiocarcinoma cell lines QBC939, RBE and TFK-1. Flow cytometry was employed to assess the effect of curcumin on cell apoptosis in cholangiocarcinoma cell lines. A nude mouse model of orthotopic transplantation of cholangiocarcinoma was developed to investigate the effect of curcumin on weight gain and survival state of mice.
RESULTS: Curcumin inhibited the proliferation of QBC939, RBE and TFK-1 cells (P < 0.05) in a dose- and time-dependent manner. Curcumin significantly induced apoptosis of cholangiocinoma cells. When curcumin concentrations were 0, 0.1, 1, 5 and 10 μmol/L, the corresponding apoptosis rates were 8.41% ± 1.22%, 21.49% ± 2.58%, 48.53% ± 2.41%, 69.75% ± 1.46% and 87.59% ± 3.25%, respectively (P < 0.05). In vivo experimental results show that curcumin significantly prolonged the survival time of tumor-bearing mice (P < 0.05) and significantly improved their survival state (P < 0.05).
CONCLUSION: Curcumin inhibits cell proliferation and induces apoptosis in cholangiocarcinoma cell lines in vitro, and prolongs the survival time of cholangiocarcinoma bearing mice and improve their survival status in vivo.
- Citation: Guo XJ, Wang M, Jiang JX, Shi CJ, Qin RY. Curcumin inhibits cell proliferation and induces apoptosis in cholangiocarcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(26): 3898-3903
- URL: https://www.wjgnet.com/1009-3079/full/v22/i26/3898.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i26.3898
胆管癌手术难度大、术后易复发、放化疗不敏感、远期疗效差[1,2]. 胆管癌化疗敏感性差, 目前对胆管癌的化疗仍无确切有效的方案[3,4]. 姜黄素的抑制肿瘤增殖、促进肿瘤细胞凋亡的作用受到广泛重视[5,6], 可能成为一种有效的肿瘤化疗药物[7,8], 但姜黄素对胆管癌的作用还没有研究. 本文初步在体外实验研究姜黄素对胆管癌增殖和凋亡的影响, 体内实验研究姜黄素对胆管癌生存期的影响, 为深入研究奠定基础.
人胆管癌细胞株QBC939、RBE、TFK-1为本实验室长期冻存; RPMI 1640培养基购自美国Hyclone公司; 胎牛血清购自美国Gibco公司; CCK-8试剂盒购自日本Dojindo公司; 姜黄素购自美国Sigma公司; 姜黄素溶液的配制: 以少量二甲亚砜(dimethyl sulfoxide, DMSO)溶解姜黄素粉剂, 配成10 mmol/L溶液, 置4 ℃冰箱保存, 临用时稀释至所需浓度(DMSO终浓度<0.1%); Annexin V-FITC/PI apoptosis kit购自联科生物科技有限公司; Balb/c裸鼠购自北京华阜康生物科技股份有限公司, 在华中科技大学同济医学院附属同济医院动物房培养, 所有操作严格遵守华中科技大学动物实验伦理学规定.
1.2.1 细胞培养: QBC939、RBE、TFK-1细胞用含有10%胎牛血清、100 U/mL青霉素和100 g/mL链霉素的RPMI 1640培养基, 置于37 ℃、5%CO2的饱和湿度细胞培养箱中培养, 0.25%胰蛋白酶溶液消化、传代. 选用对数生长期的细胞进行实验.
1.2.2 CCK-8法检测姜黄素对胆管癌增殖的影响: 取对数生长期的QBC939、RBE、TFK-1细胞, 调整细胞密度为1.0×104个/mL接种于96孔培养板中, 每孔100 μL, 置于培养箱中培养, 待细胞完全贴壁后吸去培养液, 分别加入100 μL含0、0.1、0.5、1、5、10、20 μmol/L姜黄素的培养液, 同时设立空白对照组及含有同等稀释度DMSO的阴性对照组, 每组设6个复孔. 分别作用24和48 h后, 每孔加入10 μL CCK-8, 继续培养1 h后, 于酶标仪波长450 nm处读取吸光度(A)值. 按公式计算细胞的增殖抑制率, 抑制率(inhibitory rate, IR)(%) = (1-药物处理组平均A值/细胞对照孔平均A值)×100%, 以上实验重复3次.
1.2.3 AnnexinⅤ-FITC/PI双标法检测姜黄素对胆管癌凋亡的影响: 取对数生长期的TFK-1细胞, 调整细胞密度为1×105个/mL, 接种于6孔培养板中, 2 mL/孔. 待细胞完全贴壁后吸弃培养液, 分别用含终浓度为0、0.1、1、5.0和10.0 μmol/L姜黄素的2 mL培养液处理细胞24 h. 消化收集细胞, PBS洗涤细胞2 次, 每管收集约1×105个细胞; 加入500 μL Binding buffer重悬细胞后, 再分别加入10 μL AnnexinⅤ与10 μL PI染料混匀, 室温避光反应20 min, 1 h内流式细胞仪检测, 采用CellQuest软件分析实验结果. 实验重复3次.
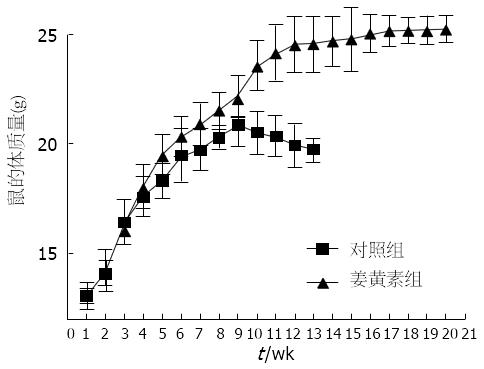
1.2.4 体内实验: 取胆管癌TFK-1细胞行裸鼠腋下皮下接种, 其接种量为细胞数2×107/只. 接种后待肿瘤长至约5 mm大小. 取新鲜瘤组织切成1 mm×l mm×1 mm大小的组织块, 将另一裸鼠用2%戊巴比妥腹腔注射(2 mL/kg)麻醉后, 常规消毒, 在剑突下沿腹白线开腹, 将组织块接种于胆管与门静脉间组织间隙紧贴胆管处, 压迫止血, 依次关腹, 结束手术[9]. 实验鼠共10只, 分为两组: 对照组和姜黄素组, 每组5只, 对照组每周腹腔注射1%DMSO的PBS(1 μL/g), 姜黄素组每周腹腔注射10 μmol/L姜黄素(1 μL/g). 每日监测小鼠活动状态、毛色、摄食、体质量等一般状态的变化, 记录小鼠体质量的变化情况, 待小鼠出现恶病质, 处死动物.
统计学处理 应用SPSS21.0软件统计分析, 数据采用mean±SD统计, 计量资料采用t检验, P<0.05为差异有统计学意义.
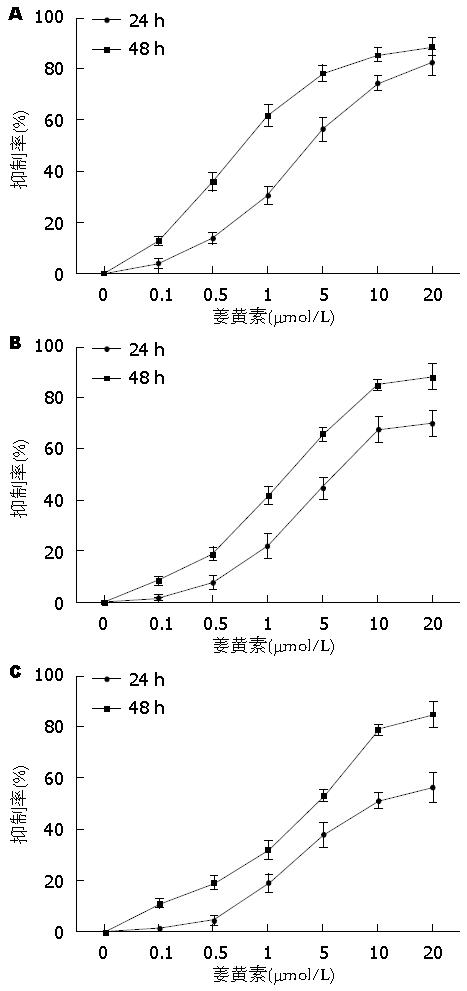
CCK-8实验结果显示, 随着姜黄素浓度的增加, QBC939、RBE和TFK-1细胞的增殖抑制率也逐渐增高, 姜黄素组与对照组相比, 差异均有统计学意义(P<0.05); 而同一浓度的姜黄素作用48 h与24 h相比, 细胞增殖抑制率亦逐渐增高, 差异有统计学意义(P<0.05). 提示姜黄素对QBC939、RBE和TFK-1细胞的增殖抑制作用呈浓度依赖性和时间依赖性(图1).
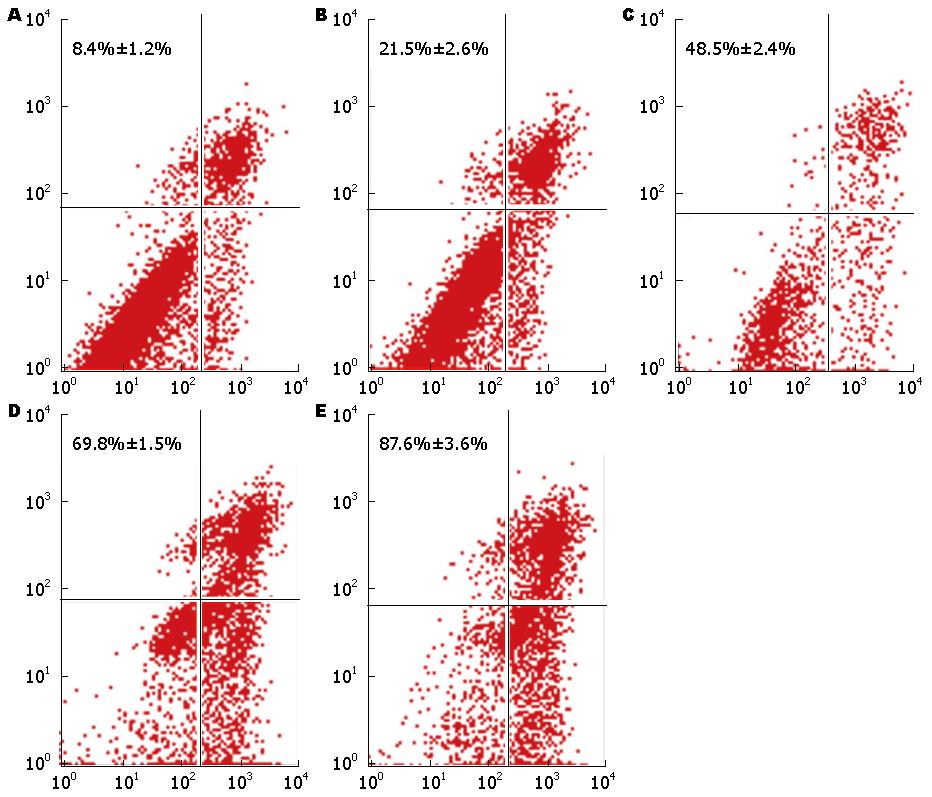
AnnexinV-FITC/PI双标法检测结果显示, 不同浓度的姜黄素(0、0.1、1、5和10 μmol/L)分别作用TFK-1细胞24 h后, 其凋亡率分别为8.41%±1.22%、21.49%±2.58%、48.53%±2.41%、69.75%±1.46%和87.59%±3.55%, 差异有统计学意义(P<0.01). 表明随着药物浓度的增加, 细胞凋亡率亦逐渐上升(图2).
胆管癌是胆道系统常见的恶性肿瘤, 近年来发病率呈逐年上升的趋势. 手术切除是治疗胆管癌最有效的方法. 大多数胆管癌均难以早期发现, 在最终明确诊断时已属中晚期, 失去了手术机会; 对能够手术切除的患者, 术后转移和复发率也较高[10]. 因此, 手术切除后患者和晚期胆管癌患者均需接受化疗, 然而胆囊癌对当前的一线化疗药物均极其耐药, 导致其治疗效果不佳. 因此, 开发新的、有效的抗胆囊癌化疗药物具有重要意义.
姜黄素是从姜科、天南星科中的一些植物的根茎中提取的一种化学成分, 为二酮类化合物[11]. 研究发现姜黄素可以抗炎、抗氧化、清除氧自由基、抗人类免疫缺陷病毒、保护肝脏和肾脏、抗纤维化的作用[12-14]. 尤其是作为一种具有良好发展前景的抗癌药物具有抗癌谱广、不良反应小的优点, 最近被肿瘤学家们认为是一种潜在的第三代抗肿瘤药[15-17], 可能与其抑制核因子-κB和激活蛋白-1等转录因子的激活及表达有关, 而且无明显的不良反应[18-20]. 研究发现, 姜黄素主要对肿瘤起到抑制增殖的作用[21-23]和诱导凋亡的作用[24-26], 本文初步在体外实验研究姜黄素对胆管癌增殖和凋亡的影响, 体内实验研究姜黄素对胆管癌荷瘤裸鼠生存时间的影响. 郑伟等[27]研究发现姜黄素能通过下调Survivin蛋白表达抑制肺癌细胞的生长并诱导其凋亡, 杨芳等[28]研究发现姜黄素通过STAT3信号通路抑制胰腺癌细胞的增殖. 本研究结果显示姜黄素对胆管癌细胞株QBC939、RBE和TFK-1细胞的增殖抑制作用呈浓度依赖性和时间依赖性, 对胆管癌细胞株TFK-1起到诱导凋亡的作用. 姜丽平等[29]研究也发现姜黄素可抑制大肠癌细胞的生长, 其机制可能与诱导细胞凋亡有关, 与我们在胆管癌中的研究结果一致. 郑丽端等[30]研究发现姜黄素能显著抑制卵巢癌细胞的体外生长. 这都说明姜黄素可能成为潜在的新的肿瘤治疗的药物. 在本研究中, 我们建立胆管癌裸鼠原位移植模型, 发现姜黄素能显著改善荷瘤裸鼠生存状态, 延长荷瘤裸鼠的生存时间, 提示在体内实验姜黄素也可能起到治疗胆管癌的作用, 但其作用的具体机制还需要进一步的研究.
本研究发现, 在体外实验中, 姜黄素可以抑制胆管癌细胞的增殖, 而且这种效应呈时间依赖性和浓度依赖性; 姜黄素还可以诱导胆管癌的凋亡; 在体内实验中, 姜黄素明显改善胆管癌荷瘤小鼠生存状态, 延长生存时间, 为姜黄素进一步临床转化打下基础.
胆管癌目前治疗效果不理想, 亟需寻找新的治疗药物; 姜黄素可能成为一种有效的肿瘤化疗药物.
康春博, 副主任医师, 北京大学航天临床医院普通外科
姜黄素已被证实能有效抑制多种肿瘤细胞的增殖, 并促进细胞凋亡, 但其与胆管癌的相关研究目前仍未达成共识, 其生物学特性尚需要进一步研究证明.
姜黄素为一种具有良好发展前景的抗癌药物, 具有抗癌谱广、不良反应小的优点, 最近被肿瘤学家们认为是一种潜在的第三代抗肿瘤药, 可能与其抑制核因子-κB和激活蛋白-1等转录因子的激活及表达有关, 而且无明显的不良反应.
本研究首次在体外实验探讨姜黄素对胆管癌细胞增殖和凋亡的作用, 并建立胆管癌裸鼠原位移植模型, 在体内实验中证明姜黄素能改善荷瘤小鼠生存状态, 延长荷瘤小鼠生存时间.
本文为进一步研究姜黄素对胆管癌的生物学调控作用提供了理论基础, 为姜黄素进一步临床转化打下基础.
本文研究内容较好, 对临床具有一定的指导意义和实用价值. 而且提供了比较充足的有意义的信息, 具有一定的新颖性.
编辑: 郭鹏 电编:闫晋利
| 1. | Blechacz B, Gores GJ. Cholangiocarcinoma: advances in pathogenesis, diagnosis, and treatment. Hepatology. 2008;48:308-321. [PubMed] [DOI] |
| 2. | Rizvi S, Gores GJ. Pathogenesis, diagnosis, and management of cholangiocarcinoma. Gastroenterology. 2013;145:1215-1229. [PubMed] [DOI] |
| 3. | Razumilava N, Gores GJ. Classification, diagnosis, and management of cholangiocarcinoma. Clin Gastroenterol Hepatol. 2013;11:13-21.e1; quiz e3-4. [PubMed] [DOI] |
| 7. | Dulbecco P, Savarino V. Therapeutic potential of curcumin in digestive diseases. World J Gastroenterol. 2013;19:9256-9270. [PubMed] [DOI] |
| 8. | Li Y, Zhang T. Targeting cancer stem cells by curcumin and clinical applications. Cancer Lett. 2014;346:197-205. [PubMed] [DOI] |
| 10. | Skipworth JR, Olde Damink SW, Imber C, Bridgewater J, Pereira SP, Malagó M. Review article: surgical, neo-adjuvant and adjuvant management strategies in biliary tract cancer. Aliment Pharmacol Ther. 2011;34:1063-1078. [PubMed] [DOI] |
| 11. | Mair JW, Day HG. Curcumin method for spectrophotometric determination of boron extracted from radiofrequency ashed animal tissues using 2-ethyl-1,3-hexanediol. Anal Chem. 1972;44:2015-2017. [PubMed] |
| 12. | Jiménez-Flores LM, López-Briones S, Macías-Cervantes MH, Ramírez-Emiliano J, Pérez-Vázquez V. A PPARγ, NF-κB and AMPK-dependent mechanism may be involved in the beneficial effects of curcumin in the diabetic db/db mice liver. Molecules. 2014;19:8289-8302. [PubMed] [DOI] |
| 13. | Tu Y, Sun D, Zeng X, Yao N, Huang X, Huang D, Chen Y. Piperine potentiates the hypocholesterolemic effect of curcumin in rats fed on a high fat diet. Exp Ther Med. 2014;8:260-266. [PubMed] |
| 14. | Antoine F, Girard D. Curcumin increases gelatinase activity in human neutrophils by a p38 mitogen-activated protein kinase (MAPK)-independent mechanism. J Immunotoxicol. 2014; Jun 13. [Epub ahead of print]. [PubMed] |
| 15. | Das SS, Nanda GG, Alone DP. Artemisinin and Curcumin inhibit Drosophila brain tumor, prolong life span, and restore locomotor activity. IUBMB Life. 2014;66:496-506. [PubMed] [DOI] |
| 16. | Chen J, Li L, Su J, Li B, Chen T, Wong YS. Synergistic apoptosis-inducing effects on A375 human melanoma cells of natural borneol and curcumin. PLoS One. 2014;9:e101277. [PubMed] [DOI] |
| 17. | Fan S, Xu Y, Li X, Tie L, Pan Y, Li X. Opposite angiogenic outcome of curcumin against ischemia and Lewis lung cancer models: in silico, in vitro and in vivo studies. Biochim Biophys Acta. 2014;1842:1742-1754. [PubMed] [DOI] |
| 18. | Yoysungnoen-Chintana P, Bhattarakosol P, Patumraj S. Antitumor and antiangiogenic activities of curcumin in cervical cancer xenografts in nude mice. Biomed Res Int. 2014;2014:817972. [PubMed] [DOI] |
| 19. | Sobolewski C, Muller F, Cerella C, Dicato M, Diederich M. Celecoxib prevents curcumin-induced apoptosis in a hematopoietic cancer cell model. Mol Carcinog. 2014; May 5. [Epub ahead of print]. [PubMed] [DOI] |
| 20. | Roy M, Mukherjee S. Reversal of resistance towards cisplatin by curcumin in cervical cancer cells. Asian Pac J Cancer Prev. 2014;15:1403-1410. [PubMed] |
| 21. | He M, Li Y, Zhang L, Li L, Shen Y, Lin L, Zheng W, Chen L, Bian X, Ng HK. Curcumin suppresses cell proliferation through inhibition of the Wnt/β-catenin signaling pathway in medulloblastoma. Oncol Rep. 2014;32:173-180. [PubMed] [DOI] |
| 22. | Wu J, Tang Q, Zhao S, Zheng F, Wu Y, Tang G, Hahn SS. Extracellular signal-regulated kinase signaling-mediated induction and interaction of FOXO3a and p53 contribute to the inhibition of nasopharyngeal carcinoma cell growth by curcumin. Int J Oncol. 2014;45:95-103. [PubMed] [DOI] |
| 23. | Lim TG, Lee SY, Huang Z, Lim do Y, Chen H, Jung SK, Bode AM, Lee KW, Dong Z. Curcumin suppresses proliferation of colon cancer cells by targeting CDK2. Cancer Prev Res (Phila). 2014;7:466-474. [PubMed] [DOI] |
| 24. | Guo Y, Shan Q, Gong Y, Lin J, Shi F, Shi R, Yang X. Curcumin induces apoptosis via simultaneously targeting AKT/mTOR and RAF/MEK/ERK survival signaling pathways in human leukemia THP-1 cells. Pharmazie. 2014;69:229-233. [PubMed] |
| 25. | Xue X, Yu JL, Sun DQ, Kong F, Qu XJ, Zou W, Wu J, Wang RM. Curcumin induces apoptosis in SGC-7901 gastric adenocarcinoma cells via regulation of mitochondrial signaling pathways. Asian Pac J Cancer Prev. 2014;15:3987-3992. [PubMed] |
| 26. | Lev-Ari S, Starr A, Katzburg S, Berkovich L, Rimmon A, Ben-Yosef R, Vexler A, Ron I, Earon G. Curcumin induces apoptosis and inhibits growth of orthotopic human non-small cell lung cancer xenografts. J Nutr Biochem. 2014;25:843-850. [PubMed] [DOI] |