修回日期: 2014-06-18
接受日期: 2014-07-15
在线出版日期: 2014-09-08
目的: 筛选重症急性胰腺炎(severe acute pancreatitis, SAP)肝损伤大鼠高迁移率族蛋白B1(high mobility group protein B1, HMGB1)的启动子结合蛋白.
方法: 牛黄胆酸钠胆胰管逆行注射法制备SAP大鼠模型, 与对照组同时处死, 取肝组织提取细胞核蛋白, PCR扩增末端带生物素标记的HMGB1启动子探针, 将核蛋白与HMGB1探针孵育, 然后用链亲和素磁珠分离HMGB1启动子-蛋白复合物, 分别用0.25 mol/L和1 mol/L NaCl洗脱探针上结合的蛋白, 用SDS-PAGE电泳分离样本蛋白, SilverQuest银染试剂染色, 比较SAP组和对照组的差异条带并做质谱鉴定.
结果: 对照组和SAP组共有14条差异条带, 质谱鉴定这些差异条带得到H2A、H2B、H3、H4、S100A9转录相关蛋白.
结论: 该研究筛选到一些SAP肝损伤特异性的HMGB1启动子结合蛋白, 对于下一步研究HMGB1在SAP肝损伤过程中的转录调控机制具有重要意义.
核心提示: 以重症急性胰腺炎(severe acute pancreatitis, SAP)肝损伤大鼠为研究模型, 结合生物素-链亲和素系统, 从"组学"的角度和活体组织水平, 筛选了SAP肝损伤大鼠肝脏中参与高迁移率族蛋白B1(high mobility group protein B1)基因表达调控的蛋白分子, 并对其中的重要调节分子进行了质谱鉴定和深入研究.
引文著录: 杨莉, 张仕荣, 王红梅, 周晓东. 利用生物素-链亲和素系统筛选重症急性胰腺炎肝损伤大鼠HMGB1启动子结合蛋白. 世界华人消化杂志 2014; 22(25): 3796-3800
Revised: June 18, 2014
Accepted: July 15, 2014
Published online: September 8, 2014
AIM: To screen proteins that interact with high mobility group protein B1 (HMGB1) promoter in rat hepatic injury secondary to severe acute pancreatitis (SAP).
METHODS: A rat model of SAP was generated by retrograde injection of 5% sodium taurocholate into the bilio-pancreatic duct. The SAP group and control group were executed simultaneously, and the liver nuclear extracts were prepared. PCR was used to amplify the biotin labeled tail probes of the HMGB1 promoter. The probes were incubated with cell nuclear extracts, and HMGB1 promoter-protein complexes were then separated using streptavidin conjugated magnetic beads. The proteins were eluted from probes with 0.25 mol/L and 1 mol/L NaCl, resolved using SDS-PAGE electrophoresis, and visualized by silver staining, and the differential bands were identified by mass spectrometry (MS).
RESULTS: A total of 14 differential protein bands between the SAP and control groups were screened, 5 of which were identified as transcription related proteins by MS.
CONCLUSION: Proteins that interact with HMGB1 promoter in SAP-associated hepatic injury were acquired and identified, which have important value for the further study of regulatory mechanism of HMGB1.
- Citation: Yang L, Zhang SR, Wang HM, Zhou XD. Screening HMGB1 promoter binding proteins in rat hepatic injury secondary to severe acute pancreatitis using biotin-streptavidin system. Shijie Huaren Xiaohua Zazhi 2014; 22(25): 3796-3800
- URL: https://www.wjgnet.com/1009-3079/full/v22/i25/3796.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i25.3796
重症急性胰腺炎(severe acute pancreatitis, SAP)发病凶险、并发症多、病死率高, 是临床上常见的危急重症, 死亡率达30%, 其中死亡率最高的是肝衰竭患者(83%)[1]. 高迁移率族蛋白B1(high mobility group protein B1, HMGB1)是近年发现的一种晚期炎性介质, 参与了SAP后期的肿瘤坏死因子γ(tumor necrosis factor γ, TNF-γ)持续激活、肠源性感染和微循环障碍等多个病理生理过程, 造成感染性休克和多器官功能不全综合征(multiorgan dysfunction syndrome, MODS)[2,3]. 研究表明, SAP大鼠肝组织中的HMGB1及其相关Toll样受体4(Toll-like receptor 4, TLR4) mRNA水平上调, 但其基因调控的具体机制还有待阐明[4]. 我们认为, 如果能阐明HMGB1基因上调的机制, 并进一步进行相应的靶向干预治疗, 有望阻断SAP相应的炎症反应过程, 从而提高SAP患者的存活率. 本研究通过生物素-链亲和素系统和磁珠分离技术, 寻找SAP时HMGB1的启动子结合蛋白, 为阐明HMGB1在SAP中的具体调控机制奠定基础.
♂清洁级SD大鼠12只, 8-12周龄, 体质量210-270 g(南方医科大学动物实验中心), Taq DNA聚合酶及DNA Marker(日本Takara公司); 牛黄胆酸钠、鲑鱼精DNA、琼脂糖(美国Sigma公司); 2-D Quant Kit蛋白定量试剂盒(GE Amersham公司); 基因组DNA回收试剂盒和DNA凝胶回收试剂盒(杭州Axygen公司); 全自动生化检测仪(日本Olympus公司); μMACS FactorFinder Kit(德国Miltenyi Biotec公司).
1.2.1 标本的制备: 12只SD大鼠随机分成假手术组和SAP组. 术前12 h禁食不禁水, 10%水合氯醛0.3 mL/100 g腹腔麻醉后, 常规消毒, 腹部正中切口入腹腔, 找到胆胰管, 于其出肝门端以动脉夹暂时夹闭胆管, 以5号针头注射器逆行刺入胆胰管内, 于胆胰管入十二指肠端用小动脉夹暂时夹闭胆胰管, 以0.1 mL/min速度匀速注入5%牛磺胆酸钠(1.5 mL/kg), 注射完毕后10 min去除动脉夹, 逐层关腹. 假手术组大鼠开腹后翻动肠管后关腹. 术后禁食, 自由饮水, 皮下注射生理盐水40 mL/(kg·6 h), 行液体复苏. 术后关腹, 自由饮水. 24 h后剖腹处死, 留取静脉血离心(3000 r/min×15 min)分离血浆, -80 ℃冻存待测. 无菌采取肝脏组织, 液氮速冻, -80 ℃贮存备用. 以病理学检测符合SAP病理改变和血清淀粉酶升高作为SAP模型建立成功指标.
1.2.2 肝脏组织细胞核蛋白提取物制备: 肝组织进行液氮研磨, 按10 mL/g加入匀浆缓冲液, 冰上匀浆15 min. 以3000 r/min 4 ℃离心20 min, 取沉淀胞核. 按0.5 mL/0.1 g加入匀浆缓冲液洗涤2次. 重新以3000 r/min离心10 min, 收集沉淀, 加入1/2体积核提取缓冲液, 涡旋振荡重悬后置冰上, 150 r/min 摇动1 h. 以14000 r/min 4 ℃离心20 min, 保留上清. 用MilliQ 4 mL 10 kDa蛋白浓缩柱对上清除盐及Buffer置换至终体积约500 μL, 取上清-80 ℃保存备用.
1.2.3 末端带biotin标记的HMGB1启动子探针扩增: 使用基因组DNA提取试剂盒提取大鼠血基因组DNA, 并以其为模版, 根据大鼠HMGB1启动子序列(Genbank: 15289)设计HMGB1启动子区探针, 5'末端生物素标记. PCR扩增产物行琼脂糖凝胶电泳, 切下目的条带用Axygen凝胶回收试剂盒进行DNA回收. DNA定量仪定量回收产物浓度后置-20 ℃备用.
1.2.4 DNA pull-down分析: 取透析后SAP鼠和正常对照鼠的核蛋白提取物各1.25 mg/组, 加入2倍体积的Binding Buffer、5 μL鲑鱼精DNA(10 mg/mL)、cocktail 10 μL, 2 μL Binding Enhancer、55 pmol/组探针, 按μMACS FactorFinder Kit说明操作, 分别用低盐(0.25 mol/L)和高盐(1 mol/L)洗脱液80 μL洗脱SAP组和正常对照组磁珠结合蛋白, 置-80 ℃保存备用.
1.2.5 SDS-PAGE凝胶改良考染及回收: 将DNA pull-down实验中的高盐和低盐洗脱液分别行12%SDS-PAGE凝胶电泳. 凝胶按改良考染方法行考染, 步骤为: 40%甲醇、10%乙酸、50%ddH2O固定凝胶30 min, 200 mL ddH2O洗涤15 min×4次, 置4 ℃ ddH2O保存. 切下有差异的条带用胰酶胶内消化, 行MALDI-TOF质谱鉴定.
1.2.6 质谱分析: 用Mascot Distiller(NCBI)数据库进行在线搜索. 搜索参数为: 肽质量指纹图中的肽片段质量(1000-3000 Da), 可耐受的精确程度(±200 ppm), 每个肽包含的不完全裂解位点(1个), 最少匹配肽片段数(4个), 半胱氨酸类型[脲甲基半胱氨酸(carbamidomethy-cys)], 可变修饰[carbamidomethyl(C)、oxidation(M)], 物种来源(鼠), 离子选择([M+H]+), 模式(monoisotopic). 蛋白质得分下限(60分), 满足上述条件认为有显著性差异(P<0.05).
统计学处理 数据均以mean±SD表示, SPSS10.0统计分析软件进行处理, 采用单因素方差分析和q检验, P<0.05为差异有统计学意义.
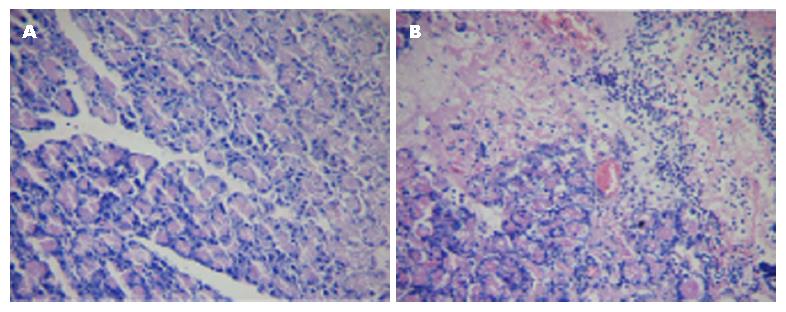
血清淀粉酶检测SAP组较对照组有明显升高(7823.5 U/L±1487.2 U/L vs 876.5 U/L±133.6 U/L, P<0.05). SAP组大鼠胰腺组织HE染色可见胰腺组织水肿, 出血坏死明显, 有大量炎症细胞浸润. 证明SAP大鼠模型建立成功(图1).
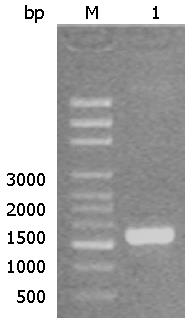
1%琼脂糖凝胶电泳结果: 可见一条1600 bp左右的特异性条带, 与大鼠HMGB1启动子序列(Genbank: 1528)相符(图2).
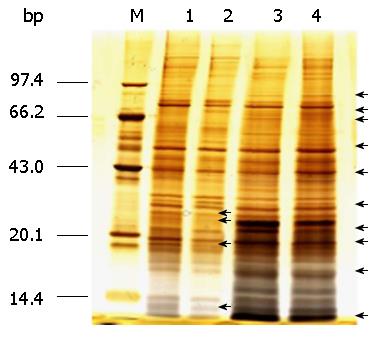
用2-D Quant Kit定量试剂盒对对照组和SAP组核蛋白定量, 浓度均约为3 mg/mL. 低盐洗脱的为DNA亲和力弱的蛋白, 高盐洗脱的则为DNA特异性结合的蛋白. 如图3中黑色箭头表示SAP组大鼠同HMGB1启动子结合有差异的条带, 表明SAP状态下部分转录因子或转录调节蛋白参与HMGB1转录调节. 低盐洗脱组有4条差异条带, 高盐洗脱组有10条差异条带(图3).
将高盐洗脱组的10条差异条带行MALDI-TOF/TOF鉴定, 与NCBI数据库进行对比(Mascot软件), 共鉴定出5种转录相关蛋白(表1).
| 蛋白名称 | 功能 |
| S100A9(myelord-related protein-14, MRP14) | 转录因子、参与炎症反应, 调节细胞生长和分化, 参与细胞骨架构成和蛋白质磷酸化, 调节酶活性, 维持钙离子稳态 |
| Histone 2A(H2A); Histone 2B(H2B); Histone 3(H3); Histone 4(H4) | 核心组蛋白, 存在于染色体结构中, 具有高度保守性, 是核小体单元组成的主要成员, 通过其乙酰化调控基因转录的"开"和"关" |
HMGB1是广泛存在于真核细胞核中最重要的非组蛋白之一, 虽然其在细胞内并不是组成性表达, 但在大多数细胞和组织内都在严格调控下处于一个基础表达水平[5,6]. 近年研究者通过对HMGB1的信号转导机制进行研究发现该蛋白可受到类固醇雌激素等不同因子的调控, 但具体调控机制、序列和信号通路尚不明确[7]. 已知在许多炎性反应, 如内毒素休克、SAP、缺血再灌注损伤、呼吸机所致肺损伤等疾病进展过程中, 血中高水平的HMGB1, 对机体具有致命性的作用[8,9].
真核生物基因表达是由一个高度复杂、精确调控的过程组成. 在其复制、转录、转录后、翻译和翻译后多等级水平上进行, 而mRNA的转录起始是基因表达调控的基本控制点, 具有时间和空间的特异性. 并在此基础上, 研究特异性基因的启动子与调节蛋白相互作用. 启动子DNA结合蛋白实验是从转录水平上来研究基因表达调控, 探寻新的调节蛋白. 从而研究其对转录调控的作用, 并最终阐明某些与疾病相关的基因表达的机制, 为开发新的治疗手段提供理论基础[10].
生物素-链亲和素系统是近年广泛用于研究蛋白质-DNA相互作用的生物学技术, 二者都可以耦联蛋白质、核酸、糖和酶等生物活性物质, 并以超强的非共价键特异性结合, 且这种结合高度稳定. 磁珠分离技术在研究蛋白质-DNA相互作用时具有结合力强、操作方便、效率高等优点, 加上后续质谱技术鉴定, 为DNA-蛋白质相互作用的目标蛋白鉴定提供了极为方便和有效的手段[11,12].
本研究结合生物素-链亲和素系统和磁珠分离技术, 在SAP模型大鼠肝脏组织中筛选HMGB1启动子结合蛋白, 成功地在活体组织筛选并鉴定得到可能参与HMGB1表达调控的转录因子, 包括H2A、H2B、H3、H4、S100A9. 其中组蛋白是真核细胞特有的染色体结构蛋白, 与DNA组装成核小体, 通过氨基末端富含赖氨酸和乙酰基结合或者解构的特点, 改变DNA的构象, 在基因表达中其重要作用. 组蛋白在炎症反应的多个环节中都发挥重要作用, 与脓毒血症患者死亡密切相关[13]. S100A9则是钙结合蛋白S100家族成员, 通常与S100A8结合形成复合物, 在炎症病变早期渗出的炎性细胞中表达, 抑制酪蛋白激酶Ⅰ和Ⅱ的活性, 间接影响转录和翻译过程中的磷酸化过程[14]. Wiechert等[15]通过对S100A9转基因鼠研究发现, 肝脏特异性S100A9过表达可导致中性粒细胞的动员和聚集. Moles等[16]最新的研究结果表明, S100A9在炎症性肝损伤中性粒细胞的趋化聚集中发挥着关键的调控作用. 综上所述, 我们认为, S100A9可能通过转录上调HMGB1的表达促进SAP的炎症反应, S100A9可能是HMGB1在SAP病程中关键的转录调控因子. 采用基因沉默等手段将进一步明确该蛋白在SAP炎症反应乃至肝损伤中的作用.
总之, 该研究通过寻找SAP时HMGB1的启动子结合蛋白, 为后续体内、体外实验的鉴定并深入进行基因靶向治疗SAP奠定了基础.
根据DNA-蛋白质相互作用的原理, 筛选高迁移率族蛋白B1(high mobility group protein B1, HMGB1)启动子区的差异结合蛋白, 并行质谱分析鉴定; 通过对差异蛋白的深入研究, 以期从"组学"的角度和活体组织水平鉴定参与急性重症胰腺炎(severe acute pancreatitis, SAP)中HMGB1转录表达的调控蛋白以及与其相关的信号转导通路, 明确SAP中HMGB1转录表达的调控机制、进而为SAP的治疗提供新的途径和可能的药物靶点.
宣世英, 教授, 青岛市市立医院肝病内科
启动子DNA结合蛋白实验是从转录水平上来研究基因表达调控, 探寻新的调节蛋白. 从而研究其对转录调控的作用, 并最终阐明某些与疾病相关的基因表达的机制, 为开发新的治疗手段提供理论基础.
生物素-链亲和素系统是近年广泛用于研究蛋白质-DNA相互作用的生物学技术, 二者都可以耦联蛋白质, 核酸, 糖和酶等生物活性物质, 并以超强的非共价键特异性结合, 且这种结合高度稳定. 磁珠分离技术在研究蛋白质-DNA相互作用时具有结合力强、操作方便, 效率高等优点, 加上后续质谱技术鉴定, 为DNA-蛋白质相互作用的目标蛋白鉴定提供了极为方便和有效的手段.
磁珠分离技术具有重复性好、结合效率高、操作方便等优点, 这使得这一系统在鉴定DNA-蛋白质相互作用方面表现出特有的优势, 同时, 生物质谱作为一种重要的蛋白鉴定技术, 灵敏度高、准确度高、快速、易于自动化等特点, 已经广泛的应用于生命科学领域, 尤其是串连飞行质谱仪的出现, 大大的增强了蛋白质鉴定的准确性, 这一技术与生化手段的有效结合, 为鉴定参与DNA-蛋白质相互作用提供了无可比拟的强大手段.
本研究结合生物素-链亲和素系统和磁珠分离技术, 在SAP模型大鼠肝脏组织中筛选HMGB1启动子结合蛋白, 成功的在活体组织筛选并鉴定得到可能参与HMGB1表达调控的转录因子, 为后续体内、体外实验的鉴定并深入进行基因靶向治疗SAP奠定了基础.
生物素-链亲和素系统(BAS): 一种具有高亲和力、灵敏度高、特异性强和稳定性好等优点的信号放大标记技术, 研究证明生物素与亲和素依靠接触表面均一的多层膜来维系其稳定的结合.
该研究成功制备SAP大鼠模型, 通过寻找SAP时HMGB1的启动子结合蛋白, 为后续体内、体外实验的鉴定并深入进行基因靶向治疗SAP奠定了基础, 本文立意新颖, 数据可靠, 具有重要的理论和临床意义.
编辑: 郭鹏 电编:都珍珍
| 2. | Shen Y, Cui N, Miao B, Zhao E. Immune dysregulation in patients with severe acute pancreatitis. Inflammation. 2011;34:36-42. [PubMed] [DOI] |
| 3. | Yasuda T, Ueda T, Takeyama Y, Shinzeki M, Sawa H, Nakajima T, Ajiki T, Fujino Y, Suzuki Y, Kuroda Y. Significant increase of serum high-mobility group box chromosomal protein 1 levels in patients with severe acute pancreatitis. Pancreas. 2006;33:359-363. [PubMed] |
| 5. | Stros M. HMGB proteins: interactions with DNA and chromatin. Biochim Biophys Acta. 2010;1799:101-113. [PubMed] [DOI] |
| 6. | Lum HK, Lee KL. The human HMGB1 promoter is modulated by a silencer and an enhancer-containing intron. Biochim Biophys Acta. 2001;1520:79-84. [PubMed] |
| 7. | El Marzouk S, Gahattamaneni R, Joshi SR, Scovell WM. The plasticity of estrogen receptor-DNA complexes: binding affinity and specificity of estrogen receptors to estrogen response element half-sites separated by variant spacers. J Steroid Biochem Mol Biol. 2008;110:186-195. [PubMed] [DOI] |
| 8. | Lamkanfi M, Sarkar A, Vande Walle L, Vitari AC, Amer AO, Wewers MD, Tracey KJ, Kanneganti TD, Dixit VM. Inflammasome-dependent release of the alarmin HMGB1 in endotoxemia. J Immunol. 2010;185:4385-4392. [PubMed] [DOI] |
| 9. | Luan ZG, Zhang H, Ma XC, Zhang C, Guo RX. Role of high-mobility group box 1 protein in the pathogenesis of intestinal barrier injury in rats with severe acute pancreatitis. Pancreas. 2010;39:216-223. [PubMed] [DOI] |
| 10. | Luscombe NM, Austin SE, Berman HM, Thornton JM. An overview of the structures of protein-DNA complexes. Genome Biol. 2000;1:REVIEWS001. [PubMed] |
| 12. | Wilchek M, Bayer EA, Livnah O. Essentials of biorecognition: the (strept)avidin-biotin system as a model for protein-protein and protein-ligand interaction. Immunol Lett. 2006;103:27-32. [PubMed] |
| 13. | Xu J, Zhang X, Pelayo R, Monestier M, Ammollo CT, Semeraro F, Taylor FB, Esmon NL, Lupu F, Esmon CT. Extracellular histones are major mediators of death in sepsis. Nat Med. 2009;15:1318-1321. [PubMed] [DOI] |
| 14. | Ehrchen JM, Sunderkötter C, Foell D, Vogl T, Roth J. The endogenous Toll-like receptor 4 agonist S100A8/S100A9 (calprotectin) as innate amplifier of infection, autoimmunity, and cancer. J Leukoc Biol. 2009;86:557-566. [PubMed] [DOI] |
| 15. | Wiechert L, Németh J, Pusterla T, Bauer C, De Ponti A, Manthey S, Marhenke S, Vogel A, Klingmüller U, Hess J. Hepatocyte-specific S100a8 and S100a9 transgene expression in mice causes Cxcl1 induction and systemic neutrophil enrichment. Cell Commun Signal. 2012;10:40. [PubMed] [DOI] |