修回日期: 2014-07-07
接受日期: 2014-07-28
在线出版日期: 2014-09-08
目的: 观察硫化氢对脂肪肝β氧化的影响.
方法: ♂SD大鼠18只, 随机分成正常对照组、高脂饮食组和高脂饮食+NaHS组. 高脂饲料是在普通饲料的基础上添加2%的胆固醇和18%猪油. 高脂饮食+NaHS组动物在高脂饮食基础上, 用400 mmol/L硫氢化钠(sodium hydrosulfide, NaHS)溶液5 mL/kg腹腔注射干预, 8 wk后处死动物, 检测肝匀浆中的酮体含量和烯脂酰CoA水合酶活性, 检测肝脏病理变化.
结果: 高脂饮食8 wk后动物脂肪肝形成, 肝脏匀浆中的甘油三酯和胆固醇较正常饮食组动物明显增高(3.87 mmol/L±2.63 mmol/L vs 1.18 mmol/L±0.85 mmol/L, 5.00 mmol/L±1.01 mmol/L vs 2.61 mmol/L±0.33 mmol/L); 应用NaHS的动物肝脂肪变性程度较高脂饮食组动物明显减轻, 肝脏匀浆中甘油三酯和胆固醇明显下降(2.28 mmol/L±0.51 mmol/L vs 3.87±2.63 mmol/L, 4.50 mmol/L±1.25 mmol/L vs 5.00 mmol/L±1.01 mmol/L). 高脂饮食组动物肝脏内硫化氢较正常对照组含量明显减少(14.00 μmol/L±6.21 μmol/L vs 20.20 μmol/L±11.90 μmol/L), NaHS干预的动物肝脏内硫化氢明显增加(48.20 μmol/L±8.50 μmol/L vs 14.00 μmol/L±6.21 μmol/L), 与对照组动物比较, 高脂饮食组动物肝脏内的烯脂酰CoA活性明显降低(25.0 μmol/min±7.7 μmol/min vs 12.6 μmol/min±3.1 μmol/min), 下降达50%, NaHS干预组烯脂酰CoA活性较高脂饮食组明显增加(19.9 μmol/min±6.0 μmol/min vs 12.6 μmol/min±3.1 μmol/min), 幅度达60%. 高脂饮食组硫化氢与甘油三酯(triglyceride)、总胆固醇(total cholesterol)成负相关r = -0.621、-0.432, P = 0.01036、0.04497, 与烯脂酰CoA水合酶活性之间成正相关, r = 0.513、P = 0.00833.
结论: 硫化氢可能促进脂肪肝β氧化减少肝内脂肪积聚.
核心提示: 硫化氢能够通过提高脂肪肝的β-氧化清除肝内脂肪是硫化氢的又一功能, 也是脂肪肝研究和治疗的又一个亮点.
引文著录: 王新国, 韩淼, 张丽旦, 吴桂香, 丁虹, 张波, 黄利华. 硫化氢对脂肪肝β氧化的调节作用. 世界华人消化杂志 2014; 22(25): 3791-3795
Revised: July 7, 2014
Accepted: July 28, 2014
Published online: September 8, 2014
AIM: To observe the regulatory effect of hydrogen sulfide on β oxidation in fatty liver in rats.
METHODS: Eighteen male SD rats were randomly divided into a normal control group, a high-fat diet group and a high-fat diet + NaHS group. High-fat diet was ordinary diet supplemented with 2% cholesterol and 18% lard. The high-fat diet + NaHS group was given a high-fat diet and intraperitoneal injection of 400 mmol/L sodium hydrosulfide solution (5 mL/kg). Eight weeks after treatment, the animals were killed. The content of ketones and enoyl-CoA hydratase activity in liver homogenates were measured, and pathological changes in the liver were observed.
RESULTS: After 8 wk of treatment, fatty liver was successfully induced. Application of sodium hydrosulfide reduced fatty liver significantly. Intrahepatic triglyceride and cholesterol significantly increased in the high-fat diet group compared with the normal control group (3.87 mmol/L ± 2.63 mmol/L vs 1.18 mmol/L ± 0.85 mmol/L, 5.00 mmol/L ± 1.01 mmol/L vs 2.61 mmol/L ± 0.33 mmol/L), while treatment with sodium hydrosulfide significantly reduced hepatic lipid composition (2.28 mmol/L ± 0.51 mmol/L vs 3.87 ± 2.63 mmol/L, 4.50 mmol/L ± 1.25 mmol/L vs 5.00 mmol/L ± 1.01 mmol/L). Compared with the normal control group, hydrogen sulfide content in the high-fat diet group was significantly reduced (14.00 µmol/L ± 6.21 µmol/L vs 20.20 µmol/L ± 11.90 µmol/L); however, application of sodium hydrosulfide significantly increased hydrogen sulfide content (48.20 µmol/L ± 8.50 µmol/L vs 14.00 µmol/L ± 6.21 µmol/L). Compared with the control animals, the liver enoyl-CoA activity was significantly reduced in the high-fat diet group (25.0 µmol/min ± 7.7 µmol/min vs 12.6 µmol/min ± 3.1 µmol/min), by up to 50%, while sodium hydrosulfide significantly increased enoyl-CoA activity (19.9 µmol/min ± 6.0 µmol/min vs 12.6 µmol/min ± 3.1 µmol/min), by 60%. Hydrogen sulfide content was negatively correlated with TG and TC in the high-fat diet group (r = -0.621, -0.432, P = 0.01036, 0.04497), but positively correlated with enoyl-CoA hydratase activity (r = 0.513, P = 0.00833).
CONCLUSION: Hydrogen sulfide promotes β oxidation and reduces fat accumulation in fatty liver in rats.
- Citation: Wang XG, Han M, Zhang LD, Wu GX, Ding H, Zhang B, Huang LH. Regulatory effect of hydrogen sulfide on β oxidation in fatty liver in rats. Shijie Huaren Xiaohua Zazhi 2014; 22(25): 3791-3795
- URL: https://www.wjgnet.com/1009-3079/full/v22/i25/3791.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i25.3791
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)已经是我国第二大肝病, 严重影响人民健康, 因此, 更多的临床医师开始注重脂肪肝的诊治, 但是仍不能控制转氨酶的反复发作和体质量增长[1]. 这与脂肪肝发病机制不明确有关. 我们既往发现硫化氢抑制大鼠肝内脂肪积聚, 但机制尚未阐明[2]. 由于肝内脂肪主要通过β氧化为转化为能量, 并且近几年各种调节β氧化作用的措施均很好的控制肝细胞内脂肪, 所以β氧化成为NAFLD的治疗靶点[3-5]. 那么, 我们前期研究中的硫化氢有可能促进脂肪酸β氧化减少肝内脂肪积聚[2], 为求证这一推断, 本研究观察硫化氢对β氧化的调节作用.
清洁级♂SD大鼠18只, 体质量130-150 g, 购自常州卡文斯实验动物有限公司, 生产许可证号为SCXK(苏)2011-0003, 在标准饲养条件下进行饲养. 主要试剂均购自Sigma公司. Olympus Au5400自动生化仪用于检测组织匀浆中生化指标. 甘油三酯(triglyceride, TG)检测试剂购自日本协和株式会社203ACB; 总胆固醇(total cholesterol, TC)检测试剂盒购自日本协和株式会社223ABK; 组织长链烯脂酰CoA水合酶活性比色法定量检测试剂盒购自百事创新(北京)科技有限公司(GMS50120.2.3). 高脂饲料是在普通饲料的基础上添加2%的胆固醇和18%猪油.
1.2.1 脂肪肝模型建立: ♂SD大鼠18只, 随机分成给予正常饲料的正常对照组, 给予高脂饲料的高脂饮食组和高脂饮食+NaHS组, 每组动物各6只, 饲养8 wk后处死, 取肝脏做病理判定脂肪变性情况. 每2天给予正常和高脂饮食组动物0.5 mL生理盐水腹腔注射, 高脂饮食+NaHS组动物给予腹腔注射400 mmol/L NaHS溶液5 mL/kg.
1.2.2 肝脏匀浆: 取新鲜肝脏500 mg(应用生理盐水冲洗血液并滤纸吸干称质量), 剪成碎粒移至组织匀浆器中, 加生理盐水0.5 mL, 在冰上研磨3 min.
1.2.3 肝脏脂肪测定: 肝脏匀浆离心之后, 上清液应用Olympus Au5400自动生化仪酶法检测TG和TC.
1.2.4 肝脏硫化氢测定: 用亚甲基蓝分光光度法测定. 取肝组织匀浆0.5 mL置入37 ℃温箱15 min, 加入反应液(含5 mmol的左旋半胱氨酸, 2 mmol/L的5-磷酸吡多醛3.6 mL). 将反应液移至反应瓶, 加入0.5 mL的1%醋酸锌, 另裁剪2 cm×2.5 cm滤纸以增加反应面积. 氮气吹20 s, 石蜡膜双层封口转移到37 ℃水浴锅中震荡反应90 min, 再加入50%的三氯醋酸0.5 mL中止反应, 石蜡膜封闭. 37 ℃水浴60 min使H2S完全吸收, 将中央室中内容物转移到含有3.5 mL水的试管中, 立即加入20 mmol/L的对苯二胺盐酸盐0.5 mL和30 mmol/L的FeCl3 50 µL, 室温静置20 min, 使之充分显色, 测定各管的光密度值, 根据H2S标准曲线计算血清中H2S的含量(µmol/L).
1.2.5 肝脏丙酮测定: 根据脂肪酸经β-氧化生成的乙酰CoA, 再缩合成乙酰乙酸, 脱羧生成丙酮代表β-氧化功能的原理, 本研究用正丁酸做底物, 将之与新鲜的肝匀浆一起保温后, 测定其中丙酮的生成量判定β-氧化功能. 酮体测定: (1)取2个锥形瓶, 分别加入预先煮沸肝匀浆(编号为A)和新鲜肝匀浆(编号为B)2 mL、pH 7.7的磷酸缓冲液3 mL、0.5 mol/L正丁酸溶液2 mL, 摇匀, 43 ℃恒温水浴锅孵育40 min. 加入20%三氯乙酸溶液3 mL摇匀, 室温放置10 min; (2)将混合物用滤纸在漏斗上过滤, 收集滤液5 mL于编号A、B的碘量瓶中; (3)加入0.1 mol/L碘液和10%NaOH各3 mL室温放置10 min后10%盐酸溶液中和至pH 7.2; (4)用0.02 mol/L硫代硫酸钠溶液滴定到碘量瓶中的溶液呈浅黄色时, 往瓶中滴加数滴0.1%淀粉溶液, 使瓶中溶液呈蓝色; (5)继续用0.02 mol/L硫代硫酸钠溶液滴定到碘量瓶中溶液的蓝色消褪为止; (6)记录所用的硫代硫酸钠溶液毫升数, 计算实验中肝匀浆生成丙酮的量(mol) = (A-B)×0.02 mol/L×1/6. 其中A为滴定样品(对照)所消耗的0.02 mol/L硫代硫酸钠溶液的毫升数, B为不滴定样品所消耗的0.02 mol/L硫代硫酸钠溶液的毫升数.
1.2.6 烯脂酰CoA水合酶活性检测: 应用试剂盒比色法定量细胞短链烯脂酰辅酶A水合酶检测活性, 上述肝匀浆加入细胞裂解液冰上反应30 min(每10 min涡旋震荡30 s), 4 ℃台式离心机离心10000 g离心10 min, 取上清. 再取10 µL作蛋白定量. 另取缓冲液100 µL于比色皿中, 加入肝匀浆上清20 µL(100 µg蛋白)上下颠倒混匀, 30 ℃静置2 min, 放分光光度计中置零(波长为263 nm). 取出比色皿, 加入反应液20 µL上下颠倒混匀, 即刻放入比色皿中读数(0-15 min读数值). 计算方法: 样品中烯脂酰CoA水合酶转化量(µmol/min) = 6.25×(0 min读数-15 min读数值)/0 min读数.
统计学处理 应用SPSS19.0统计软件对数据进行分析, 计量资料以mean±SD表示, LSD-t法对均数进行检验, Spearman对肝内脂质与硫化氢、烯脂酰辅酶A水合酶活性进行相关性分析. P<0.05为差异有统计学意义.
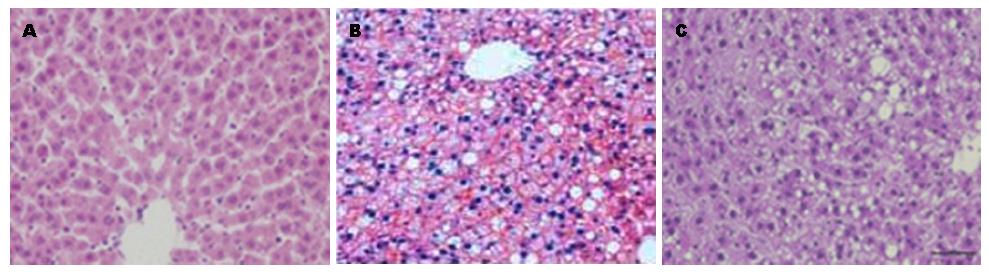
动物经过8 wk高脂饮食后, 肝小叶20%发生脂肪变, 以混合不均一脂肪变为主, 炎症细胞浸润轻度. 高脂饮食+NaHS组肝脏脂肪变性明显减轻, 炎症不明显(图1).
2.2.1 肝脏内脂肪含量变化: 高脂饮食动物肝内TG和胆固醇明显升高, 腹腔应用NaHS干预后肝脏脂质成分明显降低(表1).
2.2.2 肝脏丙酮含量变化: 高脂饮食组动物肝脏内的丙酮生成量明显少于正常组, 在NaHS的作用下, 丙酮生成量增加, 改善β-氧化(表1).
2.2.3 肝脏硫化氢变化: 高脂饮食动物肝脏内硫化氢较正常组含量明显减少, 应用NaHS干预组的硫化氢明显增加(表1).
2.2.4 肝脏烯脂酰CoA水合酶活性变化: 高脂饮食组动物肝脏内的烯脂酰CoA水合酶活性较正常组动物烯脂酰CoA水合酶的活性下降达50%, 高脂饮食+NaHS组烯脂酰CoA水合酶活性较高脂饮食组增加达60%(表1).
高脂饮食组硫化氢与TG、TC成负相关r = -0.621、-0.432, P = 0.01036、0.04497, 与烯脂酰CoA水合酶活性成正相关, r = 0.513、P = 0.00833.
NAFLD是以肝细胞脂肪变性为主的临床病理综合征, 其主要病理结果为肝内脂肪积聚, 这与β-氧化功能低下有关[6,7]. 尽管目前把"二次打击"理论认为胰岛素抵抗是肝内脂肪积聚的主要原因[8,9], 然而, 在研究中均显示胰岛素增敏剂并不能理想地控制肝细胞脂肪变性[10,11], 而提高β-氧化促进脂肪消耗则较为理想地控制肝细胞的脂肪变性[12,13], 说明β-氧化是治疗NAFLD关键.
β-氧化是脂酰CoA脱氢酶、烯酰CoA水合酶、β-羟脂酰CoA脱氢酶和β-酮脂酰CoA硫解酶先后催化完成的脂肪酸降解的主要方式, 其中任何一种酶的活性和含量改变均可以导致肝脏脂肪变性异常. 其中, 烯酰CoA水合酶被证实与非酒精性脂肪肝病的β-氧化降低有关, 在蛋氨酸胆碱缺乏造模饲料(methionine- and choline-ceficent diet, MCD)诱导的脂肪肝动物体内和体外均证实其含量减少[6]. 我们应用高脂饮食形成的脂肪肝生成的酮体减少, β-氧化降低, 同时发现烯酰CoA水合酶活性降低, 与MCD饲料复制动物模型结果相一致, 再次证实非酒精性脂肪肝病的β-氧化功能障碍.
β-氧化功能障碍的直接作用是对脂肪酸的代谢减少, 最终导致脂肪酸积聚在细胞内, 并且与甘油中间产物合成TG, 导致肝细胞内脂肪积聚. 既往没有直接文献证实非酒精性脂肪肝肝内β-氧化障碍与肝细胞内脂肪呈正比, 本研究则直接证实β-氧化与肝细胞内脂肪的积聚相关, 为治疗肝内脂肪变性提供实验依据.
酶活性受pH值、底物浓度、气体小分子等调节, 其中硫化氢作为重要的气体信号分子调节多种酶的活性[14], 在非酒精性脂肪肝中调节自由基产生酶的活性, 改善脂肪肝炎症程度和脂肪变性[15]. 而本研究显示较低浓度硫化氢提高烯脂酰CoA水合酶活性而提升β-氧化, 促进脂肪代谢, 使肝细胞内TG和胆固醇降低, 提示硫化氢可以促进β-氧化缓解肝内脂肪变性.
总之, 在非酒精性脂肪肝发生中, 硫化氢不足可能导致β氧化下降, 增加硫化氢可能促进肝内脂肪的消耗.
目前对非酒精性脂肪肝的重视度越来越高. 但是, 临床治疗效果不尽人意, 表现为体质量控制不理想、转氨酶反复波动、肝脏内部脂肪不易消除等, 这与脂肪肝的发病机制不明确有关. 有研究提示β-氧化功能降低是脂肪肝形成的主要原因, 所以, 通过提高β-氧化是治疗脂肪肝的主要途径.
党双锁, 教授, 西安交通大学医学院第二附属医院感染科
对于脂肪肝的基本病变(肝细胞脂肪变性)的机制研究尚少. 事实上, 减少肝内脂肪的合成和促进肝内脂肪分解是治疗的重点. 已经有文献提示脂肪肝的β-氧化途径功能下降, 这为消除脂肪肝肝内脂肪提供思路.
我们前期的研究已经提示硫化氢可以减少肝内脂肪的积聚, 之后有学者研究也提示其参与了非酒精性脂肪性肝炎的发病, 并且通过调节细胞炎症因子来实现, 对于肝细胞内脂肪的作用机制尚未见报道.
本研究通过实验性研究硫化氢对非酒精性脂肪肝的脂肪积聚的抑制作用, 并阐明其通过提高β-氧化途径实现, 是既往未曾报道过的. 本研究中直接检测肝脏中的脂肪变化较既往检测血液中的脂肪改变更直接、更科学的反映肝脏脂肪变性程度.
本研究方法中关于肝脏脂肪测定反应脂肪肝变化程度, 是今后脂肪肝动物研究应借鉴的. 硫化氢提升脂肪肝的β-氧化功能是今后临床治疗的又一方向.
β-氧化(β-oxidat-ion): 又称为脂肪酸的β-氧化, 指脂肪酸活化为脂酰CoA, 脂酰CoA进入线粒体基质后, 在脂肪酸β-氧化多酶复合体的催化下, 依次进行脱氢、水化、再脱氢和硫解四步连续反应, 释放出一分子乙酰CoA和一分子比原来少两个碳原子的脂酰CoA过程. 由于反应均在脂酰CoA的β-碳原子与β-碳原子间进行, 最后β-碳原子被氧化成酰基, 故称β-氧化. 他是脂肪氧化分解的主要方式.
本文能够以β氧化为切入点设计脂肪肝动物模型, 观察硫化氢对脂肪肝β氧化的影响, 并发现硫化氢可能促进脂肪肝β氧化减少肝内脂肪积聚, 揭示硫化氢可能参与了脂肪肝的发生过程, 具有重要的科学意义.
编辑: 郭鹏 电编:都珍珍
| 3. | Morris EM, Meers GM, Booth FW, Fritsche KL, Hardin CD, Thyfault JP, Ibdah JA. PGC-1α overexpression results in increased hepatic fatty acid oxidation with reduced triacylglycerol accumulation and secretion. Am J Physiol Gastrointest Liver Physiol. 2012;303:G979-G992. [PubMed] [DOI] |
| 4. | Li Y, Wong K, Walsh K, Gao B, Zang M. Retinoic acid receptor β stimulates hepatic induction of fibroblast growth factor 21 to promote fatty acid oxidation and control whole-body energy homeostasis in mice. J Biol Chem. 2013;288:10490-10504. [PubMed] [DOI] |
| 5. | Huang J, Jia Y, Fu T, Viswakarma N, Bai L, Rao MS, Zhu Y, Borensztajn J, Reddy JK. Sustained activation of PPARα by endogenous ligands increases hepatic fatty acid oxidation and prevents obesity in ob/ob mice. FASEB J. 2012;26:628-638. [PubMed] [DOI] |
| 6. | Zhang X, Yang J, Guo Y, Ye H, Yu C, Xu C, Xu L, Wu S, Sun W, Wei H. Functional proteomic analysis of nonalcoholic fatty liver disease in rat models: enoyl-coenzyme a hydratase down-regulation exacerbates hepatic steatosis. Hepatology. 2010;51:1190-1199. [PubMed] [DOI] |
| 7. | Rector RS, Thyfault JP, Uptergrove GM, Morris EM, Naples SP, Borengasser SJ, Mikus CR, Laye MJ, Laughlin MH, Booth FW. Mitochondrial dysfunction precedes insulin resistance and hepatic steatosis and contributes to the natural history of non-alcoholic fatty liver disease in an obese rodent model. J Hepatol. 2010;52:727-736. [PubMed] [DOI] |
| 8. | Pirgon Ö, Bilgin H, Çekmez F, Kurku H, Dündar BN. Association between insulin resistance and oxidative stress parameters in obese adolescents with non-alcoholic fatty liver disease. J Clin Res Pediatr Endocrinol. 2013;5:33-39. [PubMed] [DOI] |
| 9. | Conlon BA, Beasley JM, Aebersold K, Jhangiani SS, Wylie-Rosett J. Nutritional management of insulin resistance in nonalcoholic fatty liver disease (NAFLD). Nutrients. 2013;5:4093-4114. [PubMed] [DOI] |
| 10. | Ozturk ZA, Kadayifci A. Insulin sensitizers for the treatment of non-alcoholic fatty liver disease. World J Hepatol. 2014;6:199-206. [PubMed] [DOI] |
| 11. | Chang E, Park CY, Park SW. Role of thiazolidinediones, insulin sensitizers, in non-alcoholic fatty liver disease. J Diabetes Investig. 2013;4:517-524. [PubMed] [DOI] |
| 12. | Ishikawa H, Takaki A, Tsuzaki R, Yasunaka T, Koike K, Shimomura Y, Seki H, Matsushita H, Miyake Y, Ikeda F. L-carnitine prevents progression of non-alcoholic steatohepatitis in a mouse model with upregulation of mitochondrial pathway. PLoS One. 2014;9:e100627. [PubMed] [DOI] |
| 13. | Nassir F, Ibdah JA. Role of mitochondria in nonalcoholic fatty liver disease. Int J Mol Sci. 2014;15:8713-8742. [PubMed] [DOI] |
| 14. | Módis K, Panopoulos P, Coletta C, Papapetropoulos A, Szabo C. Hydrogen sulfide-mediated stimulation of mitochondrial electron transport involves inhibition of the mitochondrial phosphodiesterase 2A, elevation of cAMP and activation of protein kinase A. Biochem Pharmacol. 2013;86:1311-1319. [PubMed] [DOI] |
| 15. | Luo ZL, Tang LJ, Wang T, Dai RW, Ren JD, Cheng L, Xiang K, Tian FZ. Effects of treatment with hydrogen sulfide on methionine-choline deficient diet-induced non-alcoholic steatohepatitis in rats. J Gastroenterol Hepatol. 2014;29:215-222. [PubMed] [DOI] |