修回日期: 2014-07-07
接受日期: 2014-07-28
在线出版日期: 2014-09-08
目的: 探讨核转录因子-κB(nuclear factor kappa B, NF-κB)在卵圆细胞增殖分化中的作用及黄芩苷的调节机制.
方法: 64只健康SD大鼠随机分为假手术组、模型组、黄芩苷低剂量组和黄芩苷高剂量组. 模型组采用2-乙酰氨基芴+2/3肝切除术(2-acetylaminofluorene + two thirds partial hepatectomy, 2-AAF+2/3PH)的方法建立卵圆细胞增殖模型, 黄芩苷干预组建立模型的同时分别给予50 mg/kg和100 mg/kg黄芩苷. 各组分别于手术后第1、7、14、21天取材. HE染色观察肝组织病理学表现; 免疫荧光技术、免疫组织化学检测HOC的增殖分化情况; RT-PCR法和Western blot检测NF-κB表达.
结果: 本实验成功建立了卵圆细胞增殖模型, 卵圆细胞在肝切除术后第7-14天增加明显, 第14天达到峰值, 第21天下降. NF-κB的表达趋势与卵圆细胞增殖一致. 黄芩苷干预组卵圆细胞和NF-κB的表达均减少, 与模型组相比差异均有统计学意义(P<0.05).
结论: 卵圆细胞的增殖和分化与NF-κB的激活有关. 黄芩苷可能通过抑制NF-κB信号通路而抑制卵圆细胞的增殖, 并诱导卵圆细胞向成熟的肝细胞及胆管细胞分化, 这可能是黄芩苷作用于肝脏的一种机制.
核心提示: 本实验成功建立了卵圆细胞增殖的肝损伤模型, 证明了卵圆细胞的增殖分化与核转录因子-κB(nuclear factor-kappa B, NF-κB)有关. 并应用黄芩苷干预, 结果显示黄芩苷可通过抑制NF-κB信号传导通路, 从而抑制卵圆细胞的增殖, 并诱导增殖的卵圆细胞向成熟的肝细胞及胆管细胞分化.
引文著录: 张文娟, 郭昱, 尹崇娇, 李元, 姚金锋, 巩翠洁. NF-κB在卵圆细胞增殖和分化中的作用及黄芩苷的调节机制. 世界华人消化杂志 2014; 22(25): 3736-3743
Revised: July 7, 2014
Accepted: July 28, 2014
Published online: September 8, 2014
AIM: To explore the role of nuclear factor kappa B (NF-κB) in hepatic oval cell proliferation and the possible mechanism underlying the therapeutic effect of baicalin against liver injury.
METHODS: 64 SD rats were randomly divided into 4 groups: a sham operation group, a model group, a low-dose baicalin group and a high-dose baicalin group. 2-acetylaminofluorene plus 2/3 partial hepatectomy (2-AAF+2/3PH) was used to establish the hepatic oval cell (HOC) proliferation model. The two baicalin groups were given 50 and 100 mg/kg of baicalin daily by lavage when modeling, respectively. The rats were killed on 1, 7, 14 and 21 d after PH in each group, and serum and liver tissue samples were collected. Hepatic pathological changes were observed by hematoxylin and eosin (HE) staining. Immunofluorescence, immunohistochemical staining, reverse transcription-polymerase chain reaction (RT-PCR) and Western blot were used to evaluate the proliferation and differentiation of HOCs and the expression of NF-κB.
RESULTS: The HOC proliferation model was successfully established. HOC proliferation began to increase after PH, peaked on the 14th day and decreased on the 21st day. The expression pattern of NF-κB was consistent with the proliferation pattern of HOCs, and they were both reduced by baicalin intervention.
CONCLUSION: HOC proliferation is related to the activation of NF-κB. Baicalin could inhibit HOC proliferation possibly through the NF-κB signaling pathway, and this may be a possible mechanism for the therapeutic effect of baicalin against liver injury.
- Citation: Zhang WJ, Guo Y, Yin CJ, Li Y, Yao JF, Gong CJ. Role of NF-κB in hepatic oval cell proliferation: Implications for mechanism underlying protective effects of baicalin against liver injury. Shijie Huaren Xiaohua Zazhi 2014; 22(25): 3736-3743
- URL: https://www.wjgnet.com/1009-3079/full/v22/i25/3736.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i25.3736
肝病的治疗一直是医学上的难点, 肝脏干细胞的发现为肝病的治疗带来新的希望, 近年来卵圆细胞成为研究的热点, 被认为具有治疗急慢性肝损伤的潜能[1], 另一方面也有认为卵圆细胞过度增殖转化为癌, 与肝癌的发生有关系, 有文献支持卵圆细胞是肝癌的起源这个学说[2]. 理解调控卵圆细胞生物学的复杂的生长因子和信号通路将帮助我们阐明卵圆细胞在肝再生和肿瘤发生方面的作用. 有研究表明核转录因子-κB(nuclear factor kappa B, NF-κB)与卵圆细胞激活有关, 在肝再生过程起重要作用[3]. 中药治疗肝损伤是一个值得研究的领域. 研究表明黄芩苷对急性肝损伤有治疗保护作用[4,5], 但其具体的作用机制尚不清楚. 本实验将从NF-κB信号通路入手研究其对卵圆细胞增殖分化的影响, 并应用黄芩苷干预, 研究黄芩苷对NF-κB的影响及肝脏保护作用的可能机制.
清洁级成年健康SD大鼠, 体质量200 g±20 g, 雌雄不限, 由河北省实验动物中心提供(合格证编号1303121). 黄芩苷(成都曼斯特生物科技有限公司); 2-乙酰氨基芴(2-acetylaminofluorene, 2-AAF)(阿拉丁试剂有限公司); 兔抗大鼠甲胎蛋白(α-fetoprotein, AFP)单克隆抗体, 兔抗大鼠CK19单克隆抗体(Proteintech Group. Inc公司), 鼠抗大鼠OV6单克隆抗体, c-kit单克隆抗体(Santa Cruz公司), NF-κB p65抗体(Bioworld), 超纯RNA提取试剂盒, HiFi-MMLV cDNA第一链试剂盒(北京康为世纪生物科技公司).
1.2.1 分组及取材: 将64只健康SD大鼠随机分为假手术组(A)、模型组(B)、黄芩苷低剂量组(C)、黄芩苷低剂量组(D). 假手术组常规饲养, 术中仅将肝左叶、中叶、尾状叶置于腹腔外10 min, 不做切除, 送还腹腔后关腹. 模型组以每天15 mg/kg的2-AAF连续灌胃4 d, 第5天行2/3部分肝切除, 然后继续灌胃5 d. 黄芩苷干预组在造模的同时分别给予50 mg/kg、100 mg/kg的黄芩苷灌胃, 直至处死. 各组分别于手术后1、7、14、21 d收集肝组织标本.
1.2.2 显微镜观察及图像分析: 常规石蜡包埋、切片, 脱水后苏木素-伊红(HE)染色, 显微镜下观察肝组织结构. 应用免疫组织化学染色方法检测AFP、CK19及c-kit的表达, 免疫荧光染色检测OV6表达, 分别对各实验组进行100倍和400倍的显微照相, 选择有意义的视野, 计数并分析数据.
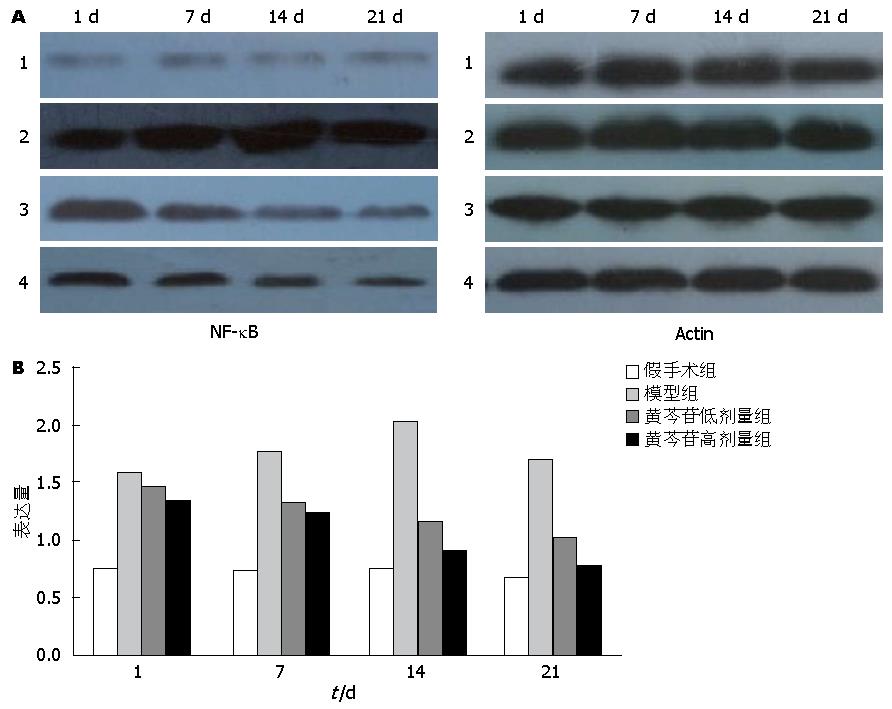
1.2.3 Western blot检测NF-κB p65蛋白的表达: 将留取的100 mg肝组织置入匀浆管壶腹部, 用剪刀将其剪碎, 加入1 mL RIPA裂解缓冲液, 研磨、震荡、离心后取上清液, 操作按常规进行检测. 结果定量分析选用美国Kodak公司ID成像分析系统软件.
1.2.4 RT-PCR法检测NF-κB mRNA表达: 提取样本总RNA、RNA电泳、RNA消化、反转录过程按照说明书步骤进行. 引物设计: NF-κB上游引物: 5'-ACGATCTGTTTCCCCTCATC-3', NF-κB下游引物: 5'-GCTTCTCTCCCCAGGAATACTGCC-3', 内参β-actin上游引物: 5'-TGGAGTCTACTGGCGTCTT-3', 内参β-actin下游引物: 5'-TGTCATATTTCTCGTGGTTCA-3'. 扩增程序为: 95 ℃ 10 min, (95 ℃ 15 s, 60 ℃ 60 s)×45个循环. 分别用目的基因引物和内参基因引物进行扩增. 实时荧光定量PCR中每个样本重复3次, 取其平均值为Ct值, 按照2-△△Ct相对定量计算公式, 计算出各样品的目的基因相对定量结果.
统计学处理 数据均以mean±SD表示, 应用SPSS13.0软件进行统计分析. 多组间计量资料均数比较采用单因素方差分析(One-way ANOVA), 组间比较采用SNK检验. P<0.05为差异有统计学意义.
假手术组大鼠肝小叶结构正常, 未见到典型的卵圆细胞. 模型组大鼠肝组织内可见到大量炎细胞浸润, 肝小叶结构破坏, 实质细胞出现变性坏死. 术后第1天, 偶可见卵圆细胞. 术后第7天可见到肝小叶汇管区周围有散在或呈簇状分布的卵圆细胞. 术后第14天汇管区及小叶内胆管周围出现大量卵圆细胞, 并且周围肝实质内也可见大量散在的卵圆细胞. 术后第21天可见肝细胞再生, 肝小叶结构渐恢复完整, 组织内的卵圆细胞数量减少. 黄芩苷干预组术后肝组织标本各时间点卵圆细胞增生的数目较模型组少, 分布范围较小, 且黄芩苷高剂量组减少更明显.
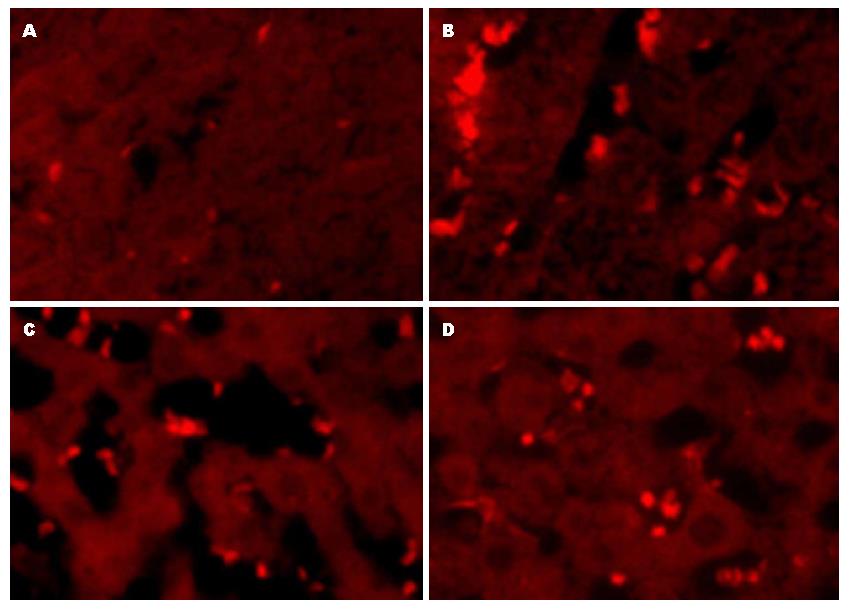
假手术组偶可见OV6阳性染色细胞, 在各时间点间无明显差别(P>0.05). 模型组在大鼠肝切除术后第1天可见少量阳性细胞, 第7天增多, 14天达峰值, 21天下降, 与假手术组相比明显增多, 差异有统计学意义(P<0.05). 黄芩苷干预组较模型组卵圆细胞减少, 且高剂量组较低剂量组减少更明显, 各组间差别有统计学意义(P<0.05)(图1).
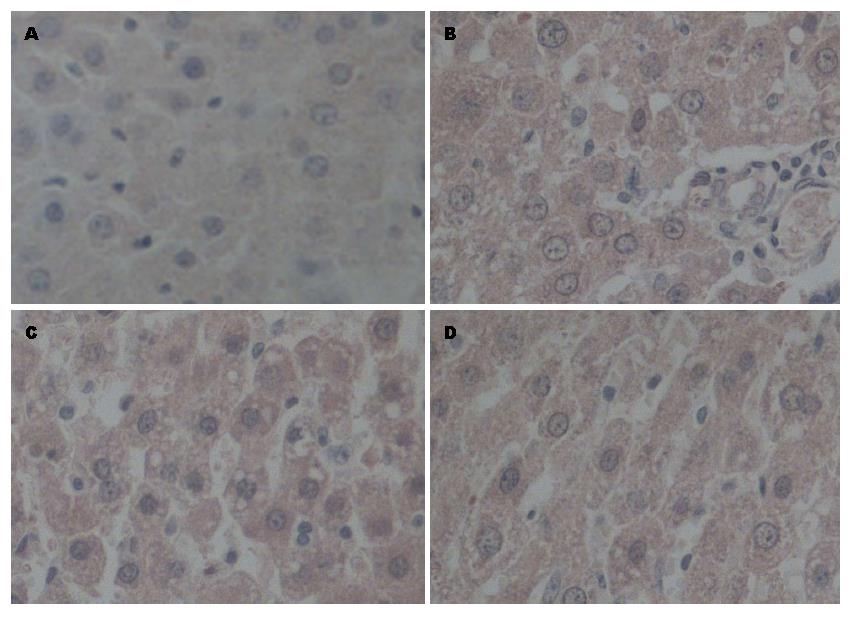
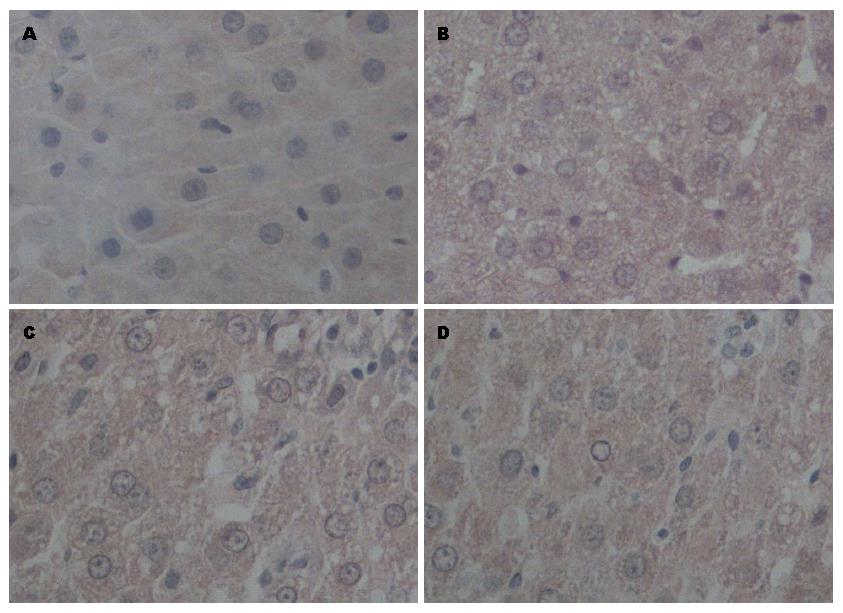
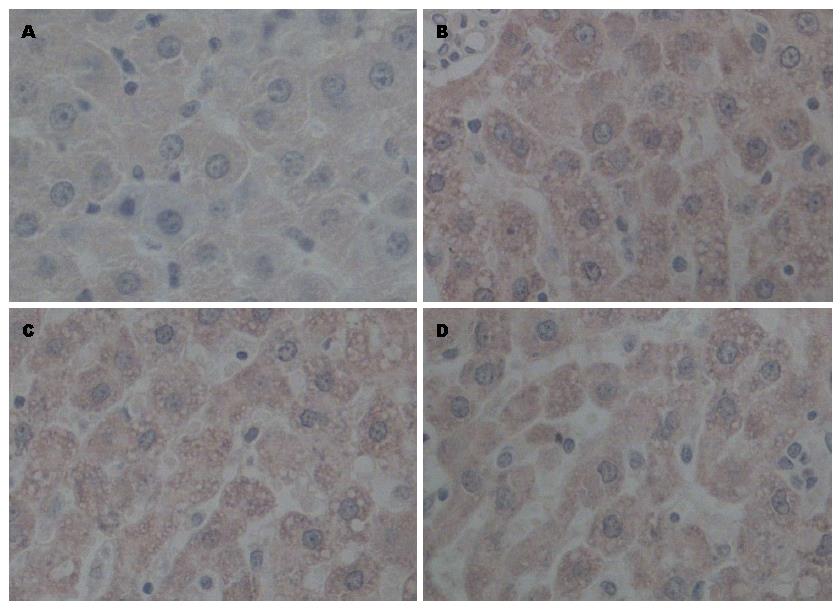
模型组CK19、c-kit、AFP表达均在大鼠肝切除术后第7-14天增加明显, 第14天达到峰值, 第21天下降, 与OV6表达趋势一致. 在1、7、14、21 d与假手术组相比均明显升高, 定量分析差异有统计学意义(P<0.05). 黄芩苷干预组CK19的表达增加, c-kit、AFP的表达下降, 黄芩苷高剂量组变化更明显, 各组间差异有统计学意义(P<0.05)(图2, 图3, 图4)
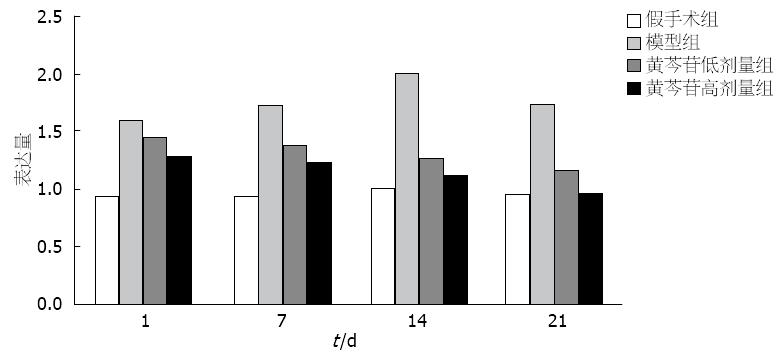
实时荧光定量PCR和Western blot检测均显示, 模型组NF-κB表达第1-14天呈上升趋势, 14 d达到峰值, 第21天下降, 与卵圆细胞增殖趋势一致, 较假手术组明显增加, 差异有统计学意义(P<0.05). 与模型组比较, 黄芩苷干预组NF-κB表达减少, 随时间变化呈下降趋势, 且黄芩苷高剂量组较低剂量组下降更明显, 三组间比较差异有统计学意义(P<0.05)(图5, 图6).
肝病是危害人类健康常见的严重疾病, 体内外多种因素均可导致肝细胞损害. 当前肝病的治疗缺乏有效的措施, 对于终末期肝病, 肝移植被认为是最有效的治疗手段, 但是由于肝源的短缺、免疫排斥和治疗费用等问题, 仍然使数以万计的患者不能得到救治. 近年来, 随着肝干细胞的发现和体外培养的成功, 从分子水平探讨肝损伤修复的机制成为研究的热点, 也为肝病的治疗带来新的希望.
卵圆细胞是一种具有多向分化潜能的肝脏干细胞, 具有形态小、核质比高的特点, 定位于移行胆管或终末小胆管形成的Hering管, 在正常情况下含量非常少, 通常是无法检测到, 但当肝脏受到严重损伤, 肝细胞增殖受阻和延迟时起重要作用[6,7], 此时卵圆细胞开始被激活, 可分化为肝细胞和胆管细胞, 参与肝损伤的修复[8-12]. 卵圆细胞能表达白蛋白(albumin, ALB)、AFP、CK19、OV6、Thy-1、Sca-1、c-kit等[13], OV6是卵圆细胞特异性分子标志物[14], 卵圆细胞还表达干细胞标志物c-kit、胎肝细胞标志物AFP及成熟胆管细胞标志物CK19等. 本实验采用OV6阳性细胞计数卵圆细胞, 并根据c-kit、AFP、CK19的定量表达来反应卵圆细胞向成熟细胞分化的情况. 2-乙酰氨基芴+2/3肝切除(2-AAF+2/3PH)大鼠模型为最常用的卵圆细胞增殖模型[15-17], 其原理是由于2-AAF是一种肝细胞毒性药物, 能够特异性抑制肝细胞增殖而不影响卵圆细胞, 肝2/3切除使肝细胞大量丢失, 肝细胞生长反馈信息缺失导致卵圆细胞的快速生长. 本课题在前期工作的基础上成功建立了2-AAF+2/3PH急性肝损伤的卵圆细胞增殖模型, HE染色、电镜及OV6免疫荧光染色均证明了卵圆细胞的存在, 并发现卵圆细胞的增殖规律为在PH术后第1天可见少量卵圆细胞, 1-14 d呈增多趋势, 14 d达高峰, 之后开始下降. 这为进一步研究卵圆细胞的增殖分化打好基础.
卵圆细胞增殖受多种信号通路的调节, 已有研究证明在卵圆细胞的增殖过程中NF-κB和STAT3被激活[18]. NF-κB广泛存在于真核生物中, 作为信号传导途径中的中枢, 是一种重要的核转录因子, 与肿瘤、炎症、免疫等密切相关. NF-κB为一个转录因子蛋白家族, 包括5个亚单位: p65、p52、cRel、p50和RelB[19]. 两个亚基一起可以形成同源或异源二聚体, 再与靶基因上特定的序列结合来调节基因的转录. 在静息细胞中, NF-κB与NF-κB的抑制蛋白(inhibitor of NF-κB, IκB)形成复合体, 以无活性的形式存在于细胞浆中[20,21]. 当细胞受到各种信号刺激后, IκB激酶复合体(IκB kinase, IKK)被激活, 磷酸化IκB, 使NF-κB暴露核位点. 游离的NF-κB将快速转移到细胞核中, 与特异性的κB位点序列结合, 从而诱导相应的基因转录. 近年来研究发现, 一些与细胞增殖调控有关的基因转录过程中NF-κB信号传导通路起重要作用, NF-κB的活化可启动转录的开始. 在肝损伤过程中NF-κB的活性明显升高, 他在肝细胞增殖和肝再生过程中是必须的[3]. 但是NF-κB作用尚存在争议, 在不同的生理和病理条件下可能起不同的作用, 与炎症和肿瘤的发生有关系, 可以作为药物治疗疾病的一个靶点[22]. 有文献报道TNF能激活体外卵圆细胞系的增殖, 这个作用与激活NF-κB和STAT3有关[23], 在体外NF-κB保护肝细胞和其他肝细胞系对抗凋亡[24]. 然而在体内NF-κB是否参与肝卵圆细胞增殖分化的调控呢, 本实验分别通过Western blot和PCR方法, 检测NF-κB蛋白表达及NF-κB mRNA的表达, 结果显示在体内随时间变化其表达结果与卵圆细胞增殖趋势一致, 从术后第1天开始增多, 在第14天达高峰, 第21天下降, 从而说明NF-κB与卵圆细胞的激活有一定的相关性, 参与卵圆细胞增殖分化的调控. 这与之前研究的结果一致[18], NF-κB可能促进了卵圆细胞的增殖, 在肝损伤的修复过程中起重要作用.
但是对于卵圆细胞的作用一直以来是有争议的, 他对于肝损伤修复起双刃剑的作用, 一方面增殖的卵圆细胞分化为成熟肝细胞和胆管细胞, 促进肝脏损伤的修复; 另一方面大量研究证明他与肝癌的发生有关[25-27]. 从而推测卵圆细胞适度的增殖有助于肝脏的修复, 而一旦失去了调控过度增殖, 有可能转变为癌. 如何通过信号通路调控卵圆细胞, 促使其向成熟肝细胞或胆管细胞分化, 抑制其过度增殖, 对肝损伤修复及干细胞移植治疗肝病都有重要意义.
在肝损伤的治疗中, 西药缺乏确切的疗效, 近年来传统中药成为研究的热点, 并已取得一定的成就. 黄芩苷是从传统中药黄芩中提取分离出来的有效成分, 属于黄酮类化合物, 分子式为C21H18O11, 具有抗炎、抑菌、利尿、清除自由基等重要作用. 已有研究证明了黄芩苷能抑制肝癌细胞黏附、增殖、迁移[28], 并保护肝脏免受CCl4介导的氧化损伤及对肝纤维化有治疗作用[4,5], 但其具体的调节机制及对卵圆细胞的作用尚不清楚. 黄芩苷对NF-κB有抑制作用已在动物炎症模型中得到证实[29,30]. 本实验通过建立2-AAF+2/3PH模型, 成功诱导卵圆细胞增殖, 并应用不同剂量的黄芩苷进行干预, 初步研究了黄芩苷对卵圆细胞增殖分化的影响, 并探究其作用的可能的分子机制. 结果显示黄芩苷干预组NF-κB的表达减少, 同时卵圆细胞数量也减少, 黄芩苷高剂量组减少更明显, 差异有统计学意义(P<0.05). 同时免疫组织化学染色显示黄芩苷干预组c-kit、AFP不成熟细胞表面标志物表达减少, 成熟胆管表面标志物CK19表达增加, 并且与黄芩苷剂量有关. 这表明黄芩苷影响卵圆细胞的增殖分化, 而这种作用可能是通过NF-κB信号通路起作用. 结合卵圆细胞在肝损伤修复及肿瘤发生中的双重角色以及NF-κB的致炎和抗凋亡双重作用, 从而可以很好地解释黄芩苷对肝脏的保护作用, 他可以作为一种协调剂, 抑制卵圆细胞过度增殖, 防止其转化为癌, 并促进其分化为成熟的肝细胞和胆管细胞, 起到抗肿瘤及促进肝损伤修复的作用.
总之, 应用2-AAF灌胃联合2/3PH可以成功的造成肝损伤, 诱导大鼠肝卵圆细胞增殖; 卵圆细胞的增殖分化受NF-κB信号通路的调节; 黄芩苷具有抗氧化、抗自由基的作用, 作用于NF-κB信号通路, 调节卵圆细胞的增殖分化, 可促进其向肝细胞及胆管细胞分化. 但是影响卵圆细胞增殖分化的信号通路及因子众多, 本实验的不足之处在于没有应用NF-κB抑制剂干预进一步验证NF-κB与卵圆细胞增殖的关系, 另外应用黄芩苷体外定向诱导卵圆细胞分化尚需要进一步探究, 肝病的治疗任重而道远需要我们继续进一步研究.
我国是一个肝病大国, 每年因为重症肝功能衰竭导致死亡的人数约为30.5万, 肝病的治疗一直是医学上的难点, 肝脏干细胞-卵圆细胞的发现为肝病的细胞治疗带来新的希望, 近年来肝卵圆细胞在肝病中的作用成为研究的热点.
唐世刚, 教授, 湖南省人民医院
调控卵圆细胞生物学的复杂的生长因子和信号通路是研究的重点与热点, 这将帮助我们阐明卵圆细胞在肝再生和肿瘤发生方面的作用. 如何诱导其分化为肝细胞和胆管细胞以修复损伤的肝脏并防止其过度增殖转化为癌细胞是亟待研究的问题.
一方面卵圆细胞增殖分化为成熟肝细胞和胆管细胞促进肝损伤的修复; 另一方面卵圆细胞与肝癌的发生有关. 核转录因子-κB(nuclear factor kappa B, NF-κB)信号传导通路在一些与细胞增殖调控有关的基因转录过程中起重要作用, 在肝损伤过程中NF-κB的活性明显升高, 他在肝细胞增殖和肝再生过程中是必须的.
研究发现在体外卵圆细胞的增殖过程与NF-κB的激活有关, 然而在肝损伤中体内NF-κB是否参与肝卵圆细胞增殖分化的调控呢, 本实验对其进行了初步研究, 并应用黄芩苷进行干预, 首次发现了黄芩苷可能通过NF-κB信号通路作用于卵圆细胞.
对肝卵圆细胞在今后可能的临床应用中提供实验依据, 为肝损伤的治疗提供新的靶点. 同时在肝病的细胞治疗和防范肝病恶性变方面具有一定的实用价值.
卵圆细胞: 1956年, Ferber在研究大鼠肝细胞癌变机制时, 发现一类体积较小, 核较大, 呈卵圆形, 胞浆少而浅染的细胞, 命名为卵圆细胞, 此后研究发现此类细胞可分化为肝细胞和胆管细胞, 认为他是一种肝脏干细胞.
本文通过在原有基础上研究了NF-κB在肝卵圆细胞增殖和分化的作用, 并探讨了黄芩苷可能通过干预NF-κB信号通路而发挥对肝卵圆细胞增殖和分化起到调节作用. 对肝卵圆细胞在今后可能的临床应用中提供了较好的实验数据. 在肝病的细胞治疗和防范起潜在的恶性变上具有一定的实用价值.
编辑: 郭鹏 电编:都珍珍
| 1. | Martínez-Palacián A, del Castillo G, Suárez-Causado A, García-Álvaro M, de Morena-Frutos D, Fernández M, Roncero C, Fabregat I, Herrera B, Sánchez A. Mouse hepatic oval cells require Met-dependent PI3K to impair TGF-β-induced oxidative stress and apoptosis. PLoS One. 2013;8:e53108. [PubMed] [DOI] |
| 2. | Mishra L, Banker T, Murray J, Byers S, Thenappan A, He AR, Shetty K, Johnson L, Reddy EP. Liver stem cells and hepatocellular carcinoma. Hepatology. 2009;49:318-329. [PubMed] [DOI] |
| 3. | Malato Y, Ehedego H, Al-Masaoudi M, Cubero FJ, Bornemann J, Gassler N, Liedtke C, Beraza N, Trautwein C. NF-κB essential modifier is required for hepatocyte proliferation and the oval cell reaction after partial hepatectomy in mice. Gastroenterology. 2012;143:1597-1608.e11. [PubMed] [DOI] |
| 4. | Peng XD, Dai LL, Huang CQ, He CM, Chen LJ. Correlation between anti-fibrotic effect of baicalin and serum cytokines in rat hepatic fibrosis. World J Gastroenterol. 2009;15:4720-4725. [PubMed] |
| 5. | Park SW, Lee CH, Kim YS, Kang SS, Jeon SJ, Son KH, Lee SM. Protective effect of baicalin against carbon tetrachloride-induced acute hepatic injury in mice. J Pharmacol Sci. 2008;106:136-143. [PubMed] |
| 6. | Li Z, Chen J, Li L, Ran JH, Liu J, Gao TX, Guo BY, Li XH, Liu ZH, Liu GJ. In vitro proliferation and differentiation of hepatic oval cells and their potential capacity for intrahepatic transplantation. Braz J Med Biol Res. 2013;46:681-688. [PubMed] [DOI] |
| 7. | Fausto N, Campbell JS. The role of hepatocytes and oval cells in liver regeneration and repopulation. Mech Dev. 2003;120:117-130. [PubMed] |
| 8. | Tanaka M, Itoh T, Tanimizu N, Miyajima A. Liver stem/progenitor cells: their characteristics and regulatory mechanisms. J Biochem. 2011;149:231-239. [PubMed] [DOI] |
| 9. | Koike H, Taniguchi H. Characteristics of hepatic stem/progenitor cells in the fetal and adult liver. J Hepatobiliary Pancreat Sci. 2012;19:587-593. [PubMed] [DOI] |
| 10. | Bird TG, Lorenzini S, Forbes SJ. Activation of stem cells in hepatic diseases. Cell Tissue Res. 2008;331:283-300. [PubMed] |
| 11. | Best J, Dollé L, Manka P, Coombes J, van Grunsven LA, Syn WK. Role of liver progenitors in acute liver injury. Front Physiol. 2013;4:258. [PubMed] |
| 12. | Oertel M, Shafritz DA. Stem cells, cell transplantation and liver repopulation. Biochim Biophys Acta. 2008;1782:61-74. [PubMed] [DOI] |
| 13. | Cantz T, Manns MP, Ott M. Stem cells in liver regeneration and therapy. Cell Tissue Res. 2008;331:271-282. [PubMed] |
| 15. | Dezső K, Papp V, Bugyik E, Hegyesi H, Sáfrány G, Bödör C, Nagy P, Paku S. Structural analysis of oval-cell-mediated liver regeneration in rats. Hepatology. 2012;56:1457-1467. [PubMed] [DOI] |
| 16. | Dusabineza AC, Van Hul NK, Abarca-Quinones J, Starkel P, Najimi M, Leclercq IA. Participation of liver progenitor cells in liver regeneration: lack of evidence in the AAF/PH rat model. Lab Invest. 2012;92:72-81. [PubMed] [DOI] |
| 17. | László V, Dezso K, Baghy K, Papp V, Kovalszky I, Sáfrány G, Thorgeirsson SS, Nagy P, Paku S. Triiodothyronine accelerates differentiation of rat liver progenitor cells into hepatocytes. Histochem Cell Biol. 2008;130:1005-1014. [PubMed] [DOI] |
| 18. | Sánchez A, Factor VM, Schroeder IS, Nagy P, Thorgeirsson SS. Activation of NF-kappaB and STAT3 in rat oval cells during 2-acetylaminofluorene/partial hepatectomy-induced liver regeneration. Hepatology. 2004;39:376-385. [PubMed] |
| 19. | Xiao C, Ghosh S. NF-kappaB, an evolutionarily conserved mediator of immune and inflammatory responses. Adv Exp Med Biol. 2005;560:41-45. [PubMed] |
| 20. | Basak S, Kim H, Kearns JD, Tergaonkar V, O'Dea E, Werner SL, Benedict CA, Ware CF, Ghosh G, Verma IM. A fourth IkappaB protein within the NF-kappaB signaling module. Cell. 2007;128:369-381. [PubMed] |
| 21. | Hoffmann A, Natoli G, Ghosh G. Transcriptional regulation via the NF-kappaB signaling module. Oncogene. 2006;25:6706-6716. [PubMed] |
| 22. | Muriel P. NF-kappaB in liver diseases: a target for drug therapy. J Appl Toxicol. 2009;29:91-100. [PubMed] [DOI] |
| 23. | Kirillova I, Chaisson M, Fausto N. Tumor necrosis factor induces DNA replication in hepatic cells through nuclear factor kappaB activation. Cell Growth Differ. 1999;10:819-828. [PubMed] |
| 24. | Bellas RE, FitzGerald MJ, Fausto N, Sonenshein GE. Inhibition of NF-kappa B activity induces apoptosis in murine hepatocytes. Am J Pathol. 1997;151:891-896. [PubMed] |
| 25. | Cai X, Zhai J, Kaplan DE, Zhang Y, Zhou L, Chen X, Qian G, Zhao Q, Li Y, Gao L. Background progenitor activation is associated with recurrence after hepatectomy of combined hepatocellular-cholangiocarcinoma. Hepatology. 2012;56:1804-1816. [PubMed] [DOI] |
| 26. | Pusterla T, Nèmeth J, Stein I, Wiechert L, Knigin D, Marhenke S, Longerich T, Kumar V, Arnold B, Vogel A. Receptor for advanced glycation endproducts (RAGE) is a key regulator of oval cell activation and inflammation-associated liver carcinogenesis in mice. Hepatology. 2013;58:363-373. [PubMed] [DOI] |
| 27. | Sell S. Stem cell origin of cancer and differentiation therapy. Crit Rev Oncol Hematol. 2004;51:1-28. [PubMed] |
| 28. | Chiu YW, Lin TH, Huang WS, Teng CY, Liou YS, Kuo WH, Lin WL, Huang HI, Tung JN, Huang CY. Baicalein inhibits the migration and invasive properties of human hepatoma cells. Toxicol Appl Pharmacol. 2011;255:316-326. [PubMed] |
| 29. | Lixuan Z, Jingcheng D, Wenqin Y, Jianhua H, Baojun L, Xiaotao F. Baicalin attenuates inflammation by inhibiting NF-kappaB activation in cigarette smoke induced inflammatory models. Pulm Pharmacol Ther. 2010;23:411-419. [PubMed] [DOI] |
| 30. | Guo M, Zhang N, Li D, Liang D, Liu Z, Li F, Fu Y, Cao Y, Deng X, Yang Z. Baicalin plays an anti-inflammatory role through reducing nuclear factor-κB and p38 phosphorylation in S. aureus-induced mastitis. Int Immunopharmacol. 2013;16:125-130. [PubMed] [DOI] |