修回日期: 2014-06-09
接受日期: 2014-07-05
在线出版日期: 2014-08-28
目的: 构建人乳头瘤病毒(human papillomavirus, HPV)18型E6、E7基因的短发夹RNA(short hairpin ribonucleic acid, shRNA)重组腺病毒载体, 为探讨食管癌与其发病关系的研究提供实验基础.
方法: 设计并合成2条shRNA均克隆到PL-Dest腺病毒骨架载体(pAd/PL-Dest)之中, 分别组成HPV18 E6、HPV18 E7基因重组腺病毒基因沉默子(shpAd-E6-eGFP、shpAd-E7-eGFP). 然后对重组腺病毒基因沉默子(shpAd-E6-eGFP、shpAd-E7-eGFP)采用酶切、DNA测序、PCR鉴定. 将验证后的沉默子经酶切后转染至HEK293A细胞, 然后再行包装、扩增、纯化与病毒滴度测定.
结果: 酶切鉴定得到阳性shpAd-E6-eGFP、shpAd-E6-eGFP重组腺病毒质粒; 转染到HEK293A细胞包装成功.
结论: 成功构建了HPV18 E6、HPV18 E7基因的shRNA重组腺病毒载体, 为HPV相关食管癌的基因治疗研究提供实验基础.
核心提示: 构建人乳头瘤病毒(human papillomavirus)18 E6、E7基因的短发夹RNA(short hairpin ribonucleic acid)重组腺病毒载体, 为探讨食管癌与其发病关系的研究及RNA干扰沉默食管癌细胞株中对人类白细胞抗原类分子的影响提供实验基础.
引文著录: 李钢, 冯彪, 邓彦超, 李德生, 居来提·艾尼瓦尔, 张力为. HPV18 E6、E7基因-shRNA重组腺病毒表达载体的构建及鉴定. 世界华人消化杂志 2014; 22(24): 3608-3612
Revised: June 9, 2014
Accepted: July 5, 2014
Published online: August 28, 2014
AIM: To construct adenovirus expression vectors carrying short hairpin RNAs (shRNAs) targeting human papillomavirus (HPV) 18 E6 and E7 to provide an experimental basis for gene therapy of HPV-associated esophageal cancer.
METHODS: The sequences of HPV18 E6 and E7 genes were retrieved from GenBank, and shRNAs for HPV18 E6 and E7 genes were designed, synthesized and cloned into an adenovirus plasmid (shpAd/PL-Dest) to result in the E6/-shRNA expression vectors shpAd-E6/E7-eGFP.The recombinant expression vectors were identified by restriction enzyme digestion, PCR and sequence analysis. After verification, the two vectors were transfected into HEK293A cells to obtain HPV18 E6 and E7 adenoviral expression vectors.
RESULTS: Enzyme digestion analysis of shpAd-E6-eGFP and shpAd-E7-eGFP adenovirus vectors showed positive results. The two adenovirus vectors were transfected into HEK293A cells successfully.
CONCLUSION: The adenoviral expression vectors carrying shRNAs targeting HPV18 E6 and E7 have been constructed successfully.
- Citation: Li G, Feng B, Deng YC, Li DS, Julaiti·Ainiwaer, Zhang LW. Construction and identification of recombinant adenovirus expression vectors expressing short hairpin RNAs targeting HPV18 E6 and E7. Shijie Huaren Xiaohua Zazhi 2014; 22(24): 3608-3612
- URL: https://www.wjgnet.com/1009-3079/full/v22/i24/3608.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i24.3608
人乳头瘤病毒(human papillomavirus, HPV)属于乳多空病毒科, 是一类共价双链环状DNA病毒, 他常特异感染人的皮肤、黏膜的. 按照与肿瘤发生的关系, 我们将HPV分高危型、中危型以及低危型. 有研究表明HPV16、HPV18型与宫颈癌、食管癌的发病密切相关, 所以我们常常把HPV16、HPV18归为高危型HPV. 近年来在食管癌的研究中, 高危型HPV作为生物性危险因素越来越受到研究者的重视. Jung等[1]通过体外研究证实, 高危型HPV产生的E6、E7癌蛋白可以有效导致人体细胞发生癌变, 当其与细胞周期调控因子p53[2]、pRB[3,4]相互作用时, 直接干预细胞周期进程, 在HPV诱导肿瘤形成过程中发挥极其重要的作用.
短发夹RNA(short hairpin ribonucleic acid, shRNA)是一段具有紧密发卡环(tight hairpin turn)的RNA序列, 常被用于RNA干扰沉默靶基因的表达. 利用载体把shRNA导入细胞, 载体中的U6启动子确保shRNA总是表达; 这种装载了shRNA载体可被传递到子代细胞中去, 从而使基因的沉默可被遗传. 在宫颈癌治疗中, 抑制HPV E6和E7的表达已经成为一种有效手段. RNA干扰技术能使HPV E6和E7癌基因沉默, 或者特异性的抑制HPV E6和E7癌基因的表达, 从而促使肿瘤细胞的凋亡和坏死, 对抑制肿瘤生长有着显著效果[5]. RNA干扰技术的不足之处是是转染效率低、安全性差、容量小和免疫原性强. 新型重组腺病毒载体是基因治疗中最常用的病毒载体之一[6], 其优点在于其介导的基因转移效率较高、感染细胞谱较广、病毒滴度较高, 而且浓缩和贮存方便. 有研究表明, HPV18 E6和E7与食管癌发病关系之间的关系密切[7,8]. 查阅大量文献, 有关构建了HPV18 E6、E7基因的shRNA重组腺病毒载体的文献很少. 本实验拟构建HPV18 E6和HPV18 E7基因的重组腺病毒载体(shpAd-E6-eGFP、shpAd-E7-eGFP), 开展并推广以腺病毒载体为基因转移工具的基因治疗, 为今后进行重组HPV E6和E7腺病毒对HPV相关肿瘤细胞凋亡作用的体内外实验研究打下基础.
感受态大肠杆菌DH5α、HEK293A细胞、Gateway® LRClonase® Ⅱ Plus Enzyme Mix、shpDown多克隆位点(multiple cloning site, MCS)-eGFP载体和腺病毒骨架载体pAd/PL-Dest购自Invitrogen公司; dNTP Mix、GeneRulerTM 100 bp DNA Ladder、Taq DNA Polymerase购自Fermentas公司; HpaⅠ、XhoⅠ等限制性内切酶、T4 DNA Ligase购自TAKARA公司; 总RNA提取试剂(TRIzol Reagent)、ThermoscriptTM RT-PCR System、Lipofectamine 2000、超纯质粒提取试剂盒、质粒小提试剂盒、绿色荧光蛋白(eGFP)(增强型)购自Invitrogen公司; 高糖DMEM和胎牛血清购自GIBCO公司.
1.2.1 目的基因的设计及合成: 在GenBank中检索到HPV18 E6 E7基因序列(基因编号NC_001357). 根据shRNA设计原则, 设计合成3对shRNA, 分别为E6、E7的特异性干扰序列以及阴性对照无关序列(表1), 使用美国国立生物技术信息中心(National Center of Biotechnology Information, NCBI)的数据库对阴性对照无关序列进行了序列检索.
| 名称 | 序列 |
| shRNA-E6-F' | 5'-TCACTTCACTGCAAGACATACTCGAGTATGTCTTGCAGTGAAGTGTTTTTC-3' |
| shRNA-E6-R' | 5'-TCGAGAAAAACACTTCACTGCAAGACATACTCGAGTATGTCTTGCAGTGAAGTGA-3' |
| ShRNA-E7-F' | 5'-TCCACCAACGTCACACAATGTCTCGAGACATTGTGTGACGTTGGTGGTTTTTC-3' |
| shRNA-E7-R' | 5'-TCGAGAAAAACCACCAACGTCACACAATGTCTCGAGACATTGTGTGACGTTGGTGGA-3' |
| 阴性对照-F' | 5'-TGCGCGCTTTGTAGGATTCGCTCGAGCGAATCCTACAAAGCGCGCTTTTTC-3' |
| 阴性对照-R' | 5'-TCGAGAAAAAGCGCGCTTTGTAGGATTCGCTCGAGCGAATCCTACAAAGCGC-3' |
1.2.2 真核表达载体shpDown-U6-E6-eGFP和shpDown-U6-E7-eGFP的构建: 以HPV18 E6、E7基因为模板用应酶切、PCR及DNA连接构建重组腺病毒基因沉默子. 回收酶切载体shpDown-U6-MCS-eGFP, DNA琼脂糖凝胶电泳回收试剂盒. 将上述合成的shRNA、T4 DNA ligase等加入在回收产物中, 16 ℃连接过夜, 然后将连接产物转化DH5α感受态细菌, PCR扩增以后选取阳性克隆质粒进行测序鉴定.
1.2.3重组腺病毒shpAd-E6-eGFP、shpAd-E7-eGFP质粒的构建及鉴定: 根据Gateway Technology说明书构建shpAd/PL-E6-eGFP, shpAd/PL-E7-eGFP, 提取质粒shpDown-E6-eGFP、shpDown-E7-eGFP和shpAD/PL-Dest, 用Gateway® LRClonase® Ⅱ Plus Enzyme Mix试剂盒连接shpDown-E6-eGFP与shpAd/PL-Dest. 选阳性克隆质粒进行测序鉴定.
1.2.4 重组腺病毒shpAd-E6-eGFP、shpAd-E7-eGFP的包装及纯化: PacⅠ酶切线性化腺病毒质粒, 按超纯质粒提取试剂盒说明书回收纯化, 接种HEK293A细胞到六孔板内(2×105个/孔), 培养至80%-90%融合度, 参照lipofectamine 2000说明书介导质粒DNA转染, 二者比例为1 μg:3 μL接种于六孔板内, 轻微摇晃, 37 ℃、5%CO2环境下培养过夜, 大部分细胞开始出现病变7 d之后. 当细胞病变时, 开始收集细胞和上清液. 进行反复冻融(37 ℃/-80 ℃)3次, 以裂解细胞、释放病毒. 设定初次包装好的病毒代号为P0, 随后用P0转染HEK293A细胞, 大部分的细胞出现病变时, 收集细胞和培养上清200 g离心10 min, 弃上清, 无菌PBS将沉淀细胞重悬. 反复冻融(37 ℃/-80 ℃)3次, 以裂解细胞、释放病毒, 惊醒腺病毒的扩增与浓缩, 通过TCID50法测病毒滴度.
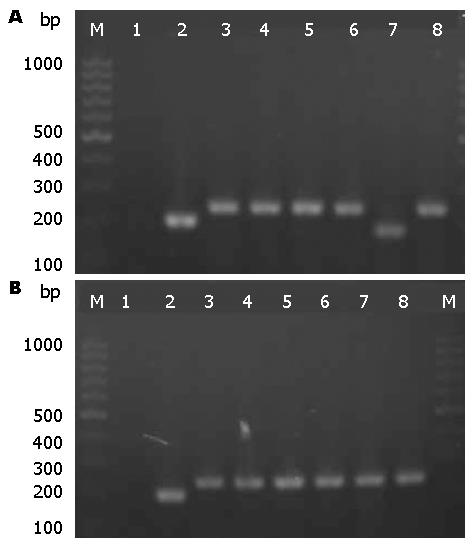
在1.5%的琼脂糖凝胶电泳中, PCR扩增片段中可以清楚地看出非阳性克隆条带比阳性克隆条带低, 与阴性对照(195 bp)相比, 阳性克隆的PCR产物片段(lane3-8)多出40 bp(图1). 成功的构建了shpDown-U6-E6-eGFP和shpDown-U6-E7-eGFP.
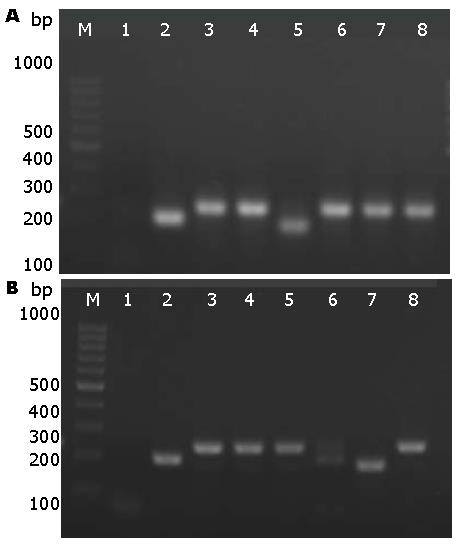
PCR扩增片段在1.5%的琼脂糖凝胶电泳中可以明显看出阳性克隆条带比非阳性条带高, 与阴性对照(195 bp)相比, 阳性克隆的PCR产物片段(lane3-8)多了40 bp(图2). 成功构建shpAd-E6-eGFP、shpAd-E7-eGFP.
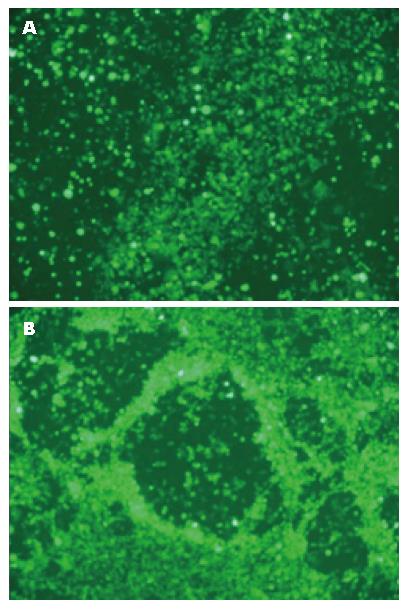
腺病毒质粒(shpAd-E6-eGFP、shpAd-E7-eGFP)转染HEK293A细胞后7 d产生明显病变, 病变细胞活力下降, 大多数细胞不能贴壁生长, 细胞内部出现空泡. 此结果表明了重组腺病毒包装成功. 在显微镜100×下观察病变观察细胞如图3. TCID50法测病毒滴度为1.26×1010 PFU/mL.
大量的研究表明, HPV与多种肿瘤发生关系密切. 在宫颈癌的研究中已得到突破性进展, 证实了HPV高度的致癌性. HPV是一种高度螺旋的环状双链DNA病毒, 含有7900 bp, 具备体积较小、结构高度螺旋的环状的特点. 通过病毒编码蛋白宿主细胞的调节蛋白与病毒的编码蛋白可形成复合物, 破坏细胞DNA修复以及有丝分裂. 高危型HPV(16、18型)E6、E7蛋白就是其可转化基因产物. 他们可干扰抑癌基因使其失去正常功能, 如p53、Rb. 有研究指出高危型HPV E6、E7是最有效的病毒癌蛋白, 与细胞的永生化以及恶性转化相关, 可能是食管肿瘤发生的重要危险因素之一. PRb蛋白与HPV18型编码的E7原癌蛋白相结合, 致使PRB蛋白高度磷酸化, 基因转录同时也进入了S期. 研究表明, 宫颈癌细胞中E6/E7-shRNA已经成功表达, 抑制作用表现突出. 郭建新等[9]成功干扰了宫颈癌细胞中HPV16型E6基因的表达, 并抑制癌细胞生长的作用. 食管与宫颈有相类似的鳞状上皮, 都是HPV易侵袭组织结构. 本研究所构建的HPV18 E6、E7基因的shRNA重组腺病毒载体为下一步食管癌细胞中E6/E7-shRNA能抑制食管肿瘤的研究提供一个重要的工具.
自20世纪90年代开始, RNA干扰(RNA interference, RNAi)引起了人们广泛的关注, RNA干扰技术同时也得到广泛发展. RNAi的作用主要是在转录、转录后、翻译等多个不同的水平上实现的. 通过抑制靶mRNA的翻译, 阻止靶蛋白表达[10]. 生物界广泛存在RNAi高效且特异的阻断基因表达方式. 有研究报道, 在多种疾病模型动物的治疗实验中, 用多种的载体将siRNA介导RNAi治疗中, 治疗效果特别明显. 灵长类动物抗病毒治疗中也显示出其可行性[11]. 美国宾夕法尼亚大学于2011年利用基因疗法, 治疗晚期慢性淋巴细胞白血病进行治疗, 获得好很的治疗效果. 再次掀起了人们对基因治疗这一新的肿瘤治疗手段的极大热情[12]. Davis等[13]更是让研究人员鼓足了信心, 在治疗肿瘤的Ⅰ期临床试验中, 他们开发的RNAi药物取得初步成功. 腺病毒基因组长约36 kb, 是一种无包膜的线性双链DNA病毒, 在自然界广泛分布, 有100多种血清型. 其两端的反向末端重复区内侧是病毒包装信号. 他不受靶细胞是否为分裂细胞限制, 而且转基因效率高, 易制成高滴度病毒载体, 瞬间表达及安全性高, 让其在进入细胞内不能整合到宿主细胞基因组. 腺病毒载体越来越多的应用在基因治疗临床试验之中, 成为最具前景的病毒载体之一.
RNAi技术在宫颈癌的基因治疗中的研究已进入临床阶段. 查阅国内外文献, 在食管癌中的研究尚且不多. 本研究将构造一个柄袢状结构的siRNA, 即shRNA, 能够从多种启动子进行表达. 比如RNAⅢ多聚酶启动子H1和U6, 在整合入shpAD-E6(E7)-eGFP后, 并跟腺病毒载体融合过程里, 产生出了稳定的转染细胞系. 因此就有了能够长久抑制蛋白质表达的可能性[14,15]. 通过采用连接腺病毒载体骨架shpAd/PL-Dest与E6 E7-siRNA的DNA片段的方法, 成功构建腺病毒表达载体E6(E7)-shRNA, 且质粒shpAd-E6(E7)-eGFP中因含有GFP, 在转染、包装HEK293A后, 通过荧光显微镜能很方便的得到检测. 本实验成功设计两条E6(E7)shRNA腺病毒表达载体, 但是有研究[11]显示不同位点的RNAi作用效果存在着很大的差异, 导致差异的原因至今尚不明确, 与靶位点的依赖差异、病毒RNA序列以及二级结构等可能相关. 因此, 为了确保RNAi的作用, 多数研究者建议每个基因至少选择3-4个靶位点, 这是本研究中的不足之处. 本研究为进一步阐明HPV与食管癌的关系作出了一定的贡献, 并为以后HPV相关食管癌的基因治疗打下了基础.
有研究表明人乳头瘤病毒(human papillomavirus, HPV)18 E6、E7基因与食管癌发病密切相关, 20世纪90年代开始, RNAi已引起了人们广泛的关注的同时, RNA干扰技术同时亦广泛发展.
姜春萌, 教授, 主任, 大连医科大学附属第二医院消化科
HPV18 E6、E7基因-shRNA重组腺病毒表达载体的构建为高危型HPV18感染食管的进一步研究提供了一个重要的实验工具. RNAi技术在宫颈癌的基因治疗中的研究已进入临床阶段. 在食管癌中的研究尚且不多. 本研究将构造一个柄袢状结构的siRNA, 即短发卡RNAs(shRNA), 能够从多种启动子进行表达.
目前有关HPV16 E6、E7基因-shRNA重组腺病毒表达载体的构建的文献报道相对较多, 同为食管癌、宫颈癌感染的高危型HPV16 E6、E7基因-shRNA重组腺病毒表达载体的构建很少.
RNAi技术在宫颈癌的基因治疗中的研究已进入临床阶段. 在食管癌中的研究尚且不多.
本研究将构造一个柄袢状结构的siRNA, 即短发卡RNAs(shRNA), 能够从多种启动子进行表达.
选题有意义, 实验设计方合理, 采用方法适当, 成功建立并鉴定人乳头瘤病毒(human papillomavirus, HPV)18 E6、E7基因-shRNA腺病毒表达载体, 对HPV相关的食管癌病因及治疗研究具有一定意义.
编辑: 郭鹏 电编:闫晋利
| 1. | Jung AC, Briolat J, Millon R, de Reyniès A, Rickman D, Thomas E, Abecassis J, Clavel C, Wasylyk B. Biological and clinical relevance of transcriptionally active human papillomavirus (HPV) infection in oropharynx squamous cell carcinoma. Int J Cancer. 2010;126:1882-1894. [PubMed] [DOI] |
| 2. | Sümbül AT, Akkız H, Bayram S, Bekar A, Akgöllü E, Sandıkçı M. p53 codon 72 polymorphism is associated with susceptibility to hepatocellular carcinoma in the Turkish population: a case-control study. Mol Biol Rep. 2012;39:1639-1647. [PubMed] [DOI] |
| 3. | Yu H, Huang YJ, Liu Z, Wang LE, Li G, Sturgis EM, Johnson DG, Wei Q. Effects of MDM2 promoter polymorphisms and p53 codon 72 polymorphism on risk and age at onset of squamous cell carcinoma of the head and neck. Mol Carcinog. 2011;50:697-706. [PubMed] [DOI] |
| 4. | Jiang M, Milner J. Selective silencing of viral gene E6 and E7 expression in HPV-positive human cervical carcinoma cells using small interfering RNAs. Methods Mol Biol. 2005;292:401-420. [PubMed] [DOI] |
| 5. | Ahn KS, Sethi G, Aggarwal BB. Simvastatin potentiates TNF-alpha-induced apoptosis through the down-regulation of NF-kappaB-dependent antiapoptotic gene products: role of IkappaBalpha kinase and TGF-beta-activated kinase-1. J Immunol. 2007;178:2507-2516. [PubMed] [DOI] |
| 7. | 齐 宗利, 霍 霞, 张 宝, 杨 海伟, 邱 波, 彭 琳, 沈 忠英, 徐 锡金. 食管癌EC109细胞属人类乳头瘤病毒18型阳性细胞株. 汕头大学医学院学报. 2006;19:136-153. |
| 8. | 许 丽艳, 沈 忠英, 李 恩民, 蔡 唯佳, 沈 健, 李 淳, 洪 超群, 陈 炯玉, 曾 毅. HPV E6 E7基因诱发的人胎儿食管上皮永生化和恶性转化细胞端粒长度和端粒酶活性. 癌变·畸变·突变. 2001;13:137-140. |
| 9. | 郭 建新, 李 力, 白 垚等, 程 小星, 邓 少丽, 郑 秀惠. 慢病毒携带shRNA对宫颈癌细胞中HPV16型E6表达的抑制作用. 第三军医大学学报. 2006;28:1218-1220. |
| 10. | Yokota T, Iijima S, Kubodera T, Ishii K, Katakai Y, Ageyama N, Chen Y, Lee YJ, Unno T, Nishina K. Efficient regulation of viral replication by siRNA in a non-human primate surrogate model for hepatitis C. Biochem Biophys Res Commun. 2007;361:294-300. [PubMed] [DOI] |
| 11. | Waterhouse PM, Wang MB, Lough T. Gene silencing as an adaptive defence against viruses. Nature. 2001;411:834-842. [PubMed] [DOI] |
| 12. | Porter DL, Levine BL, Kalos M, Bagg A, June CH. Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia. N Engl J Med. 2011;365:725-733. [PubMed] [DOI] |
| 13. | Davis ME, Zuckerman JE, Choi CH, Seligson D, Tolcher A, Alabi CA, Yen Y, Heidel JD, Ribas A. Evidence of RNAi in humans from systemically administered siRNA via targeted nanoparticles. Nature. 2010;464:1067-1070. [PubMed] [DOI] |
| 14. | Brummelkamp TR, Bernards R, Agami R. A system for stable expression of short interfering RNAs in mammalian cells. Science. 2002;296:550-553. [PubMed] [DOI] |
| 15. | Yu JY, DeRuiter SL, Turner DL. RNA interference by expression of short-interfering RNAs and hairpin RNAs in mammalian cells. Proc Natl Acad Sci U S A. 2002;99:6047-6052. [PubMed] [DOI] |