修回日期: 2014-06-18
接受日期: 2014-06-19
在线出版日期: 2014-08-18
目的: 探讨直肠癌组织中拓扑异构酶Ⅱ(topoisomerase Ⅱ, TopoⅡ)高表达与其淋巴结转移规律的相关性及其临床意义.
方法: 收集2008-01-30/2012-01-29于北京肿瘤医院术后诊断为直肠癌的手术石蜡标本126例, 免疫组织化学法检测126例直肠癌组织中TopoⅡ的表达情况, 分析TopoⅡ高表达与淋巴结转移之间关系.
结果: TopoⅡ高表达与直肠癌的病理分型(P = 0.007)、细胞分化程度(P = 0.004)、浸润深度(P = 0.042)及淋巴结转移(P = 0.027)均呈正相关. 而与患者性别、年龄、肿瘤部位、组织学类型、有无脉管内癌栓无关.
结论: TopoⅡ在直癌组织高表达与直肠癌淋巴结转移密切相关, 可以作为直肠癌淋巴结转移的标志物.
核心提示: 以免疫组织化学法检测126例直肠癌组织中拓扑异构酶Ⅱ(topoisomerase Ⅱ, TopoⅡ)的表达情况, 分析TopoⅡ高表达与淋巴结转移之间关系. 显示TopoⅡ高表达与直肠癌的病理分型、细胞分化程度、浸润深度及淋巴结转移均呈正相关; 而与患者性别、年龄、肿瘤部位、组织学类型、有无脉管内癌栓无关; 因此, TopoⅡ在直癌组织高表达与直肠癌淋巴结转移密切相关, 可以作为直肠癌淋巴结转移的标志物.
引文著录: 段树全, 刘琳, 赵巧燕, 步召德, 李敬, 王卫, 王虎明. TopoⅡ蛋白表达与直肠癌淋巴结转移的关系. 世界华人消化杂志 2014; 22(23): 3521-3526
Revised: June 18, 2014
Accepted: June 19, 2014
Published online: August 18, 2014
AIM: To detect topoisomerase Ⅱ (TopoⅡ) protein expression in colorectal cancer and to analyze its clinical significance.
METHODS: One hundred and twenty-six specimens were collected from patients with rectal cancer who were treated surgically from January 30, 2008 to January 29, 2012. The expression of TopoⅡ in the above specimens was detected by immunohistochemistry. The correlation between TopoⅡ expression and clinicopathologic parameters was then analyzed.
RESULTS: TopoⅡ was highly expressed in rectal cancer. TopoⅡ expression was positively correlated with rectal cancer pathological type (P = 0.007), cell differentiation (P = 0.004), depth of invasion (P = 0.042) and lymph node metastasis (P = 0.027), but not with sex, age, tumor location, histological type, or vascular thrombosis.
CONCLUSION: TopoⅡ is highly expressed in rectal cancer. TopoⅡ expression is closely associated with lymph node metastasis of rectal cancer, and can be used as a marker for lymph node metastasis of rectal cancer.
- Citation: Duan SQ, Liu L, Zhao QY, Bu ZD, Li J, Wang W, Wang HM. Relationship between TopoⅡ protein expression and lymph node metastasis in rectal cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(23): 3521-3526
- URL: https://www.wjgnet.com/1009-3079/full/v22/i23/3521.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i23.3521
直肠癌是常见的消化系恶性肿瘤之一. 近年来, 随着外科医师对直肠癌全直肠系膜切除手术(total mesorectal excision, TME)的认识、放化疗疗效的提升、医疗器械的发展以及综合治疗模式的变化, 特别是临床多学科综合治疗团队(multidisciplinary team, MDT)的出现, 使直肠癌治疗观念方面发生了巨大的变化, 对直肠癌的诊断治疗及预后也有了很大的进步, 但目前其发病率和死亡率仍然呈逐渐上升的趋势. 直肠癌难以治愈且复发率高, 其5年生存率仅为62.3%, 根治术后局部复发率甚至高达50%[1,2]. 据统计, 导致其复发的主要因素主要是淋巴结转移和肿瘤的耐药性[3]. 因此, 研究分析直肠癌淋巴结转移规律和肿瘤耐药蛋白的表达相关性对于进行合理的淋巴结清扫和制定化疗方案以及判断预后都具有十分重要的临床意义. 基于上述问题, 本研究选择直肠癌患者术后病理为研究对象, 对其临床资料进行回顾性分析, 研究直肠癌淋巴结转移的规律, 阐述拓扑异构酶Ⅱ(topoisomerase Ⅱ, TopoⅡ)在直肠癌中表达的意义, 从淋巴结转移规律和化疗耐药性角度来阐述直肠癌个体化治疗的必要性.
选取2008-01-30/2012-01-29于北京肿瘤医院胃肠肿瘤外科术后诊断为直肠癌的患者126例, 男65例, 女61例, 年龄28-86岁, 中位年龄59岁. 纳入标准: 术前未接受放化疗、非双原发癌、既往无恶性肿瘤病史、均未发生远处转移的直肠癌患者, 所有入选患者均一期行手术治疗. 手术方式均为TME下的"直肠癌低位前切除(low anterior resection, LAR)或腹会阴联合切除术(abdominal-perineal resection, APR)", 该组病例中并无"经肛局部切除术"患者. 术中视具体情况行肠系膜动脉(inferior mesenteric artery, IMA)根部进行结扎(高位结扎)或直肠上动脉起始部结扎(低位结扎). TopoⅡ兔抗人单克隆抗体试剂盒, 对二甲氨基偶氮苯(DAB)显色剂, 均购自福州迈新生物技术开发公司. BP121S型分析天平、病理石蜡切片机、电热恒温培养箱、低温冰箱、医用烧烤微波炉、自动染片机、自动脱水机、微量吸管、光学显微镜、镜下图像以Olympus Dp70图像采集分析仪进行采集、分析.
1.2.1 分组: 按照2013版美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)指南直肠癌浸润分法和淋巴结分站法. 肿瘤浸润深度: T1肿瘤侵犯黏膜下层, T2肿瘤侵犯固有肌层, T3肿瘤穿透固有肌层到达结直肠旁组织, T4a肿瘤穿透腹膜脏层, T4b肿瘤直接侵犯或黏连于其他器官或结构; 淋巴结转移: N0无区域淋巴结转移, N1有1-3枚区域淋巴结转移, N2有4枚以上区域淋巴结转移; 根据淋巴结分布位置分为: 肠周组(直肠周围淋巴结和肠系膜淋巴结)和IMA组(肠系膜下血管根部淋巴结); 分化程度: 高分化、中分化、低分化, 印戒细胞癌、液细胞癌统一划分为低分化腺癌组. 年龄分组: 中、青年组≤60岁, 老年组>60岁. 中低位直肠距肛缘≤10 cm, 上段直肠11-15 cm.
1.2.2 免疫组织化学检测(TopoⅡ阳性表达): 免疫组织化学染色采用EnVision二步法: 组织标本经常规40 g/L甲醛固定, 石蜡包埋, 4 μm切片. 切片经二甲苯脱蜡和梯度乙醇脱水, EDTA缓冲液冲洗, 微波炉孵育抗原修复10 min. 0.5%H2O2阻断内源性过氧化物酶. PBS液清洗, 加入兔抗人TopoⅡ单克隆抗体, 4 ℃保存孵育过夜. 切片经PBS冲洗后滴加生物素化二抗, 37 ℃下孵育60 min. DAB显色, 苏木素复染, 干燥后树胶封固, 镜检.
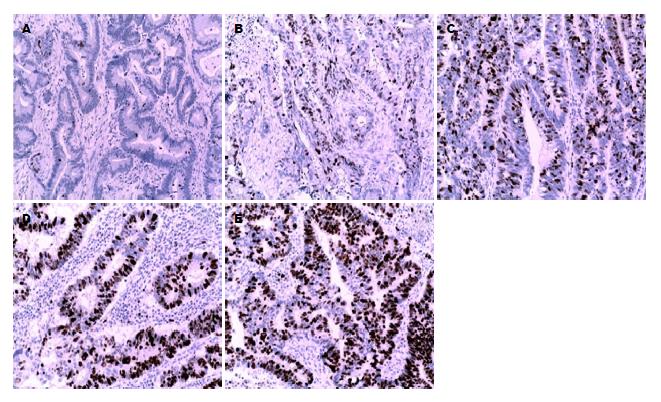
1.2.3 结果判定标准: TopoⅡ阳性表达主要见于细胞核, 依据细胞核有棕黄色颗粒样沉淀为阳性判定, 染色细胞数所占比例分为无阳性细胞或阳性细胞数<25%记为-/+, 阳性细胞数为25%-50%记为2+, 阳性细胞数为50%-75%记为3+, 阳性细胞数≥75%记为4+. -/+为表达减弱或缺失, 2+、3+、4+为表达强阳性.
统计学处理 采用SPSS19.0软件进行统计分析. 计数资料采用χ2检验和Fisher精确概率法检验. P<0.05为差异有统计学意义.
细胞核有棕黄色颗粒样沉淀为阳性判定, 依据棕黄色细胞数所占比例分为-/+、2+、3+、4+等(图1).
本组资料中62例发生淋巴结转移, 转移率为49.2%, 46例检查有IMA组淋巴结, 有4例存在IMA组淋巴结阳性, 阳性率为8.7%, 占总例数的3.2%. 淋巴结转移与肿瘤浸润深度和有无脉管内癌栓显著相关(P = 0.020, P = 0.012)(表1), 差异有统计学意义. 与年龄、性别、部位、病理分型、组织类型及分化程度无统计学意义, 但本资料发现淋巴结转移与肿瘤分化程度有关系, 分化程度越差, 阳性率越高. 溃疡型比隆起型淋巴结转移阳性率高.
| 临床病理因素 | 肠周淋巴结转移 | P值 | |
| 阴性 | 阳性 | ||
| 性别 | 0.062 | ||
| 男性 | 38(58.5) | 27(41.5) | |
| 女性 | 25(41.0) | 35(57.4) | |
| 年龄(岁) | 0.247 | ||
| <60 | 36(55.4) | 29(44.6) | |
| ≥60 | 27(44.3) | 33(54.1) | |
| 部位 | 1.000 | ||
| 上段 | 40(50.0) | 39(48.8) | |
| 中下段 | 22(51.2) | 21(48.8) | |
| 病理分型 | 0.423 | ||
| 隆起型 | 16(61.5) | 10(38.5) | |
| 溃疡型 | 47(47.5) | 51(51.5) | |
| 组织类型 | 0.094 | ||
| 腺癌 | 62(52.5) | 55(46.6) | |
| 黏液腺癌及其他 | 1(12.5) | 7(87.5) | |
| 分化程度 | 0.518 | ||
| 高分化 | 3(60.0) | 2(40.0) | |
| 中分化 | 57(51.4) | 53(47.7) | |
| 低分化 | 3(30.0) | 7(70.0) | |
| 浸润深度 | 0.020 | ||
| T1 | 2(100.0) | 0(0.0) | |
| T2 | 14(82.4) | 3(17.6) | |
| T3 | 12(50.0) | 12(50.0) | |
| T4 | 35(42.2) | 47(56.6) | |
| 脉管癌栓 | 0.012 | ||
| NO | 58(55.2) | 46(43.8) | |
| YES | 5(23.8) | 16(76.2) | |
本组资料中TopoⅡ表达阳性率为66.7%. TopoⅡ表达与病理分型(P = 0.007)、分化程度(P = 0.004)、浸润深度(P = 0.042)及淋巴结转移(P = 0.027)均显著相关(表2). 与患者性别、年龄、肿瘤部位、组织学类型、脉管内癌栓无关; 而且与分化程度、淋巴结转移及浸润深度呈正相关. 溃疡型比隆起型表达增强.
| 临床病理因素 | TopoⅡ | P值 | |
| -/+ | 2+/3+/4+ | ||
| 性别 | 0.101 | ||
| 男性 | 26(40.0) | 39(60.0) | |
| 女性 | 16(26.2) | 45(73.8) | |
| 年龄(岁) | 0.900 | ||
| ≤60 | 22(33.8) | 43(66.2) | |
| >60 | 20(32.8) | 41(67.2) | |
| 部位 | 0.894 | ||
| 上段 | 27(33.8) | 53(66.2) | |
| 中下段 | 14(32.6) | 41(67.4) | |
| 病理分型 | 0.007 | ||
| 隆起型 | 3(11.5) | 23(88.5) | |
| 溃疡型 | 39(39.4) | 60(60.6) | |
| 组织学类型 | 0.718 | ||
| 腺癌 | 40(33.9) | 78(66.1) | |
| 黏液腺癌其他 | 2(25.0) | 6(75.0) | |
| 分化程度 | 0.004 | ||
| 高分化 | 4(80.0) | 1(20.0) | |
| 中分化 | 38(34.2) | 73(65.8) | |
| 低分化 | 0(0.0) | 10(100.0) | |
| 浸润深度 | 0.042 | ||
| T1 | 2(100.0) | 0(0.0) | |
| T2 | 8(47.1) | 9(52.9) | |
| T3 | 10(41.7) | 14(58.3) | |
| T4 | 22(26.5) | 61(73.5) | |
| 脉管癌栓 | 0.310 | ||
| 无 | 37(35.2) | 68(64.8) | |
| 有 | 5(23.8) | 16(76.2) | |
| 淋巴结转移 | 0.027 | ||
| N0 | 27(42.2) | 37(57.8) | |
| N1 | 9(28.1) | 23(71.9) | |
| N2 | 6(20.0) | 28(80.0) | |
直肠癌的淋巴结清扫范围在学术界上一直是一个争论的话题, 究竟如何行直肠癌周围淋巴结清扫国内外的医师学者一直有自己的观点. 直肠淋巴循环有上方、侧方及下方3种引流途径, 远端直肠癌能向上方和侧方的淋巴结转移, 但是近端直肠癌几乎只向上方转移[4]. 上方淋巴引流收集上、中、下段直肠淋巴引流, 沿直肠上动脉引流至肠系膜下动脉(inferior mesenteric artery, IMA)旁淋巴结, 其径路从肠壁内末梢淋巴管至肠壁淋巴结开始, 沿肠系膜、系膜血管根部及系膜上下血管、腹主动脉周围至乳糜池及胸导管, 是直肠最主要的淋巴引流途径, 也是进展期直肠癌的最主要转移途径[5]. 本组资料淋巴结的转移与肿瘤浸润深度及有无脉管癌栓显著相关. 与肿瘤分化程度相关, 分化程度越差, 阳性率越高, 本结果与Tsai等[6]的研究一致. 因为直肠黏膜层和黏膜下层无淋巴组织, 或淋巴管分布很少, 所以肿瘤浸润至T1的淋巴结转移的发生率很低, 但随着肿瘤向肠壁的深层浸润, 淋巴管数目增加并互相吻合成网, 肿瘤细胞接触淋巴管的机会增加. 因此, 淋巴结发生转移概率增加[7], 本资料中浸润至T1的病理中无阳性淋巴结. 另外本组资料中印戒细胞癌及黏液腺癌发生淋巴结转移的几率明显大于腺癌, 溃疡型比隆起型淋巴结转移阳性率高, 原因可能为黏液腺癌和印戒细胞癌多为浸润性生长, 管状腺癌多为溃疡型或隆起型生长[8]. 隆起型的肿瘤主要向肠腔内生长, 侵袭力较弱; 而溃疡型的肿瘤呈浸润性生长, 侵袭力较强, 容易突破肠壁, 与淋巴管接触的面积更大, 时间更长, 则更容易发生淋巴结转移[9,10].
是否常规行肠系膜根部淋巴结清扫也是一争论的问题, 最简而易行的方法是IMA高位结扎, 是指在IMA自腹主动脉发出部位结扎, 低位结扎是指在左结肠动脉水平以下结扎. 但诸多学者对高位结扎的态度依然褒贬不一, 国内大部分腹腔镜辅助直肠癌手术经常行高位结扎, 因为在断血管方面降低了手术难度, 同时有利于无张力低位吻合[11], 还有利于其根部淋巴结整块切除, 可以获得更高的淋巴结检出率[12], 但另一些学者认为高位结扎会造成乙状结肠血供下降, 增加手术难度和风险[13]. 本组资料IMA旁淋巴转移率为3.2%, 与文献报道的0.7%-14.4%相符[14], 我们认为不需常规清扫IMA组淋巴结, 但对肿瘤分化差, 浸润深度达T3、T4的患者清扫是有必要的[15]. 所以有学者提出对直肠癌淋巴结清扫实行个体化治疗原则, 应根据手术技术的需要和患者的个体情况决定[16]. 另外侧方淋巴结清扫问题也一直是各家争论不休的话题, 西方有学者认为侧方淋巴结转移已是远处转移, 清扫后并不能延长患者生存期[17], 另外侧方淋巴结清扫后会增加术后并发症的发生, 近年来由于放化疗的治疗进展, 治疗效果的提升, 对侧方淋巴结清扫的观点提及渐少.
Topo包括TopoⅠ和TopoⅡ两种, TopoⅡ具有两种功能, 一是作为反应细胞增殖的指标, 表达于S2、G2/M期, 高表达时使肿瘤复制加快, 增加肿瘤的恶性程度, 临床方面已逐渐将TopoⅡ作为判断细胞或肿瘤增殖程度的一个标志[18]. 本研究中TopoⅡ的阳性表达与直肠癌组织的分化程度、淋巴结转移及浸润深度相关, 低分化者表达显著高于高中分化, 直肠癌T分期越晚其表达越高, 提示组织分化越差, 分期越晚, 说明其恶性程度高, 细胞增殖活跃, 存在于S2、G2/M期的TopoⅡ量多, 阳性率就高. 本组资料中溃疡型比隆起型直肠癌表达增强, 因为溃疡型恶型程度高于隆起型. 本资料结果中TopoⅡ的表达与淋巴结转移呈正相关, 提示TopoⅡ可以作为直肠癌淋巴结转移的标志物. 既往已有学者报道, TopoⅡ与胃癌、肺癌、乳腺癌及结直肠癌的淋巴结转移均有相关性[19-21].
另外TopoⅡ是一重要的核酶影响着化疗的效果越来越受到人们的关注, TopoⅡ可作为抗癌药物(如蒽环类抗生素、足叶乙甙、替尼泊甙)的作用靶点[22], 细胞内TopoⅡ水平下降直接影响TopoⅡ抑制剂的抗肿瘤活性, TopoⅡ含量和活性的降低可导致肿瘤细胞产生耐药[23,24]. 本资料提示对于直肠癌发生淋巴结转移而TopoⅡ表达阳性的患者, 应当鼓励给予以TopoⅡ为靶点的化疗药物, 可能能得到更好的治疗效果.
总之, 鉴于本资料和相关资料的报道TopoⅡ与直肠癌淋巴结转移显著相关, 我们认为TopoⅡ可以作为直肠癌淋巴结转移的标志物, 直肠癌的治疗是多方面的, 我们既要充分认识到手术的重要性, 又要合理选择相应敏感的化疗药物, 期望在临床工作中做到更为合理的个体化治疗, 为肿瘤患者带来更大的受益.
拓扑异构酶Ⅱ(topoisomerase Ⅱ, TopoⅡ)在增殖细胞中的分布和定位比较准确, 能比较准确地反映细胞的增生状态, TopoⅡ是一重要的核酶影响着化疗的效果, 越来越受到人们的关注, TopoⅡ可作为抗癌药物的作用靶点, 细胞内TopoⅡ水平下降直接影响TopoⅡ抑制剂的抗肿瘤活性, TopoⅡ含量和活性的降低可导致肿瘤细胞产生耐药.
姚登福, 教授, 南通大学附属医院.
TopoⅡ是调节DNA构象动态变化的关键性核酶也被认为是肿瘤细胞增殖的一个特异性标志, 在恶性肿瘤中起着非常重要的生物学作用.
TopoⅡ在直肠癌中的表达与其淋巴结转移规律在以往的资料文献中报道相对较少, 本文以相对充足的病例数来阐述TopoⅡ的表达与淋巴结转移规律的关系.
TopoⅡ在直癌组织高表达与直肠癌淋巴结转移密切相关, 可以作为直肠癌淋巴结转移的标志物.
本文具有一定的临床参考价值.
编辑 田滢 电编 都珍珍
| 1. | Rosenberg R, Friederichs J, Schuster T, Gertler R, Maak M, Becker K, Grebner A, Ulm K, Höfler H, Nekarda H. Prognosis of patients with colorectal cancer is associated with lymph node ratio: a single-center analysis of 3,026 patients over a 25-year time period. Ann Surg. 2008;248:968-978. [PubMed] [DOI] |
| 2. | Lim YK, Law WL, Liu R, Poon JT, Fan JF, Lo OS. Impact of neoadjuvant treatment on total mesorectal excision for ultra-low rectal cancers. World J Surg Oncol. 2010;8:23. [PubMed] [DOI] |
| 3. | Labialle S, Gayet L, Marthinet E, Rigal D, Baggetto LG. Transcriptional regulators of the human multidrug resistance 1 gene: recent views. Biochem Pharmacol. 2002;64:943-948. [PubMed] |
| 4. | Chang HC, Huang SC, Chen JS, Tang R, Changchien CR, Chiang JM, Yeh CY, Hsieh PS, Tsai WS, Hung HY. Risk factors for lymph node metastasis in pT1 and pT2 rectal cancer: a single-institute experience in 943 patients and literature review. Ann Surg Oncol. 2012;19:2477-2484. [PubMed] [DOI] |
| 6. | Tsai HL, Cheng KI, Lu CY, Kuo CH, Ma CJ, Wu JY, Chai CY, Hsieh JS, Wang JY. Prognostic significance of depth of invasion, vascular invasion and numbers of lymph node retrievals in combination for patients with stage II colorectal cancer undergoing radical resection. J Surg Oncol. 2008;97:383-387. [PubMed] [DOI] |
| 7. | Nagy VM. Updating the management of rectal cancer. J Gastrointestin Liver Dis. 2008;17:69-74. [PubMed] |
| 8. | Thorn CC, Woodcock NP, Scott N, Verbeke C, Scott SB, Ambrose NS. What factors affect lymph node yield in surgery for rectal cancer? Colorectal Dis. 2004;6:356-361. [PubMed] |
| 9. | Ishikawa Y, Akishima-Fukasawa Y, Ito K, Akasaka Y, Yokoo T, Ishii T. Histopathologic determinants of regional lymph node metastasis in early colorectal cancer. Cancer. 2008;112:924-933. [PubMed] [DOI] |
| 10. | Choi PW, Yu CS, Jang SJ, Jung SH, Kim HC, Kim JC. Risk factors for lymph node metastasis in submucosal invasive colorectal cancer. World J Surg. 2008;32:2089-2094. [PubMed] [DOI] |
| 12. | Rutegård M, Hemmingsson O, Matthiessen P, Rutegård J. High tie in anterior resection for rectal cancer confers no increased risk of anastomotic leakage. Br J Surg. 2012;99:127-132. [PubMed] [DOI] |
| 13. | Tsujinaka S, Kawamura YJ, Tan KY, Mizokami K, Sasaki J, Maeda T, Kuwahara Y, Konishi F, Lefor A. Proximal bowel necrosis after high ligation of the inferior mesenteric artery in colorectal surgery. Scand J Surg. 2012;101:21-25. [PubMed] |
| 14. | Kanemitsu Y, Hirai T, Komori K, Kato T. Survival benefit of high ligation of the inferior mesenteric artery in sigmoid colon or rectal cancer surgery. Br J Surg. 2006;93:609-615. [PubMed] |
| 15. | Steup WH, Moriya Y, van de Velde CJ. Patterns of lymphatic spread in rectal cancer. A topographical analysis on lymph node metastases. Eur J Cancer. 2002;38:911-918. [PubMed] |
| 17. | McClendon AK, Osheroff N. DNA topoisomerase II, genotoxicity, and cancer. Mutat Res. 2007;623:83-97. [PubMed] |
| 18. | Georgiou P, Tan E, Gouvas N, Antoniou A, Brown G, Nicholls RJ, Tekkis P. Extended lymphadenectomy versus conventional surgery for rectal cancer: a meta-analysis. Lancet Oncol. 2009;10:1053-1062. [PubMed] [DOI] |
| 19. | Campiglio M, Somenzi G, Olgiati C, Beretta G, Balsari A, Zaffaroni N, Valagussa P, Ménard S. Role of proliferation in HER2 status predicted response to doxorubicin. Int J Cancer. 2003;105:568-573. [PubMed] |
| 20. | Varis A, Wolf M, Monni O, Vakkari ML, Kokkola A, Moskaluk C, Frierson H, Powell SM, Knuutila S, Kallioniemi A. Targets of gene amplification and overexpression at 17q in gastric cancer. Cancer Res. 2002;62:2625-2629. [PubMed] |
| 21. | Wikman H, Kettunen E, Seppänen JK, Karjalainen A, Hollmén J, Anttila S, Knuutila S. Identification of differentially expressed genes in pulmonary adenocarcinoma by using cDNA array. Oncogene. 2002;21:5804-5813. [PubMed] |
| 23. | Albadine R, Wang W, Brownlee NA, Toubaji A, Billis A, Argani P, Epstein JI, Garvin AJ, Cousi R, Schaeffer EM. Topoisomerase II alpha status in renal medullary carcinoma: immuno-expression and gene copy alterations of a potential target of therapy. J Urol. 2009;182:735-740. [PubMed] [DOI] |
| 24. | Heisig P. Type II topoisomerases--inhibitors, repair mechanisms and mutations. Mutagenesis. 2009;24:465-469. [PubMed] [DOI] |