修回日期: 2014-06-05
接受日期: 2014-06-11
在线出版日期: 2014-08-18
目的: 观察梗阻性黄疸(obstructive jaundice, OJ)患者肠黏膜瘦素(leptin, Lp)、瘦素受体(leptin receptor, Ob-R)、肠黏膜细胞增殖与凋亡的变化, 分析肠黏膜Lp和Ob-R表达变化与梗阻性黄疸患者肠黏膜损害的关系.
方法: 收集滨州医学院附属医院肝胆外科2012-03/2013-07因梗阻性黄疸住院手术治疗患者30例为实验组(OJ组); 根据血清总胆红素浓度, 再将实验组分为轻度黄疸组(≤171 μmol/L, OJ1组, n = 17)、中重度黄疸组(>171 μmol/L, OJ2组, n = 13); 非黄疸患者21例为对照组. 免疫组织化法(immunohistochemical method, IHC)检测空肠黏膜中Lp、Ob-R以及象征细胞增殖的Ki67的表达, TUNEL法检测肠黏膜细胞凋亡, HE染色测量肠绒毛高度、隐窝深度.
结果: 实验组空肠黏膜Lp和Ob-R表达低于对照组(Lp: 1.63±1.25, 2.48±1.25, P<0.05; Ob-R: 2.63±1.27, 3.90±1.00, P<0.05), 肠黏膜Lp和Ob-R与肠黏膜细胞增殖呈正相关, 与凋亡呈负相关.
结论: 梗阻性黄疸患者肠黏膜Lp和Ob-R表达减少与肠黏膜细胞增殖、凋亡有关, Lp对梗阻性黄疸患者肠黏膜屏障的稳定起到一定作用.
核心提示: 梗阻性黄疸时患者肠黏膜瘦素(leptin, Lp)和瘦素受体(leptin receptor, Ob-R)的表达减少, 这种表达的变化与肠黏膜细胞的增殖减少、凋亡增加有明显的相关性. 根据Lp在肠道中多种生理功能推测, 梗阻性黄疸时, 患者肠黏膜Lp和Ob-R表达的减少参与肠黏膜屏障功能的损害.
引文著录: 郭松, 陈强谱, 林绪涛, 张帆, 张兴元. 梗阻性黄疸患者肠黏膜瘦素及其受体表达变化与肠黏膜细胞增殖、凋亡的关系. 世界华人消化杂志 2014; 22(23): 3510-3516
Revised: June 5, 2014
Accepted: June 11, 2014
Published online: August 18, 2014
AIM: To investigate the changes in leptin (Lp)/leptin receptor (Ob-R) expression, and cell proliferation and apoptosis in the small intestinal mucosa of patients with obstructive jaundice (OJ), and to analyze their relationship.
METHODS: Thirty patients with OJ treated at our hospital from March 2012 to July 2013 were selected as the experimental group. They were further divided into a mild jaundice subgroup ( ≤ 171 μmol/L, OJ1 subgroup, n = 17) and a moderate to severe jaundice subgroup ( > 171 μmol/L, OJ2 subgroup, n = 13). Twenty-one patients without OJ were selected as negative controls. Immunohistochemistry was performed to detect he expression of Lp, Ob-R and Ki67 in the intestinal mucosa, TUNEL was used to detect the apoptosis of intestinal mucosal cells, and the intestinal villus height and crypt depth were measured by HE staining.
RESULTS: The expression of Lp and Ob-R in the small intestinal mucosa of patients with OJ was significantly lower than that in the control group (Lp: 1.63 ± 1.25, 2.48 ± 1.25, P < 0.05; Ob-R: 2.63 ± 1.27, 3.90 ± 1.00, P < 0.05). Lp/Ob-R expression was positively correlated with proliferation of intestinal epithelial cells, but negatively correlated with apoptosis.
CONCLUSION: There is a significant correlation between the expression of intestinal mucosa Lp/Ob-R and intestinal mucosal cell proliferation and apoptosis. Lp exerts positive effects in the small intestinal mucosa of patients with OJ.
- Citation: Guo S, Chen QP, Lin XT, Zhang F, Zhang XY. Relationship between changes in intestinal mucosal leptin/leptin receptor expression and proliferation and apoptosis of intestinal mucosal cells in patients with obstructive jaundice. Shijie Huaren Xiaohua Zazhi 2014; 22(23): 3510-3516
- URL: https://www.wjgnet.com/1009-3079/full/v22/i23/3510.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i23.3510
梗阻性黄疸(obstructive jaundice, OJ)也称外科黄疸, 是临床常见的病理状态. 梗阻性黄疸时, 肠黏膜屏障受损, 肠道细菌移位, 产生肠源性内毒素血症及全身炎症反应综合征, 严重者可导致多器官功能障碍. 瘦素(leptin, Lp)是由肥胖基因(Ob基因)编码的产物, 是一种具有167个氨基酸的蛋白质; 其主要生理功能为抑制摄食、增加能量消耗、维持正常的血脂代谢等. 随着研究的深入, 人们开始认识到Lp在内分泌系统外的广泛生物学效应, 包括调节生长发育, 调节炎症反应、免疫功能, 促进创伤修复, 促上皮细胞生长, 保护消化系统功能等. 肠道Lp和瘦素受体(leptin receptor, Ob-R)的发现, 揭示Lp可能作为一种新的肠道激素, 在肠道功能和肠黏膜屏障中具有重要的作用. 已有报道证实, Lp在甲氨蝶呤、肠缺血再灌注所引起的肠道损伤中起到保护作用[1,2], 并且能够改善短肠综合征大鼠剩余肠道的适应性[3]. 目前, 梗阻性黄疸患者肠道Lp和Ob-R表达变化与肠黏膜细胞增殖及凋亡的相关性研究尚未见报道, 本研究对梗阻性黄疸患者肠黏膜细胞增殖及凋亡与肠黏膜Lp和Ob-R表达变化的关系做初步探索.
经滨州医学院附属医院伦理委员会批准, 选取肝胆外科2012-03/2013-07因梗阻性黄疸行胰十二指肠切除或胆肠吻合术的患者30例(肿瘤患者21例, 结石患者8例, 胆管狭窄患者1例, 年龄58.2岁±11.4岁)为实验组(OJ组); 入选标准为血清总胆红素高于正常值5倍以上且持续1 wk以上, 无内分泌疾病、炎性肠病、严重腹泻, 过去6 mo内未使用免疫抑制剂, 未接受过放疗和化疗等. 根据患者入院后首次生化检查中血清总胆红素浓度, 再将实验组分为轻度黄疸组(≤171 μmol/L, OJ1组), 中重度黄疸组(>171 μmol/L, OJ2组). 对照组为非黄疸患者21例(行胃大部切除术者9例; 先天性胆管扩张症5例; 腹部外伤4例; 胰腺结石1例; 胰腺囊肿1例; 小肠良性肿瘤1例; 年龄54.1岁±15.1岁). 兔抗人Lp一抗、兔抗人Ob-R一抗、Ki67即用型一抗、HE染色试剂盒购自北京中杉生物技术有限公司; SABC试剂盒、DAB显色试剂盒购自武汉博士德公司; TUNEL凋亡检测试剂盒购自碧云天生物公司.
1.2.1 制作石蜡切片: 在患者手术时取大小约0.5 cm×0.5 cm×0.3 cm的空肠黏膜组织, 迅速放置于40 g/L甲醛溶液中固定, 常规石蜡包埋, 4 μm连续切片.
1.2.2 免疫组织化学染色: 采用SABC法. 石蜡切片梯度乙醇脱水, 二甲苯透明, 3%H2O2孵育10 min, PBS洗涤, 将切片置于0.01 mol/L柠檬酸盐缓冲液(pH 6.0)中微波加热修复抗原15 min, 自然冷却后滴加5%BSA封闭20 min, 滴加一抗(Lp和Ob-R 1:50)4 ℃孵育过夜; 次日将切片以PBS洗涤后, 再依次滴加生物素化二抗、SABC, 最后DAB显色, 苏木素复染, 梯度乙醇脱水, 二甲苯透明, 中性树胶封片保存. 光镜下观察并分析表达情况. 用PBS代替一抗作阴性对照.
1.2.3 TUNEL法细胞凋亡检测: 切片常规脱蜡脱水, PBS洗涤, 2%蛋白酶K 37 ℃反应20 min, PBS洗涤, 20 ℃封闭液封闭10 min, PBS洗涤, 滴加50 μL TUNEL反应液, 湿盒中37 ℃避光反应1 h, PBS洗涤, 加入50 μL转化剂-POD, 湿盒中37 ℃孵育30 min; PBS洗涤, 加入50-100 μL DAB, 室温孵育10 min, 再PBS洗涤, 封片, 在光镜下观察凋亡细胞.
1.2.4 HE染色: 石蜡切片经二甲苯脱蜡、梯度乙醇处理至水洗, 以Gill改良苏木素溶液染色、盐酸乙醇分化、稀氨水返蓝、伊红溶液染色, 再经梯度乙醇处理、二甲苯透明后, 用中性树脂封片, 采用图像采集系统观察并测量绒毛高度和隐窝深度.
1.2.5 结果判定: Lp、Ob-R结果判定及分析: Lp、Ob-R阳性物质位于黏膜细胞胞质中, 少量间质细胞亦可少量表达, 呈棕褐色着色. 在低倍镜下应用Motic医学图像分析系统(MMD6.0A)测定目标图片中阳性目标的百分率(%). 表达阴性和阳性根据细胞染色强度和染色细胞所占面积, 即两者积分之和来判断. 染色程度分为: 不着色为0分, 轻度着色为1分, 中度着色为2分, 强度着色为3分. 染色面积分为: 不染色为0, 25%以下为1分, 25%-50%为2分, 50%以上为3分. 将染色程度与染色面积积分之和为其最后得分. 得0分为阴性(-), 得2分为弱阳性(+), 得3-4分为阳性(++), 得5分及5分以上为强阳性(+++)[4]. TUNEL法细胞凋亡检测: 细胞核呈棕色着色为阳性细胞; 每张切片随机观察4个有代表意义的高倍视野, 每个视野计数100个细胞中的阳性细胞数, 取阳性细胞百分率(%)作为结果. 增殖检测结果判定和图象分析: 阳性细胞染色呈细颗粒状棕黄色分布于胞浆中, 采用Motic医学图像分析系统软件, 测定标本中阳性目标的百分率(%).
统计学处理 采用SPSS19.0统计软件进行统计分析, 计量资料以mean±SD表示. 对于非正态分布的计量资料, 组间比较采用两独立样本秩和检验; 绒毛高度、隐窝深度、增殖、凋亡与肠黏膜Lp和Ob-R间的相关性采用Spearman相关分析. P<0.05为差异有统计学意义.
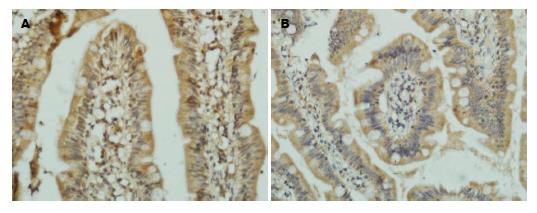
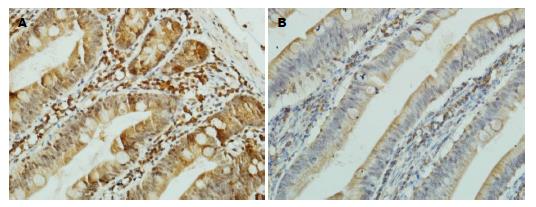
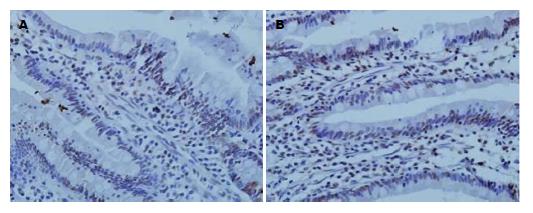
结果显示, OJ组肠黏膜组织Lp表达积分低于对照组(OJ: 1.63±1.25, 实验组: 2.48±1.25, P<0.05); OJ组肠黏膜组织Ob-R表达积分低于对照组(OJ: 2.63±1.27, 实验组: 3.90±1.00, P<0.05), OJ2组Lp表达积分低于OJ1组(OJ2: 1.00±1.15, OJ1: 2.12±1.11, P<0.05); OJ2组Ob-R表达积分低于OJ1组(OJ2: 1.77±1.30, OJ1: 3.29±0.77, P<0.05)(表1, 图1, 图2).
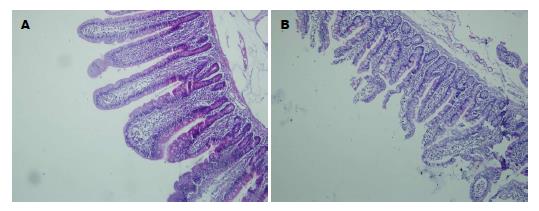
OJ组空肠黏膜厚度减小, 绒毛的数量与密度下降, 长度变短, 黏膜绒毛间质明显水肿, 隐窝深度变浅. 对照组空肠黏膜形态正常(图3). 绒毛高度和隐窝深度测量: 绒毛高度: OJ组288.89 μm±22.49 μm, 对照组318.98 μm±26.22 μm, OJ1组298.79 μm±20.22 μm, OJ2组274.10 μm±17.39 μm, 比较差异有统计学意义(P<0.05). 隐窝深度: OJ组67.46 μm±8.56 μm, 对照组75.10 μm±6.35 μm, OJ1组71.61 μm±6.93 μm, OJ2组62.04 μm±7.53 μm, 差异有统计学意义(P<0.05)(表2).
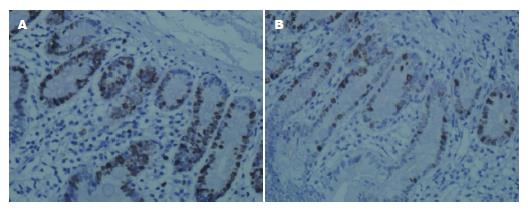
肠黏膜增殖活跃的细胞主要集中于肠黏膜隐窝处, 阳性细胞染色呈细颗粒状棕黄色分布于胞浆中(图4, 图5). OJ组增殖指数为8.43%±1.43%, 对照组为13.61%±2.41%, OJ1组9.19%±1.26%, OJ2组7.44%±0.97%, 比较差异有统计学意义(P<0.05)(表3). OJ组细胞凋亡指数较对照组明显增高21.72%±5.07%, 13.57%±3.59%, OJ1组低于OJ2组19.31%±4.38%, 24.86%±4.21%, 差异有统计学意义(P<0.05)(表3).
梗阻性黄疸状态下, 肠黏膜Lp与肠黏膜细胞增殖、凋亡以及绒毛高度、隐窝深度有显著相关性(P<0.01); 肠黏膜Ob-R与肠黏膜细胞增殖、凋亡以及绒毛高度、隐窝深度有显著相关性(P<0.01). OJ1组肠黏膜Lp与凋亡有显著相关性, 与其他指标无明显相关性; 肠黏膜Ob-R除与隐窝深度无明显相关性外, 与其他指标有相关性. OJ2组肠黏膜Lp和Ob-R与增殖、凋亡有相关性, 与其他指标无相关性(表4).
Lp是一种主要由脂肪细胞分泌的中分子活性蛋白, 是调控代谢的重要因子, 因此他在内环境失调中发挥特殊作用, 成为联系能量代谢、免疫调控和神经-内分泌三大功能系统的枢纽, 直接或间接的参与代谢反应、生长发育、免疫反应等. Lp要发挥这些重要的功能, 必然要通过与其特异性受体结合. Ob-R属于Ⅰ型细胞因子受体家族, 除脂肪组织外, 还存在于肝脏、肠道以及下丘脑等组织. 随着对肠道Lp和Ob-R研究的不断深入, 揭示Lp可能作为一种新的肠道激素, 在肠道功能和肠黏膜屏障中具有重要的作用, 参与肠道的炎症、免疫、损伤等病理过程.
肠黏膜屏障功能障碍是梗阻性黄疸关键和核心损害之一, 是由肠道菌群失调、氧化应激、肠道细胞凋亡与增殖失衡、肠黏膜萎缩、肠上皮细胞间的紧密连接被破坏所致; 进而可以引起肠道细菌移位、内毒素血症, 甚至是败血症及多脏器功能衰竭. 梗阻性黄疸时肠黏膜隐窝细胞的增殖减少以及肠黏膜细胞非正常凋亡的增加是肠黏膜屏障功能受损的关键原因. 研究发现, 梗阻性黄疸患者小肠黏膜上皮细胞增生受到明显抑制, 凋亡速度增快, 在光镜下观察到小肠黏膜厚度减小, 绒毛的数量与密度下降, 组织形态学观察肠黏膜隐窝内有丝分裂细胞减少, 凋亡的上皮细胞增加[5]. Yang等[6]报道梗阻性黄疸幼大鼠回肠黏膜结构异常, 肠黏膜明显萎缩, 黏膜绒毛脱落, 间质明显水肿, 部分上皮细胞凋亡. 本研究结果显示, OJ患者肠黏膜细胞增殖较对照组减少, 而凋亡明显增多; HE染色, 镜下见OJ组肠黏膜细胞间隙增大, 水肿明显, 黏膜萎缩变薄, 绒毛高度变短, 隐窝变浅; OJ2组与OJ1组相比, 肠黏膜的损害进一步加重; 实验结果证实OJ患者肠黏膜屏障损害与肠上皮细胞凋亡和增殖失衡有关.
Lp在肠道中的潜在作用, 推测肠道Lp可能参与梗阻性黄疸所致肠黏膜屏障功能障碍. 实验结果显示, 梗阻性黄疸患者肠黏膜Lp和Ob-R与对照组相比明显降低(P<0.05), OJ2组评分低于OJ2组, 差异有统计学意义, 随着黄疸程度的加重, 肠黏膜Lp和Ob-R表达也逐渐降低(P<0.05). 相关性分析得出, OJ组患者肠黏膜Lp和Ob-R的低表达与肠黏膜细胞增殖呈正相关, 与肠黏膜细胞凋亡呈负相关; OJ1组Lp与凋亡有相关性; OJ1组肠黏膜Ob-R和OJ2组肠黏膜Lp和Ob-R与肠黏膜细胞增殖、凋亡均具有相关性. 由此可以推测, 肠黏膜Lp可能通过信号通路参与肠黏膜细胞的增殖与凋亡.
许多研究表明, Lp可以促进小肠黏膜上皮增生, 增强细胞增殖, 减少细胞凋亡. Morton等[7]发现, Lp可诱导小鼠空肠上皮和人结肠上皮细胞株CACO-2立早基因如c-fos、c-jun的转录, 而这些基因与细胞的增殖和分化有关. Sukhotnik等[3]给予短肠综合征大鼠模型外源性Lp发现, Ob-R在短肠综合征大鼠肠黏膜隐窝显著增加, Lp能够促进肠上皮细胞的增殖、减少凋亡, 增加肠黏膜重量, 增加黏膜DNA和蛋白质, 增加绒毛高度和隐窝深度, 提高剩余肠道的适应性. Sukhotnik等[1,2]研究发现, Lp能够改善甲氨蝶呤引起的肠损伤, 减轻肠缺血再灌注引起的损害, 其研究结果显示, Lp对肠黏膜的保护作用显著. 上述研究提示Lp能够刺进肠黏膜细胞增殖、抑制凋亡, 对维护肠黏膜屏障具有重要作用.
Lp促进细胞增殖、抑制凋亡的作用机制可能经由Janus蛋白酪氨酸激酶2/信号转导和转录激活子3信号通路(janus kinase signal transducers 2/activator of transcription 3, JAK2/STAT3)、丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)、磷脂酰肌醇-3-激酶/丝苏氨酸蛋白激酶(phosphoinositide 3-kinase/protein-serine-threonine, PI3K/Akt)级联途径发挥作用[8-10]; 但这些信号传导分子间的具体顺序和相互作用在不同的细胞存在差异. 在食管上皮细胞, 细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK), p38MAPK等多条通路的激活参与调节增殖和凋亡[11]; 在肺上皮细胞, Lp可能通过激活其下游JAK/STAT途径、MAPK和PI3K发挥抗细胞凋亡作用[12]; Lp与消化系肿瘤细胞增殖、凋亡的研究中, 则涉及到JAK2, ERK和PI3K等多信号通路的共同作用[13-15]. Lp能减轻缺氧复氧培养LO2肝细胞的凋亡, 其机制可能与其下调细胞中Fas/FasL mRNA的表达有关[16]. 根据上述研究推测Lp可能通过上述信号通路协同作用于肠黏膜细胞来发挥促增殖、抗凋亡的作用, 而对其具体作用机制仍有待于进一步的研究.
总之, 本研究初步证实Lp在促进肠黏膜细胞增殖、抑制凋亡方面起作用, 梗阻性黄疸时肠黏膜Lp和Ob-R表达减少与肠黏膜屏障的损害相关; Lp在维护梗阻性黄疸患者肠黏膜屏障的完整性有积极意义. 进一步研究Lp对肠黏膜细胞增殖、凋亡的作用将有助于我们了解梗阻性黄疸肠黏膜损伤的发生机制, 并有可能探索通过改变Lp或Ob-R的功能来维护梗阻性黄疸患者的肠黏膜屏障功能.
研究表明, 瘦素(1eptin)参与调节能量代谢、调节生长发育、免疫功能、促上皮细胞、血管生长、促进创伤修复、保护消化系统功能等, 这提示瘦素是与创伤修复密切相关的代谢因子. 探讨梗阻性黄疸时瘦素及其受体在肠道内的表达变化及其与肠黏膜细胞增殖、凋亡之间的关系, 为利用以瘦素为核心的调控网络对梗阻性黄疸所致肠黏膜屏障损害进行干预提供了理论依据.
崔云甫, 教授, 哈尔滨医科大学第二附属医院普外一科.
肠道是营养吸收、能量代谢的重要器官. 国内外尚未见瘦素与梗阻性黄疸所致的肠黏膜细胞增殖与凋亡失衡相关联的报道. 同时. 由于瘦素可能参与损伤后内环境紊乱的恢复过程. 研究瘦素在梗阻性黄疸介导的肠黏膜损伤中的变化. 成为证明瘦素是否对梗阻性黄疸所致肠黏膜损伤发挥保护效应的一个主要环节.
目前认为梗阻性黄疸时肠黏膜屏障的损伤机制包括肠黏膜细胞增殖减少、凋亡增多, 肠黏膜细胞间紧密连接蛋白减少, 肠黏膜免疫功能失调等, 而瘦素与这些因素都有关联, 提示他参与调节梗阻性黄疸介导的肠黏膜屏障功能损害. 国内外相关研究也证实瘦素在肠黏膜中发挥迟缓而持续的保护效应.
本研究发现瘦素在梗阻性黄疸时的肠道内发生显著的表达变化. 肠黏膜瘦素表达水平的降低与肠道损伤存在密切联系. 提示瘦素对梗阻性黄疸时的肠道结构受损和屏障功能改善很可能扮演了抗损伤因子的重要角色.
探讨瘦素在梗阻性黄疸介导的肠黏膜屏障损伤中的作用, 为充分利用以瘦素为核心的代谢、免疫及神经、内分泌网络进行内源性和外源性的干预, 开拓防治梗阻性黄疸所致肠黏膜屏障损伤的新方法有积极的意义.
本文旨在探讨梗阻性黄疸患者肠黏膜瘦素及其受体表达与肠黏膜细胞增殖及凋亡的关系, 结果证实梗阻性黄疸患者肠黏膜瘦素及其受体表达降低与肠黏膜细胞增殖、凋亡关系密切, 瘦素对梗阻性黄疸患者肠黏膜屏障的稳定起到一定作用.
编辑 郭鹏 电编 都珍珍
| 1. | Sukhotnik I, Mogilner JG, Shteinberg D, Karry R, Lurie M, Ure BM, Shaoul R, Coran AG. Leptin accelerates enterocyte turnover during methotrexate-induced intestinal mucositis in a rat. Cancer Biol Ther. 2009;8:899-906. [PubMed] [DOI] |
| 2. | Sukhotnik I, Helou H, Lurie M, Khateeb K, Bejar J, Coran AG, Mogilner JG, Shiloni E. The effect of leptin on intestinal recovery following ischemia-reperfusion injury in a rat. Pediatr Surg Int. 2007;23:473-478. [PubMed] [DOI] |
| 3. | Sukhotnik I, Coran AG, Mogilner JG, Shamian B, Karry R, Lieber M, Shaoul R. Leptin affects intestinal epithelial cell turnover in correlation with leptin receptor expression along the villus-crypt axis after massive small bowel resection in a rat. Pediatr Res. 2009;66:648-653. [PubMed] [DOI] |
| 4. | 刘 江奎, 冯 志杰, 杨 长青, 吴 晖, 沈 毅慧. 瘦素在人溃疡性结肠炎中的表达及作用机制研究. 胃肠病学和肝病学杂志. 2010;19:636-638. |
| 5. | Assimakopoulos SF, Scopa CD, Zervoudakis G, Mylonas PG, Georgiou C, Nikolopoulou V, Vagianos CE. Bombesin and neurotensin reduce endotoxemia, intestinal oxidative stress, and apoptosis in experimental obstructive jaundice. Ann Surg. 2005;241:159-167. [PubMed] |
| 6. | Yang ZW, Li JG, Mao XG, Sun B, Tong ZS, Sun HY, Li XR, Cong YP. Effects of recombinant human growth hormone on intestinal translocation of bacteria and endotoxin in rats with obstructive jaundice. Hepatobiliary Pancreat Dis Int. 2005;4:445-449. [PubMed] |
| 7. | Morton NM, Emilsson V, Liu YL, Cawthorne MA. Leptin action in intestinal cells. J Biol Chem. 1998;273:26194-26201. [PubMed] [DOI] |
| 8. | Gao J, Tian J, Lv Y, Shi F, Kong F, Shi H, Zhao L. Leptin induces functional activation of cyclooxygenase-2 through JAK2/STAT3, MAPK/ERK, and PI3K/AKT pathways in human endometrial cancer cells. Cancer Sci. 2009;100:389-395. [PubMed] [DOI] |
| 9. | Pérez-Pérez A, Maymó J, Dueñas JL, Goberna R, Calvo JC, Varone C, Sánchez-Margalet V. Leptin prevents apoptosis of trophoblastic cells by activation of MAPK pathway. Arch Biochem Biophys. 2008;477:390-395. [PubMed] |
| 10. | Saxena NK, Sharma D, Ding X, Lin S, Marra F, Merlin D, Anania FA. Concomitant activation of the JAK/STAT, PI3K/AKT, and ERK signaling is involved in leptin-mediated promotion of invasion and migration of hepatocellular carcinoma cells. Cancer Res. 2007;67:2497-2507. [PubMed] [DOI] |
| 11. | Buttar NS, Wang KK. Mechanisms of disease: Carcinogenesis in Barrett's esophagus. Nat Clin Pract Gastroenterol Hepatol. 2004;1:106-112. [PubMed] [DOI] |
| 13. | Pai R, Lin C, Tran T, Tarnawski A. Leptin activates STAT and ERK2 pathways and induces gastric cancer cell proliferation. Biochem Biophys Res Commun. 2005;331:984-992. [PubMed] |
| 14. | Rouet-Benzineb P, Aparicio T, Guilmeau S, Pouzet C, Descatoire V, Buyse M, Bado A. Leptin counteracts sodium butyrate-induced apoptosis in human colon cancer HT-29 cells via NF-kappaB signaling. J Biol Chem. 2004;279:16495-16502. [PubMed] |
| 15. | Russo VC, Metaxas S, Kobayashi K, Harris M, Werther GA. Antiapoptotic effects of leptin in human neuroblastoma cells. Endocrinology. 2004;145:4103-4112. [PubMed] [DOI] |