修回日期: 2014-06-19
接受日期: 2014-07-01
在线出版日期: 2014-08-18
目的: 探讨核转录因子-κB(nuclear factor-kappa B, NF-κB)在非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)发病机制中的作用并观察电针夹脊穴的疗效及作用途径.
方法: ♂Wistar实验大鼠随机分为正常组(11只)和造模组(32只), 造模组饲以高脂饮食(喂养饲料由20 g/L胆固醇、100 g/L猪油和880 g/L普通饲料混合组成)构建NAFLD大鼠模型, 8 wk后随机处死正常组1只和造模组2只, 病理组织学检查以验证造模成功. 然后将余下的造模组随机分为NAFLD模型组(15只), 电针组(15只). 电针组选取双侧胸9-12夹脊穴, 针刺后加通电针治疗仪(强度1-2 mA, 频率1.6-2.0 Hz的疏密波), 1次/d, 每次30 min, 连续治疗4 wk后处死所有动物, 观察肝组织病理学变化情况; 检测血清天冬氨酸氨基转移酶(aspartate aminotransferase, AST)、谷丙氨酸氨基转移酶(alanine aminotransferase, ALT)含量; 免疫组织化学法检测肝组织中NF-κB的表达.
结果: 与正常组比较, 模型组大鼠出现中度至重度的肝细胞脂肪变性, 肝NF-κB表达上调, 血清ALT及AST升高(P<0.05); 与模型组比较, 电针组肝组织脂肪性变得到不同程度的减轻; 肝NF-κB表达下调; 血清ALT及AST降低(P<0.05).
结论: 电针夹脊穴干预可抑制非酒精性脂肪肝NF-κB表达的上调, 改善其肝功能, 该作用可能是其治疗NAFLD的作用机制之一.
核心提示: 电针夹脊穴干预通过下调非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)模型大鼠肝核转录因子-κB的高表达, 缓解胰岛素抵抗的进展以及减弱氧化应激反应, 以此改善肝脏微循环和肝组织脂肪变程度, 恢复肝功能, 该作用可能是其治疗NAFLD的作用机制之一.
引文著录: 曾志华, 曾明慧, 周萍, 余海. 电针夹脊穴对非酒精性脂肪肝模型大鼠肝NF-κB表达及肝功能的影响. 世界华人消化杂志 2014; 22(23): 3440-3444
Revised: June 19, 2014
Accepted: July 1, 2014
Published online: August 18, 2014
AIM: To investigate the role of nuclear factor-kappa B (NF-κB) in the pathogenesis of nonalcoholic fatty liver disease (NAFLD) and to observe the effect of electroacupuncture (EA) at the Jiaji acupoints on liver NF-κB expression and liver function in NAFLD rats.
METHODS: Wistar rats were randomly divided into either a normal group (11 rats) or a model group (32 rats). Rats were fed a high fat diet (composed of 20 g/L cholesterol, 100 g/L lard and 880 g/L normal feed) to induce NAFLD. After 8 wk, one rat in each of the two groups was randomly selected and killed to verify the success of modelling. The rest rats were randomly divided into two groups: an NAFLD model group (n = 15) and an EA group (n = 15). The EA group underwent acupuncture at the bilateral Jiaji acupoints (strength 1-2 mA, frequency 1.6-2.0 Hz density wave, 30 min each time) once daily. All the animals were killed after 4 wk of treatment to observe pathological changes of the liver, measure serum levels of aspartate aminotransferase (AST) and glutamic alanine aminotransferase (ALT), and detect the expression of NF-κB in the liver tissue by immunohistochemistry.
RESULTS: Compared with the normal group, rats in the model group showed moderate to severe fatty degeneration of liver cells, up-regulated expression of hepatic NF-κB, and increased serum ALT and AST levels (P < 0.05). Compared with the model group, the EA group showed reduced liver tissue changes, down-regulated liver NF-κB expression, and decreased serum ALT and AST levels (P < 0.05).
CONCLUSION: EA at the Jiaji acupoints exerts a therapeutic effect against NAFLD possibly by inhibiting the up-regulation of NF-κB expression and improving the liver function in NAFLD rats.
- Citation: Zeng ZH, Zeng MH, Zhou P, Yu H. Influence of electroacupuncture at Jiaji acupoints on liver NF-κB expression and liver function in nonalcoholic fatty liver rats. Shijie Huaren Xiaohua Zazhi 2014; 22(23): 3440-3444
- URL: https://www.wjgnet.com/1009-3079/full/v22/i23/3440.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i23.3440
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)发病率逐年增加, 相关病因包括遗传-环境-代谢应激等因素, 其确切的发病机制尚不完全清楚, 病理上是以弥漫性肝细胞大泡性脂肪变为主要特征, 临床上包括单纯性脂肪肝(nonalcoholic fatty liver, NAFL)和由其演变发生的非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)以及脂肪性肝硬化3种类型[1]. 其发病机制尚不完全清楚, 近年研究发现核转录因子-κB(nuclear factor-kappa B, NF-κB)作为一类具有多向转录调节作用的核蛋白因子, 在NAFLD发生时表达增强, 启动炎症因子的基因转录而参与肝脏的炎性损伤[2]. 据近年临床报道[3,4], 针灸治疗NAFLD确有疗效. 我们的以往实验研究[5,6]结果证实电针治疗可改善其肝功. 但具体机制仍不十分明确. 本研究通过电针夹脊穴, 观察大鼠肝NF-κB的表达以及对肝功能的影响, 能进一步探讨电针治疗NAFLD的作用机制.
实验动物选用♂Wistar大鼠: 由重庆医科大学实验动物中心提供[动物使用许可证: SCXK(渝)2007-0001]; 胆固醇购自广州天马精细化工厂(进口分装); 猪油为市售; 天冬氨酸氨基转移酶(aspartate aminotransferase, AST)、谷丙氨酸氨基转移酶(alanine aminotransferase, ALT)试剂购自南京生物建成有限公司; NF-κB兔抗鼠购自北京福瑞生物工程公司; SABC试剂盒、DAB显色液购自武汉博士德生物工程公司; 华佗牌一次性无菌针灸针(0.30 mm×25 mm)、华佗牌电子针灸仪(SDZ-Ⅱ型)由重庆医科大学中医药学院实验室提供(购自苏州医疗用品有限公司). Allegrax-12型离心机(美国贝克曼库尔特有限公司)、UNICO 7200紫外分光光度计(龙尼柯仪器有限公司)、生物显微镜(日本Olympus公司)、加液器、图像采集系统及分析系统等设备由重庆医科大学中医药实验室和基础医学院提供.
1.2.1 动物模型制备: ♂Wistar大鼠43只, SPF级, 体质量200 g±20 g, 适应性饲养7 d, 标记后随机分为正常组11只, 造模组32只. 造模采用陈世清[7]高脂饮食法构建NAFLD大鼠模型, 喂养饲料由20 g/L胆固醇、100 g/L猪油和880 g/L普通饲料混合组成(由重庆医科大学动物实验中心按配方配制). 8 wk后随机抽取正常组大鼠1只和造模组大鼠2只脱颈处死, 取肝脏做病理组织学检查证实脂肪肝已形成. 将余下的造模组大鼠30只予以标记后再随机分为2组: NAFLD模型组15只, 电针组15只. 实验过程中对动物的处置符合中华人民共和国卫生技术部2006年颁布的《关于善待实验动物的指导性意见》.
1.2.2 各组处理: 将造模成功的大鼠予以标记后随机分为2组, 一组不做任何治疗, 为模型组(n = 15); 一组给予电针治疗, 为电针组(n = 15); 所取穴位参照《实用动物针灸手册》定位[8], 针刺方法: 置大鼠于"固定器"(重庆医科大学中医药实验室自制), 取双侧胸9-胸12夹脊穴, 穴位在脊柱正中旁开0.3 cm处, 使用规格为0.3 mm×15 mm的华佗牌无菌针灸针, 直刺至肌层, 然后接通电子针灸治疗仪, 采用强度1-2 mA, 频率1.6-2.0 Hz的疏密波[9], 疏波和密波自动交替, 保持清醒状态, 1次/d, 每次30 min, 连续"治疗"4 wk. 治疗期间, 模型组大鼠分别置入固定器中30 min, 连续4 wk. 正常组始终喂以基础饲料, 模型组和电针组继续饲以高脂饲料.
1.2.3 标本采集: 实验12 wk末, 大鼠禁食24 h, 腹腔注射20%水合氯醛(0.3 mL/100 g)麻醉, 经心脏穿刺采血, 迅速取出肝脏, 每只均于肝左叶取材3块(约1.0 cm×1.0 cm×0.3 cm), 浸泡于40 g/L中性甲醛固定, 用于病理切片和免疫组织化学切片. 所采血液于清洁塑料离心管中静置后, 在低温离心机上分离血清(3000 r/min, 10 min), 集中待测.
1.2.4 检测指标: 血清ALT、AST: 采用比色法, 严格按照试剂盒说明书进行检测. 肝组织病理及免疫组织化学检查: 取肝左叶, 40 g/L甲醛固定, 石蜡包埋、常规切片(切片厚度约4 μm), HE染色, 光镜下观察肝组织病理学改变; NF-κB表达: 肝脏以40 g/L甲醛固定后, 石蜡包埋、切片(切片厚度约4 μm), 每块组织切片3张. 采用链酶素抗生物素蛋白-过氧化酶免疫组织化学法, 二氨基联苯胺显色, 一抗NF-κB的工作浓度为1:100, 操作流程按试剂盒说明书进行. 每次实验均设阴性对照, 以PBS替代一抗. 免疫组织化学显示棕黄色或棕褐色颗粒为阳性, 每张切片最少20个高倍视野观察阳性颗粒的染色程度, 用IPP6.1免疫组织化学分析软件将图片阳性区域转换为累积光密度(IA)值的定量分析.
统计学处理 采用SPSS12.0软件包进行统计学分析, 数据结果用mean±SD表示, 组间比较选用方差分析中的SNK法. P<0.05为差异有统计学意义.
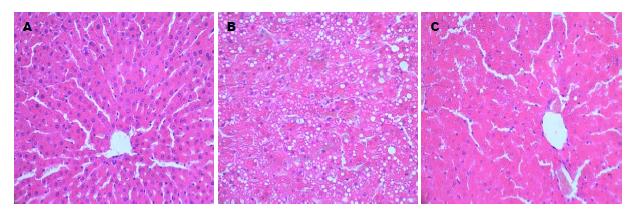
至12 wk末, 肉眼观察正常组大鼠肝色鲜红; 模型组肝脏体积增大, 颜色偏黄, 电针组大鼠肝色接近正常组. 光镜下: 正常组肝小叶结构清晰, 肝细胞形态正常, 呈放射状整齐排列; 模型组肝细胞出现中度至重度的脂肪变性, 肝索紊乱, 大量的肝细胞肿胀呈圆形, 细胞间界限不清, 胞浆内充满以大泡型为主的脂肪空泡或脂滴, 偶可见碎屑样坏死; 电针组肝脏病理形态接近正常组, 肝细胞结构趋于正常, 胞质疏松, 肝窦增宽, 极少数肝细胞内可见小脂滴, 无炎性细胞浸润. 与模型组比较, 电针组大鼠肝组织脂肪变程度和炎性损伤得到不同程度的改善(图1).
模型组与正常组比较, ALT、AST含量显著升高(P<0.05); 与模型组比较, 电针组含量显著降低(P<0.05)(表1).
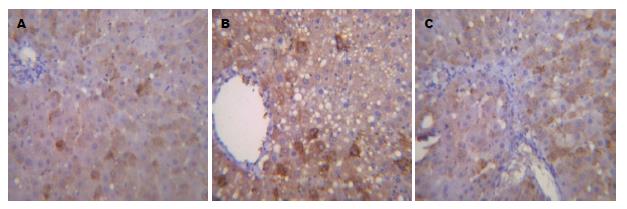
NF-κB免疫组织化学显示棕黄色或棕褐色颗粒为阳性, 正常组大鼠肝组织中NF-κB几乎未见表达, 模型组中NF-κB表达增强, 主要分布在中央静脉以及肝细胞坏死灶周围, 与模型组比较, 电针组肝组织中NF-κB的表达下调(图2).
使用IPP6.1软件对图片阳性区域进行累积光密度(IA)值测定. 与正常组(IA)值(51863.301±2943.120)比较, 模型组(IA)值(114671.591±2984.554)显著升高(P<0.01), 为强阳性表达; 与模型组比较, 电针组IA值(60302.311±2912.320)显著降低(P<0.01).
近年来, NAFLD患病率逐年增加, 引起医学和社会的密切关注[10], 目前较公认的"二次打击"学说认为: 首次打击是胰岛素抵抗(insulin resistance, IR)为主引起肝脏脂质代谢紊乱以及肝细胞脂肪变性, 增强了肝细胞对内源性和外源性损害因子的敏感性; 二次打击主要包括氧化应激、NF-κB等细胞转录因子活化等因素导致脂肪变性的肝细胞发生炎症、坏死[11]. NF-κB被激活后, 快速发生核易位, 启动炎症因子的基因转录, 加大肝脏炎症反应, 以此促进NAFLD肝炎和肝纤维化的进程.
NF-κB作为一种作用十分广泛的真核细胞转录因子, 广泛存在于多种细胞组织中, 通过调节免疫和炎症递质的表达以及炎症相关因子, 在氧化应激、免疫反应、肝组织的炎性反应、肝细胞凋亡以及再生中起重要作用[12,13]. NF-κB参与了NAFLD过程中的二次打击: NAFLD中存在的高游离脂肪酸血症引起组织蛋白酶B的释放和溶酶体失稳定, 从而导致NF-κB的活化和表达增强, 促进胰岛素受体底物损害, 造成IR的持续进展, 同时, NF-κB的活化和表达可激活肝脏枯否细胞, 释放大量活性氧和增强氧化应激, 加重肝脏的炎症反应和损伤[14]. 此外, NF-κB还可能通过诱导纤维化因子、肝星状细胞(hepatic stellate cell, HSC)的活化、cTG等基因的表达介导肝纤维化的过程[15]. 鉴于NF-κB与NAFLD的发病关系密切, 探究电针夹脊穴干预对NAFLD大鼠肝NF-κB表达的影响, 将为电针治疗NAFLD的机制提供新的理论基础.
实验结果表明, NAFLD模型大鼠肝组织病理学结果显示肝细胞出现中度至重度的脂肪变性, 免疫组织化学显示肝NF-κB表达增强, 血清ALT、AST含量上升, 提示NAFLD模型大鼠肝脏出现炎性反应和损伤, 其机制可能是由于NF-κB表达增强, 导致IR的进展以及氧化应激增强, 促进肝细胞发生炎症、坏死; 与模型组比较, 电针组大鼠脂肪变程度和炎性损伤均有不同程度的改善; 血清ALT、AST含量降低; 免疫组织化学显示肝NF-κB表达受到一定程度的抑制, 推测电针夹脊穴干预通过下调NF-κB的高表达, 缓解IR的进展以及减弱氧化应激反应, 以此改善肝脏微循环和肝组织脂肪变程度, 恢复肝功能.
NAFLD在中医学中无独立的病名, 可归属于"胁痛"、"肝着"、"积聚"等范畴. 中医认为其主要病机为肝脾气化失司、痰浊内蕴、湿邪内生, 致使后期肾精亏虚, 肝、脾、肾功能失调, 终致滞气、瘀血、痰湿相互搏结, 痹阻于肝脏脉络而成. 临床采用电针穴位治疗本病, 以达疏肝健脾、理气燥湿、活血化瘀之功, 华佗夹脊穴(简称夹脊穴)属祖国传统医学的重要组成部分, 不仅是人体最大的经外奇穴, 而且是人体与脏腑经络相互流注转输的腧穴, 他依附于足太阳膀胱经和督脉, 故有助膀胱之气, 夹督脉之阳, 疏通经脉和调理脏腑的作用. 华佗夹脊穴的这种独特的调节枢纽作用, 使其对许多疑难杂症和脏腑疾病具有较好的疗效, 越来越多的医家在临床上重视其治疗优势[16]. 局部解剖学研究也证实, 夹脊穴从分布形式上与神经节段关系非常密切, 针刺夹脊穴均可对脊神经后支以及前支产生影响, 前支因与交干相联系, 能影响交感神经, 具有调节脏腑气血的功能; 针刺夹脊穴所引起的针感传导反应, 可通过神经以及体液的调节作用, 对交感神经末梢释放的化学介质产生影响, 达到调整脏腑功能, 治疗疾病的目的[17]. 临床研究证实电针双侧T9、T10夹脊穴为主治疗NAFLD患者, 可使总胆固醇、甘油三酯、转氨酶等指标有显著改善[18]. 本次实验采用电针大鼠夹脊穴收到较好的防治NAFLD的作用, 此研究结果对临床应用电针夹脊穴治疗NAFLD有一定的参考价值.
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)发病率逐年升高. 目前临床上尚无有效的药物治疗方案, 针灸治疗NAFLD确有疗效, 但对其机制研究则相对滞后. 我们的前期实验研究证实电针可改善NAFLD大鼠肝损伤, 本实验在以往实验基础上, 继续研究电针对NAFLD的治疗机制.
迟宝荣, 教授, 吉林大学第一医院消化内科.
NAFLD的非药物治疗是目前"肝病"领域研究的热点之一, 电针对NAFLD治疗机制的研究则是近年中医药"肝病"领域研究的热点.
Grove最近报道, NF-κB在炎症和免疫反应中起枢纽作用, 调控NF-κB活性是缓解NAFLD损伤的治疗策略.
由于NF-κB与NAFLD发生发展密切相关. 本实验探讨电针夹脊穴治疗是否能降低NAFLD大鼠肝NF-κB的活性, 减轻LP反应, 减少对肝脏的炎性损伤, 实验结果对于研究电针对NAFLD的治疗机制可产生重要影响.
已有研究显示电针夹脊穴治疗NAFLD临床疗效显著, 本文探索电针夹脊穴对NAFLD大鼠NF-κB的调控以及对肝功能的影响, 研究结果可为电针夹脊穴在NAFLD的临床应用提供理论基础和参考价值.
本文设计合理, 旨在研究电针对NAFLD大鼠干预调节的微观机制, 以期为临床应用提供有力参考, 具有较好的研究价值.
编辑 田滢 电编 都珍珍
| 2. | Arkan MC, Hevener AL, Greten FR, Maeda S, Li ZW, Long JM, Wynshaw-Boris A, Poli G, Olefsky J, Karin M. IKK-beta links inflammation to obesity-induced insulin resistance. Nat Med. 2005;11:191-198. [PubMed] |
| 10. | Williams R. Global challenges in liver disease. Hepatology. 2006;44:521-526. [PubMed] |
| 11. | Lalor PF, Faint J, Aarbodem Y, Hubscher SG, Adams DH. The role of cytokines and chemokines in the development of steatohepatitis. Semin Liver Dis. 2007;27:173-193. [PubMed] |
| 12. | Cai D, Yuan M, Frantz DF, Melendez PA, Hansen L, Lee J, Shoelson SE. Local and systemic insulin resistance resulting from hepatic activation of IKK-beta and NF-kappaB. Nat Med. 2005;11:183-190. [PubMed] [DOI] |
| 13. | Ribeiro PS, Cortez-Pinto H, Solá S, Castro RE, Ramalho RM, Baptista A, Moura MC, Camilo ME, Rodrigues CM. Hepatocyte apoptosis, expression of death receptors, and activation of NF-kappaB in the liver of nonalcoholic and alcoholic steatohepatitis patients. Am J Gastroenterol. 2004;99:1708-1717. [PubMed] |
| 14. | Potoka DA, Upperman JS, Nadler EP, Wong CT, Zhou X, Zhang XR, Ford HR. NF-kappaB inhibition enhances peroxynitrite-induced enterocyte apoptosis. J Surg Res. 2002;106:7-14. [PubMed] [DOI] |
| 15. | Choudhury J, Sanyal AJ. Insulin resistance and the pathogenesis of nonalcoholic fatty liver disease. Clin Liver Dis. 2004;8:575-594, ix. [PubMed] |