修回日期: 2014-05-22
接受日期: 2014-07-01
在线出版日期: 2014-08-18
目的: 观察灭幽汤对幽门螺杆菌(Helicobacter pylori, H. pylori)相关性胃炎脾胃湿热证模型小鼠Toll样受体2(Toll-like receptor 2, TLR2)、TLR4、核转录因子-κB65(nuclear factor-kappa B 65, NF-κB65)蛋白及mRNA, 白介素(interleukin, IL)-6、IL-8表达的影响, 探讨灭幽汤治疗H. pylori相关性胃炎脾胃湿热证的机制.
方法: 将70只BALB/c小鼠随机分为对照组、模型组、高浓度灭幽汤组(高灭组)、低浓度灭幽汤组(低灭组)、胃三联组(替硝唑+克拉霉素+枸橼酸铋钾颗粒), 每组14只; 采用复合因素(肥甘食物+湿热环境+H. pylori)建立BALB/c小鼠H. pylori相关性胃炎脾胃湿热证模型; 造模成功后连续给药14 d后, 分别采用免疫组织化学检测TLR2、TLR4、NF-κB65蛋白, qPCR检测TLR2 mRNA、TLR4 mRNA、NF-κB65 mRNA的表达情况, 采用ELISA检测血清IL-6、IL-8的表达.
结果: 模型组TLR2、TLR4、NF-κB65的蛋白及mRNA、血清IL-6、IL-8含量表达均高于对照组, 差异有统计学意义; 通过药物治疗后, 低灭组、高灭组、胃三联组TLR2、TLR4、NF-κB65的蛋白及mRNA、血清IL-6、IL-8含量表达均低于模型组, 差异有统计学意义; 高灭组TLR2、TLR4、NF-κB65的蛋白及mRNA、血清IL-6、IL-8含量表达虽低于胃三联组, 但差异无统计学意义.
结论: 灭幽汤可能通过干预TLRs/NF-κB65信号通路抑制TLR2、TLR4、NF-κB65及下游因子的表达以达到治疗H. pylori相关性胃炎脾胃湿热证的目的.
核心提示: 复合因数[肥甘食物+湿热环境+幽门螺杆菌(Helicobacter pylori, H. pylori)]建立BALB/c小鼠H. pylori相关性胃炎脾胃湿热证模型. 灭幽汤可能通过干预Toll样受体/核转录因子-κB65信号通路, 达到治疗H. pylori相关性胃炎脾胃湿热证的目的.
引文著录: 王小娟, 罗燕, 喻斌, 胡淑娟, 杜中华, 尹姣, 夏蓉. 灭幽汤对幽门螺杆菌相关性胃炎脾胃湿热证模型小鼠TLRs/NF-κB65信号通路的影响. 世界华人消化杂志 2014; 22(23): 3371-3379
Revised: May 22, 2014
Accepted: July 1, 2014
Published online: August 18, 2014
AIM: To detect the gastric expression of Toll-like receptor 2 (TLR2), TLR4, nuclear factor-kappa B 65 (NF-κB65), and serum levels of interleukin-6 (IL-6) and IL-8 in mice with Helicobacter pylori (H. pylori) associated gastritis with splenogastric hygropyrexia syndrome (SGHS), and to investigate the mechanism underlying the therapeutic effect of Mieyou decoction in the treatment of chronic gastritis.
METHODS: BALB/c mouse were randomly divided into five groups: a control group, a model group, a high-concentration Mieyou decoction group, a low-concentrations Mieyou decoction group, and a triple therapy group (tinidazole, clarithromycin and bismuth potassium citrate granules), with 14 rats in each group. The BALB/c model of H. pylori-associated gastritis with SGHS using a composite method (fatness food + hygropyrexia environment + H. pylori). After the success of modeling, continuous administration 14 d. Immunohistochemistry was used to detect the expression TLR2, TLR4 and NF-κB65 proteins in gastric tissue; qPCR was used to detect the expression of TLR2, TLR4 and NF-κB65 mRNAs; ELISA was used to detect the levels of IL-6 and IL-8 in serum.
RESULTS: Compared with the control group, the expression of TLR2, TLR4, NF-κB65 proteins and mRNAs, and serum levels of IL-6 and IL-8 in the model group were significantly increased. After therapy, the expression of TLR2, TLR4, NF-κB65 proteins and mRNAs, and serum levels of IL-6 and IL-8 in the high-concentration Mieyou decoction group, low-concentration Mieyou decoction group, and triple therapy group were significantly decreased compared with the model group. The expression of TLR2, TLR4, NF-κB65 proteins and mRNAs, and serum levels of IL-6 and IL-8 in the high-concentration Mieyou decoction group were higher than those in the triple therapy group, but the differences were not statistically significant.
CONCLUSION: Mieyou decoction has a role in the treatment of H. pylori-associated gastritis with SGHS possibly by intervening the TLRs/NF-κB65 signal pathway.
- Citation: Wang XJ, Luo Y, Yu B, Hu SJ, Du ZH, Yin J, Xia R. Effect of Mieyou decoction on TLRs/NF-κB65 signal pathway in mice with Helicobacter pylori associated gastritis with splenogastric hygropyrexia syndrome. Shijie Huaren Xiaohua Zazhi 2014; 22(23): 3371-3379
- URL: https://www.wjgnet.com/1009-3079/full/v22/i23/3371.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i23.3371
慢性浅表性胃炎作为内科常见疾病之一, 发病率极高, 而幽门螺杆菌(Helicobacter pylori, H. pylori)作为消化系统常见致病菌, 是目前公认的引起胃炎、消化性溃疡、胃癌等的主要病因[1-4]. 脾胃湿热证在慢性胃炎中占首位, 研究发现H. pylori与脾胃湿热证密切相关: 湿热环境利于H. pylori生长繁殖, 在脾胃湿热证中H. pylori感染率较高, 而H. pylori在致病过程中常表现出"脾胃湿热"的症候[5,6], 故我们建立H. pylori相关性胃炎脾胃湿热证小鼠模型进行实验研究. 灭幽汤(已获得专利)是王小娟教授临床经验方, 课题组围绕灭幽汤治疗H. pylori相关性胃炎脾胃湿热证做了大量的临床和实验研究[7-14], 本实验通过研究Toll样受体2(Toll-like receptor 2, TLR2)、TLR4、核转录因子-κB65(nuclear factor-kappa B 65, NF-κB65)、白介素(interleukin, IL)-6、IL-8的变化, 进一步探讨灭幽汤治疗H. pylori相关性胃炎脾胃湿热证的作用机制, 以期为临床合理应用方药治疗H. pylori相关性胃炎脾胃湿热证提供实验依据.
8周龄SPF级BALB/c小鼠70只, 雌雄各半, 购自南京君科生物科技有限公司, 质量合格证号: SCXK(苏)2011-0003. H. pylori菌种: 悉尼标准菌株(Sydney strain 1, SSI), SSI含有细胞毒素相关基因(cagA)蛋白和空泡细胞毒素(vacA), H. pylori菌液浓度为1×109 cfu/mL, 由湖南中医药大学基础医学院病原免疫学教研室提供. 饲料: 普通饲料由湖南斯莱克景达实验动物有限公司提供, 高脂饲料(普通饲料+8%蜂蜜+12%猪油)由湖南斯莱克景达实验动物有限公司代加工. 黄芩、蒲公英、三七、白及、青皮、陈皮、乌贼骨购于湖南省药材公司饮片加工厂. 枸橼酸铋钾由丽珠医药出厂, 生产批号: 1212248. 替硝唑由山东鲁抗医药集团赛特有限责任公司出厂, 国药准字: H20033090, 生产批号: 121004. 克拉霉素由杭州中美华东制药有限公司出厂, 国药准字: H10970216, 生产批号: 121101. HHS-2电子恒温不锈钢水浴锅, 上海南阳仪器有限公司; LEICA DM LB2型双目显微镜, 德国LEICA公司; Shandon325型石蜡切片机, 英国Shandon公司; Motic B5显微摄像系统, 麦克奥迪实业集团公司. 台式冷冻离心机, Eppendorf; 荧光定量PCR仪、荧光PCR板, Thermo; 恒温水浴箱, J-MAX; 旋涡混合器, 其林贝尔; 电泳仪、水平琼脂糖电泳槽, 北京六一; -80 ℃冰箱, 中科美菱低温科技有限责任公司; 电动玻璃匀浆器, 新芝生物科技股份有限公司; 电子天平, 上海民桥精密科学仪器有限公司; 精密pH计, 上海雷磁仪器厂. 胶体金法H. pylori检测试剂盒, 艾康生物技术(杭州)有限公司, 生产批号: 201203139; TLR2抗体, 武汉博士徳生物工程有限公司(BA1716), TLR4抗体, 武汉博士徳生物工程有限公司(BA1717), NF-κB65抗体, 武汉博士徳生物工程有限公司(BA0610), 二抗试剂盒均购自北京中衫金桥生物技术有限公司(SP-9002); 逆转录试剂盒, Fermentas公司; EDTA、Tris、DEPC、E.B., Sigma公司; TRIzol, Invitrogen公司; Taq酶、DL2000 DNA Marker、dNTP, Genstar公司. 引物, 上海生物工程股份有限公司; SYBGREEN PCR Master Mix, ABI; IL-6 ELISA检测试剂盒, R&D公司(E-25764)、IL-8 ELISA检测试剂盒, R&D公司(E-07253).
1.2.1 药物制备: 灭幽汤, 经湖南中医药研究院鉴定, 符合药典标准. 药物浸泡30 min后, 加水没过药面5 cm, 武火煎至沸腾后改文火, 继续煎煮20 min, 取汁另置. 继续加水, 煎煮沸腾后, 文火续煎20 min, 取汁. 两次药汁合并后浓缩至每毫升含生药2 g, 并用离心机去除药汁中残渣, 4 ℃保存.
1.2.2 分组与造模: 将70只BALB/c小鼠按体质量随机分为5组, 雌雄各半, 分别为对照组、模型组、高浓度灭幽汤组(高灭组)、低浓度灭幽汤组(低灭组)、胃三联组, 对照组予以普通饲料饲养; 模型组、高灭组、低灭组、胃三联组予以高脂饲料饲养10 d后放入人工湿热箱(温度32 ℃±2 ℃, 湿度95%±1%)内, 继续高脂饲料喂养, 自由饮水, 于第16天以浓度为1×109 cfu/mL H. pylori混悬液0.3 mL/只灌胃. 灌胃前24 h禁食不禁水, 灌胃前4 h禁水, 灌胃后4 h给食水. 隔日接种1次, 连续接种3次, 感染后定植2 wk. 2 wk后各组随机抽取2只小鼠做病理切片观察炎症情况, 模型组、低灭组、高灭组、胃三联组各另取2只小鼠以胶体金法检测血浆H. pylori抗体, 做电镜下观察H. pylori定植情况.
1.2.3 给药及样本处理: 高灭组、低灭组、胃三联组在造模成功后开始给药, 按照小鼠与人体表面积计算比值换算公式, 计算小鼠用药剂量, 胃三联组小鼠用药剂量为279.8 mg/kg, 高浓度灭幽汤组用药剂量为12.4 g/kg, 低浓度灭幽汤组为6.2 g/kg, 每天灌胃1次, 其他组分别灌等量的蒸馏水. 给药后两周摘眼球取血, ELISA检测血清中IL-6、IL-8的含量. 脱颈椎处死所有小鼠, 将BALB/c小鼠仰卧位固定于鼠板, 迅速取出胃标本, 沿胃大弯剖开, 用冰生理盐水冲洗干净, 分别放入到盛有40 g/L甲醛溶液、4%多聚甲醛、无菌DEPC水的容器中, 备做病理检测、免疫组织化学、qRT-PCR.
1.2.4 NF-κB65、TLR2、TLR4蛋白表达的检测: 采用免疫组织化学法. 石蜡切片脱蜡至水, 蒸馏水冲洗, PBS浸泡5 min. 0.01 mol/L枸橼酸钠缓冲液(pH 6.0)中微波炉加热修复抗原. 3%H2O2室温孵育10 min, PBS冲洗, 5 min×3次. 10%正常山羊血清封闭, 室温孵育10 min. 倾去血清, 分别滴加浓度(1:100)NF-κB65、TLR2、TLR4的一抗, 37 ℃孵育2 h. PBS冲洗, 5 min×3次. 分别滴加NF-κB65、TLR2、TLR4二抗(1%BSA-PBS稀释), 37 ℃孵育30 min. PBS冲洗, 5 min×3次. 滴加辣根酶标记链霉卵白素(PBS稀释), 37 ℃孵育30 min. PBS冲洗, 5 min×3次. 加入DAB显色剂显色. 自来水充分冲洗, 复染, 封片. 使用CMIAS真彩色病理图像分析系统对样本图像进行分析. 每个样本随机选取3个高倍视野, 计算黄褐色阳性表达的面密度(阳性表达总面积/统计区域总面积)表示, 以此表示NF-κB65、TLR2、TLR4蛋白的表达, 进行半定量分析.
1.2.5 NF-κB65、TLR2、TLR4基因含量检测: 采用qRT-PCR法. 提取胃黏膜组织总RNA. 逆转录cDNA总体系20 μL: 以组织中mRNA为模板进行逆转录反应, 逆转录cDNA; 反应条件: 70 ℃加热5 min, 37 ℃加热5 min, 42 ℃加热1 h 30 min, 72 ℃反应10 min. TLR2引物序列为: F: 5'-TTTGCTCCTGCGAACTCC-3', R: 5'-CAGTGCAGCCTGGTGACATT-3'; TLR4引物序列为F: 5'-CCTTTCAGGGAATTAAGCTCC-3', R: 5'-ACCGATGGACGTGTAAACCA-3'. NF-κB65引物序列为: F: 5'-CATGTCTCACTCCACAGCT-3', R: 5'-CCGGAGAGACCATTGGGA-3'; qRT-PCR反应体系总体积30 μL, 反应条件: 95 ℃ 10 min, 然后95 ℃ 5 s, 54 ℃ 30 s, 共40个循环. 反应结束后通过电脑自动分析和计算得到各样本的mRNA表达量.
统计学处理 用SPSS17.0统计软件进行数据处理与分析, 实验数据以mean±SD表示, 符合正态性和方差齐性的资料, 采用完全随机化设计的方差分析、多重比较; 不符合正态性和方差齐性, 用秩和检验Kruskal-Wallis H检验, 两组比较用Wilcoxon检验和Mann-Whitney U检验. P<0.05为差异有统计学意义.
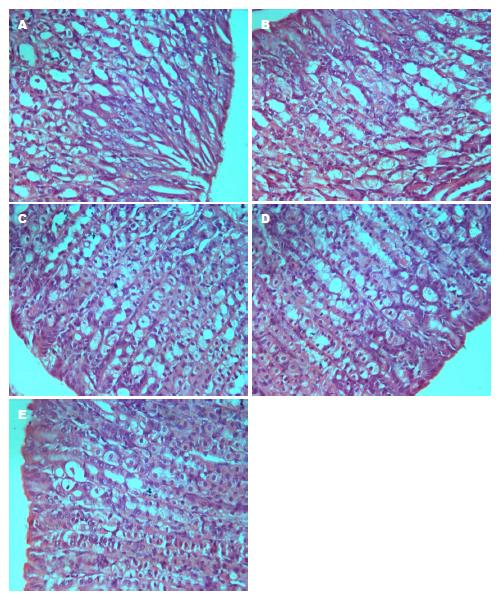
本研究从病因模拟建立H. pylori相关性胃炎脾胃湿热证模型, 本次造模研究从小鼠饮食、饮水、大小便及精神状态结果分析, 本实验造模方法成功使模型组小鼠表现出食少纳呆、少饮、大便溏、肢体困重等脾胃湿热证症状, 与2002年国家药品监督管理局《中药新药临床研究指导原则》中脾胃湿热证辩证依据相符. 光镜下模型组小鼠胃黏膜多为充血肿胀, 表面欠光整, 腺体排列较紊乱, 可见较多的嗜酸性粒细胞、中性粒细胞、淋巴细胞浸润, 未见糜烂, 模型组符合慢性非萎缩性胃炎表现. 因此, 湿热环境、肥甘饮食及H. pylori定值综合病因制造的脾胃湿热证动物模型典型, 在症状表现、病理检查及验方反证上均贴近临床, 造模方法可行.
光镜下, 正常组小鼠胃黏膜上皮细胞排列整齐, 细胞呈单柱状, 固有层内有密集排列的腺体, 个别小鼠胃黏膜底部可见少量散在的淋巴细胞. 模型组小鼠胃窦部的炎症程度重, 胃黏膜上皮排列紊乱, 固有层内可见大量淋巴滤泡、嗜酸性粒细胞及中性粒细胞浸润, 炎症细胞甚至到达黏膜下层. 低灭组炎症程度明显减轻, 黏膜层少量炎性细胞浸润, 固有层仅有水肿, 少量淋巴细胞. 高灭组治疗组和胃三联治疗组胃黏膜上皮细胞排列整齐, 炎症几乎全部消失(图1).
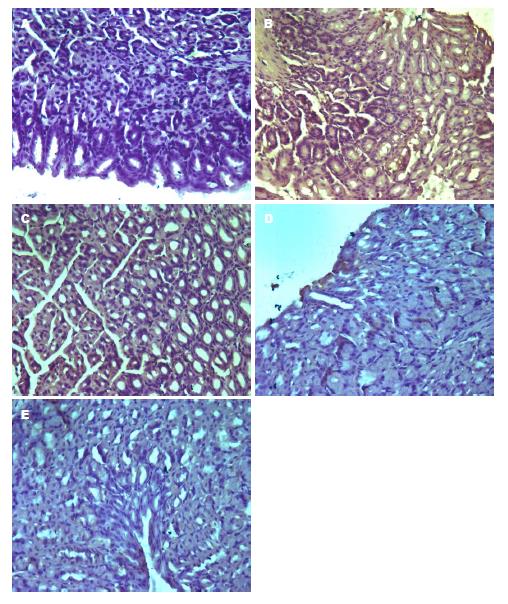
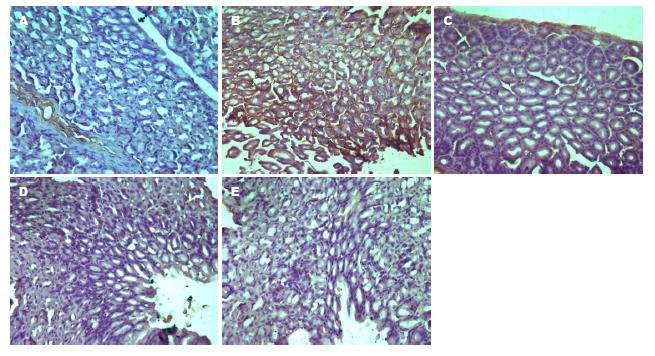
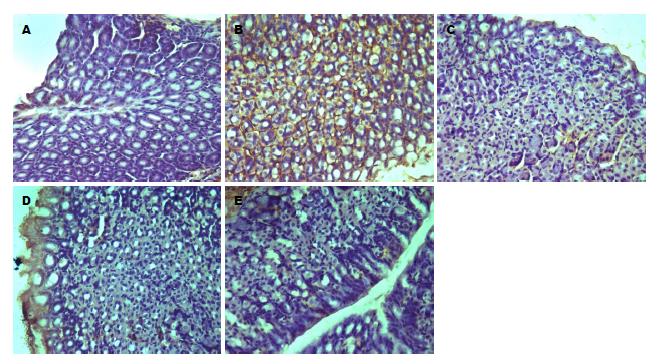
免疫组织化学图片中黄褐色区域为阳性表达. 光镜下观察, 对照组小鼠胃黏膜组织TLR2、TLR4、NF-κB65有极少量表达; 模型组小鼠胃黏膜组织TLR2、TLR4、NF-κB65有大量阳性表达; 低灭组小鼠胃黏膜组织较模型组明显减少, 少于模型组, 高灭组和胃三联组小鼠胃黏膜组织有少量TLR2、TLR4、NF-κB65阳性表达, 少于低灭组、模型组. TLR2、TLR4、NF-κB65蛋白的表达如图2, 图3, 图4.
2.4.1 各组小鼠胃黏膜组织TLR2蛋白表达的比较: 与对照组比较, 模型组TLR2蛋白表达增加(P<0.01); 与模型组比较, 高灭组、胃三联组小鼠TLR2蛋白表达均明显降低(P<0.01), 高灭组TLR2蛋白低于低灭组TLR2, 差异有统计学意义(P<0.05); 高灭组、胃三联组TLR2蛋白均降低(P>0.05)(表1).
2.4.2 各组小鼠胃黏膜组织TLR4蛋白表达的比较: 与对照组比较, 模型组TLR4蛋白表达增加(P<0.01); 与模型组比较, 高灭组、低灭组、胃三联组小鼠TLR4蛋白表达均明显降低(P<0.01); 高灭组、胃三联组TLR4蛋白均低于低灭组(P<0.01); 高灭组TLR4蛋白低于胃三联组(P>0.05)(表1).
2.4.3 各组小鼠胃黏膜组织NF-κB65蛋白表达的比较: 与对照组比较, 模型组NF-κB65蛋白表达增加(P<0.01); 与模型组比较, 高灭组、胃三联组小鼠NF-κB65蛋白表达均明显降低(P<0.01), 高灭组NF-κB65蛋白低于低灭组NF-κB65(P<0.05); 高灭组、胃三联组NF-κB65蛋白均降低(P>0.05)(表1).
2.5.1 各组小鼠胃黏膜组织TLR2 mRNA表达的比较: 与对照组比较, 模型组TLR2 mRNA表达增加(P<0.01); 与模型组比较, 高灭组、低灭组、胃三联组小鼠TLR2 mRNA表达均明显降低(P<0.01); 高灭组TLR2 mRNA低于低灭组(P<0.01), 说明药物浓度对疗效有影响; 高灭组TLR2 mRNA低于胃三联组(P>0.05)(表2).
2.5.2 各组小鼠胃黏膜组织TLR4 mRNA表达的比较: 与对照组比较, 模型组TLR4 mRNA表达增加(P<0.01); 与模型组比较, 高灭组、低灭组、胃三联组小鼠TLR4 mRNA表达均明显降低(P<0.01); 高灭组TLR4 mRNA低于低灭组(P<0.05), 说明药物浓度对疗效有影响; 高灭组TLR4 mRNA低于胃三联组(P>0.05)(表2).
2.5.3 各组小鼠胃黏膜组织NF-κB65 mRNA表达的比较: 与对照组比较, 模型组NF-κB65 mRNA表达增加(P<0.01); 与模型组比较, 高灭组、低灭组、胃三联组小鼠NF-κB65 mRNA表达均明显降低(P<0.01); 高灭组NF-κB65 mRNA均低于低灭组(P<0.05), 说明药物浓度对疗效有影响; 高灭组NF-κB65 mRNA低于胃三联组(P>0.05)(表2).
2.6 各组小鼠血清IL-6、IL-8表达的比较 对照组小鼠血清中有极少量IL-6、IL-8表达. 与对照组比较, 模型组IL-6、IL-8表达增加(P<0.01); 与模型组比较, 高灭组、低灭组、胃三联组小鼠IL-6、IL-8表达均明显降低(P<0.01); 高灭组IL-6、IL-8低于低灭组(P<0.05), 说明灭幽汤浓度影响其疗效; 高灭组IL-6、IL-8低于胃三联组(P>0.05)(表3).
脾胃湿热证是脾胃病中的一个常见证型, 流行病学调查显示[15,16]慢性胃炎脾胃湿热证主要以胃脘痞满、舌红、苔黄腻、脉滑数为主要表现, 慢性胃炎脾胃湿热证多具有病程长, 易反复发作, 难以根治等特点. H. pylori是一种定植于胃黏膜的螺旋形革兰氏阴性细菌, 他可产生空泡毒素和细胞毒素相关基因蛋白, 直接损伤胃上皮细胞, 是导致慢性胃炎最主要的原因, 我国H. pylori人群感染率为40%-70%, 与气候、居住环境、饮食、家族遗传等因素密切相关[17-19]. 越来越多的研究表明脾胃湿热证与H. pylori在慢性胃炎的发病中密切相关[20-22]: 脾胃湿热证更易导致体内环境改变, 损伤胃黏膜屏障, 给H. pylori入侵创造条件. H. pylori与湿热之邪在病因学上属同一致病原, H. pylori感染有类似于湿热病邪隐匿性、渐进性、反复性、迁延性等特点.
TLRs[23]在微生物感染中是天然免疫反应的重要组成部分, 他能特异的识别病原体, 介导跨膜信号转号并诱导活化免疫细胞而触发一系列的炎症反应; NF-κB[24]不仅参与炎症反应, 而且在细胞增殖和凋亡中起重要作用; IL-6、IL-8[25,26]等细胞因子在介导和调节免疫应答及炎症反应过程中起到重要作用, 具有参与细胞免疫、炎症反应等过程, 对炎症的发展起促进的作用. 研究表明[27]: H. pylori感染程度与细菌毒力、宿主的免疫反应、环境因素等密切相关, 而胃上皮细胞是H. pylori与宿主之间的第一接触点, 而TLRs存在于这些细胞并通过识别病原相关分子模式启动机体内免疫系统, 在H. pylori的致病作用中发挥重要作用. 有研究认为[28]TLR2、TLR4的基因多态性可影响宿主H. pylori感染的严重程度, TLRs介导的复合体诱导MyD88依赖的信号转导途径, 激活NF-κB与IL-6、IL-12增加胃上皮细胞增殖和炎症反应. Yuan等[29]和Castaño-Rodríguez等[30]研究认为TLR4主要在人类胃上皮细胞上表达, H. pylori感染可诱导TLR4的表达, 产生炎症和免疫反应, 并激活NF-κB及其下游因子IL-8的表达, 使NF-κB表达增加, 增强其对H. pylori脂多糖的识别, 在H. pylori所致的慢性胃炎中发挥重要作用.
本研究中发现: 灭幽汤模型组TLR2、TLR4、NF-κB65及下游炎症因子IL-6、IL-8的表达显著高于对照组; 而经灭幽汤干预治疗后高灭组、胃三联组表达显著降低. 因此我们推测TLRs/NF-κB65信号通路与H. pylori相关性胃炎脾胃湿热证具有相关性, H. pylori与湿热因素可能共同通过影响TLRs/NF-κB65信号通路使胃黏膜组织产生炎症, 而灭幽汤治疗H. pylori相关性胃炎脾胃湿热证, 其机制可能是通过干预TLRs/NF-κB65信号通路, 抑制及杀灭H. pylori并减轻湿热证候, 从而降低胃黏膜组织的炎性程度以达到治疗H. pylori相关性胃炎脾胃湿热证的目的.
幽门螺杆菌(Helicobacter pylori, H. pylori)是慢性胃病(慢性胃炎、消化性溃疡和胃癌)的重要病因, 对人类健康构成严重危害, 是胃肠病研究中的重点, 世界卫生组织国际癌研究会将H. pylori定位Ⅰ级或明确的致癌因子, 防治本疾病具有非常重要的意义.
王富春, 教授, 长春中医药大学.
西药治疗H. pylori相关性胃炎不良反应较大, 且现在抗生素耐药性逐渐增加, 亟需发现对治疗H. pylori有效而不良反应小的药物. 而本文中的灭幽汤正是针对H. pylori治疗的方剂.
本文探讨了新模型的研发, 且通过经典炎症通路验证灭幽汤的治疗作用.
本研究为进一步丰富中医药理论提供实验依据, 为H. pylori感染及其相关性胃炎发病机制与治疗思路的研究提供新的策略, 具有广泛的应用前景.
本文具有一定指导意义.
编辑 田滢 电编 都珍珍
| 1. | Heyl KA, Fischer A, Göbel UB, Henklein P, Heimesaat MM, Bereswill S. Inhibition of Helicobacter pylori urease activity in vivo by the synthetic nickel binding protein Hpn. Eur J Microbiol Immunol (Bp). 2013;3:77-80. [PubMed] [DOI] |
| 2. | Pachathundikandi SK, Tegtmeyer N, Backert S. Signal transduction of Helicobacter pylori during interaction with host cell protein receptors of epithelial and immune cells. Gut Microbes. 2013;4:454-474. [PubMed] [DOI] |
| 3. | Diesing AK, Nossol C, Faber-Zuschratter H, Zuschratter W, Renner L, Sokolova O, Naumann M, Rothkötter HJ. Rapid interaction of Helicobacter pylori with microvilli of the polar human gastric epithelial cell line NCI-N87. Anat Rec (Hoboken). 2013;296:1800-1805. [PubMed] [DOI] |
| 4. | Hongying F, Xianbo W, Fang Y, Yang B, Beiguo L. Oral immunization with recombinant Lactobacillus acidophilus expressing the adhesin Hp0410 of Helicobacter pylori induces mucosal and systemic immune responses. Clin Vaccine Immunol. 2014;21:126-132. [PubMed] [DOI] |
| 11. | 王 小娟, 郭 建生, 李 倩, 郭 璇, 蒋 军林, 朱 久宜. 灭幽汤对湿热型胃炎伴幽门螺杆菌感染胃黏膜上皮细胞凋亡的影响. 中国中西医结合消化杂志. 2007;15:258-259. |
| 15. | 万 莹. 慢性胃炎脾胃湿热证流行病学、证候学及诊断标准相关因素的研究. 武汉: 湖北中医药大学 2013; . |
| 17. | Sachdeva A, Rawat S, Nagpal J. Efficacy of fermented milk and whey proteins in Helicobacter pylori eradication: a review. World J Gastroenterol. 2014;20:724-737. [PubMed] [DOI] |
| 18. | Wang BB, Li ZJ, Liu CG, Xu HM, Jin F, Lu P. Family history of cancer in Chinese gastric cancer patients. Chinese-German J Clin Oncol. 2010;9:321-326. |
| 20. | 吴 炜景, 李 立平, 林 延超, 陈 婷婷, 谢 子英, 马 艳春, 赵 亚刚. 广东地区胃窦溃疡患者幽门螺杆菌CagA基因型与中医证型相关性分析. 中华中医药杂志. 2013;28:1803-1807. |
| 21. | Liang JK, Hu L, Zheng XF. [Study of Th1/Th2 balance in peripheral blood of chronic gastritis patients with Pi-Wei damp-heat syndrome]. Zhongguo Zhongxiyi Jiehe Zazhi. 2012;32:322-324, 328. [PubMed] |
| 22. | 周 慧敏, 吕 文亮, 高 清华, 周 燕萍, 王 阶, 李 天望, 刘 林. 慢性胃炎脾胃湿热证与血清胃泌素及幽门螺杆菌感染的相关性. 世界华人消化杂志. 2010;18:845-847. [DOI] |
| 23. | Huang L, Yuan K, Liu J, Ren X, Dong X, Tian W, Jia Y. Polymorphisms of the TLR4 gene and risk of gastric cancer. Gene. 2014;537:46-50. [PubMed] [DOI] |
| 24. | Moorchung N, Srivastava AN, Sharma AK, Achyut BR, Mittal B. Nuclear factor kappa-B and histopathology of chronic gastritis. Indian J Pathol Microbiol. 2010;53:418-421. [PubMed] [DOI] |
| 25. | Rose-John S. IL-6 trans-signaling via the soluble IL-6 receptor: importance for the pro-inflammatory activities of IL-6. Int J Biol Sci. 2012;8:1237-1247. [PubMed] [DOI] |
| 26. | Huang X, Lu B, Zhang S, Meng LN, Chen BB, Zhao M. [Effect of Weifuchun on inhibiting inflammation of Helicobacter pylori-infected GES-1 cells and NF-kappaB signaling pathway]. Zhongguo Zhongxiyi Jiehe Zazhi. 2014;34:450-454. [PubMed] |
| 27. | Teng GG, Wang WH, Dai Y, Wang SJ, Chu YX, Li J. Let-7b is involved in the inflammation and immune responses associated with Helicobacter pylori infection by targeting Toll-like receptor 4. PLoS One. 2013;8:e56709. [PubMed] [DOI] |
| 28. | Smith SM, Moran AP, Duggan SP, Ahmed SE, Mohamed AS, Windle HJ, O'Neill LA, Kelleher DP. Tribbles 3: a novel regulator of TLR2-mediated signaling in response to Helicobacter pylori lipopolysaccharide. J Immunol. 2011;186:2462-2471. [PubMed] [DOI] |
| 29. | Yuan X, Zhou Y, Wang W, Li J, Xie G, Zhao Y, Xu D, Shen L. Activation of TLR4 signaling promotes gastric cancer progression by inducing mitochondrial ROS production. Cell Death Dis. 2013;4:e794. [PubMed] [DOI] |