修回日期: 2014-06-05
接受日期: 2014-06-22
在线出版日期: 2014-08-08
目的: 研究miR-1290在结直肠癌(colorectal cancer, CRC)患者及健康体检者血浆中的表达差异, 并探讨其与临床特征之间的关系.
方法: 采用实时荧光定量PCR检测检测219例CRC患者及年龄、性别相匹配的45例健康体检者血浆中miR-1290的表达情况, 分析其与临床特点之间的关系.
结果: 在健康体检者与CRC患者两组中, CRC组血浆中miR-1290表达量增高, 有统计学意义(P<0.05); 以年龄分组(≥60岁,<60岁), 高龄组人群中血浆miR-1290的表达水平较低龄组增高, 有统计学意义(P<0.05); 以性别(男、女)分组, 血浆miR-1290的表达水平变化无统计学意义(P>0.05).
结论: miR-1290在CRC患者血浆中表达上调, 其高表达与CRC的分期相关, 有望成为CRC诊断及治疗的指标之一.
核心提示: 本实验用实时荧光定量PCR检测手段系统地分析健康人群、不同分期结直肠癌(colorectal cancer, CRC)患者血浆之间的miRNA表达差异, 发现miR-1290在CRC中差异表达, 并且随肿瘤进展呈现动态变化. 提示miR-1290在CRC发生发展阶段发挥重要作用.
引文著录: 徐学虎, 李勇, 江庆萍, 陈戎, 李志发, 刘海波, 黎淑玲, 伍尚标. 血浆miR-1290在结直肠癌中的表达及临床意义. 世界华人消化杂志 2014; 22(22): 3356-3360
Revised: June 5, 2014
Accepted: June 22, 2014
Published online: August 8, 2014
AIM: To assess the clinical significance of plasma miR-1290 in patients with colorectal cancer (CRC).
METHODS: Plasma levels of miR-1290 in 219 patients with CRC and 45 healthy subjects were measured using real-time quantitative PCR. The relationship between miR-1290 expression and clinical characteristics of CRC was analyzed. The diagnostic value of miR-1290 for CRC was evaluated.
RESULTS: Plasma miR-1290 levels were increased significantly in CRC patients compared with healthy controls (P < 0.05). Plasma levels of miR-1290 were not significantly associated with gender (P > 0.05), but were significantly associated with TNM stage and age of patients.
CONCLUSION: Increased plasma miR-1290 levels are detected in patients with colorectal cancer, which suggests that miR-1290 might be used as a potential marker for colorectal cancer.
- Citation: Xu XH, Li Y, Jiang QP, Chen R, Li ZF, Liu HB, Li SL, Wu SB. Clinical significance of plasma miR-1290 in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(22): 3356-3360
- URL: https://www.wjgnet.com/1009-3079/full/v22/i22/3356.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i22.3356
结直肠癌(colorectal cancer, CRC)是最常见的恶性肿瘤之一, 也是引起死亡的主要癌症之一. 在发达国家高居恶性肿瘤第2位; 在我国, 其发病率与死亡率呈逐年上升趋势[1]. 作为危害人类健康的常见恶性肿瘤, CRC发病机制的研究始终是临床基础研究的重点之一. miRNA是一类由21-23个核苷酸构成的非编码单链RNA分子, 通过与靶基因mRNA 3'端非编码区的完全或不完全互补结合, 抑制靶mRNA翻译或降解靶mRNA, 使基因在转录后水平产生沉默, 从而调节生物体内的基因表达[2]. 越来越多的研究表明, miRNA具有癌基因或抑癌基因的作用, 他在细胞的生长、增殖和凋亡过程中发挥着重要作用, 其表达水平的异常与许多肿瘤的发生发展相关[3], 研究miRNA与肿瘤的关系对于探索肿瘤的发生、发展及治疗有重要意义. 本课题组前期的研究表明, miRNA能够鉴别结直肠肿瘤组织与瘤旁正常组织[4]. miR-1290是新近发现的一种miRNA. 可通过调控细胞增殖周期进而参与肿瘤的演进过程[5], 但其在CRC中的具体表达状况尚未见研究报道. 本实验通过检测对比CRC患者及健康体检者血浆中miR-1290的表达水平, 分析其与CRC患者临床特征的关系, 探讨miR-1290在CRC发生发展中的作用.
收集广州医科大学第三附属医院2010-09/2013-09收治的219例CRC患者的外周血, 标本获得前患者未经任何放、化疗, 患者均经病理检查确诊, 无其他肿瘤病史, 所有患者均有完整的临床、病理资料. 男114例、女105例; 年龄38-82岁, 平均64.16岁±12.36岁; 按照美国癌症联合会(American Joint Committee on Cancer, AJCC)第7版标准进行TNM分期, Ⅰ期24例、Ⅱ期60例、Ⅲ期111例和Ⅳ期24例. 另外, 收集45例健康体检者外周血, 其中男30例、女15例; 年龄53-87岁, 平均67.67岁±10.31岁. CRC患者和健康体检者的年龄和性别匹配(P>0.05). 本研究已通过广州医科大学第三附属医院医学伦理委员会的审核批准, 所有标本的采集均获得患者的知情同意.
1.2.1 血浆样本的收集: 使用EDTA试管采集的每例待检者外周血2 mL, 在室温(22 ℃-25 ℃)下1 h内进行处理. 在4 ℃、1900 g离心10 min: 吸取上清至洁净的1.5 mL DEPC管, 4 ℃、16000 g离心10 min, 小心吸取上清到新的DEPC管中, 置于-80 ℃冰箱中保存备用.
1.2.2 血浆总RNA的提取: 用TRIzol法, 取适量的血浆, 加入1 mL TRIzol, 震荡混匀室温放置5 min; 加入0.2 mL氯仿, 剧烈震荡15 s, 静置3 min; 4 ℃ 10000 r/min离心10 min, 把上层水相转移到新的管中; 加入等体积异丙醇, 混匀, 静置20 min; 4 ℃ 10000 r/min离心10 min, 去上清; 用1 mL 75%DEPC乙醇洗涤沉淀; 4 ℃ 5000 r/mim离心5 min, 弃去液体; 室温晾干后, 加入30 µL DEPC处理过的ddH2O水, 溶解RNA, 取1 µL RNA在NanoDropND-2000(美国NanoDrop公司)上测定RNA浓度及A260/280比值. 抽提获得的RNA置于-80 ℃冰箱中保存备用.
1.2.3 cDNA合成: 以2 µg总RNA为模板, 按照Bestar qPCR RT Kit说明书配制逆转录反应体系, 5×RT Buffer 4.0 µL; RT Enzyme Mix 1.0 µL; Primer Mix Rnase Free dH2O 4.0 µL总体系为20 µL, 配置置于冰上进行. 37 ℃, 60 min; 98 ℃, 10 min, 合成cDNA, 收集后-20 ℃保存备用.
1.2.4 荧光定量RT-PCR检测miR-1290: 特异性引物序列在miRBASE中检索, miR-1290及U6序列如下: hsa-miR-1290: F: 5'-ACACTCCAGCTGGGTGGATTTTTGG-3', R: 5'-CTCAACTGGTGTCGTGGA-3'; U6: F: 5'-CTCGCTTCGGCAGCACA-3', R: 5'-AACGCTTCACGAATTTGCGT-3'. 引物由生工生物工程公司合成. 荧光定量RT-PCR的条件优化对Mg2+、引物等浓度进行优化. Real-time PCR 扩增的反应体系为20 µL(DBI Bestar® SybrGreen qPCR master Mix)具体为Bestar® SybrGreen qPCR master Mix 10 µL; PCR Forward Primer(10 µmol/L) 0.5 µL; PCR Reverse Primer(10 µmol/L) 0.5 µL; DNA模板(上述cDNA)1.0 µL; dH2O(灭菌蒸馏水) 8.0 µL. 反应条件为: 94 ℃ 2 min, 94 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 20 s, 40循环, 采用Agilent Stratagene荧光定量PCR仪Mx3000P进行荧光定量检测, 反应结束由计算机自动计算各反应管内的Ct值.
对于实时定量PCR结果的统计, 目的基因的表达量以2-△Ct表示, 每个血浆标本miRNA-1290 PCR平均扩增值△Ct = CtmiR-1290-CtU6[6]. CRC患者血浆中miRNA-1290表达量的平均2-△Ct值除以健康体检者血浆中miRNA-1290表达量的平均2-△Ct值, 为CRC患者血浆中miRNA-1290的表达倍数变化.
统计学处理 采用SPSS20.0统计软件, miRNA相对表达量呈偏态分布、方差不齐, 以中位数和四分位数间距表示; 两组间或多组间比较采Mann-Whitney U检验, P<0.05为差异具有统计学意义.
miR-1290及U6的Real-time PCR扩增曲线均呈"S"型; PCR产物熔解曲线均为单峰, 说明扩增的目的基因特异性好且结果可靠(图1).
以U6为内参, CRC患者血浆中miR-1290的表达量为0.481(0.05-1.54); 健康体检者血浆中表达量为0.012(0.00-0.05). CRC患者血浆中miR-1290的表达量明显高于健康体检者. 采用非参数秩和检验, 两者差异有统计学意义(P<0.05)(图2).
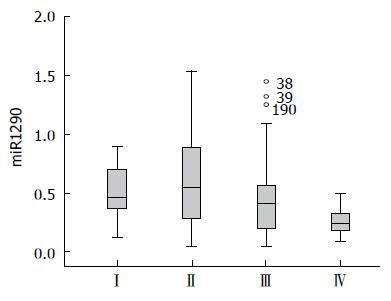
对CRC患者血浆中的表达与临床病理资料进行分析, 结果显示血浆中miR-1290的表达水平与CRC患者的性别无关(P>0.05), 但与年龄、临床分期密切相关, 在不同TNM分期的患者血浆miR-1290的与健康对照组均有统计学差异(均P<0.05)(表1).
| 临床特点 | n | miR-1290表达量1 | P值 |
| 性别 | 0.052 | ||
| 男 | 114 | 0.439(0.05-1.47) | |
| 女 | 105 | 0.528(0.05-1.54) | |
| 年龄(岁) | 0.01 | ||
| ≥60 | 136 | 0.514(0.05-1.48) | |
| >60 | 83 | 0.428(0.05-1.54) | |
| TNM分期 | 0.00 | ||
| Ⅰ | 24 | 0.511(0.13-0.90) | |
| Ⅱ | 60 | 0.628(0.05-1.54) | |
| Ⅲ | 111 | 0.443(0.05-1.45) | |
| Ⅳ | 21 | 0.263(0.09-0.50) |
提高CRC早期阶段的检出率能显著提高患者生存率, 降低癌症死亡率及延长患者生存时间. 癌胚抗原(carcinoembryonic antigen, CEA)是最早发现的CRC血液肿瘤标志物, 但CEA在大多数恶性肿瘤患者血中均有不同程度的上调, 特异性较低, 对CRC的早期诊断价值不高. 因此, 寻找理想的特异度强和灵敏度高的肿瘤标志物是提高肿瘤早期诊断的重要手段之一. 近年来的研究发现循环miRNA是一种具有功能的miRNA, 其在生物发育过程中存在着许多特异性的表达, 与人体许多种疾病都有非常密切的联系, 尤其是在肿瘤的发生和发展过程中发挥着非常重要的作用, 已发现若干miRNA直接参与某些肿瘤的发生和发展[7-13]. 2008年Lawrie等[14]发现弥漫性大B细胞淋巴瘤患者血清中miR-21水平很高, 并证实后者与无复发存活率增高密切相关, 血清miR-21成为第1个被发现的血清miRNA标志物, 同时开启了对游离miRNA的研究. Ho等[15]研究发现血浆中miRNA性质非常稳定, 即便在100 ℃煮沸10 min或室温下放置不同的时间(4、12、24 h)或反复冻融, 其表达水平基本不变, 这为今后的研究奠定了基础. 随后在乳腺癌、胃癌、胰腺癌、肝癌及肺癌等恶性肿瘤患者的血浆中发现: miRNAs 异常的表达与组织病理学特征以及疾病的不同阶段之间有着密切的关系.
miR-1290在人胚胎肝细胞中首次被发现[16], 随后研究者发现其表达量在胰腺癌、乳腺癌中均有不同程度的变化[17,18], 同时Wu等[5]发现上调miR-1290能损害胞质分裂, 影响结肠癌细胞的重编程. 但是miR-1290在CRC患者的体液(包括血液、尿液、胸腹水、唾液等)中的研究仍然缺乏, 这将是今后研究的新领域. 本研究中, miR-1290在CRC患者血浆中表达量相比健康对照组显著升高, 两者差异有统计学意义, 这与Li等[17]报道的在其他消化系肿瘤中情况相符. Ⅰ期、Ⅱ期CRC患者血浆miR-1290的表达量随肿瘤进展逐渐增加并达到高峰, 到Ⅲ期、Ⅳ期其表达量有所下降但维持在较高水平(P<0.05); 这种在CRC早期开始升高, 病程中期达到高峰后开始缓慢下降, 病程晚期仍维持在一个较高的水平. 早期、中期、晚期的值与健康体检者相比均有显著性差异(P<0.05)的表达趋势, 与肿瘤细胞迅速生长繁殖, 中晚期开始有所坏死凋亡, 但仍维持较高的活跃增殖程度相符合, 提示miR-1290可能在CRC发生发展阶段发挥重要作用; 同时患者年龄与miR-1290表达量亦呈正相关(P<0.05), 提示年龄也是一个影响其表达的相关因素之一.
本实验研究结果表明, miR-1290可能通过突变、缺失、调节转录因子或抑癌基因等机制来发挥促癌miRNA的作用, 但是具体机制还有待进一步研究. 粪便隐血试验、血清CEA检测及肠镜仍是目前临床上发现CRC的常用手段, 但粪便隐血试验及CEA不够敏感而肠镜属于侵入性操作, 如果进一步研究更大样本量的miR-1290表达水平及临床意义, 结合其他研究者发现在CRC中发现有变化的miRNA[7], 有望建立CRC的miRNA联合诊断模型, 使血浆miRNA成为CRC常规临床诊断的非侵入性标志物. 总之, miR-1290参与了CRC的发生和发展, 可能作为CRC诊断和治疗的新指标.
结直肠癌(colorectal cancer, CRC)是最常见的恶性肿瘤之一, 也是引起死亡的主要癌症之一, 且发病率逐年上升. 严重危害人累健康. 大肠癌早期症状隐匿, 无特异性, 早期发现面临很大困难. 寻找理想的用于早期诊断CRC肿瘤标志物具有重要的临床意义.
孙学英, 教授, 哈尔滨医科大学第一附属医院; 卢晓梅, 教授, 研究员, 新疆医科大学第一附属医院临床医学研究院
miRNA是一种具有调控功能的内源性非编码RNA, 在转录后对靶标基因的表达水平进行调节, 与许多疾病相关尤其是恶性肿瘤. 近年来, 肿瘤相关miRNA陆续在患者的血清中被发现, 为肿瘤的无创性早期诊断提供了一条新的途径. miRNA稳定性非常好, 可作为潜在的肿瘤标志物.
2008年Lawrie等发现弥漫性大B细胞淋巴瘤患者血清中miR-21水平很高, 并证实后者与无复发存活率增高密切相关, Allen等研究发现血浆中miRNA性质非常稳定, 即便在100 ℃煮沸10 min或室温下放置不同的时间(4、12、24 h)或反复冻融, 其表达水平基本不变.
本实验用实时荧光定量PCR检测手段系统地分析健康人群及不同分期CRC患者之间血浆miRNA表达差异, miR-1290是本实验中发现的特异性miRNA之一, 能够准确的鉴别CRC患者及健康人群, 同时随着肿瘤的进展表达情况呈动态变化, 这在CRC中尚属首次报道.
miR-1290作为CRC中特异性表达的miRNA之一, 能够准确的鉴别CRC患者及健康人群, 同时随着肿瘤的进展呈动态变化, 结合其他被发现在CRC中发现有差异变化的miRNA, 有望建立CRC的miRNA诊断模型, 使血浆miRNA成为CRC常规临床诊断的非侵入性标志物.
2-△△Ct表示的是实验组目的基因的表达相对于对照组的变化倍数, 使用这一方法可以直接得到目的基因相对于内参基因的定量. △△Ct = (Ct目的基因-Ct内参基因)实验组-(Ct目的基因-Ct内参基因)对照组; 实验组目的基因的表达相对于对照组的变化倍数 = (目的基因的拷贝数/内参基因的拷贝数)实验组/(目的基因的拷贝数/内参基因的拷贝数)对照组.
文章通过肿瘤凋亡、侵袭性相关基因的表达变化来探讨顺铂缓释粒子对胃癌裸鼠模型的抗肿瘤效应, 结果明确, 并有一定的新颖性和创新性, 具有重要的指导价值.
编辑 郭鹏 电编 闫晋利
| 1. | Siegel R, Ma J, Zou Z, Jemal A. Cancer statistics, 2014. CA Cancer J Clin. 2014;64:9-29. [PubMed] [DOI] |
| 2. | Yanaihara N, Harris CC. MicroRNA Involvement in Human Cancers. Clin Chem. 2013;59:1811-1812. [PubMed] [DOI] |
| 3. | Corté H, Manceau G, Blons H, Laurent-Puig P. MicroRNA and colorectal cancer. Dig Liver Dis. 2012;44:195-200. [PubMed] [DOI] |
| 4. | 徐 学虎, 吴 小兵, 伍 尚标, 江 庆萍, 刘 海波, 陈 戎, 孙 嫣. miR-490-5p和miR-363作为结直肠癌诊断标记的研究. 中华胃肠外科杂志. 2014;17:45-50. |
| 5. | Wu J, Ji X, Zhu L, Jiang Q, Wen Z, Xu S, Shao W, Cai J, Du Q, Zhu Y. Up-regulation of microRNA-1290 impairs cytokinesis and affects the reprogramming of colon cancer cells. Cancer Lett. 2013;329:155-163. [PubMed] [DOI] |
| 6. | Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc. 2008;3:1101-1108. [PubMed] [DOI] |
| 7. | Huang Z, Huang D, Ni S, Peng Z, Sheng W, Du X. Plasma microRNAs are promising novel biomarkers for early detection of colorectal cancer. Int J Cancer. 2010;127:118-126. [PubMed] [DOI] |
| 8. | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 2004;116:281-297. [PubMed] [DOI] |
| 9. | Ng EK, Chong WW, Jin H, Lam EK, Shin VY, Yu J, Poon TC, Ng SS, Sung JJ. Differential expression of microRNAs in plasma of patients with colorectal cancer: a potential marker for colorectal cancer screening. Gut. 2009;58:1375-1381. [PubMed] [DOI] |
| 10. | Schetter AJ, Harris CC. Plasma microRNAs: a potential biomarker for colorectal cancer? Gut. 2009;58:1318-1319. [PubMed] [DOI] |
| 11. | Reid G, Kirschner MB, van Zandwijk N. Circulating microRNAs: Association with disease and potential use as biomarkers. Crit Rev Oncol Hematol. 2011;80:193-208. [PubMed] [DOI] |
| 12. | Jazdzewski K, Murray EL, Franssila K, Jarzab B, Schoenberg DR, de la Chapelle A. Common SNP in pre-miR-146a decreases mature miR expression and predisposes to papillary thyroid carcinoma. Proc Natl Acad Sci U S A. 2008;105:7269-7274. [PubMed] [DOI] |
| 13. | Si ML, Zhu S, Wu H, Lu Z, Wu F, Mo YY. miR-21-mediated tumor growth. Oncogene. 2007;26:2799-2803. [PubMed] [DOI] |
| 14. | Lawrie CH, Gal S, Dunlop HM, Pushkaran B, Liggins AP, Pulford K, Banham AH, Pezzella F, Boultwood J, Wainscoat JS. Detection of elevated levels of tumour-associated microRNAs in serum of patients with diffuse large B-cell lymphoma. Br J Haematol. 2008;141:672-675. [PubMed] [DOI] |
| 15. | Ho AS, Huang X, Cao H, Christman-Skieller C, Bennewith K, Le QT, Koong AC. Circulating miR-210 as a Novel Hypoxia Marker in Pancreatic Cancer. Transl Oncol. 2010;3:109-113. [PubMed] |
| 16. | Morin RD, O'Connor MD, Griffith M, Kuchenbauer F, Delaney A, Prabhu AL, Zhao Y, McDonald H, Zeng T, Hirst M. Application of massively parallel sequencing to microRNA profiling and discovery in human embryonic stem cells. Genome Res. 2008;18:610-621. [PubMed] [DOI] |
| 17. | Li A, Yu J, Kim H, Wolfgang CL, Canto MI, Hruban RH, Goggins M. MicroRNA array analysis finds elevated serum miR-1290 accurately distinguishes patients with low-stage pancreatic cancer from healthy and disease controls. Clin Cancer Res. 2013;19:3600-3610. [PubMed] [DOI] |
| 18. | Endo Y, Toyama T, Takahashi S, Yoshimoto N, Iwasa M, Asano T, Fujii Y, Yamashita H. miR-1290 and its potential targets are associated with characteristics of estrogen receptor α-positive breast cancer. Endocr Relat Cancer. 2013;20:91-102. [PubMed] [DOI] |