修回日期: 2014-06-10
接受日期: 2014-06-19
在线出版日期: 2014-08-08
目的: 探讨胰岛素样生长因子-1受体(insulin-like growth factor type 1 receptor, IGF-1R)、胰岛素样生长因子-1(insulin-like growth factor type 1, IGF-1)表达与临床病理特征之间的关系.
方法: 采用免疫组织化学的方法检测IGF-1R、IGF-1在70例胃癌组织及部分相应癌旁组织中的表达, 结合患者的性别、年龄、肿瘤大小、部位、分化程度、Borrmann分型、浸润深度、淋巴结转移和TNM分期等临床病理参数进行综合分析.
结果: 胃癌组织和癌旁组织中IGF-1R、IGF-1蛋白阳性表达分别为39例(55.71%)、8例(25.00%)和37例(52.86%)、5例(15.63%), 差别有统计学意义(P<0.05); IGF-1R在低分化组阳性表达与中高分化组阳性表达两组间比较差异有统计学差异(P<0.05, χ2 = 4.124); IGF-1R、IGF-1在T1组、T2组、T3组、T4组阳性表达四组间有统计学差异(P<0.05); IGF-1R、IGF-1在无淋巴结转移组与有淋巴结转移组中阳性表达, 两者间比较有显著统计学差异(P<0.05); IGF-1R、IGF-1在Ⅰ+Ⅱ期与Ⅲ+Ⅳ组内阳性表达两组间表达比较差异有显著统计学差异(P<0.05); IGF-1R阳性表达与患者的性别、年龄、肿瘤大小、部位及Borrmann分型均无明显相关(P>0.05). IGF-1阳性表达与患者的性别、年龄、肿瘤大小、部位、分化程度及Borrmann分型均无明显相关(P>0.05). 经Spearman秩相关分析, IGF-1R与IGF-1在胃癌组织的表达呈正相关(r = 0.310, P<0.01).
结论: IGF-1R、IGF-1在胃癌组织中存在着过表达, 在评估胃癌的发生、发展中有一定的临床价值. IGF-1R表达水平与肿瘤组织分化程度、浸润深度、淋巴结有无转移、TNM分期有关, IGF-1表达水平与肿瘤浸润深度、淋巴结有无转移、TNM分期有关. IGF-1R与IGF-1在胃癌组织中的表达呈正相关性, 两者在胃癌的发生发展中起协同作用, 未来可能会成为胃部肿瘤新型标志物.
核心提示: 胰岛素样生长因子-1受体(insulin-like growth factor type 1 receptor, IGF-1R)、胰岛素样生长因子-1(insulin-like growth factor type 1, IGF-1)在胃癌筛查诊断、病情发展评估及预后生存情况等方面有着一定的参考价值, 有望成为监测胃癌诊疗水准的新型标志物. 随着在分子水平上对IGF-1R、IGF-1的进一步深入研究, 有望找到抑制IGF-1R、IGF-1信号传导通路上的靶点, 从而为胃癌的诊疗提供更有效的方法.
引文著录: 曹友红, 许春芳, 马平, 张晓琦. 胰岛素样生长因子-1及其受体在胃癌中的表达及临床意义. 世界华人消化杂志 2014; 22(22): 3307-3315
Revised: June 10, 2014
Accepted: June 19, 2014
Published online: August 8, 2014
AIM: To investigate the expression of insulin-like growth factor type 1 receptor (IGF-1R) and IGF-1 in gastric cancer and to analyze the relationship between their expression and the clinicopathologic features.
METHODS: The expression of IGF-1R and IGF-1 proteins was detected by immunohistochemistry in 70 gastric cancer tissues and matched tumor adjacent tissues. The relationship between the expression of IGF-1R and IGF-1 and clinicopathologic parameters including gender, age, tumor diameter, site, differentiation, Borrmann type, infiltration depth, lymph node metastasis and TNM stage was then analyzed.
RESULTS: The positive rates of IGF-1R/IGF-1 expression in gastric cancer (55.17%/52.86%) were significantly higher than those in control tissue (25.00%/15.63%) (P < 0.05). IGF-1R expression was closely correlated with tumor differentiation, infiltration depth, lymph node metastasis and TNM stage (P < 0.05). IGF-1 expression was closely correlated with tumor infiltration depth, lymph node metastasis and TNM stage (P < 0.05). The expression of IGF-1R was positively correlated with that of IGF-1 in gastric cancer (r = 0.310, P < 0.01).
CONCLUSION: Over-expression of IGF-1R exists in gastric cancer and is correlated with tumor differentiation, infiltration depth, lymph node metastasis and TNM stage. Over-expression of IGF-1 also exists in gastric cancer and is correlated with infiltration depth, lymph node metastasis and TNM stage. Overexpression of IGF-1R and IGF-1 may be related to the development of gastric cancer. There is a positive correlation between IGF-1R and IGF-1 expression in gastric cancer, suggesting a synergistic effect between them in the development of gastric cancer. They may become new markers for gastric cancer.
- Citation: Cao YH, Xu CF, Ma P, Zhang XQ. Clinical significance of expression of IGF-1R and IGF-1 in gastric cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(22): 3307-3315
- URL: https://www.wjgnet.com/1009-3079/full/v22/i22/3307.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i22.3307
胃癌在我国是最常见的恶性肿瘤之一, 约占胃部恶性肿瘤的95%, 尽管近十余年胃癌全球发病率略有下降[1], 但发展中国家依然是高发, 死亡率亦较高, 目前在全球范围内每年确诊的新发恶性肿瘤中, 胃癌位居第4位, 死亡率居第2位[1,2], 而在我国胃癌是位居第2位的常见癌症及位居第3位的癌症死因. 近5年来, 我国每年新发胃癌病例达40万左右, 占全球发病率的42%, 目前, 我国的胃癌患者总数占全球胃癌患者总数的40%, 且发病率以每年1.6%的幅度逐渐攀升[3], 与发达国家发病率呈相反趋势, 故我国在胃癌的诊治能力需更进一步提升, 此外胃癌早期常无明显特异性临床表现, 绝大多数患者确诊时已属中晚期, 预后较差. 因此寻找能灵敏预警胃癌发生发展的生物学标志显得尤为重要[4], 以期能提高胃癌的诊断治疗水平和患者存活率. 胰岛素样生长因子-1受体(insulin-like growth factor type 1 receptor, IGF-1R)是一种跨膜的酪氨酸激酶蛋白, 在核糖体内合成, 组成结构与胰岛素受体具有高度的异体同型性, 由α、β两个亚单位组成一种四亚基结构. IGF-1R的信号转导可导致正常细胞的恶性转化及细胞黏附特性的改变. Chen等[5]指出IGF-1R在肿瘤的发生及发展中有着重要的角色, 在大部分恶性组织内有明显高表达. 国内外学者目前对IGF-1R在恶性肿瘤中的应用研究较多, 但主要集中于尤文氏肉瘤、肺部肿瘤、恶性神经系统肿瘤、妇科肿瘤、胸腺瘤、胃肠道间质瘤(gastrointestinal stromal tumors, GIST)等, 对胃癌中IGF-1R的表达及相关意义的研究较少. 胰岛素样生长因子-1(insulin-like growth factor type 1, IGF-1)是一种促生长因子, 又称生长激素介质或机械生长因子, 为一种分泌蛋白, 由IGF-1基因编码生成, 分子结构类似于胰岛素, 大部分IGF-1由肝脏分泌, 表达受限于生长激素, IGF-1的重要作用在调节早期细胞中2脱氧葡萄糖转运和糖原合成, IGF-1在人体内以较低剂量就能有效刺激糖原转化及DNA合成. 当机体细胞内过分表达IGF-1时, 细胞即会向恶性表型表达增殖; 在细胞周期中, IGF-1R、IGF-1发挥作用为增殖G1/G0细胞数, 加速细胞周期增殖的进程; 故从胃癌细胞周期逐步进展的不同阶段及方向去研究与细胞过度增殖相关因子的表达情况, 可能会得出这几种蛋白因子与胃癌发生发展的相关作用. 我们通过选录本院胃癌患者的临床病理资料, 观察IGF-1R、IGF-1在胃癌中的表达及与癌灶的大小、部位、浸润深度、淋巴结转移、TNM分期等参数间的关系, 以期探讨其在胃癌中的可能作用及临床意义.
选取2011-12/2012-12江苏省南京市高淳人民医院普外科手术中切除的胃癌标本70例为, 32例取到相应癌旁5 cm处正常胃黏膜组织作为对照, 所有胃癌组织均经过HE染色后病理证实; 纳入本实验内患者其中男48例, 女22例. 年龄最小35岁, 最大81岁, 平均年龄65.0岁±9.3岁. 肿瘤分化分级依据世界卫生组织(World Health Organization, WHO)(2010年)推荐标准, 70例胃癌中胃低分化腺癌41例(59%), 中高分化腺癌29例(41%). 根据Borrmann分型, Ⅰ、Ⅱ、Ⅲ、Ⅳ型分别有11例(16%)、17例(24%)、29例(41%)、13例(19%). 70例胃癌中: 贲门胃底处15例(22%)、胃体胃角处19例(27%)、胃窦幽门部36例(51%). 根据2010年国际抗癌联盟/美国癌症联合委员会(UICC/AJCC)TNM分期: Ⅰ+Ⅱ期32例(46%), Ⅲ+Ⅳ期38例(54%). 所有患者诊断前及术前均未接受药物化疗(新辅助性化疗PC)或其他治疗. IGF-1Rα兔抗人单克隆抗体由武汉博士德生物技术有限公司生产(工作浓度为1:100): IGF-1Rα亚单位试剂盒产品目录号为BA0498, 批号: 9H206C; IGF-1兔抗人单克隆抗体由武汉博士德生物技术有限公司生产(工作浓度为1:100): 产品目录号为: BA0939, 批号: 67810D273; PBS缓冲液、DAB显色剂、柠檬酸盐缓冲液、PV-9000试剂盒品名通用型Polymer Ki购自北京中杉公司.
1.2.1 免疫组织化学: 步骤按照试剂盒说明书操作, 实验结果阳性对照以武汉博士德生物技术有限公司提供的已知标记上述抗体的胃癌阳性切片, 阴性对照以PBS代替一抗作为参照. 具体操作如下: 肿瘤石蜡组织及癌旁组织用Leica RM2235切片机进行连续每4 μm切片, 切片后捞片, 于62 ℃ YABO200漂烘片机烤片备用, 脱蜡两次, 高压法进行预处理抗原, 冲洗3次, 滴加一抗, 室温下培育60 min, 第二抗体滴加, 室温培育30 min, PBS冲洗3次, 每次2 min, 滴加链霉素卵白素工作液, 室温培育30 min, PBS冲洗3次, 每次2 min, 滴加DAB显色剂, 37 ℃显色观察, 蒸馏水充分冲洗, 苏木精复染30 s, 1%盐酸乙醇分化及脱水, 二甲苯透明, 中性树脂封周, 显微镜下观察分析及记录结果.
1.2.2 IGF-1R、IGF-1结果的判断: 阳性细胞染色呈棕黄色或棕褐色, IGF-1R阳性染色主要定位于细胞质和细胞膜, 少部分定位于细胞核; IGF-1阳性染色主要定位于细胞质中, 少部分定位于细胞核. IGF-1R/IGF-1在胃癌组织细胞中免疫组织化学染色结果判断标准参照双评分半定量法进行评定. 每张切片上在×400高倍视野上随机观察5个视野, 每个视野分两步观察计数, 首先判断阳性细胞染色深度(0为未见染色, 1为轻度染色, 2为中度染色, 3为深度染色), 其次计数阳性细胞百分率(0分表示0-5%细胞着色, 1分表示5%-25%细胞着色, 2分表示25%-50%细胞着色, 3分表示50%-75%细胞着色, 4分表示>75%细胞着色), 最后以染色强度计分之和加上阳性细胞百分比计分之和所得总分进行染色结果判定, 0-1分判断为阴性(-), 2-3分判断为弱阳性(+), 4-5分判断为阳性(++),>6分判断为强阳性(+++). 两种评分综合评估后统一作出结果. 两个项目分析均用PBS代替一抗作阴性对照. 阳性对照片则由二种试剂公司分别提供. 每张病理切片由两位经验丰富的病理专科医师进行阅片后独立判断.
统计学处理 统计学处理采用SPSS17.0统计分析软件, IGF-1R、IGF-1表达在胃癌与癌旁组织之间的差异性比较采用两个(多个)样本率的χ2检验(部分为Fisher精确概率法), 多样本数据差异比较采用Kruskal-Wallis检验, 计数阳性率以百分比表示. IGF-1R和IGF-1在胃癌中的表达相关性用Spearman等级进行相关性分析, P<0.05为差异有统计学意义.
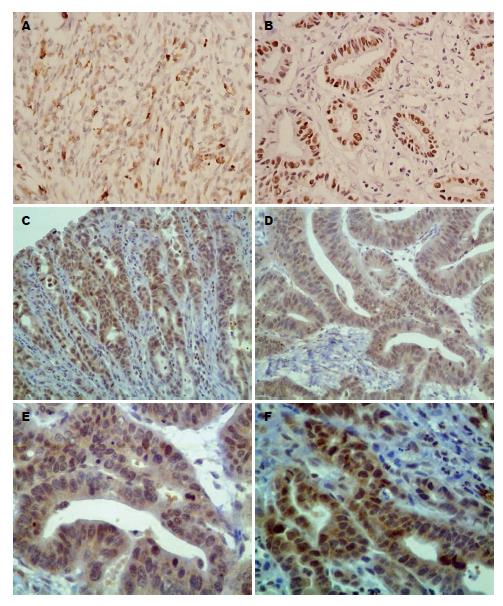
IGF-1R蛋白阳性表达定位于胃癌组织细胞质、细胞膜及少部分细胞核(图1A, B), IGF-1蛋白阳性表达定位于胃癌组织细胞质、及少部分细胞核中(图1C-F). 胃癌组织和癌旁组织中IGF-1R蛋白阳性表达分别为39例(55.71%)、8例(25.00%), 二者差别有统计学意义(P<0.05); 胃癌组织和癌旁组织中IGF-1蛋白的阳性表达分别为37例(52.86%)、5例(15.63%), 差异有统计学意义(P<0.01)(表1).
| 组织类型 | n | IGF-1R阳性n(%) | IGF-1R阴性(n) | χ2值 | P值 | IGF-1阳性n(%) | IGF-1R阴性(n) | χ2值 | P值 |
| 胃癌组织 | 70 | 39(55.71) | 31 | 8.34 | <0.01 | 37(52.86) | 33 | 12.57 | <0.01 |
| 癌旁组织 | 32 | 8(25.00) | 24 | 5(15.63) | 27 |
IGF-1R蛋白在胃癌组织分化程度比较中低分化组阳性表达率为65.85%(27/41), 中高分化组阳性表达率为41.38%(12/29), 两组间比较差异有统计学差异(P<0.05, χ2 = 4.124); IGF-1R蛋白在胃癌组织浸润深度分组比较中T1组阳性表达率为30.00%(3/10), T2组阳性表达率为31.25%(5/16), T3组阳性表达率为71.43%(25/35), T4组阳性表达率为66.67%(6/9), 4组间表达有统计学差异(P<0.05, χ2 = 10.351); IGF-1R蛋白在胃癌组织无淋巴结转移组中阳性表达率为34.48%(10/29), 有淋巴结转移组中阳性表达率为70.73%(29/41), 两者间比较有显著统计学差异(P<0.01, χ2 = 9.046); IGF-1R蛋白在胃癌组织TNM分期分组比较中Ⅰ+Ⅱ期内阳性表达率为37.50%(12/32), Ⅲ+Ⅳ组内阳性表达率为71.05%(27/38), 两组间表达比较差异有显著统计学差异(P<0.01, χ2 = 7.926); IGF-1R蛋白阳性表达与患者的性别、年龄、肿瘤大小、部位及Borrmann分型均无明显相关(P>0.05). IGF-1蛋白在胃癌组织浸润深度分组比较中T1组阳性表达率为20.00%(2/10), T2组阳性表达率为37.50%(6/16), T3组阳性表达率为62.86%(22/35), T4组阳性表达率为77.78%(7/9), 4组间表达有统计学差异(P<0.05, χ2 = 9.359); IGF-1蛋白在胃癌无淋巴结转移组中阳性表达率为37.93%(11/29), 有淋巴结转移组中阳性表达率为63.41%(26/41), 两者间比较有统计学差异(P<0.05, χ2 = 4.427); IGF-1蛋白在胃癌组织TNM分期比较中Ⅰ+Ⅱ期阳性表达率为37.50%(12/32), Ⅲ+Ⅳ期组阳性表达率为68.42%(25/38), 两组间比较差异有统计学差异(P<0.05, χ2 = 5.579); IGF-1蛋白阳性表达与患者的性别、年龄、肿瘤大小、部位、肿瘤分化程度、Borrmann分型均无明显相关(P>0.05)(表2).
| 病理参数 | n | IGF-1R阳性n(%) | χ2值 | P值 | IGF-1阳性n(%) | χ2值 | P值 |
| 性别 | 0.018 | 0.894 | 0.105 | 0.746 | |||
| 男 | 48 | 27(56.25) | 26(54.17) | ||||
| 女 | 22 | 12(54.55) | 11(50.00) | ||||
| 年龄(岁) | 0.000 | 0.983 | 0.391 | 0.532 | |||
| ≤60 | 27 | 15(55.56) | 13(48.15) | ||||
| >60 | 43 | 24(55.81) | 24(55.81) | ||||
| 肿瘤直径(cm) | 0.701 | 0.402 | 0.446 | 0.504 | |||
| <5 | 39 | 20(51.28) | 22(56.41) | ||||
| ≥5 | 31 | 19(61.29) | 15(48.38) | ||||
| 肿瘤部位 | 2.402 | 0.301 | 3.583 | 0.167 | |||
| 上(贲门/胃底) | 15 | 11(73.33) | 6(40.00) | ||||
| 中(胃体/胃角) | 19 | 10(52.63) | 8(42.11) | ||||
| 下(胃窦/幽门) | 36 | 18(50.00) | 23(63.89) | ||||
| 分化程度 | 4.124 | 0.042 | 1.686 | 0.194 | |||
| 低分化 | 41 | 27(65.85) | 19(46.34) | ||||
| 中高分化 | 29 | 12(41.38) | 18(62.07) | ||||
| Borrmann分型 | 3.137 | 0.371 | 0.851 | 0.837 | |||
| Ⅰ型 | 11 | 4(36.36) | 6(54.55) | ||||
| Ⅱ型 | 17 | 11(64.71) | 8(47.06) | ||||
| Ⅲ型 | 29 | 18(62.07) | 17(58.62) | ||||
| Ⅳ型 | 13 | 6(46.15) | 6(46.15) | ||||
| 浸润深度 | 10.351 | 0.016 | 9.359 | 0.025 | |||
| T1 | 10 | 3(30.00) | 2(20.00) | ||||
| T2 | 16 | 5(31.25) | 6(37.50) | ||||
| T3 | 35 | 25(71.43) | 22(62.86) | ||||
| T4 | 9 | 6(66.67) | 7(77.78) | ||||
| 淋巴结转移 | 4.919 | 0.003 | 4.427 | 0.035 | |||
| 无 | 29 | 10(34.48) | 11(37.93) | ||||
| 有 | 41 | 29(70.73) | 26(63.41) | ||||
| TNM 分期 | 7.926 | 0.005 | 5.579 | 0.018 | |||
| Ⅰ+Ⅱ | 32 | 12(37.50) | 12(37.50) | ||||
| Ⅲ+Ⅳ | 38 | 27(71.05) | 25(68.42) | ||||
IGF-1R与IGF-1在胃癌组织中均表达为阳性者为37.14%(26/70); IGF-1R表达阳性, 而IGF-1表达阴性者为15.72%(11/70); IGF-1表达阳性, IGF-1R表达阴性者为18.57%(13/70), IGF-1R与IGF-1均阴性者为28.57%(20/70). SPSS软件分析r = 0.310, P<0.05, 两者表达有显著相关性(表3).
| IGF-1 | IGF-1R | χ2值 | P值 | r值 | |
| 阳性 | 阴性 | ||||
| 阳性 | 26 | 13 | 6.740 | 0.009 | 0.310 |
| 阴性 | 11 | 20 | |||
胃癌是全球消化系最常见的恶性肿瘤之一, 其发病率及死亡率在我国近年均有一定的上升, 是严重危害人类的一种疾病. 第8届全国胃癌学术大会公布相关数据显示: 近5年来, 我国每年新发胃癌40万例, 发病率占全世界胃癌的42%左右[3], 故对胃癌的诊疗能力亟需提升. 本文初步探讨了IGF-1R、IGF-1在胃癌组织中的表达情况, 并分析了与临床病理特征间的关系.
IGF-1R是一种跨膜的酪氨酸激酶蛋白, 是胰岛素样生长因子家族蛋白(insulin-like growth factor or receptor, IGF)系统的主要介导者, 由α、β两个亚单位组成一种四亚基结构[6], β亚单位具有酪氨酸激酶活性特点, 属于跨膜受体酪氨酸激酶, 能交叉催化相应部位的β亚单位上的磷酸化位点磷酸化, 引起相应的细胞内信号传导和基因表达转化, 进而导致细胞有丝分裂分化及细胞分裂增殖, 细胞的过度分裂增殖则使肿瘤的发生几率大大增加[7]. IGF-1R与其相应的配体结合后, 可以发挥调控下游信号系统的作用, 促进细胞有丝分裂、提供某些类型的细胞形成、转化表型及发生肿瘤的必要条件[8], 同时发挥明显减少肿瘤细胞凋亡的作用[9]. IGF-1R在细胞的恶性表型的形成及长期维持上起了关键作用, 在许多肿瘤组织中IGF-1R均有高表达, 与肿瘤的发生发展、增殖失控、分化侵袭及转移密切相关[10]. IGF-1R的信号传导通路主要有两条信号传导链的激活启动, 位置均于细胞内, 第一条为磷脂酰肌醇3激酶(phosphoinositide 3-kinase, PI3K)-蛋白激酶(protein kinase B, AKT)-mTOR通路, 另一条信号传导通路为Ras/Raf/有丝分裂原激活蛋白激酶(mitogen-activated protein kinase, MAPK)通路[11]. IGF-1R的生物学活性在于其通过信号传导通路主导细胞的凋亡及肿瘤细胞的生长和增殖. 尽管目前对IGF-1R的组成轴在肿瘤中的作用研究较热, 但就其在肿瘤发展过程中分子水平的表达作用机制知之甚少. Dziadziuszko等在肺癌、胰腺癌及肠癌等组织中均发现了不同水平表达的IGF-1R[12-15], 在特异性表达KIT蛋白(CD117)和野生型PDGFR-α的GIST中, IGF-1R再次被证明有着明显的高表达水平[16]. 这些证据充分证明了IGF-1R在恶性肿瘤中发挥着重要作用, 在细胞的凋亡与增殖中有着主导倾向性, 打破正常细胞代谢的平稳性, 造成细胞染色体的不稳定及表型相关的微卫星不稳定, 从而促进细胞的增殖及肿瘤的形成. IGF-1R在正常组织细胞中一般为低表达或不表达, 但在人类一些肿瘤组织中存在高表达, 其表达在某些肿瘤的发生发展及治疗预后中起着重要的作用. IGF-1R能使肿瘤细胞进一步增殖分化及转移的可能机制有: (1)IGF-1R可明显提高肿瘤细胞中某些生长因子的表达, 如血管内皮生长因子(vascular endothelial growth factor, VEGF), 后者具有特异性作用于血管内皮细胞的功能, 直接参与诱导肿瘤血管的形成; (2)促进相关黏蛋白如纤黏连、钙黏、层黏连等蛋白等的合成, 增加肿瘤细胞对基底膜、内皮的黏附活性; (3)上调一些维持细胞内环境稳定的相关因子的表达, 提升如金属蛋白酶(metalloproteinases, MMP)和尿激酶型纤溶酶原活化因子(u-PA)等[17]的表达水平, 从而促进细胞外基质的降解及促进肿瘤细胞越过降解的细胞外基质, 进一步导致肿瘤的浸润.
本实验采用PV-9000二步免疫组织化学法检测胃癌及癌旁组织中IGF-1R的表达水平, 结果显示, 胃癌组织和癌旁组织中IGF-1R蛋白阳性表达分别为39例(55.71%)、8例(25.00%), 二者差别有统计学意义(P<0.01), 阳性细胞染色表达定位于细胞质、细胞膜及少部分细胞核中, 表明IGF-1R的高表达可能与胃癌的发生有关. 日本学者Matsubara等[18]研究得出IGF-1R在胃癌组织中的表达率为78.95%, 本实验发现IGF-1R蛋白表达水平与胃癌分化程度、浸润深度、淋巴结转移、TNM分期有关, 且在有无淋巴结转移组间及在TNM分期中Ⅰ+Ⅱ与Ⅲ+Ⅳ期组间比较均有显著差异(P<0.01). IGF-1R蛋白阳性表达与患者的性别、年龄、肿瘤大小、部位及Borrmann分型均无明显差异相关性(P>0.05). 而Ge等[19]研究发现IGF-1R在胃癌中的表达与肿瘤的大小、淋巴结的转移情况、胃壁的浸润深度、肿瘤的分化程度及TNM分期相关, 结论与本研究结果有所区别, 可能与样本数量的大小及检测IGF-1R表达水平的方法不同有关, 同时他们指出IGF-1R高表达者, 对进一步化疗敏感的程度、预后生存期的统计均明显低于IGF-1R低表达者或不表达者. 根据研究结果, IGF-1R阳性程度的表达与胃癌的淋巴结转移、TNM临床分期相关, 检测IGF-1R表达水平可间接判断胃癌患者的预后不良; IGF-1R阳性程度的表达与肿瘤浸润深度有关, 检测IGF-1R可间接提示肿瘤的生长浸润程度; IGF-1R阳性程度的表达与组织的分化程度低有关, 检测IGF-1R表达可间接判读胃癌的恶性程度及发展速度. 由此得出: IGF-1R在胃癌诊断、病情进展等方面具有重大意义,可能会成为新型标志物之一.
IGF-1是一种促生长因子, 为一种分泌蛋白, 为胰岛素家属蛋白中一员, 由70个氨基酸构成, 相对分子质量为7649 Da, 是通过内分泌、自分泌、旁分泌的三种途径产生的低分子单链多肽, 人类主要合成分泌IGF-1的脏器有: 肝脏、肾脏、肺脏、脑、神经组织等. IGF-1可明显诱导细胞周期中减数分裂再次开始, 增强有丝分裂效应, 是非常重要的有丝分裂促进剂之一. 通过促进机体糖原合成代谢来刺激细胞增殖及分化, 同时又具有切断凋亡部分途径抑制细胞凋亡的特性, 上调细胞周期中周期素D1(cyclin D1)的表达, 增加DNA的合成, 进而加速代谢周期中细胞从G1至S期生长发展过程. IGF-1的信号通路主要为PI3K-AKT通路和MAPK通路, 与IGF-1R的信号传导链的激活启动一致; IGF-1通过促进细胞有丝分裂扩增效应, 继而可促进细胞, 尤其是肿瘤细胞的增殖、分化及存活, 同时亦可抑制细胞的凋亡. IGF-1抑制细胞凋亡的基因信号机制有: 通过激活PI3K、AKT介导的信号通路阻止细胞凋亡[20]; 通过MAPK信号转化到细胞核内, 修饰基因转录, 阻止细胞凋亡[21]; 联合其他蛋白因子如Bcl-2蛋白、P53等阻止线粒体膜的去极化和细胞色素C的释放来抑制细胞凋亡; 此外, IGF-1与其受体IGF-1R通过与其他因子如VEGF-C的相互作用, 诱导恶性肿瘤的血管生成, 从而进一步影响肿瘤的侵袭和转移能力, 这些功能包括细胞的生长增殖、细胞的运动调节入侵、细胞在组织第二站的增长、及获得对多种药物耐药的能力. IGF-1在体内主要由肝脏合成分泌, 发挥促进有丝分裂、细胞增殖及抑制细胞凋亡的作用; 通过不同分泌方式的途径来实现其功能, 主要有自分泌、旁分泌及内分泌三种方式, 而自分泌及旁分泌为其最主要的途径. IGF-1在正常组织细胞中一般为较低表达, 在胃癌组织中呈现明显升高的表达水平, IGF-1在胃癌的发生发展中起着关键作用, 同时在胃癌组织周边淋巴管生成, 胃癌淋巴结转移中亦起着重要作用.
本实验采用PV-9000二步免疫组织化学法检测胃癌及癌旁组织中IGF-1的表达水平, 结果显示胃癌组织和癌旁组织中IGF-1蛋白的阳性表达分别为37例(52.86%)、5例(15.63%), 差异有统计学意义(P<0.01); 阳性细胞染色表达主要定位于细胞质, 少部分定位于细胞核, 表明IGF-1的高表达可能与胃癌的发生发展有关. 研究IGF-1在胃癌中的高表达具有一定的临床意义, 另有研究, IGF-1蛋白高表达的患者术后5年生存率明显低于IGF-1低表达的患者, 说明IGF-1的水平可以帮助预测患者预后.本研究得出IGF-1蛋白表达水平与胃癌浸润深度、淋巴结转移、TNM分期有关(P<0.05); IGF-1蛋白阳性表达与患者的性别、年龄、肿瘤大小、部位、肿瘤分化程度、Borrmann分型均无明显相关(P>0.05), IGF-1在胃癌组织中存在着显著表达, IGF-1阳性程度的表达与胃癌的淋巴结转移、TNM临床分期相关, 故检测IGF-1可间接判断胃癌患者的预后不良; IGF-1阳性程度的表达与肿瘤浸润深度有关, 检测IGF-1R可间接提示肿瘤的生长浸润程度, 可作为判读胃癌预后的参考指标之一, 由此我们得出: IGF-1在胃癌筛查、病情评估及预后情况等方面有着一定的参考价值. 有望成为监测胃癌诊断及判断预后的一项标志物, 研究其靶点基因可为有效治疗提供新的思路.
IGF-1R与IGF-1是胰岛素样生长因子家族蛋白(IGFs)中两个重要的多肽成员, 表达受限于生长激素, 具有促进细胞有丝分裂, 合成翻译核酸DNA、蛋白质及代谢碳水化合物、葡萄糖类等物质的作用, 可以通过自分泌及旁分泌方式参与组织细胞的生长分化、胚胎发育, 增殖凋亡和细胞转化及肿瘤的发生发展起重要作用, 当这些作用过分表达时, 细胞即会向恶性表型表达; IGF-1必须通过结合其受体(IGF-1R)才能发挥调节细胞分化转化、增殖凋亡的作用, IGF-1受体为IGF-1的相关表达起介导作用, 在某些IGF-1R基因缺陷的动物模型试验中发现肿瘤的发生发展明显较正常者发生率低[22]. 本实验在进行了IGF-1R与IGF-1在胃癌组织中表达情况关联性分析, 通过Spearman秩和检验相关性分析后得出r = 0.310, P<0.01, 提示两者表达有显著相关性. 说明IGF-1R与IGF-1在胃癌的发生发展中起着协同作用, 两者共同分析表达水平可作为胃癌发生发展及预后的监测指标.
总之, IGF-1R、IGF-1在胃癌组织存在着明显过表达, 提示参与了胃癌的发生. IGF-1R与IGF-1的表达呈正相关, 在胃癌的发生发展中起着协同作用. IGF-1R在胃癌组织的阳性表达与肿瘤组织分化程度、浸润深度、淋巴结转移、TNM分期相关联, 其中与淋巴结转移和TNM分期相关联性更明显; IGF-1在胃癌组织中的阳性表达与胃癌浸润深度、淋巴结转移、TNM分期相关联. IGF-1R、IGF-1在胃癌筛查诊断、病情发展评估及预后生存情况等方面有着一定的参考价值, 有望成为监测胃癌诊疗水准的新型标志物. 随着在分子水平上对IGF-1R、IGF-1的进一步深入研究, 有望找到抑制IGF-1R、IGF-1信号传导通路上的靶点, 从而为胃癌的诊疗提供更有效的方法.
胃癌在我国是最常见的恶性肿瘤之一, 为常见癌症发生第2位及癌症死因第3位; 近5年, 我国每年新发胃癌病例达40万左右, 占全球发病率的42%, 且发病率以每年1.6%的幅度逐渐攀升; 胃癌早期常无特异性临床表现, 绝大多数患者确诊时已属中晚期, 预后较差. 因此寻找能灵敏预警胃癌发生发展的生物学标志显得尤为重要.
傅红, 副教授, 上海复旦大学肿瘤医院肿瘤外科
本文重点就胰岛素样生长因子-1受体(insulin-like growth factor type 1 receptor, IGF-1R)、胰岛素样生长因子-1(insulin-like growth factor type 1, IGF-1)在胃癌中的表达及临床意义做出了详细研究.
胃癌的早期诊断治疗目前特异性生物学标志有CEA、CA724等相关癌性指标.
本文较系统的总结了胃癌组织中存在IGF-1R、IGF-1的表达升高现象, 同时对胃癌组织中的IGF-1R、IGF-1表达与临床病理特征做了较深刻的分析.
IGF-1R、IGF-1在胃癌诊断、病情发展方面, 有着一定的临床应用价值.
本文有一定临床指导意义.
编辑 田滢 电编 闫晋利
| 1. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 2. | Ferlay J, Steliarova-Foucher E, Lortet-Tieulent J, Rosso S, Coebergh JW, Comber H, Forman D, Bray F. Cancer incidence and mortality patterns in Europe: estimates for 40 countries in 2012. Eur J Cancer. 2013;49:1374-1403. [PubMed] [DOI] |
| 3. | Cheung TK, Wong BC. Treatment of Helicobacter pylori and prevention of gastric cancer. J Dig Dis. 2008;9:8-13. [PubMed] [DOI] |
| 4. | Yamada Y, Boku N, Nishina T, Yamaguchi K, Denda T, Tsuji A, Hamamoto Y, Konishi K, Tsuji Y, Amagai K. Impact of excision repair cross-complementing gene 1 (ERCC1) on the outcomes of patients with advanced gastric cancer: correlative study in Japan Clinical Oncology Group Trial JCOG9912. Ann Oncol. 2013;24:2560-2565. [PubMed] [DOI] |
| 5. | Chen HX, Sharon E. IGF-1R as an anti-cancer target--trials and tribulations. Chin J Cancer. 2013;32:242-252. [PubMed] [DOI] |
| 6. | Wang Z, Liang Z, Liu J, Shi W, Bai P, Lin X, Magaye R, Zhao J. Expression and clinical significance of IGF-1, IGFBP-3, and IGFBP-7 in serum and lung cancer tissues from patients with non-small cell lung cancer. Onco Targets Ther. 2013;6:1437-1444. [PubMed] |
| 7. | Atzori F, Traina TA, Ionta MT, Massidda B. Targeting insulin-like growth factor type 1 receptor in cancer therapy. Target Oncol. 2009;4:255-266. [PubMed] [DOI] |
| 8. | Aleksic T, Chitnis MM, Perestenko OV, Gao S, Thomas PH, Turner GD, Protheroe AS, Howarth M, Macaulay VM. Type 1 insulin-like growth factor receptor translocates to the nucleus of human tumor cells. Cancer Res. 2010;70:6412-6419. [PubMed] [DOI] |
| 9. | Massoner P, Ladurner-Rennau M, Eder IE, Klocker H. Insulin-like growth factors and insulin control a multifunctional signalling network of significant importance in cancer. Br J Cancer. 2010;103:1479-1484. [PubMed] [DOI] |
| 10. | Mitchell GC, Fillinger JL, Sittadjody S, Avila JL, Burd R, Limesand KH. IGF1 activates cell cycle arrest following irradiation by reducing binding of ΔNp63 to the p21 promoter. Cell Death Dis. 2010;1:e50. [PubMed] [DOI] |
| 11. | Dalle S, Imamura T, Rose DW, Worrall DS, Ugi S, Hupfeld CJ, Olefsky JM. Insulin induces heterologous desensitization of G-protein-coupled receptor and insulin-like growth factor I signaling by downregulating beta-arrestin-1. Mol Cell Biol. 2002;22:6272-6285. [PubMed] [DOI] |
| 12. | Dziadziuszko R, Merrick DT, Witta SE, Mendoza AD, Szostakiewicz B, Szymanowska A, Rzyman W, Dziadziuszko K, Jassem J, Bunn PA. Insulin-like growth factor receptor 1 (IGF1R) gene copy number is associated with survival in operable non-small-cell lung cancer: a comparison between IGF1R fluorescent in situ hybridization, protein expression, and mRNA expression. J Clin Oncol. 2010;28:2174-2180. [PubMed] [DOI] |
| 13. | Gong Y, Yao E, Shen R, Goel A, Arcila M, Teruya-Feldstein J, Zakowski MF, Frankel S, Peifer M, Thomas RK. High expression levels of total IGF-1R and sensitivity of NSCLC cells in vitro to an anti-IGF-1R antibody (R1507). PLoS One. 2009;4:e7273. [PubMed] [DOI] |
| 14. | Zha J, O'Brien C, Savage H, Huw LY, Zhong F, Berry L, Lewis Phillips GD, Luis E, Cavet G, Hu X. Molecular predictors of response to a humanized anti-insulin-like growth factor-I receptor monoclonal antibody in breast and colorectal cancer. Mol Cancer Ther. 2009;8:2110-2121. [PubMed] [DOI] |
| 15. | Pitts TM, Tan AC, Kulikowski GN, Tentler JJ, Brown AM, Flanigan SA, Leong S, Coldren CD, Hirsch FR, Varella-Garcia M. Development of an integrated genomic classifier for a novel agent in colorectal cancer: approach to individualized therapy in early development. Clin Cancer Res. 2010;16:3193-3204. [PubMed] [DOI] |
| 16. | Tarn C, Rink L, Merkel E, Flieder D, Pathak H, Koumbi D, Testa JR, Eisenberg B, von Mehren M, Godwin AK. Insulin-like growth factor 1 receptor is a potential therapeutic target for gastrointestinal stromal tumors. Proc Natl Acad Sci U S A. 2008;105:8387-8392. [PubMed] [DOI] |
| 17. | Dunn SE, Torres JV, Oh JS, Cykert DM, Barrett JC. Up-regulation of urokinase-type plasminogen activator by insulin-like growth factor-I depends upon phosphatidylinositol-3 kinase and mitogen-activated protein kinase kinase. Cancer Res. 2001;61:1367-1374. [PubMed] |
| 18. | Matsubara J, Hirashima Y, Yamada Y. [Impact of HER2, EGFR, IGF-1R, and VEGFR expressions on the outcome of chemotherapy for advanced gastric cancer]. Gan To Kagaku Ryoho. 2010;37:1489-1496. [PubMed] |
| 19. | Ge J, Chen Z, Wu S, Chen J, Li X, Li J, Yin J, Chen Z. Expression levels of insulin-like growth factor-1 and multidrug resistance-associated protein-1 indicate poor prognosis in patients with gastric cancer. Digestion. 2009;80:148-158. [PubMed] [DOI] |
| 20. | Badr G, Garraud O, Daghestani M, Al-Khalifa MS, Richard Y. Human breast carcinoma cells are induced to apoptosis by samsum ant venom through an IGF-1-dependant pathway, PI3K/AKT and ERK signaling. Cell Immunol. 2012;273:10-16. [PubMed] [DOI] |
| 21. | Ness JK, Scaduto RC, Wood TL. IGF-I prevents glutamate-mediated bax translocation and cytochrome C release in O4+ oligodendrocyte progenitors. Glia. 2004;46:183-194. [PubMed] [DOI] |
| 22. | Varkaris A, Gaur S, Parikh NU, Song JH, Dayyani F, Jin JK, Logothetis CJ, Gallick GE. Ligand-independent activation of MET through IGF-1/IGF-1R signaling. Int J Cancer. 2013;133:1536-1546. [PubMed] [DOI] |