肝门部胆管癌的发生是一个涉及到细胞增殖、凋亡、分化等方面的相关机制的复杂过程. 随着分子生物学技术的进步以及人们对恶性肿瘤在细胞受体及增殖调控等分子水平的不断研究, "分子靶向治疗"的治疗方法逐渐进入研究者的视线. 近年来诸多研究认为白介素-6(interleukin 6, IL-6)和环氧化酶(cyclooxygenase, COX)水平的高低与胆管癌的发生发展及预后有关, 这些细胞因子的详细作用机制可能为肝门胆管癌的治疗提供新的方法. 本文就IL-6和COX对于胆管癌的目前研究情况进行综述.
关键词: 白介素-6; 环氧化酶2; 胆管癌; 肝门胆管癌; 研究进展
核心提示: 白介素-6(interleukin-6, IL-6)或环氧化酶2(cyclooxygenase-2, COX-2)信号的激活均可使前列腺素E2(prostaglandin E2)合成增加, 促进细胞存活, 刺激增殖和活力, 诱导血管生成等. 针对COX-2信号和其他有关的关键分子在胆管癌变中的作用, 联合抑制IL-6和COX-2的治疗, 对于肝门胆管癌或许是治疗的合适选择.
引文著录: 李志鹏, 曾兆林. 肝门胆管癌中IL-6与COX-2作用的研究进展. 世界华人消化杂志 2014; 22(22): 3225-3231
Interleukin-6 and cyclooxygenase-2 in hilar cholangiocarcinoma
Zhi-Peng Li, Zhao-Lin Zeng
Zhi-Peng Li, Zhao-Lin Zeng, Department of Hepatic Surgery, the Second Affiliated Hospital, Harbin Medical University, Harbin 150086, Heilongjiang Province, China
Correspondence to: Zhao-Lin Zeng, Chief Physician, Department of Hepatic Surgery, the Second Affiliated Hospital, Harbin Medical University, 148 Baojian Road, Nangang District, Harbin 150086, Heilongjiang Province, China. zengzhaolin999@sina.com
Received: May 27, 2014
Revised: June 12, 2014
Accepted: June 22, 2014
Published online: August 8, 2014
0 引言
肝门胆管癌是指发生在左肝管、右肝管、左右肝管分叉部和肝总管上段的癌, 又称Klatskin肿瘤, 亦称高位胆管癌[1]; 约占胆管癌总发病率的60%-70%[2]. 因缺乏早期特异性的临床表现而诊断困难, 大多数病例就诊时往往已侵犯周围脏器而无法手术切除. 白介素-6(interleukin-6, IL-6)是一种多效细胞因子, 不但能诱导肿瘤细胞生长, 还有抗凋亡的作用. 国外有研究显示, IL-6水平的增高对胆管癌诊断的灵敏度、特异性分别为100%与91.4%, 而且胆管癌患者血清中的IL-6值与肿瘤负荷量呈正相关[3]. 环氧化酶(cyclooxygenase, COX)在某些细胞内、外刺激因子的刺激下其表达急剧增加, 产生前列腺素类(prostaglandins, PGs)物质, 在肿瘤组织的生长中发挥着重要作用. 另有很多证据显示在IL-6和COX-2参与的肿瘤形成中, 刺激IL-6或COX-2信号通路均可使介导的前列腺素E2(prostaglandin E2, PGE2)合成增加. 因而推测在IL-6和COX-2之间存在交叉对话.
1 胆管癌
胆管癌的发病率约占人类恶性肿瘤的2%, 男性发病稍高于女性, 约为1.5:1[4]; 而其中的58%-75%发生在肝胆管分叉处[5]. 据统计, 肝门胆管癌的发病率和死亡率有逐年上升的趋势[6]. 有报道称, 原发硬化性胆管炎、胆道慢性炎和胆汁淤积引起的胆管细胞损伤[7,8]以及寄生虫感染[9]是胆道肿瘤发生的最重要原因. 肝门胆管癌不仅是一个局部病变, 更是一个区域性病变[10], 由于解剖部位特殊, 其周围的淋巴组织临近肝组织、血管、神经等特征, 肿瘤常累及周围组织、发生淋巴结转移, 并多呈浸润、跳跃性生长, 预后不甚理想[11]. 目前研究者认为, 根治性手术切除是肝门胆管癌患者获得长期生存最重要的措施[12]. 然而, 由于该病的解剖以及生长特性, 早期缺乏特异性的临床表现而诊断困难, 大多数病例在就诊时往往已侵犯周围脏器, 而无法手术切除. 一些单药或联合细胞毒类药物对胆管癌的治疗反应率低, 而且对患者的不良反应大, 目前尚没有相应的化疗方案显示能延长晚期胆管癌患者的生存期[13]; 也无随机前瞻性临床试验支持常规使用辅助、新辅助或姑息性化疗. 而放疗一般对胆管癌也不敏感, 作用效果不理想[13]. 近年来, 随着分子生物学技术的进步以及人们对恶性肿瘤在细胞受体及增殖调控等分子水平的不断研究, 细胞受体、调控分子和关键基因为靶点的"分子靶向治疗"的治疗方法逐渐进入研究者的视线[14].
2 IL-6
IL-6是一种多效性细胞因子, 能调节多种细胞功能. 包括细胞增殖、细胞分化、免疫防御机制及细胞生成. IL-6可由T细胞、B细胞、单核细胞、上皮细胞以及一些肿瘤细胞等多种细胞分泌, 通过自分泌或旁分泌与IL-6的膜受体或可溶性受体结合而发挥其生物活性[15]. IL-6的信号传导作用是由IL-6受体所介导的. IL-6受体由配体结合链(CD126)和信号传递链(gp130)组成, 后者无配体结合能力, 但参与组成IL-6高亲和力结合位点; IL-6受体广泛表达于活化B细胞、骨髓瘤细胞、髓样白血病细胞、肝细胞等细胞的表面. IL-6R能与IL-6形成复合物, 进一步与gp130结合. 发挥IL-6的生物学作用[16]. 在信号传递过程中, JAK蛋白酪氨酸激酶、转录激活子(signal transducer and activator of transcription, STAT)以及Ras信号途径中的各种蛋白都参与了IL-6R在靶细胞中的信号转导, 形成了JAK/STAT途径、Ras/细胞外调节蛋白激酶(extracellular signal-regulated kinase, Erk)途径、磷脂酰肌醇3激酶(phosphatidyl inositol 3-kinase, PI3K)等介导的信号通路, 通过调控肿瘤细胞的细胞周期, 调节癌基因的表达, 促进肿瘤血管的生成, 促进肿瘤的侵袭转移等多种机制, 影响着肿瘤的发生和发展[17].
近年来, 胆管癌的发生率呈逐年上升趋势[6]. 有关胆管癌发病机制方面的研究成为研究焦点, 尤其是异常高表达的IL-6在胆管癌的作用逐渐受到重视[18]. Meng等[19]研究表明, 在胆管炎患者的胆汁以及胆管癌患者的血清中, IL-6的水平均明显增高; 尤其是在胆管癌中, IL-6值与肿瘤负荷及患者的预后有明显相关. 国外有研究显示, IL-6水平的增高对胆管癌诊断的灵敏度、特异性分别为100%与91.4%, 而且胆管癌患者血清中的IL-6值与肿瘤负荷量呈正相关[3].
根据研究认为, IL-6可以通过改变胆管癌细胞启动子的甲基化并调控下游基因的表达[20]、激活下游丝裂原活化蛋白激酶[19]、提高细胞端粒酶的活性[21]等方面影响胆管癌细胞的增殖. 体外实验表明, 不同浓度的IL-6对胆管癌的有不同的增殖作用, 随着rhuIL-6刺激剂量的增加, STAT3被激活的特异性条带逐渐增加[22]. 此外, IL-6在诱导胆管肿瘤血管生成中也起到一定的重要作用, 新生血管在向肿瘤组织运送营养物质及排泄代谢废物的同时, 肿瘤细胞也在进行血行转移[23].
此外, IL-6在诱导肿瘤细胞生长的同时, 还起到一定的抗凋亡作用. 研究已证实, IL-6可以激活PI3K/AKT和JAK/STAT3途径共同发挥其抗凋亡作用, 从而促进肿瘤的发生[24]. IL-6作为一种具有多种功能的细胞因子, 参与肿瘤细胞的增殖和凋亡的调控, 与多种肿瘤的发生发展关系密切[25-31].
有学者认为, IL-6不但与胆管癌的发生关系密切, 并与其诊断及预后有一定关联. Cheon等[32]报道, 通过对胆管癌患者与正常人血清中IL-6水平的研究发现, 胆管癌患者中IL-6的浓度明显高于正常人的水平; 胆管癌患者在经过一定的光子治后, IL-6的水平渐趋于正常. 因此认为, 血清IL-6的水平测定对于诊断胆管癌具有重要的参考意义, 并可作为光子疗法治疗胆管癌效果的监测指标.
3 COX-2
目前已经确定的COXs有COX-1和COX-2两个亚型, 二者可催化相似的酶促反应. 尽管有着结构上相似性, 但COX-1和COX-2拥有其各自的调节和功能. COX-1表达在机体大多数组织中, 并通过生成的PGs控制正常的生理功能, 包括保护胃黏膜、血小板聚集和肾血流量的调节. 生理状态下COX-2在正常组织细胞不表达或低水平表达, 而某些细胞内外刺激因子可使其表达急剧增加. COX-2能将细胞内释放的花生四烯酸进一步代谢产生PGE2, 随后与G蛋白偶联型受体结合, 产生前列腺素类物质如PGE2、血栓烷素A2等, 并启动细胞内的事件. 大量研究证实, 许多肿瘤细胞中PGE2合成分泌的增加, 与细胞增殖、迁移及抑制肿瘤细胞凋亡相关[33]. 通过对大多数高表达前列腺素的上皮恶性肿瘤的检测, 前列腺素已被证明是促进细胞存活, 刺激细胞增殖和活力, 诱导血管生成和抑制免疫监视[34].
COX-2的上调已在家族性腺瘤性息肉病和散发性大肠癌, 以及在胃、肺、食道、肝、胰腺等癌症中被观察到[34]. 在人类胆管癌细胞的细胞质和原发性硬化性胆管炎患者的胆管上皮细胞也表现出COX-2的阳性高表达, 而正常胆管上皮细胞则表现为COX-2的低表达[35-37]. 在体外培养的人胆管癌细胞中, COX-2的过表达可以促进PGE2的生成以及肿瘤生长, 而抑制COX-2的表达则可降低胆管癌细胞的生长[38,39]. COX-2的表达与肿瘤发生发展的密切关系, 表明COX-2可能是一个合适的癌症的化学预防指标. 在相关的动物实验中, COX-2选择性抑制剂可使多种肿瘤的形成减少[34]. 可以猜测, 选择性COX-2抑制剂在抑制胆管癌的治疗中至关重要. 另有研究发现, COX-2抑制剂能降低肿瘤的发生率和病死率, 而其抗肿瘤作用与其抑制COX-2的活性, 减少前列腺素的生成有关[40].
多种肿瘤如头颈部肿瘤、肝癌、胰腺癌等肿瘤[41]在体内外均能使前列腺素类, 尤其是PGE2合成增加. 胆道上皮细胞和胆管癌细胞的PG主要是PGE2[34]. PGE2通过与自身细胞(自分泌)或相邻细胞(旁分泌)G蛋白偶联的EP1、EP2、EP3和EP4受体[42]相互作用发挥其生理作用. EP受体为7次跨膜G蛋白偶联受体, 受体胞外结构域识别胞外信号分子并与之结合, 胞内结构域与G蛋白偶联, 调节相关酶活性, 在细胞内通过第二信使将信号跨膜传递至胞内. 选择性拮抗剂阻断EP1受体后, 可降低PGE2诱导胆管癌细胞增殖和侵袭的能力. 相比之下, EP2、EP3及EP4受体和反义抑制这些受体的激动剂则对细胞浸润无相关明显作用[34].
有研究表明, 在PGE2诱导的细胞生长中, EP1受体介导的Akt活化起了一个重要的作用[42]. 其他活化的机制包括通过cAMP/蛋白激酶A(protein kinase A, PKA)信号级联的磷酸化; 高浓度钙离子促使表皮生长因子受体(epidermal growth factor receptor, EGFR)磷酸化, 激活Erk和Akt信号转导通路[43]等.
4 COX-2与IL-6的相互联系
过去认为COX-2抑制剂是通过阻断COX-2通路, 减少COX-2的产物(PG)生成而达到其抗癌活性作用. 而在近几年文献报道中, COX-2的非依赖通路在肿瘤中也被发现[44,45], 其作用靶点包括蛋白激酶以及其上游的磷酸肌醇依赖激酶1(phosphoinositide dependent kinase 1, PDK1)、CDK周期蛋白、STAT3等. COX-2抑制剂应用于培养的人类和大鼠胆管癌细胞, 可诱导出现明显的细胞凋亡, 细胞死亡; 其通过抑制Akt的减少导致胆管癌细胞活力下降表明, Akt的失活, 被涉及在COX-2抑制剂介导的细胞凋亡[46].
Ancrile等[47]研究发现, IL-6可以促进Ras的致癌效力, 但在敲除IL-6相关基因后可以阻断Ras/MAPK介导的肿瘤细胞生长, 因此认为IL-6可能是Ras/MAPK的下游基因的一个效应因子; 同时还发现, IL-6还可起到Ras/MAPK上游基因的作用. 因而推测, 在IL-6与Ras/MAPK之间存在一定的相互影响的环路联系.
研究还发现, 前列腺素的信号传导除了直接促进细胞生长, 也参与胆道中IL-6诱导的胆管癌细胞生长. 阻断PGE2的合成, 也能部分地抑制IL-6诱导的胆管癌细胞生长[48]. 有研究表明, 除了IL-6可诱导PG合成, PGE2也可增加IL-6的生成, 并激活细胞内IL-6介导的信号转导通路[49]. 而在其他相关文献报道中发现: IL-6信号通路激活后促使MAPK的活性增加, 导致细胞内磷脂酶A2(cytosolic phospholipase A2, cPLA2)介导的花生四烯酸增多, 增加了COX-2的作用底物合成; 与此同时, COX-2介导生成的PGE2可以启动正反馈途径刺激IL-6通路, 从而刺激细胞的增殖[34]. 因此, IL-6和cPLA2/COX-2的回路介导的PG的信号传导通路的自分泌/旁分泌可促进胆管癌的发生发展.
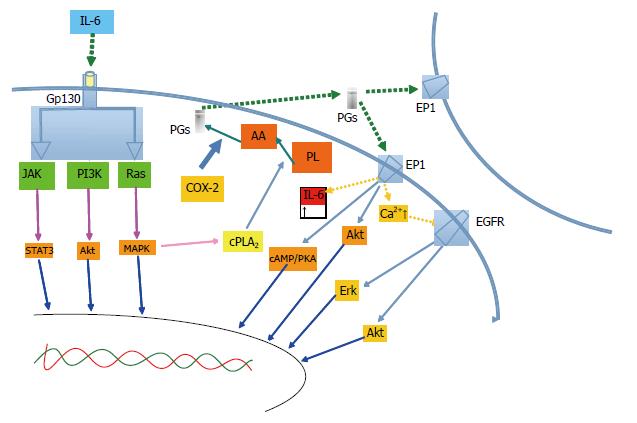
总之, 细胞内的IL-6和COX-2之间存在着一定的交叉对话, 很可能为: IL-6与IL-6R结合激活IL-6介导的信号通路后, 信号向细胞核传导促进癌细胞的增生; 同时, 还可以促进COX-2通路的活性, 增加前列腺素合成、正反馈刺激IL-6通路(图1).
图1 胆管细胞增生信号传导途径.
IL-6: 白介素-6; JAK: 酪氨酸激酶; PI3K: 磷脂酰肌醇3激酶; STAT3: 信号转导子与转录激活子; Akt: 蛋白激酶; MAPK: 丝裂原活化蛋白激酶; COX-2: 环氧合酶-2; AA: 花生四烯酸; PL: 磷脂; PGs: 前列腺素; cPLA2: 胞浆型磷脂酶A2; cAMP: 环磷酸腺苷; PKA: 蛋白激酶A; Erk: 细胞外信号调节激酶; EP1: 前列腺素受体1.
5 结论
肝门胆管癌由于其解剖位置及生理活性的特殊性, 预后不甚理想[11]. 此外, 胆管癌对一般放疗及化疗药物也不敏感[13,50]. 近年来, "分子靶向治疗"治疗方法逐渐进入研究者的视线[14].
正常情况下, 血清中IL-6及sIL-6R不能测出, 但在100%胆管癌、92.9%肝细胞癌、53.8%结直肠癌肝转移(metastatic colorectal cancer, MCRC)和40%良性胆道疾病(benign biliary tract disease, BBD)患者的血清中IL-6可被检测[51]. 而IL-6水平的增高对胆管癌诊断有较高的特异性(91.4%), 与肿瘤负荷量也呈正相关[3]. 有实验证明, 胆管癌细胞在无血清培养的情况下也能分泌一定量的IL-6, 说明在胆管癌细胞中存在着IL-6的自分泌; 而IL-6的自分泌环路在胆管癌的发生、发展中起到一定的重要作用[52]. COX-2水平的上调已在多种消化系肿瘤中被观察到. COX-2的表达在人胆管癌细胞和原发性硬化性胆管炎患者的胆管上皮细胞中明显高于正常肝内胆管上皮细胞的表达. 目前认为, COX-2的高表达与肿瘤细胞增殖、凋亡抑制、恶性转化等相关. COX-2能将细胞内释放的花生四烯酸进一步代谢成PGE2. 而此前研究显示, 多种肿瘤细胞能在体内外使PGE2合成分泌增加, 促进肿瘤细胞增殖、迁移及抑制肿瘤细胞凋亡[12].
在过去的研究中, 关于COX-2和胆管癌变之间的联系已经取得了重大进展. 虽然选择性COX-2抑制剂尚未在临床试验中评估化学预防胆管癌患者, 但其已被证明能抑制在体外和动物模型中的胆管癌变作用胆管癌细胞的生长. 最近, 有关人士提出一些发生在抗肿瘤化学预防中使用相对高剂量COX-2抑制剂的心血管不良反应[53]. 因此, 有迫切和实际需要, 开发新的化学预防策略. 多种证据显示, 在IL-6和COX-2参与的肿瘤形成中, IL-6或COX-2信号通路的激活均可使PGE2的合成增加. Wu[34]认为, 胆管细胞内的IL-6和COX-2的信号传导相互影响. IL-6信号活化后, 主要通过JAK/STAT途径、Ras/Erk途径、PI3K介导的信号通路发挥生物学功能, MAPKs信号还可导致磷脂酶A2磷酸化, 促进COX-2代谢产生PGE2, 与EP1结合后启动细胞内的事件; 与此同时, COX-2衍生的PGE2还可以正反馈IL-6通路活性, 刺激细胞增殖[34]. 肿瘤的相关回归分析中已经很少看到有选择性COX-2抑制剂单独应用. 临床前研究表明, 其他的抗肿瘤药物, 可增强选择性COX-2抑制剂的分子机制[34]. 因此, 对于胆管癌的治疗来说, 靶向处理IL-6与COX-2间的交叉对话有一定的重要意义. 而且, 联合阻断肿瘤细胞相关分子靶点, 能减少细胞内信号通路间的互补代偿效应, 从而有效地减弱癌细胞增殖、抗凋亡之间的协同作用, 增强单药的疗效.
IL-6和COX-2间的这种交叉对话在肿瘤的发生中具有重要作用. 但是, IL-6和他的下游效应分子也可以通过非COX-2/PGE2的途径而激活, 同样COX-2/PGE2也可以通过非IL-6信号通路调节. 因此, 联合疗法胆管癌的治疗显得尤为重要. 而COX-2抑制剂与常规放、化疗的联合疗法对肿瘤尤其是胆管癌的防治还需进一步临床观察. 然而, 近年有不少试验对联合治疗的效果提出质疑. 有报道称联合尼美舒利与放疗干预头颈细胞癌株SCC9和SCCD25, 结果并没有如预期出现放疗增敏作用[54]. 也有文献指出由于肿瘤自身产生大量的COX-2产物后表现出对COX-2抑制剂逃逸, 从而使COX-2抑制剂的抗肿瘤生成作用不能长期维持[55]. 目前, 靶向治疗是抗肿瘤研究的热点, 但其仅对部分患者有效且疗效短暂. 究其原因, 尚不十分清楚, 可能与信号转导系统之间的交叉对话有关. 因此, 选择多靶点联合治疗胆管癌, 应该具有一定的合理性.
总之, 针对COX-2信号和其他有关的关键分子在胆管癌变作用, 联合抑制IL-6和COX-2的靶向治疗, 对于肝门胆管癌或许是治疗的合适选择. 这种方法能协同的提供抗肿瘤效果且副作用较小. 在此背景下, 划定的COX-2活性的PG信号和其他监管途径, 如IL-6/GP130之间的相互关系, 预期将为发展未来的组合疗法提供重要的思路.
评论
背景资料
胆管癌的发生是一个涉及到多方面机制的复杂过程. 肝门胆管癌由于其解剖位置及生理活性的特殊性, 预后不甚理想. 此外, 胆管癌对一般放疗及化疗药物也不敏感 近年来, 随着分子生物学技术的进步以及人们对恶性肿瘤分子水平的不断研究, "分子靶向治疗"的治疗方法逐渐进入研究者的视线.
同行评议者
王铮, 副研究员, 西安交通大学医学院第一附属医院肝胆病院肝胆外科
研发前沿
多种证据显示, 在白介素-6(interleukin-6, IL-6)和环氧化酶2(cyclooxygenase-2, COX-2)参与的肿瘤形成中, IL-6或COX-2信号通路的激活均可使前列腺素E2(prostaglandin E2, PGE2)的合成增加. 临床前研究表明, 其他的抗肿瘤药物, 可增强选择性COX-2抑制剂的分子机制. 因此, 对于胆管癌的治疗来说, 靶向处理IL-6与COX-2间的交叉对话有一定的重要意义.
相关报道
Smith等研究发现, 生长因子、细胞因子、癌基因和促癌物刺激COX-2的转录, 通过Ras和蛋白激酶C(protein kinase C, PKC)介导的信号. Khan等研究表明, 胞浆型磷脂酶A2(cytosolic phospholipase A2, cPLA2)介导的花生四烯酸代谢生成的前列腺素可以直接影响某些酶的活性, 如PKC. Wu等认为, 胆管癌细胞中的IL-6诱导的前列腺素的合成, 可通过cPLA2的磷酸化介导, 并依赖于蛋白激酶.
创新盘点
联合阻断肿瘤细胞相关分子靶点, 能减少细胞内信号通路间的互补代偿效应, 从而有效地减弱癌细胞增殖、抗凋亡之间的协同作用, 增强单药的疗效. 对于胆管癌的治疗来说, 靶向处理IL-6与COX-2间的交叉对话有一定的重要意义.
应用要点
联合抑制IL-6和COX-2的靶向治疗, 二者能协同的提供抗肿瘤效果且不良反应较小. 在此背景下, 划定的COX-2活性的PG信号和其他监管途径, 如与IL-6/GP130之间的相互关系, 预期将为发展未来的组合疗法提供重要的思路.
同行评价
本文应在胆管癌、IL-6、COX-2及交互作用方面进行更加深入的描述.