修回日期: 2014-06-18
接受日期: 2014-06-19
在线出版日期: 2014-08-08
目的: 观察CD14-shRNA慢病毒载体转染SGC-7901细胞后CD14 mRNA及蛋白变化, 为胃癌发病机制的研究奠定实验基础.
方法: 将构建好的CD14-shRNA慢病毒载体, 转染SGC-7901细胞后, 用Real-time PCR和Western blot分别检测空白对照组、NC-CD14 shRNA阴性对照组及CD14-shRNA慢病毒载体组的CD14 mRNA和蛋白质的表达.
结果: CD14-shRNA慢病毒载体成功转染至胃癌细胞系, RT-PCR结果显示转染CD14-shRNA慢病毒组CD14的2Ct值(1±0.08)比NCshRNA对照组2Ct值(0.16±0.02)降低(P = 0.0001; P<0.001), 差异有统计学意义; Western blot检测结果显示, CD14-shRNA慢病毒组CD14蛋白相对表达量为0.01, 远远小于SGC-7901空白组(1.00)及NCshRNA阴性对照组(0.83).
结论: CD14-shRNA慢病毒载体转染至胃癌 SGC-7901细胞后能抑制胃癌细胞CD14 mRNA及蛋白表达, CD14在胃癌发生、发展中具有重要作用, 有望为胃癌防治提供新的思路.
核心提示: 采用shRNA技术构建稳定沉默CD14的人胃癌SGC-7901细胞体系, CD14在胃癌发生、发展中具有重要作用, 有望为胃癌防治提供新的思路.
引文著录: 张涛, 曹火留, 罗淑娟, 郑东林, 陈远能. 稳定沉默CD14胃腺癌SGC-7901细胞体系的构建. 世界华人消化杂志 2014; 22(22): 3194-3200
Revised: June 18, 2014
Accepted: June 19, 2014
Published online: August 8, 2014
AIM: To develop a SGC-7901 cell line with stably silenced expression of CD14 to provide an experimental basis for the study of the pathogenesis of gastric cancer.
METHODS: A CD14-shRNA lentiviral vector was constructed to transfect gastric cancer SGC-7901 cells. RT-PCR and Western blot were used to detect the CD14 mRNA and protein levels in untreated SGC-7901 cells (blank control group), SGC-7901 cells transfected with NC-CD14 shRNA (NC-CD14 shRNA control group) and SGC-7901 cells transfected with the CD14-shRNA lentiviral vector (CD14-shRNA lentiviral vector group).
RESULTS: CD14-shRNA expression vector was successfully constructed and transfected into gastric cancer cells. RT-PCR showed that the Ct value for the CD14-shRNA lentiviral vector group was significantly higher than those for the NC-CD14 shRNA control group and blank control group (P = 0.000; P < 0.001), and the 2Ct value for the CD14-shRNA lentiviral vector group (1±0.08) was significantly lower than those for the NC-CD14 shRNA control group and blank control group (P = 0.0001; P < 0.001). Western blot analysis showed that the relative expression of CD14 protein in the CD14-shRNA lentiviral vector group (0.01) was significantly less than that in the blank control group (1.0) and NC-CD14 shRNA control group (0.83).
CONCLUSION: A CD14-shRNA lentiviral vector has been successfully transfected into gastric cancer SGC-7901 cells, which can inhibit the expression of CD14 mRNA and protein in SGC-7901 cells.
- Citation: Zhang T, Cao HL, Luo SJ, Zheng DL, Chen YN. Construction of a gastric cancer cell line with stably silenced expression of CD14. Shijie Huaren Xiaohua Zazhi 2014; 22(22): 3194-3200
- URL: https://www.wjgnet.com/1009-3079/full/v22/i22/3194.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i22.3194
胃癌与饮食、感染、环境、遗传等因素关系密切, 其发生涉及多种基因突变的积累, 属于一种多基因疾病[1]. 该病致死率较高, 全世界每年约有647000例因胃癌死亡, 位居癌症死因的第2位[2]. 近年来, 尽管胃癌发病率在全球呈下降趋势, 但在中国、日本和韩国等地区仍维持较高的发病率[3]. 该病已严重影响到人民群众生命健康, 开展胃癌防治研究已成为当前我们面临的重要课题之一. 1994年, 世界卫生组织/国际癌症研究组织(World Health Organization/International Agency for Research on Cancer, WHO/IARC)将幽门螺杆菌(Helicobacter pylori, H. pylori)列为Ⅰ类致癌因子. 研究认为人群中绝大多数胃癌与H. pylori感染有关, 其流行病学和生物学行为与非H. pylori相关胃癌是截然不同的[4]. 研究发现, 遗传易感性差异可能决定不同个体感染H. pylori后炎性反应的过程及其严重程度, 最终决定细菌感染的结局[5]. CD14为细菌内毒素脂多糖(lipopolysaccharide, LPS)的高亲和受体, 主要表达于单核-巨噬细胞表面, 参与LPS的识别、结合并介导下游一系列的炎性反应. 近来有研究指出CD14启动子区的多态性与胃癌的易感性密切相关, 推测其可能与CD14的表达改变进而影响机体对LPS的识别存在某种联系[6], 国外学者[7-9]认为CD14在胃癌组织中存在高表达, CD14多态性能增加胃癌的风险. 本研究利用靶向性CD14-shRNA慢病毒载体, 转染胃癌细胞SGC-7901后, 用Real-time PCR和Western blot分别检测空白对照组、阴性对照组及CD14-shRNA慢病毒载体组的CD14 mRNA和蛋白质的表达, 进一步探讨RNAi抑制CD14表达对胃癌的功能作用, 以期为CD14与胃癌发生、发展的关系研究奠定基础.
人胃癌细胞SGC-7901由中山大学实验中心细胞库提供; 慢病毒阴性对照(NCshRNA)
GV112由上海吉凯基因化学技术有限公司提供, 包装量1×108 TU 40 μL; CD14-shRNA慢病毒: GV248由上海吉凯基因化学技术有限公司提供, 包装量1×108 TU 40 μL; Real-time PCR引物由广州吉坤公司合成. 胎牛血清、DMEM-高糖培养基、青链霉素、PBS磷酸钾缓冲液购自Hyclone公司; HRP标记的GAPDH优质内参购自上海康成生物公司; 一抗Anti-CD14 antibody、二抗Rabbit Anti-Mouse IgG(H+L)、Goat Anti-Rabbit IgG (H+L chain specific)购自southern biotech公司; 过氧化物酶标记兔抗山羊IgG、过氧化物酶标记兔抗大鼠IgG购自武汉博士德生物工程有限公司; 发光液、PVDF膜购自MILLIPORE公司.
1.2.1 感染细胞最佳感染复数(multiplicity of infection, MOI)的测定: 将处于生长良好状态的SGC-7901细胞接种3×103-5×103个目的细胞于96孔培养板中, 所加培养基体积为90 μL, 一次实验需要10个孔. 实验共分为两组不同感染条件, 每组均有3个不同梯度的MOI. 将10 μL 3个不同梯度的病毒加到各组的相应孔中, 加入的病毒量分别为1×106 TU, 1×105 TU, 1×104 TU, 而细胞经过生长, 此时细胞的数目大约为1×104个, 所以3个孔的MOI分别为100、10、1. 感染2-3 d后, 观察荧光表达情况. 对于生长缓慢代谢慢的细胞, 可以适当延长观察时间, 中途可以换液, 保持细胞的活性. 通过细胞感染效果, 确认目的细胞的感染条件和感染参数.
1.2.2 细胞感染: 将SGC-7901细胞接种2×103-5×103个目的细胞于24孔培养板中. 感染前从冰箱取出并在37 ℃水浴中快速融化病毒, 并立即用事先加热到37 ℃的新鲜完全培养基稀释成所需浓度, 轻轻混匀, 不要使用振荡器, 吸去细胞原有培养基, 将稀释好的病毒液, 以最佳MOI加入细胞中, 同时设置相应的空白对照试验(以未转染慢病毒载体的空细胞为空白对照, 以转染含无义序列的慢病毒载体为阴性对照, 即NCshRNA组), 37 ℃培养过夜, 感染后第2天, 吸去含病毒的培养液, 换上新鲜的完全培养液, 继续37 ℃培养, 感染6 h后换液; 感染后培养72 h后, 抽提总RNA和蛋白分别进行mRNA和蛋白水平的CD14表达检测;
1.2.3 RT-PCR检测CD14 mRNA表达: 收集细胞, 用TRIzol法提取各细胞总RNA, 采用cDNA第一链合成试剂盒反转录成cDNA. 按照引物设计原则设计PCR引物, CD14的上、下游引物序列分别为: 5'-ACACTCGCCTGCCTTTTCCT-3', 5'-GCGTCTCCATTCCTGTGTTG-3', 扩增片段长度170 bp, β-actin上、下游引物序列分别为: 5'-TGGATCAGCAAGCAGGAGTA-3', 5'-TCGGCCACATTGTGAACTTT-3', 扩增片段长度275 bp. PCR反应体系如下: cDNA模板5 μL, 上、下游引物各0.5 μL, 2×SYBR Green qPCR SuperMix 10 μL, ddH2O补足总体积至20 μL. PCR反应条件为: 50 ℃ 2 min; 95 ℃ 2 min; 95 ℃ 15 s; 60 ℃ 32 s读板, 共40个循环; 融解曲线分析: 温度60 ℃-95 ℃, 每个样重复3次.
1.2.4 Western blot检测CD14蛋白表达: 在细胞中加入RIPA裂解液提取总蛋白, BCA法定量蛋白. 将提取好样品的蛋白进行SDS-PAGE, 电泳结束后电转移至PVDF膜上, 5%脱脂奶粉溶液室温封闭1 h. 加入合适的一抗稀释浓度4 ℃温育过夜(CD14按1:500稀释, GAPDH按1:1000稀释), 加入1:4000倍稀释的二抗, 37 ℃孵育1 h. 温育结束后, ECL底物发光法进行曝光. 洗涤PVDF膜, 剥脱后加入1:10000内参抗体, 4 ℃温育过夜, 曝光成像.
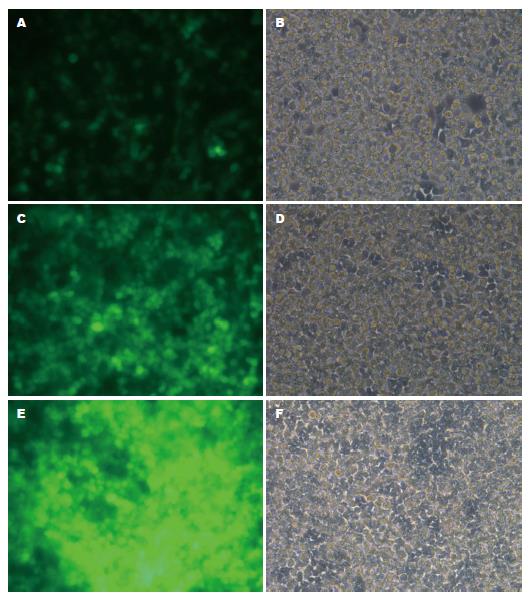
成功转染慢病毒CD14-shRNA的SGC-7901人胃腺癌细胞可表达绿色荧光蛋白, 测得在病毒MOI = 10时转染72 h后, 腺病毒的转染效率最佳(图1).
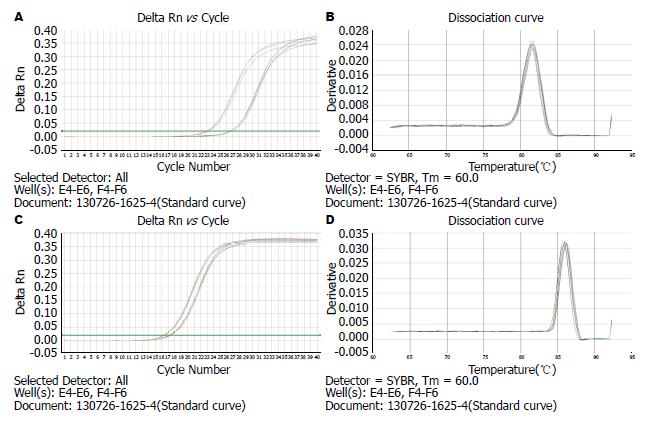
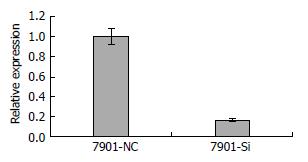
RT-PCR结果显示, CD14及参照物β-actin扩增产物的扩增曲线中可明显看到典型的PCR扩增曲线的对数扩增前期、对数扩增期和平台期, 说明有足够量PCR产物, 可见引物有较高的敏感度. 溶解曲线基本均为单峰, 可见引物的特异性好, 产物单一, 无明显非特异产物(图2). 在CD14-shRNA慢病毒载体转染胃癌细胞后, 通过Real-time PCR定量实验, 判定目的基因CD14 mRNA表达水平. 其中Ct值是达到规定荧光强度所需的循环数, Ct值越大, 所需的循环数越多, 目的基因的拷贝数越少. 表1显示, 转染CD14-shRNA慢病毒组CD14的Ct值比NCshRNA对照组增高(P = 0.000; P<0.001), CD14-shRNA慢病毒组CD14的2Ct值(1.00±0.08)比NCshRNA对照组2Ct值(0.16±0.02)降低(P = 0.0001; P<0.001), 差异有显著统计学意义, 所以CD14-shRNA慢病毒载体转染SGC-7901后, CD14 mRNA的表达下调. 同样以PCR的扩增指数RQ值为纵坐标作图也反映了这样的结果(图3).
| 样品-基因 | 重复1 C t值 | 重复2 C t值 | 重复3 C t值 | Ct平均值 | Ct | Ct | Ct | 抑制效率(%) |
| 7901-NC-CD14 | 22.12 | 21.96 | 21.80 | 21.96±0.16 | 6.63±0.11 | 0.00±0.11 | 1.00±0.08 | - |
| 7901-Si-CD14 | 25.81 | 25.38 | 25.38 | 25.52±0.25 | 9.27±0.18 | 2.64±0.18 | 0.16±0.02 | 83.94 |
| 7901-NC-β-actin | 15.39 | 15.31 | 15.29 | 15.33±0.06 | - | - | - | - |
| 7901-Si-β-actin | 16.33 | 16.23 | 16.20 | 16.25±0.07 | - | - | - | - |
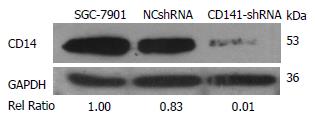
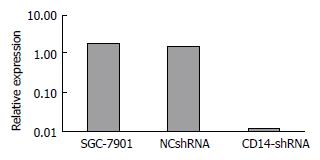
Western blot检测结果显示, 在转染胃癌细胞后, CD14-shRNA慢病毒载体组细胞的CD14蛋白表达相对于空白组及阴性对照组明显减少, 从灰度值分析显示看出(表2, 图4), CD14-shRNA慢病毒组CD14蛋白相对表达量为0.01, 远远小于SGC-7901空白组(1.00)及NCshRNA阴性对照组(0.83), 分别下降99.0%及98.8%, 由此推断CD14-shRNA慢病毒载体转染胃癌细胞SGC-7901后使CD14的蛋白的表达量明显降低, 同样以Western blot的灰度值为纵坐标作图也反映了这样的结果(图5).
| IA | SGC-7901 | NCshRNA | CD14-shRNA |
| GLS2 | 158948 | 149978.7 | 1283.66666 |
| GAPDH | 85659.67 | 96812.7 | 106470 |
| GLS2/GAPDH | 1.856 | 1.549 | 0.012 |
| 校正值 | 1.00 | 0.83 | 0.01 |
晚期研究发现, 炎症尤其是非可控性炎症在肿瘤的发生、发展中占据重要地位[10]. 作为一把"双刃剑", 炎症既能保护机体, 又能损伤机体. 反复的炎症刺激可能通过释放大量的反应性氧自由基、一氧化氮等炎症介质, 经由模式识别受体介导的固有免疫或获得性免疫, 将炎症放大, 加重组织损伤, 组织修复中出现DNA错配、基因位点突变等, 最终导致恶性肿瘤发生[11-15]. 慢性胃炎, 尤其是H. pylori感染相关的慢性胃炎作为非可控性炎症的一大类, 被公认为癌前状态[16-18]. H. pylori感染后经由CD14/TLR4信号调控核因子κB(nuclear factor-kappa B, NF-κB)活化, NF-κB在调节涉及黏膜炎症反应的基因中起核心作用, 被认为在慢性炎症相关的恶性病变中具有关键作用. 研究发现胃癌患者存在NF-κB异常增高的活性, NF-κB在肿瘤发展中的主要作用可能是在肿瘤发生和进展阶段阻止恶变前期细胞的凋亡. 研究提示NF-κB对促进炎症相关的肿瘤发生是必需的, 可能涉及以下几种机制: (1)产生炎症因子和生长因子; (2)促进肿瘤细胞生长、抑制其凋亡; (3)通过介导活化诱导胞嘧啶核苷脱氨酶(activation-induced cytidine deaminase, AID)在胃黏膜异位表达而诱导基因突变[19-23]. 因此, 调控CD14/TLR4-NF-κB通路对于降低H. pylori感染后炎症反应, 防治H. pylori感染后相关胃癌发生、发展无疑是非常有利的[24-29].
鉴于CD14在胃癌的发生发展过程中具有重要作用, 本研究通过构建CD14-shRNA的慢病毒载体转染胃癌细胞SGC-7901, 我们发现CD14基因沉默后的胃癌细胞CD14 mRNA受到抑制, 蛋白表达降低. RT-PCR检测结果说明, 实验组的重组CD14-shRNA慢病毒载体转染至胃癌细胞SGC-7901后, 使CD14 mRNA的表达量降低, 相对于阴性对照组有明显的统计学意义, 说明实验组转染胃癌细胞SGC-7901成功, 并成功抑制胃癌细胞SGC-7901的CD14 mRNA的表达. Western blot检测结果说明, 实验组的重组CD14-shRNA慢病毒载体转染至胃癌细胞SGC-7901后, CD14-shRNA慢病毒组CD14蛋白相对表达量远远小于空白组及阴性对照组, 由此推断CD14-shRNA慢病毒载体转染胃癌细胞SGC-7901后使CD14的蛋白的表达量明显降低, 说明实验组成功抑制胃癌细胞SGC-7901的CD14蛋白的表达.
总之, 我们成功的利用重组慢病毒载体抑制了CD14在胃癌细胞SGC-7901中的表达, 为后续动物模型实验提供理论基础和前期准备, 初步证实CD14在胃癌发生、发展中具有重要作用, 有望为胃癌防治提供新的思路.
1996年幽门螺杆菌(Helicobacter pylori, H. pylori)被WHO指出为I类致癌因子而为医学界所共识, 但是关于H. pylori导致胃癌的具体机制尚未明晰, 2006-2010年在《nature》,《science》等杂志均刊出文章明确"炎症作为第7大致癌因素, 尤其是非可控性炎症在肿瘤的发生、发展中占据重要地位", 由此我们开展H. pylori感染相关胃癌研究, 从先天免疫模式识别角度, 探讨H. pylori在胃癌发生中的地位和可能机制.
王小众, 教授, 福建医科大学附属协和医院消化内科
晚近研究报道发现, CD14基因多态性在H. pylori感染相关胃癌的易感性相关, 尤其是CD14-159位点、CD14-260位点是值得令人关注的, 亦是当前研究领域中的重点, 本文采用shRNA技术稳定沉默CD14表达, 观察CD14沉默后胃癌细胞生物学行为的变化, 以及构建CD14细胞体系中的病毒滴定等技术问题是亟待研究的.
本文的亮点部分在于沉默CD14基因表达人胃癌SGC-7901细胞体系的构建, 细胞转染中病毒复数的最佳滴定度, 以及沉默CD14基因后胃癌细胞生物学行为的变化.
本文基于前期临床观察H. pylori感染相关胃癌患者存在CD14-159位点表达变化, 而应用shRNA技术稳定沉默CD14表达, 拟证实CD14在胃癌的发生、发展中有重要作用.
胃癌的诊断方面, 我们可以推测CD14基因位点检测在胃癌发生的预测价值, 以及H. pylori感染阳性胃癌患者采用CD14阻断技术在胃癌中的治疗价值.
本研究利用重组慢病毒载体抑制了CD14在胃癌细胞SGC-7901中的表达, 初步证实CD14在胃癌发生、发展中具有一定意义.
编辑 田滢 电编 闫晋利
| 1. | Schmidt C, Gerdes H, Hawkins W, Zucker E, Zhou Q, Riedel E, Jaques D, Markowitz A, Coit D, Schattner M. A prospective observational study examining quality of life in patients with malignant gastric outlet obstruction. Am J Surg. 2009;198:92-99. [PubMed] [DOI] |
| 2. | Takachi R, Inoue M, Shimazu T, Sasazuki S, Ishihara J, Sawada N, Yamaji T, Iwasaki M, Iso H, Tsubono Y. Consumption of sodium and salted foods in relation to cancer and cardiovascular disease: the Japan Public Health Center-based Prospective Study. Am J Clin Nutr. 2010;91:456-464. [PubMed] [DOI] |
| 3. | McCracken M, Olsen M, Chen MS, Jemal A, Thun M, Cokkinides V, Deapen D, Ward E. Cancer incidence, mortality, and associated risk factors among Asian Americans of Chinese, Filipino, Vietnamese, Korean, and Japanese ethnicities. CA Cancer J Clin. 2007;57:190-205. [PubMed] [DOI] |
| 4. | Shah MA, Ajani JA. Gastric cancer--an enigmatic and heterogeneous disease. JAMA. 2010;303:1753-1754. [PubMed] [DOI] |
| 5. | Fock KM, Talley N, Moayyedi P, Hunt R, Azuma T, Sugano K, Xiao SD, Lam SK, Goh KL, Chiba T. Asia-Pacific consensus guidelines on gastric cancer prevention. J Gastroenterol Hepatol. 2008;23:351-365. [PubMed] [DOI] |
| 6. | Snaith A, El-Omar EM. Helicobacter pylori: host genetics and disease outcomes. Expert Rev Gastroenterol Hepatol. 2008;2:577-585. [PubMed] [DOI] |
| 7. | Hubacek JA, Rothe G, Pit'ha J, Skodová Z, Stanĕk V, Poledne R, Schmitz G. C(-260)-->T polymorphism in the promoter of the CD14 monocyte receptor gene as a risk factor for myocardial infarction. Circulation. 1999;99:3218-3220. [PubMed] |
| 8. | Kato I, Canzian F, Plummer M, Franceschi S, van Doorn LJ, Vivas J, Lopez G, Lu Y, Gioia-Patricola L, Severson RK. Polymorphisms in genes related to bacterial lipopolysaccharide/peptidoglycan signaling and gastric precancerous lesions in a population at high risk for gastric cancer. Dig Dis Sci. 2007;52:254-261. [PubMed] [DOI] |
| 9. | Zhao D, Sun T, Zhang X, Guo Y, Yu D, Yang M, Tan W, Wang G, Lin D. Role of CD14 promoter polymorphisms in Helicobacter pylori infection--related gastric carcinoma. Clin Cancer Res. 2007;13:2362-2368. [PubMed] [DOI] |
| 11. | Mantovani A, Allavena P, Sica A, Balkwill F. Cancer-related inflammation. Nature. 2008;454:436-444. [PubMed] [DOI] |
| 12. | Wang G, Yu D, Tan W, Zhao D, Wu C, Lin D. Genetic polymorphism in chemokine CCL22 and susceptibility to Helicobacter pylori infection-related gastric carcinoma. Cancer. 2009;115:2430-2437. [PubMed] [DOI] |
| 13. | Wu WK, Cho CH, Lee CW, Fan D, Wu K, Yu J, Sung JJ. Dysregulation of cellular signaling in gastric cancer. Cancer Lett. 2010;295:144-153. [PubMed] [DOI] |
| 14. | Kim J, Cho YA, Choi IJ, Lee YS, Kim SY, Hwang JA, Cho SJ, Kook MC, Kim CG, Kim YW. Effects of polymorphisms of innate immunity genes and environmental factors on the risk of noncardia gastric cancer. Cancer Res Treat. 2013;45:313-324. [PubMed] [DOI] |
| 15. | Bornschein J, Selgrad M, Warnecke M, Kuester D, Wex T, Malfertheiner P. H. pylori infection is a key risk factor for proximal gastric cancer. Dig Dis Sci. 2010;55:3124-3131. [PubMed] [DOI] |
| 16. | Li K, Dan Z, Hu XJ, Gesang LB, Ze YG, Bianba ZX, Ciren CM, Nie YQ. Association of CD14/-260 polymorphism with gastric cancer risk in Highland Tibetans. World J Gastroenterol. 2014;20:2688-2694. [PubMed] [DOI] |
| 17. | Kim EJ, Chung WC, Lee KM, Paik CN, Kim SB, Oh YS, Lee YW, Kang SG, Noh SJ. Helicobacter pylori Infection Enhances Gastric Mucosal Inflammation in Individuals Carrying the 260-T Allele of the CD14 Gene. Gut Liver. 2013;7:317-322. [PubMed] [DOI] |
| 18. | Castaño-Rodríguez N, Kaakoush NO, Goh KL, Fock KM, Mitchell HM. The role of TLR2, TLR4 and CD14 genetic polymorphisms in gastric carcinogenesis: a case-control study and meta-analysis. PLoS One. 2013;8:e60327. [PubMed] [DOI] |
| 19. | Li K, Dan Z, Hu X, Ouzhu M, Ciren Y, Wang Z, Wang J, Yang X, Ze Y. CD14 overexpression upregulates TNF-α-mediated inflammatory responses and suppresses the malignancy of gastric carcinoma cells. Mol Cell Biochem. 2013;376:137-143. [PubMed] [DOI] |
| 20. | Cheng YB, Guo LP, Yao P, Ning XY, Aerken G, Fang DC. Telomerase and hTERT: Can they serve as markers for gastric cancer diagnosis? World J Gastroenterol. 2014;20:6615-6619. [PubMed] [DOI] |
| 21. | Yang M, Zhong J, Zhao M, Wang J, Gu Y, Yuan X, Sang J, Huang C. Overexpression of Nuclear Apoptosis-Inducing Factor 1 Altered the Proteomic Profile of Human Gastric Cancer Cell MKN45 and Induced Cell Cycle Arrest at G1/S Phase. PLoS One. 2014;9:e100216. [PubMed] [DOI] |
| 22. | Maeda S, Akanuma M, Mitsuno Y, Hirata Y, Ogura K, Yoshida H, Shiratori Y, Omata M. Distinct mechanism of Helicobacter pylori-mediated NF-kappa B activation between gastric cancer cells and monocytic cells. J Biol Chem. 2001;276:44856-44864. [PubMed] |
| 23. | Dzierzanowska-Fangrat K, Michalkiewicz J, Cielecka-Kuszyk J, Nowak M, Celinska-Cedro D, Rozynek E, Dzierzanowska D, Crabtree JE. Enhanced gastric IL-18 mRNA expression in Helicobacter pylori-infected children is associated with macrophage infiltration, IL-8, and IL-1 beta mRNA expression. Eur J Gastroenterol Hepatol. 2008;20:314-319. [PubMed] [DOI] |
| 24. | Tahara T, Shibata T, Hirata I, Nakano H, Arisawa T. CD14 promoter-159 polymorphism is associated with reduced risk of intestinal-type gastric cancer in a Japanese population. Dig Dis Sci. 2009;54:1508-1512. [PubMed] [DOI] |
| 25. | Shen Z, Seppänen H, Vainionpää S, Ye Y, Wang S, Mustonen H, Puolakkainen P. IL10, IL11, IL18 are differently expressed in CD14+ TAMs and play different role in regulating the invasion of gastric cancer cells under hypoxia. Cytokine. 2012;59:352-357. [PubMed] [DOI] |
| 26. | Chun KH, Seong SY. CD14 but not MD2 transmit signals from DAMP. Int Immunopharmacol. 2010;10:98-106. [PubMed] [DOI] |
| 27. | Fehlings M, Drobbe L, Moos V, Renner Viveros P, Hagen J, Beigier-Bompadre M, Pang E, Belogolova E, Churin Y, Schneider T. Comparative analysis of the interaction of Helicobacter pylori with human dendritic cells, macrophages, and monocytes. Infect Immun. 2012;80:2724-2734. [PubMed] [DOI] |
| 28. | Hold GL, Rabkin CS, Gammon MD, Berry SH, Smith MG, Lissowska J, Risch HA, Chow WH, Mowat NA, Vaughan TL. CD14-159C/T and TLR9-1237T/C polymorphisms are not associated with gastric cancer risk in Caucasian populations. Eur J Cancer Prev. 2009;18:117-119. [PubMed] [DOI] |
| 29. | Saito H, Kuroda H, Matsunaga T, Osaki T, Ikeguchi M. Increased PD-1 expression on CD4+ and CD8+ T cells is involved in immune evasion in gastric cancer. J Surg Oncol. 2013;107:517-522. [PubMed] [DOI] |