修回日期: 2014-06-06
接受日期: 2014-06-11
在线出版日期: 2014-08-08
目的: 研究低氧条件下, merlin-1蛋白对汉族、回族和藏族胃癌细胞增殖、黏附能力及细胞骨架表达的调节作用, 同时比较常氧或低氧条件下, merlin-1蛋白的作用是否具有民族特异性.
方法: 用MTT方法检测常氧或低氧条件下, merlin对回族、藏族和汉族胃癌原代细胞增殖及黏附、侵移的影响; 免疫荧光染色法检测常氧或低氧条件下merlin对汉族、回族和藏族胃癌细胞骨架、细胞形态及细胞表面微绒毛表达的影响. 同时分析merlin在常氧或低氧条件下的影响作用是否具有民族特异性.
结果: 常氧或低氧条件下, merlin-1蛋白均对汉族(P常氧 = 0.00, P低氧 = 0.00)、回族(P常氧 = 0.00, P低氧 = 0.00)和藏族(P常氧 = 0.00, P低氧 = 0.00)胃癌细胞增殖均有明显的抑制作用, 但merlin-1对不同民族胃癌细胞增殖的抑制作用无民族特异性(P常氧>0.05, P低氧>0.05). 黏附能力检测结果显示, 在常氧及低氧条件下merlin-1蛋白对汉族(P常氧 = 0.00, P低氧 = 0.00)、回族(P常氧 = 0.00, P低氧 = 0.00)和藏族(P常氧 = 0.00, P低氧 = 0.00)胃癌细胞黏附能力均有抑制作用, 且抑制能力亦无民族特异性[P常氧 = 0.51(3 h)、0.07(48 h), P低氧 = 0.47(3 h)、0.17(48 h)]. 在对细胞骨架、细胞形态变化及细胞微绒毛表达实验中, 观察到merlin-1在低氧条件下可加强细胞骨架表达.
结论: 低氧条件对merlin-1抑制回族、藏族和汉族胃癌细胞增殖能力无明显影响, 且merlin-1蛋白对胃癌细胞的抑制能力无论在常氧或低氧条件下, 均无民族特异性. merlin蛋白在低氧条件下对胃癌细胞骨架表达有促进作用.
核心提示: 利用胃癌原代细胞, 发现merlin蛋白在低氧条件下对胃癌细胞增殖、黏附能力及细胞骨架表达均有明显的调节作用, 但是回族、汉族和藏族之间无论常氧还是低氧条件, 均无显著性差异. 暗示肿瘤在相对缺氧条件下, 可能通过相应的细胞信号途径来调节自身的增殖和扩散侵移行为.
引文著录: 苏占海, 刘永年, 王荣华, 乔金婉, 解亚丽. 低氧环境下merlin-1蛋白对胃癌细胞黏附能力及细胞骨架表达调节的影响. 世界华人消化杂志 2014; 22(22): 3185-3193
Revised: June 6, 2014
Accepted: June 11, 2014
Published online: August 8, 2014
AIM: To investigate the regulatory effect of merlin-1 on cell proliferation, adhesion/metastasis and cytoskeleton remodeling in gastric cancer cells under hypoxia from Qinghai Han-, Hui- and Tibetan-ethnic patients, and to study if the function of merlin-1 in different ethnic groups is related to ethnic specificity under normoxic or hypoxic conditions.
METHODS: MTT assay was used to analyze the influence of merlin-1 on the cell proliferation, adhesion/metastasis and motility, and immunofluorescence staining was performed to detect cytoskeleton remodeling, morphological changes, and the distribution of microvilli on the surface of gastric cancer cells from Han-, Hui- and Tibetan-ethnic patients. In addition, we explored whether the function of merlin-1 in different ethnic groups is correlated with ethnic specificity under normoxic or hypoxic conditions.
RESULTS: The proliferation of gastric cancer cells from Han-, Hui- and Tibetan-ethnic groups was inhibited by merlin-1 under both normoxic and conditions (Pnormoxic = 0.00, 0.00, 0.00; Phypoxic = 0.00, 0.00, 0.00), and the influence of merlin-1 on cancer cell proliferation was not related to ethnic specificity (Pnormoxic ≥ 0.05; Phypoxic ≥ 0.05). The results of adhesion/metastasis analysis showed that merlin-1 inhibited the adhesion/metastasis ability of gastric cancer cells from Han-, Hui- and Tibetan-ethnic groups under both normoxic and hypoxic conditions (Pnormoxic = 0.00, 0.00, 0.00; Phypoxic = 0.00, 0.00, 0.00), and the inhibitory effect of merlin-1 in three ethnic groups showed no significant differences [Pnormoxic = 0.51 (3 h), 0.07 (48 h); Phypoxic = 0.47 (3 h), 0.17 (48 h)]. By detection of cytoskeleton remodeling, morphological change and microvilli distribution, it was found that merlin-1 enhanced cytoskeleton remodeling under hypoxic conditions compared with normoxic conditions.
CONCLUSION: Merlin-1 can inhibit the proliferation and adhesion/metastasis of gastric cancer cells under both hypoxic and normoxic conditions, which is independent on the ethnicity of patients from whom gastric cancer cells are obtained. However, merlin-1 enhances cytoskeleton remodeling under hypoxic conditions.
- Citation: Su ZH, Liu YN, Wang RH, Qiao JW, Xie YL. Regulatory effect of merlin-1 on adhesion/metastasis and cytoskeleton remodeling in gastric cancer cells under hypoxia. Shijie Huaren Xiaohua Zazhi 2014; 22(22): 3185-3193
- URL: https://www.wjgnet.com/1009-3079/full/v22/i22/3185.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i22.3185
肿瘤在增殖过程中由于实体瘤增长导致缺氧, 这种微环境的"低氧"状态并未阻止肿瘤继续增殖和侵移的行为[1-6], 如在结肠癌中发现整合素连接激酶(integrin-linked kinase, ILK)在低氧环境下可促进肿瘤增殖和侵移[7-11]. 肿瘤细胞通过细胞骨架重组、细胞极化和改变黏附能力来增强自身向周围细胞、组织和器官的侵移能力, 而与细胞骨架重组有密切关系的默林(merlin)蛋白在这一过程中起重要作用[12-16]. Merlin在其N端有一共同保守结构域4.1蛋白结构域(four.1 protein, Ezrin, Radixin, Moesin, FERM), 因此属于4.1蛋白家族. Merlin蛋白丢失、突变或活性被抑制, 将会导致中枢神经系统相关肿瘤的发生, 如神经鞘瘤、间皮瘤或脑膜瘤的发生[17-20]. Merlin蛋白存在两种主要异构体, 即merlin-1与merlin-2, 前者具有抑癌基因蛋白功能[18-21]. 在低氧环境下肿瘤细胞增殖和侵移、细胞骨架等如何变化及调节, 目前并未研究阐明清楚. 本研究拟探讨低氧条件下, merlin-1对青海回族、藏族和汉族胃癌原代细胞增殖与黏附的影响, 同时分析这种影响或变化是否具有民族差异性, 以及对细胞骨架的调节作用, 最终为胃癌早期诊断、治疗和胃癌发病分子机制提供重要的实验依据.
青霉素/链霉素双抗(10 mg/mL)购自上海生工生物公司, PRMI 1640细胞培养液(高糖)、胰酶、HEPES缓冲液、胎牛血清、Lipofectamine 2000购自英国Invitrogen公司, MTT购自北京碧云天生物公司, 倒置显微镜购自麦克奥迪公司, Olympus IX71免疫荧光显微镜购自日本Olympus公司, 落地式离心机购自湖南湘仪离心机公司, iMark全波长酶标仪购自美国Bio-rad公司, 超净工作台购自美国Thermo公司, 三气培养箱购自上海力康公司、四型胶原酶购自美国Gibco公司、胃癌组织成纤维抑制剂购自美国CHI Scientific公司.
1.2.1 胃癌原代细胞培养: 胃癌患者术后新鲜组织块, 用机械方式迅速剪碎之浆糊状态, 随即加入200 U/mL四型胶原酶在37 ℃孵育细胞2 h, 用缓冲液进行离心收集细胞沉淀, 弃掉上清液, 加入细胞培养液PRMI 1640(含10%胎牛血清、5% HEPES、5%青霉素/链霉素双抗)进行培养, 24 h后, 更换为内含胃癌组织成纤维抑制剂培养液继续培养. 低氧培养条件为, 用三气培养箱在50 mL/L CO2、10 mL/L O2和950 mL/L N2条件下进行培养. 胃癌原代细胞一般需要生长5-7代后才能获得足够细胞用于实验.
1.2.2 MTT检测细胞增殖: 将对数生长期胃癌原代细胞根据民族来源不同, 以1×105/mL均匀接种于96孔培养板, 每组设3个复孔. 24 h培养后, 利用Lipofectamine 2000将100 ng/mL pcDNA3.1+-merlin-1重组质粒转染到细胞内. 共接种5块培养板, 分别培养相应的时间段. 常氧或低氧条件下培养6、12、24、48和72 h后, 将5 g/L MTT溶液20 μL加入, 37 ℃培养4 h, 之后加入150 μL DMSO, 震荡混匀10 min, 在酶标仪波长492 nm处检测, 实验重复3次. 以3个复孔转染空白pcDNA3.1+质粒载体作为对照组. 利用结果分析常氧或低氧条件对回族、藏族及汉族胃癌细胞增殖的影响, 同时分析三者之间是否具有显著差异性.
1.2.3 细胞黏附侵移实验: 基底膜基质包埋的96-孔板被用于细胞基质黏附能力检测实验, 首先加入50 μL未含胎牛血清PRMI 1640培养液, 并在37 ℃孵育30 min, 然后根据民族来源不同将相应的300 μL细胞悬浮液(1×105 cells/mL) 接种于板中, 培养12 h后利用Lipofectamine 2000转染相应的重组质粒pcDNA3.1+-merlin-1以及对照载体pcDNA3.1+, 并将细胞在37 ℃常氧及低氧条件下分别培养3和48 h, 利用MTT方法检测细胞黏附能力转染. 利用结果分析常氧或低氧条件对回族、藏族及汉族胃癌细胞黏附侵移的影响, 同时分析三者之间是否具有显著差异性.
1.2.4 免疫荧光标志: 培养的细胞生长到相应对数期后, 分离到内含有细胞爬片的6孔培养板中, 24 h后, 用Lipofectamine 2000将重组质粒载体pcDNA3.1+-merlin-1按照300 ng/mL浓度导入胃癌原代细胞内, 培养48 h后, 将培养液吸去, PBS清洗2次, 用4 g/L甲醛固定液进行固定, 1:200稀释一抗(actin抗体), 在室温孵育细胞2 h, 之后用PBS清洗2次, 立刻用稀释好的二抗室温孵育2 h. 细胞再次用PBS清洗2次后, 立刻用荧光标志物孵育细胞5 min(避光), 之后用PBS清洗、并将片子固定后, 用Olympus IX71荧光显微镜进行观察, 并记录.
统计学处理 实验数据为计量资料, 均以mean±SD描述, 两组间比较采用t检验, 多组间比较采用方差分析, 多组间两两比较采用LSD, 运用SPSS17.0统计软件包进行统计分析, 检验水准α = 0.05, P<0.05差异有统计学意义.
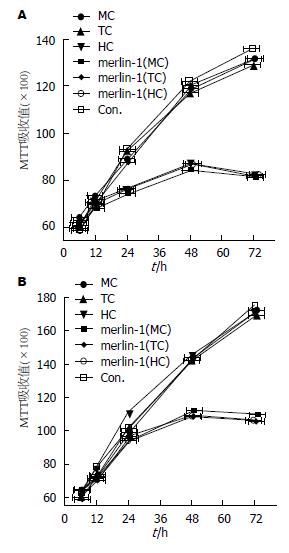
MTT实验结果表明, 和未转染组相比, merlin-1蛋白在24、48、72 h对汉族(P常氧 = 0.00)、回族(P常氧 = 0.00)和藏族(P常氧 = 0.00)胃癌细胞具有一定抑制作用(表1, 表2, 表3, 图1A); 常氧条件下, merlin-1蛋白对细胞增殖的影响在回族、藏族和汉族胃癌细胞中差异无统计学意义(表4). 在低氧条件下细胞在48 h和72 h发现转染merlin-1后对汉族(P常氧 = 0.00)、回族(P常氧 = 0.00)和藏族(P常氧 = 0.00)胃癌细胞增殖具有抑制作用(表5, 表6, 表7, 图1B). 和常氧环境比较, 低氧条件下merlin-1蛋白对汉族(P低氧>0.05)、回族(P低氧>0.05)和藏族(P低氧>0.05)的抑制能力也无显著加强(表8).
| 分组 | 6 h | 12 h | 24 h | 48 h | 72 h |
| 对照组 | 61±1.60 | 72±2.00 | 90±1.20 | 116±1.20 | 129±1.90 |
| 转染组 | 63±1.00 | 71±1.00 | 75±1.40 | 84±1.20 | 82±2.00 |
| t值 | 2.37 | 1.00 | 18.19 | 42.16 | 38.10 |
| P值 | 0.05 | 0.35 | 0.00 | 0.00 | 0.00 |
| 分组 | 6 h | 12 h | 24 h | 48 h | 72 h |
| 对照组 | 59±4.00 | 71±1.10 | 88±1.00 | 119±2.00 | 127±3.00 |
| 转染组 | 61±2.60 | 70±1.30 | 75±1.20 | 86±1.60 | 82±2.00 |
| t值 | 0.94 | 1.31 | 18.61 | 28.81 | 27.91 |
| P值 | 0.38 | 0.23 | 0.00 | 0.00 | 0.00 |
| 分组 | 6 h | 12 h | 24 h | 48 h | 72 h |
| 对照组 | 59±2.00 | 73±1.10 | 89±1.50 | 117±2.10 | 128±2.00 |
| 转染组 | 61±2.30 | 72±1.00 | 76±1.70 | 85±2.00 | 83±2.00 |
| t值 | 1.47 | 1.50 | 12.82 | 24.67 | 35.58 |
| P值 | 0.18 | 0.17 | 0.00 | 0.00 | 0.00 |
| 分组 | 6 h | 12 h | 24 h | 48 h | 72 h |
| Han(-) | 61±1.6 | 72±2 | 90±1.2 | 116±1.2 | 129±1.9 |
| Hui(-) | 59±4 | 71±1.1 | 88±1 | 119±2 | 127±3 |
| Tibetan(-) | 59±2.00 | 73±1.1 | 89±1.5 | 117±2.1 | 128±2 |
| F值 | 0.87 | 2.34 | 3.20 | 3.55 | 0.90 |
| P值 | 0.44 | 0.14 | 0.08 | 0.06 | 0.43 |
| Han(+) | 63±1 | 71±1 | 75±1.4 | 84±1.2 | 82±2 |
| Hui(+) | 61±2.6 | 70±1.3 | 75±1.2 | 86±1.6 | 82±2 |
| Tibetan(+) | 61±2.3 | 72±1 | 76±1.7 | 85±2 | 83±2 |
| F值 | 1.53 | 4.07 | 0.80 | 1.88 | 0.42 |
| P值 | 0.26 | 0.05 | 0.47 | 0.20 | 0.67 |
| 分组 | 6 h | 12 h | 24 h | 48 h | 72 h |
| 对照组 | 63±1.60 | 77±2.00 | 95±2.10 | 141±3.00 | 170±2.00 |
| 转染组 | 62±1.00 | 75±1.00 | 96±1.30 | 114±2.10 | 108±2.00 |
| t值 | 1.19 | 2.00 | 0.91 | 16.48 | 56.13 |
| P值 | 0.27 | 0.08 | 0.39 | 0.00 | 0.00 |
| 分组 | 6 h | 12 h | 24 h | 48 h | 72 h |
| 对照组 | 61±4.00 | 75±1.00 | 93±1.80 | 141±3.00 | 172±4.00 |
| 转染组 | 62±2.60 | 76±1.00 | 95±1.20 | 113±2.00 | 109±3.00 |
| t值 | 0.47 | 1.58 | 2.07 | 17.36 | 28.17 |
| P值 | 0.65 | 0.15 | 0.07 | 0.00 | 0.00 |
| 分组 | 6 h | 12 h | 24 h | 48 h | 72 h |
| 对照组 | 63±2.00 | 76±1.60 | 95±2.00 | 142±1.30 | 168±3.20 |
| 转染组 | 62±2.30 | 76±1.20 | 96±2.10 | 115±1.50 | 107±2.30 |
| t值 | 0.73 | 0.00 | 0.77 | 30.42 | 34.61 |
| P值 | 0.48 | 1.00 | 0.46 | 0.00 | 0.00 |
| 分组 | 6 h | 12 h | 24 h | 48 h | 72 h |
| Han(-) | 63±1.6 | 77±2 | 95±2.1 | 141±3 | 170±2 |
| Hui(-) | 61±4 | 75±1 | 93±1.8 | 141±3 | 172±4 |
| Tibetan(-) | 63±2 | 76±1.6 | 95±2 | 142±1.3 | 168±3.2 |
| F值 | 0.89 | 1.98 | 1.72 | 0.25 | 1.98 |
| P值 | 0.44 | 0.18 | 0.22 | 0.78 | 0.18 |
| Han(+) | 62±1 | 75±1 | 96±1.3 | 114±2.1 | 108±2 |
| Hui(+) | 62±2.6 | 76±1 | 95±1.2 | 113±2 | 109±3 |
| Tibetan(+) | 62±2.3 | 76±1.2 | 96±2.1 | 115±1.5 | 107±2.3 |
| F值 | 0.00 | 1.45 | 0.66 | 1.41 | 0.82 |
| P值 | 1.00 | 0.27 | 0.53 | 0.28 | 0.46 |
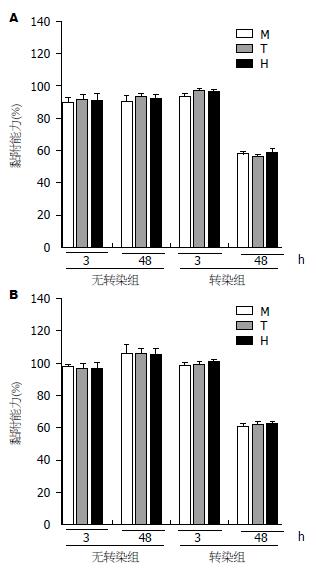
根据细胞基质黏附能力检测实验发现, 胃癌细胞转染merlin-1重组质粒48 h后显示, merlin-1蛋白在常氧及低氧条件下均对汉族(P常氧 = 0.00, P低氧 = 0.00)、回族(P常氧 = 0.00, P低氧 = 0.00)和藏族(P常氧 = 0.00, P低氧 = 0.00)胃癌细胞的黏附能力具有抑制作用(表9, 表10, 图2), 且常氧及低氧条件对merlin-1在细胞黏附作用中影响不大, 且不同民族之间差异无统计学意义[P常氧 = 0.51(3 h), P常氧 = 0.07(48 h), P低氧 = 0.47(3 h), P低氧 = 0.17(48 h)](表9, 表10).
| 分组 | 回族 | 藏族 | 汉族 | F/ P值 | ||||
| 3 h | 48 h | 3 h | 48 h | 3 h | 48 h | 3 h | 48 h | |
| 对照组 | 92±2 | 92±2 | 93±2 | 94±2 | 92±1 | 93±1.6 | 0.56/0.59 | 1.42/0.28 |
| 转染组 | 93±1 | 58±1 | 94±1.3 | 57±1 | 93±2.1 | 59±1.6 | 0.70/0.51 | 3.29/0.07 |
| F值 | 1.00 | 34.00 | 0.94 | 37.00 | 0.96 | 33.60 | ||
| P值 | 0.35 | 0.00 | 0.38 | 0.00 | 0.36 | 0.00 | ||
| 分组 | 回族 | 藏族 | 汉族 | F/ P值 | ||||
| 3 h | 48 h | 3 h | 48 h | 3 h | 48 h | 3 h | 48 h | |
| 对照组 | 98±1 | 106±1 | 97±0.6 | 105±1 | 96±2 | 105±1 | 2.80/0.10 | 1.66/0.23 |
| 转染组 | 99±2 | 60±1.8 | 98±1.1 | 62±1.6 | 98±1 | 62±2 | 0.80/0.47 | 2.04/0.17 |
| F值 | 1.00 | 49.95 | 1.78 | 50.96 | 2.00 | 43.00 | ||
| P值 | 0.35 | 0.00 | 0.11 | 0.00 | 0.08 | 0.00 | ||
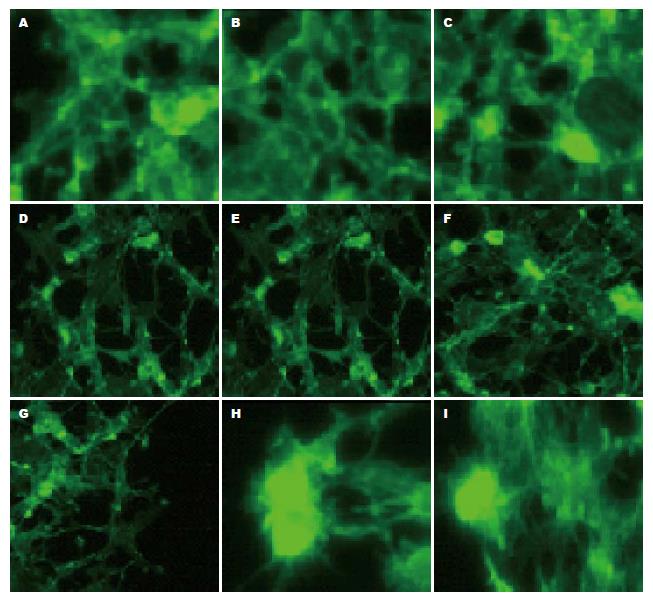
免疫荧光标志实验结果显示, 相对于merlin-1转染细胞及常氧转染细胞, 转染merlin-1的细胞在低氧培养后显示出细胞微绒毛增多细胞发生极化、细胞骨架更加密集且明显, 说明低氧环境可能会促进merlin-1对细胞骨架和微绒毛的表达(图3).
有研究者[22-24]在2012年发现, 肿瘤在增殖过程中由于实体瘤增长导致缺氧, 从而诱导细胞内糖酵解途径进行供能, 这使得能量转换效率降低, 肿瘤细胞更加处于"饥饿或缺能"状态, 为保证肿瘤持续增殖将进行血管增生以便保证供能, 从而进入肿瘤恶性增殖循环状态. 本研究显示, merlin-1蛋白在常氧条件下对回族、藏族和汉族胃癌细胞增殖、细胞黏附侵移能力有明显抑制能力(P<0.05), 而低氧环境下merlin-1对汉族、藏族及回族胃癌细胞增殖、黏附侵移的抑制能力与常氧条件下相比, 没有显著性变化(P>0.05). 因merlin蛋白发生突变、缺失或失活将会导致中枢神经系统相关肿瘤的发生, 如神经鞘瘤、间皮瘤或脑膜瘤的发生. 同时许多肿瘤的发生与merlin蛋白基因发生突变相关, 如子宫颈鳞状细胞癌、乳腺癌、非小细胞肺癌和胰腺癌等肿瘤[25-30]. 在前期研究中, 发现相对于正常组织, 在青海回族、藏族和汉族胃癌组织中merlin基因神经纤维瘤病Ⅱ型(neurofibromatosis type 2, NF2)发生突变率很高(P<0.05), 且与组织分化程度、淋巴结转移具有相关性[20], 这提示merlin作为抑癌基因蛋白, 在维护细胞正常增殖方面起重要作用, 这种抑癌基因蛋白的功能不受常氧或低氧环境的影响, 亦即低氧不会影响其抑癌基因蛋白的功能, 同时此结果提示, merlin蛋白在回族、藏族和汉族胃癌组织中的高突变率是导致胃癌恶性增殖或转移的分子机制之一. 沈建康等[31]对神经鞘瘤中NF2基因突变分析发现, 其外显子2、4、6和13突变率较高, 而在青海回族、汉族和藏族胃癌组织中发现突变率较高的是NF2基因外显子2和17, 或许说明在不同肿瘤组织中, merlin蛋白基因NF2外显子突变情况所有不同, 或许具有一定组织特异性, 但这需要继续深入研究其外显子突变特征进行验证.
急性低氧环境可诱导细胞内血管内皮生长因子(vascular endothelial growth factor, VEGF)和低氧诱导因子-1(hypoxia inducible factor-1, HIF-1)基因表达及细胞内蛋白含量升高, 这可能与肿瘤恶性增殖及适应低氧微环境具有密切关系. 本研究显示低氧条件下, merlin抑癌基因蛋白对胃癌细胞增殖和黏附侵移的抑制能力的调节作用未发生改变. 但是利用免疫荧光染色技术发现, 与常氧条件相比, 低氧条件下merlin-1对细胞形态改变、细胞微绒毛的表达具有一定影响, 且这种调节影响作用在回族、藏族和汉族胃癌细胞中均被观察到. 本实验结果暗示, 在低氧环境下, 肿瘤细胞利用merlin蛋白基因突变使其抑制增殖及黏附侵移作用的丧失, 同时通过提高细胞骨架重组、增强细胞表面微绒毛表达来增强自身黏附侵移的能力, 从而导致肿瘤细胞在低氧环境下恶性增殖和黏附侵移能力的提升, 这对于理解微环境"低氧"状态下肿瘤继续增殖及黏附侵移提供了重要的实验依据.
肿瘤恶性增殖时其微环境处于"缺氧"状态, 这并不影响肿瘤的恶性增殖和扩散侵移, 但是肿瘤在缺氧条件下, 如何继续保持恶性增殖的和扩散侵移的能力, 并未研究清楚. Merlin蛋白, 不但是抑癌基因神经纤维瘤病Ⅱ型(neurofibromatosis type 2, NF2)的产物, 而且merlin还参与细胞骨架重组、细胞极化和细胞侵移等功能, 这些主要功能和肿瘤的侵移、扩散有极为密切的关系. 因此理解merlin蛋白在肿瘤黏附、侵移过程中的具体机制和信号途径就较为重要.
蒋敬庭, 教授, 常州市第一人民医院(苏州大学附属第三医院)肿瘤生物诊疗中心
小RhoGTP(Ras homologue GTP)激酶家族诱导的细胞信号途径在肌动蛋白骨架重组领域扮演重要作用, 研究发现merlin蛋白可以和RhoGTP激酶途径中的蛋白RhoGDI(Rho guanine nucleotide dissociation inhibitor)在体外可以相互整合/融合, 因此merlin及4.1蛋白结构域(four.1 protein, Ezrin, Radixin, Moesin, FERM)结构域在RhoGTP激酶诱导的信号途径中扮演何种角色, 是目前研究的热点之一.
merlin蛋白基因在许多肿瘤中发现其外显子有突变发生, 这种突变导致merlin蛋白无法行使正常的肿瘤抑制功能, 最终导致肿瘤恶性增殖. merlin蛋白在Ser518位的磷酸化/去磷酸化过程是调节其功能的重要步骤之一, 并且发现merlin可以和4.1蛋白家族成员ezrin结合, 后者通过肌动蛋白骨架系统可以将质膜信息传递到细胞内.
本实验首次模拟低氧条件, 探讨merlin蛋白在低氧条件下对肿瘤细胞增殖、黏附能力及细胞骨架表达的影响.
肿瘤恶性增殖可以通过外科手术进行处理, 但是其扩散侵移就容易导致严重后果. 理解和掌握肿瘤黏附、扩散和侵移的具体分子机制, 对临床应用提供重要的指导. merlin不但具有抑癌作用, 而且还参与调解细胞黏附和侵移活动, 因此深入研究其在肿瘤增殖、扩散侵移中的作用, 对肿瘤扩散的预防、治疗提供重要的实验依据.
本实验对理解肿瘤侵移、扩散的机制有重要意义.
编辑 郭鹏 电编 闫晋利
| 1. | Abaza M, Luqmani YA. The influence of pH and hypoxia on tumor metastasis. Expert Rev Anticancer Ther. 2013;13:1229-1242. [PubMed] [DOI] |
| 2. | Huang D, Li C, Zhang H. Hypoxia and cancer cell metabolism. Acta Biochim Biophys Sin (Shanghai). 2014;46:214-219. [PubMed] [DOI] |
| 3. | Bensaad K, Harris AL. Hypoxia and metabolism in cancer. Adv Exp Med Biol. 2014;772:1-39. [PubMed] [DOI] |
| 4. | Mimeault M, Batra SK. Hypoxia-inducing factors as master regulators of stemness properties and altered metabolism of cancer- and metastasis-initiating cells. J Cell Mol Med. 2013;17:30-54. [PubMed] [DOI] |
| 5. | Mucaj V, Shay JE, Simon MC. Effects of hypoxia and HIFs on cancer metabolism. Int J Hematol. 2012;95:464-470. [PubMed] [DOI] |
| 6. | Semenza GL. Regulation of cancer cell metabolism by hypoxia-inducible factor 1. Semin Cancer Biol. 2009;19:12-16. [PubMed] [DOI] |
| 7. | Liao J, Qian F, Tchabo N, Mhawech-Fauceglia P, Beck A, Qian Z, Wang X, Huss WJ, Lele SB, Morrison CD. Ovarian cancer spheroid cells with stem cell-like properties contribute to tumor generation, metastasis and chemotherapy resistance through hypoxia-resistant metabolism. PLoS One. 2014;9:e84941. [PubMed] [DOI] |
| 8. | Liu Z, Jia X, Duan Y, Xiao H, Sundqvist KG, Permert J, Wang F. Excess glucose induces hypoxia-inducible factor-1α in pancreatic cancer cells and stimulates glucose metabolism and cell migration. Cancer Biol Ther. 2013;14:428-435. [PubMed] [DOI] |
| 9. | Masson N, Ratcliffe PJ. Hypoxia signaling pathways in cancer metabolism: the importance of co-selecting interconnected physiological pathways. Cancer Metab. 2014;2:3. [PubMed] [DOI] |
| 10. | Raja R, Kale S, Thorat D, Soundararajan G, Lohite K, Mane A, Karnik S, Kundu GC. Hypoxia-driven osteopontin contributes to breast tumor growth through modulation of HIF1α-mediated VEGF-dependent angiogenesis. Oncogene. 2014;33:2053-2064. [PubMed] [DOI] |
| 11. | Kimura M, Murakami T, Kizaka-Kondoh S, Itoh M, Yamamoto K, Hojo Y, Takano M, Kario K, Shimada K, Kobayashi E. Functional molecular imaging of ILK-mediated Akt/PKB signaling cascades and the associated role of beta-parvin. J Cell Sci. 2010;123:747-755. [PubMed] [DOI] |
| 12. | Guo L, Moon C, Zheng Y, Ratner N. Cdc42 regulates Schwann cell radial sorting and myelin sheath folding through NF2/merlin-dependent and independent signaling. Glia. 2013;61:1906-1921. [PubMed] [DOI] |
| 13. | Cačev T, Aralica G, Lončar B, Kapitanović S. Loss of NF2/Merlin expression in advanced sporadic colorectal cancer. Cell Oncol (Dordr). 2014;37:69-77. [PubMed] [DOI] |
| 14. | Smole Z, Thoma CR, Applegate KT, Duda M, Gutbrodt KL, Danuser G, Krek W. Tumor suppressor NF2/Merlin is a microtubule stabilizer. Cancer Res. 2014;74:353-362. [PubMed] [DOI] |
| 15. | Petrilli A, Bott M, Fernández-Valle C. Inhibition of SIRT2 in merlin/NF2-mutant Schwann cells triggers necrosis. Oncotarget. 2013;4:2354-2365. [PubMed] |
| 16. | Schroeder RD, Angelo LS, Kurzrock R. NF2/merlin in hereditary neurofibromatosis 2 versus cancer: biologic mechanisms and clinical associations. Oncotarget. 2014;5:67-77. [PubMed] |
| 17. | Kim JE, Finlay GJ, Baguley BC. The role of the hippo pathway in melanocytes and melanoma. Front Oncol. 2013;3:123. [PubMed] [DOI] |
| 18. | Schulz A, Baader SL, Niwa-Kawakita M, Jung MJ, Bauer R, Garcia C, Zoch A, Schacke S, Hagel C, Mautner VF. Merlin isoform 2 in neurofibromatosis type 2-associated polyneuropathy. Nat Neurosci. 2013;16:426-433. [PubMed] [DOI] |
| 19. | Murray LB, Lau YK, Yu Q. Merlin is a negative regulator of human melanoma growth. PLoS One. 2012;7:e43295. [PubMed] [DOI] |
| 20. | Morrow KA, Shevde LA. Merlin: the wizard requires protein stability to function as a tumor suppressor. Biochim Biophys Acta. 2012;1826:400-406. [PubMed] [DOI] |
| 21. | Pećina-Šlaus N. Merlin, the NF2 gene product. Pathol Oncol Res. 2013;19:365-373. [PubMed] [DOI] |
| 22. | Cui F, Gao L, Yuan F, Dong ZF, Zhou ZN, Kline DD, Zhang Y, Li DP. Hypobaric intermittent hypoxia attenuates hypoxia-induced depressor response. PLoS One. 2012;7:e41656. [PubMed] [DOI] |
| 23. | Eguchi D, Ikenaga N, Ohuchida K, Kozono S, Cui L, Fujiwara K, Fujino M, Ohtsuka T, Mizumoto K, Tanaka M. Hypoxia enhances the interaction between pancreatic stellate cells and cancer cells via increased secretion of connective tissue growth factor. J Surg Res. 2013;181:225-233. [PubMed] [DOI] |
| 24. | Cui J, Mao X, Olman V, Hastings PJ, Xu Y. Hypoxia and miscoupling between reduced energy efficiency and signaling to cell proliferation drive cancer to grow increasingly faster. J Mol Cell Biol. 2012;4:174-176. [PubMed] [DOI] |
| 25. | 韩 辉, 韩 琳琳, 高 海东, 侯 琳. MTHFR、MS基因多态及NF2基因甲基化与乳腺癌发病关系的研究. 中国现代普通外科进展. 2011;11:846-850. |
| 27. | 李 达, 郝 淑煜, 张 俊廷. 神经纤维瘤病2型分子生物学研究进展. 国际神经病学神经外科学杂志. 2010;3:290-293. |