修回日期: 2014-03-25
接受日期: 2014-05-29
在线出版日期: 2014-07-28
目的: 探讨肝细胞癌(hepatocellular carcinoma, HCC)中microRNA-22(miR-22)表达及其在肿瘤细胞表型转化中的作用.
方法: 应用实时荧光定量PCR技术检测108例HCC及其对应癌旁组织和不同转移潜能的肝癌细胞MHCC97-L、Huh7中miR-22的表达情况; 免疫组织化学SP法检测上述HCC及其对应癌旁组织中上皮钙黏蛋白(E-cadherin, E-cad)、波形蛋白(Vimentin)的表达; Pearson's软件分析miR-22的表达与E-cad、波形蛋白之间的相关性.
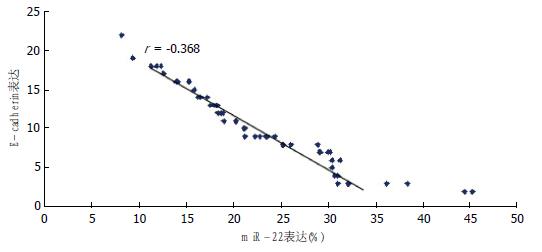
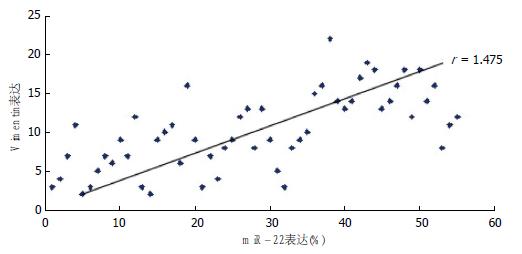
结果: miR-22在HCC组织中的表达显著高于对应的癌旁组织(P<0.05). E-cad在HCC组织中的表达显著低于对应的癌旁组织(P<0.05), 而HCC组织中波形蛋白表达显著高于对应的癌旁组织(P<0.05). Pearson's相关性分析表明, HCC组织中miR-22表达与E-cad呈负相关(r = -0.368, P<0.05), 与波形蛋白表达呈正相关(r = 1.475, P<0.05). 间质表型的肝癌细胞MHCC97-L中miR-22表达显著高于上皮表型的肝癌细胞Huh7(P<0.05).
结论: 肝癌细胞高表达miR-22, 且与E-cad表达呈负相关, 而与波形蛋白表达呈正相关;miR-22可能是一个促进肝癌发生和转移的重要分子.
核心提示: 本研究发现肝癌细胞中高表达microRNA-22(miR-22), 且与E钙黏蛋白(E-cadherin, E-cad)表达呈负相关, 与波形蛋白表达呈正相关. 而E-cad是上皮性标志物, 波形蛋白是间质性标志物, 提示miR-22表达与肝癌细胞的表型转化有关, miR-22可能通过参与肝癌细胞的上皮-间质表型转化而促进肝癌侵袭和转移.
引文著录: 丁隆, 杨宇, 何淑玲, 夏伟滨, 曲义坤, 刘伟新, 徐剑, 张英海. miR-22在肝细胞癌中的表达及其与上皮钙黏蛋白、波形蛋白的相关性. 世界华人消化杂志 2014; 22(21): 3142-3147
Revised: March 25, 2014
Accepted: May 29, 2014
Published online: July 28, 2014
AIM: To explore the expression of microRNA-22 (miR-22) in hepatocellular carcinoma (HCC) and its role in phenotype transition.
METHODS: Real-time polymerase chain reaction (qPCR) was used to detect the expression of miR-22 in HCC tissues from 108 patients and in two liver cancer cell lines MHCC97-L and Huh7, which have different potential of metastasis. The expression of epithelial marker E-cadherin (E-cad) and mesenchymal marker Vimentin was evaluated by the immunohistochemistry technique. The correlation between miR-22 expression and E-cad and Vimentin expression was analyzed.
RESULTS: The expression of miR-22 was higher in HCC tissues than in matched tumor-adjacent tissues (P < 0.05). The expression of E-cad was significantly lower and that of Vimentin was significantly higher in HCC tissues than in matched tumor-adjacent tissues (P < 0.05). There was a negative correlation between miR-22 and E-cad expression (r = -0.368, P < 0.05), but a positive correlation between miR-22 and Vimentin expression (r = 1.475, P < 0.05). Therefore, mesenchymal MHCC97-L cells demonstrated high miR-22 expression, while epithelial Huh7 cells demonstrated low miR-22 expression, and the difference was significant between the two cell types (P < 0.05).
CONCLUSION: There is a negative correlation between miR-22 and E-cad expression and a positive correlation between miR-22 and Vimentin expression in HCC cells. miR-22 may be a vital factor contributing to the development and metastasis of HCC.
- Citation: Ding L, Yang Y, He SL, Xia WB, Qu YK, Liu WX, Xu J, Zhang YH. miR-22 expression in hepatocellular carcinoma: Correlation with E-cadherin and Vimentin expression. Shijie Huaren Xiaohua Zazhi 2014; 22(21): 3142-3147
- URL: https://www.wjgnet.com/1009-3079/full/v22/i21/3142.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i21.3142
肝细胞癌(hepatocellular carcinoma, HCC)是世界上癌症相关死亡的第三大原因, 每年约700000例死于HCC, 而中国约占全世界死亡人数的55%[1]. 虽然目前治疗HCC的方法很多, 也取得一些进展, 但复发转移仍是影响HCC治愈率的最主要障碍, 而且肝癌细胞如何获得侵袭转移潜能目前尚不十分清楚. 研究表明, 上皮-间质表型转化(epithelial-mesenchymal transitions, EMT)是HCC侵袭转移的重要机制之一[2]. EMT是指上皮细胞在特定的情况下向间质细胞转分化的现象, 其主要的特征为上皮细胞黏附分子[如E钙黏蛋白(E-cadherin, E-cad)]表达的丧失, 并获得间质细胞的特性[成纤维细胞样的外形、波形蛋白(Vimentin)的重新表达][3]. MicroRNAs(miRNAs)是一类长约17-25 nt的单链内源性非编码RNA, 其在体内的主要功能是采用降解靶mRNA和结合于靶mRNA的3'端非翻译区(3' untranslated region, 3'UTR)端抑制其翻译两种作用方式调控基因的表达[4]. 近年来, miRNA已成为生命科学领域研究的热点, 认为miRNAs参与了多种生物学过程的调节[5]. 阐明miRNA在HCC侵袭转移中的作用将为开发新的治疗药物以提高HCC治愈率和患者的长期生存期提供理论依据. 本研究拟检测108例HCC组织及其对应的癌旁组织中和不同转移潜能的肝癌细胞株MHCC97-L、Huh7中的miR-22、E-cad和波形蛋白的表达并分析其相关性, 以探讨miR-22在HCC侵袭转移中的作用及可能机制.
标本取自2008-01/2011-12在我院手术切除的108例肝癌标本及对应的癌旁组织, 均经病理证实为HCC(按世界卫生组织1997年标准). 108例患者中, 男97例, 女11例, 年龄26-71岁, 中位年龄52.6岁. 所有患者均签署知情同意书. 所有标本速冻于液氮中, 随后即置于-80 ℃保存备用. 不同转移潜能的肝癌细胞株MHCC97-L(间质表型)和Huh7(上皮表型)[6,7]由佳木斯大学基础医学院提供. TRIzol试剂和实时荧光定量PCR试剂盒购自美国Promega Corporation公司(Madison, WI, USA), DEPC购自美国Sigma公司,引物购自RiboBio公司(广州, 中国). 逆转录酶MMLV购自Promega Corporation(Madison, WI, USA). 100 bp DNA Ladder Marker购自Applied Biosystems(Foster City, CA, USA). 荧光定量PCR仪为美国Roche公司产品, 紫外分光光度计为Thermo Scientific公司(Worcester, MA, USA)产品, 凝胶电泳成像系统为美国Bio-Rad公司产品. 兔抗人E-cad和波形蛋白多克隆抗体购自中山金桥公司(中国, 北京), 免疫组织化学SP试剂盒及DAB染色试剂盒均购自福州迈新生物技术有限公司.
1.2.1 HCC组织总RNA提取: 从108例肝癌及其配对的癌旁组织中取约50 mg的新鲜组织加1 mL TRIzol试剂后立即研碎、匀浆, 氯仿去蛋白, 异丙醇沉淀, 冰浴下提取总RNA, 测260和280 nm时的吸光度, 计算RNA的纯度和浓度. 然后将RNA逆转录成cDNA. 肝癌细胞株MHCC97-L和Huh7用DMEM培养基加入10%胎牛血清在5%CO2、合适湿度条件下培养, 同上方法提取细胞的总RNA, 并逆转录成cDNA.
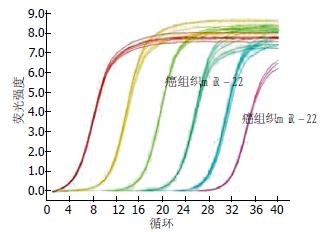
1.2.2 实时荧光定量PCR检测肝癌组织和肝癌细胞MHCC97-H、Huh7中miR-22表达: 取cDNA 2.0 μL, 10×RT酶1.5 μL, 10×RT缓冲液1.5 μL, 5×RT引物3.0 μL, dNTP 1.5 μL, RNA酶抑制剂(40 U/μL)0.2 μL, 加Rnase Freed H2O至15 μL. 反应条件: 16 ℃ 30 min, 42 ℃ 30 min, 85 ℃ 5min; Real-time PCR反应体系: Real-time PCR Master Mix 10 μL, TaqMan探针1 μL, RT产物2 μL, 加ddH2O至20 μL, 反应条件95 ℃预热30 s, 95 ℃ 3 s, 56 ℃ 15 s, 72 ℃ 30 s, 50个循环.
1.2.3 免疫组织化学SP法检测E-cad和波形蛋白的表达: 全部实验用组织蜡块4 μm厚切片, 0.01 mol/L柠檬酸盐缓冲液抗原修复, SP免疫组织化学操作按说明书进行, DAB显色; 分别用已知的阳性切片作为阳性对照, 用PBS液代替一抗做阴性对照, 选择表达最密集的10个视野, 在40倍显微镜下观察目的蛋白表达情况. 阳性反应的判断根据癌细胞显色强度计分: 0分细胞无色; 1分呈浅黄色; 2分呈棕黄色(中等染色); 3分呈棕褐色(强染色),≥2分记为阳性,<2分记为阴性.
统计学处理 所有资料采用SPSS18.0 for Windows(SPSS, Inc., Chicago, IL, USA). 软件处理, 计量数据均以means±SD表示. 采用t检验、方差分析, 相关性分析采用Pearson's correlation处理. P<0.05为差异有统计学意义.
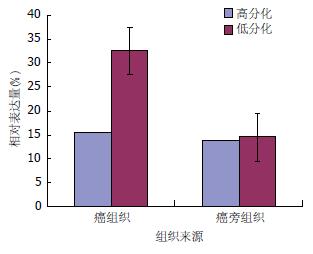
108例肝癌组织中, miR-22的相对表达量为22.86%±12.54%(图1); 82例低分化肝细胞癌中miR-22的表达量最高, 为32.46%±8.73%, 显著高于其配对的癌旁组织14.42%±8.85%, 两组间比较有显著性差异(P<0.05); 26例高分化肝癌组织中miR-22表达量(15.36%±9.72%)稍高于其配对的癌旁组织(13.75%±10.85%), 两组间比较无显著性差异(P>0.05)(图2).
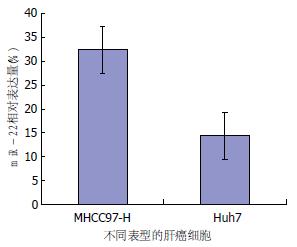
间质表型的肝癌细胞株MHCC97-H高表达miR-22(31.45±7.86), 而上皮表型的肝癌细胞株Huh7中miR-22表达显著低于MHCC97-H(图3).
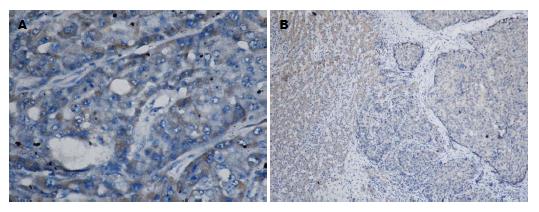
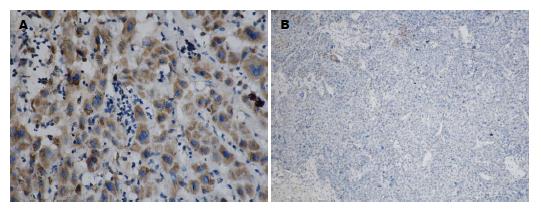
E-cad主要在细胞膜或细胞质表达, 癌组织以胞质着色为主(图4A), 阳性表达率为53.84%(28/52), 低于对应的癌旁组织(以胞膜表达为主)的73.08%(38/52)(图4B), 两者比较有显著性差异(P<0.05). 波形蛋白主要表达于肝癌细胞的胞浆, 在间质细胞胞浆和肝癌血管内皮细胞及肝窦血管内皮也有表达(图5A), 阳性表达率84.61%(44/52), 高于配对的癌旁组织51.92%(27/52)(图5B), 两组间比较有显著性差异(P<0.05).
miRNAs是近年来发现的一类进化上高度保守、长度约22 nt、具有转录后负调节靶基因活性的小分子非编码RNA[8], 主要是通过作为RNA诱导的沉默复合体(RNA-induced silencing complex, RISC)的一个组成部分, 识别mRNA的3'UTR, 引起该mRNA降解或者翻译抑制, 从而负性调节该基因的蛋白表达, 进而参与多种重要的细胞途径和生理病理过程[9]. 这些miRNAs对维持人体正常发育和生理活动是非常重要的, 若miRNAs表达及其功能失调, 则会导致疾病的发生[10]. Hudder等[11]预测人类至少有1/3的基因受miRNAs调控, 但是迄今为止仅有500多个人类miRNAs被克隆并已经测序证实[12].
Bracken等[13]用Real-time PCR检测发现miR-22在非小细胞肺癌组织中的表达显著升高, 其过表达与淋巴结转移和临床分期有显著相关性, 而与肿瘤的分化程度无相关性, 而且其表达水平与患者的生存期呈显著负相关, 即miR-22表达水平越高, 患者的生存期越短. Song等[14]研究表明miR-22过表达与临床预后差有关, 可沉默患者的TET-miR-200轴, 并且miR-22通过诱导肿瘤细胞发生EMT促进乳腺癌从乳腺组织扩散到肺部, 且miR-22是通过直接靶向TET蛋白来抑制miR-200分子产生的, 而miR-200是一种抵抗肿瘤转移的microRNA分子. Song等[15]进一步鉴定出在模式小鼠体内, miR-22作为一种表观遗传修饰剂, 在骨髓增生异常综合征(myeolodysplastic syndrome, MDS)和白血病发病过程中发挥着关键性的致癌作用.
我们的研究发现miR-22在HCC组织中的表达显著高于其对应的癌旁组织, 上皮性表型标志物E-cad在HCC组织中的阳性表达率显著低于对应的癌旁组织, 间叶性表型标志物在HCC组织中的阳性表达率显著高于配对的癌旁组织, 而且miR-22表达与E-cad呈负相关, 与波形蛋白呈正相关, 提示miR-22在HCC组织中的过表达与肝癌细胞发生表型转化有关, 进一步检测上皮表型肝癌细胞Huh7和间质表型肝癌细胞MHCC97-H中miR-22的表达, 发现间质表型的肝癌细胞MHCC97-H中miR-22的表达显著高于上皮表型肝癌细胞Huh7, 进一步提示miR-22与HCC表型有关. 研究表明上皮表型细胞无迁移和侵袭能力, 而间质表型的肿瘤细胞迁移和侵袭性能力显著增强, 而且癌细胞表型发生改变是恶性肿瘤转移侵袭的早期阶段[16]. 研究证实特异性的miRNAs是转移过程和EMT过程中的重要调控因子[13]. 在HCC组织中过表达的miR-22是否与在乳腺癌一样, 诱导肝癌细胞发生EMT, 并通过EMT促进肝癌细胞发生肺、脊椎等远处转移, 需要进一步的细胞迁移和侵袭实验等证实, 而且miR-22的下游靶分子尚需进一步的鉴定.
全世界每年约70万例死于肝细胞癌(hepatocellular carcinoma, HCC), 而中国约占全世界死亡人数的55%. 目前治疗HCC的方法较多, 但总体治愈率不高, 复发转移是影响HCC治愈率的最主要障碍, 且机制尚不完全清楚. 研究表明, 上皮-间质表型转化(epithelial-mesenchymal transitions, EMT)是HCC侵袭转移的重要机制之一. 新近研究发现异常表达的miRNAs参与了多种恶性肿瘤的侵袭转移过程. 因此探讨miRNA在HCC侵袭转移中的作用及分子机制将为开发新的治疗策略以提高HCC治愈率和患者的长期生存期提供理论依据.
李孟森, 教授, 海南医学院/海南省肿瘤发生和干预重点实验室
HCC预后的瓶颈, 90%以上的癌症死亡都是复发转移等并发症直接引起的, 也是相关科研人员研究的热点和难点. HCC侵袭转移是一个多因素参与的复杂过程, 与HCC侵袭转移有关的因素很多, 如乙型肝炎病毒DNA和丙型肝炎病毒抗体的持续存在、基因突变、miRNA异常表达等, 但任何一种因素都不能完全解释HCC侵袭转移的发生和进展. 因此需要进一步研究参与调控HCC侵袭转移的上游因子及其信号转导通路.
国内外众多研究表明, miRNA参与增殖、分化、凋亡等多种重要细胞活动的调控, 并且具有癌基因和抑癌基因样的作用, 在包括肝癌在内的多种肿瘤的发生、发展、侵袭、转移中发挥重要作用. 这些发现极大地扩展了HCC发病和侵袭转移机制的研究领域, 并且显示了miRNA作为一类新的诊断标记和治疗靶点的巨大潜力, 开发靶向miRNA的治疗可能是今后的一个重要策略.
EMT是HCC侵袭转移的机制之一, 其特征是上皮标志物E钙黏蛋白(E-cadherin, E-cad)表达下调, 间质标志物Vimentin表达增加, 细胞极性丧失等. 目前对调控EMT的下游信号转导通路研究较多, 如Src激酶通路、Wnt/β-catenin通路等, 而对诱导EMT的上游因子研究较少. 本研究表明肝癌细胞中异常高表达的miR-22与HCC的E-cad表达呈负相关, 与Vimentin呈正相关, 提示miR-22可能是诱导肝癌细胞发生EMT的上游因子并促进HCC侵袭转移.
通过阐明miR-22在HCC侵袭转移中的作用及可能机制, 为临床开发防治HCC复发转移的新策略提供理论依据, 并靶向miR-22及其信号通路的治疗将提高HCC的治愈率并改善HCC患者的生存.
本文有一定创新性, 对临床肝癌的治疗有一定的参考价值.
编辑 田滢 电编 鲁亚静
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Giannelli G, Bergamini C, Fransvea E, Sgarra C, Antonaci S. Laminin-5 with transforming growth factor-beta1 induces epithelial to mesenchymal transition in hepatocellular carcinoma. Gastroenterology. 2005;129:1375-1383. [PubMed] [DOI] |
| 3. | Thiery JP. Epithelial-mesenchymal transitions in development and pathologies. Curr Opin Cell Biol. 2003;15:740-746. [PubMed] [DOI] |
| 4. | Xia M, Hu MH. The Role of MicroRNA in Tumor Invasion and Metastasis. J Cancer Mol. 2010;5:33-39. |
| 6. | You H, Ding W, Dang H, Jiang Y, Rountree CB. c-Met represents a potential therapeutic target for personalized treatment in hepatocellular carcinoma. Hepatology. 2011;54:879-889. [PubMed] [DOI] |
| 7. | Li Y, Tang ZY, Ye SL, Liu YK, Chen J, Xue Q, Chen J, Gao DM, Bao WH. Establishment of cell clones with different metastatic potential from the metastatic hepatocellular carcinoma cell line MHCC97. World J Gastroenterol. 2001;7:630-636. [PubMed] |
| 9. | Kim VN, Nam JW. Genomics of microRNA. Trends Genet. 2006;22:165-173. [PubMed] [DOI] |
| 10. | Gregory RI, Yan KP, Amuthan G, Chendrimada T, Doratotaj B, Cooch N, Shiekhattar R. The Microprocessor complex mediates the genesis of microRNAs. Nature. 2004;432:235-240. [PubMed] [DOI] |
| 11. | Hudder A, Novak RF. miRNAs: effectors of environmental influences on gene expression and disease. Toxicol Sci. 2008;103:228-240. [PubMed] [DOI] |
| 12. | Le XF, Merchant O, Bast RC, Calin GA. The Roles of MicroRNAs in the Cancer Invasion-Metastasis Cascade. Cancer. Microenviron. 2010;3:137-147. [PubMed] [DOI] |
| 13. | Bracken CP, Gregory PA, Khew-Goodall Y, Goodall GJ. The role of microRNAs in metastasis and epithelial-mesenchymal transition. Cell Mol Life Sci. 2009;66:1682-1699. [PubMed] [DOI] |
| 14. | Song SJ, Poliseno L, Song MS, Ala U, Webster K, Ng C, Beringer G, Brikbak NJ, Yuan X, Cantley LC. MicroRNA-antagonism regulates breast cancer stemness and metastasis via TET-family-dependent chromatin remodeling. Cell. 2013;154:311-324. [PubMed] [DOI] |
| 15. | Song SJ, Ito K, Ala U, Kats L, Webster K, Sun SM, Jongen-Lavrencic M, Manova-Todorova K, Teruya-Feldstein J, Avigan DE. The oncogenic microRNA miR-22 targets the TET2 tumor suppressor to promote hematopoietic stem cell self-renewal and transformation. Cell Stem Cell. 2013;13:87-101. [PubMed] [DOI] |
| 16. | Onder TT, Gupta PB, Mani SA, Yang J, Lander ES, Weinberg RA. Loss of E-cadherin promotes metastasis via multiple downstream transcriptional pathways. Cancer Res. 2008;68:3645-3654. [PubMed] [DOI] |