修回日期: 2014-06-04
接受日期: 2014-06-06
在线出版日期: 2014-07-28
目的: 分析细丝蛋白A(filamin A, FLNA)在胃及胃癌组织中的表达并探讨其与肿瘤浸润、转移的关系及其与基质金属蛋白酶9(matrix metallopeptidase 9, MMP-9)的相互关系.
方法: 利用组织芯片通过免疫组织化学方法检测210例胃腺癌, 50例正常胃黏膜组织中FLNA和MMP-9蛋白的表达, 同时分析二者表达水平的变化与病理参数的关系.
结果: 胃癌组织中FLNA蛋白表达低于正常胃组织而MMP-9的表达水平高于正常胃组织(P<0.05). FLNA的表达与患者性别、年龄、肿瘤组织学分级无关(P>0.05), 而与肿瘤淋巴结转移、临床分期和肿瘤浸润深度相关(P<0.05); Spearman等级相关分析显示: FLNA和MMP-9蛋白表达呈负相关(r = -0.138, P = 0.044).
结论: 胃癌组织中FLNA低表达与肿瘤的淋巴结转移、临床分期、浸润深度相关; 我们猜测: FLNA的缺失上调了MMP-9蛋白水平而影响了肿瘤的发生和发展.
核心提示: 细丝蛋白A(filamin A, FLNA)能够通过抑制Ras/MAPK/ERK级联反应, 降低基质金属蛋白酶9(matrix metallopeptidase 9, MMP-9)的表达, 最终降低肿瘤细胞的侵袭力. 我们的实验用Spearman等级相关分析结果显示FLNA与MMP-9的蛋白表达在胃癌组织中呈负相关(r = -0.138, P = 0.044), 我们猜测: FLNA的缺失上调了MMP-9蛋白水平而影响了肿瘤的发生和发展.
引文著录: 郭云娣, 白光辉. 胃癌组织中FLNA与MMP-9蛋白表达的关系. 世界华人消化杂志 2014; 22(21): 3113-3117
Revised: June 4, 2014
Accepted: June 6, 2014
Published online: July 28, 2014
AIM: To detect the expression of filamin A (FLNA) and matrix metallopeptidase 9 (MMP-9) in gastric carcinoma and to analyze their clinical significance.
METHODS: Immunohistochemistry was used to detect FLNA and MMP-9 protein expression in 210 gastric cancer specimens and 50 normal tissues to study their correlations with clinical factors. The correlation between FLNA and MMMP-9 protein expression was also analyzed.
RESULTS: The level of FLNA protein expression was significantly lower in gastric cancer tissues than in normal tissues (P < 0.05). The level of MMP-9 protein expression was significantly higher in gastric cancer tissues than in normal tissues (P < 0.05). FLNA protein expression was not correlated with gender, age, or histological grade (P > 0.05), but correlated with lymph node metastasis, clinical stage and tumor invasion (P < 0.05). Moreover, there was a negative correlation between the expression of FLNA and MMP-9 protein in gastric cancer (r = -0.138, P = 0.044).
CONCLUSION: FLNA expression decreases in gastric cancer and correlates significantly with lymph node metastasis, clinical stage and tumor invasion, suggesting that FLNA may play an important role as a negative regulator of gastric carcinogenesis by promoting the degradation of MMP-9.
- Citation: Guo YD, Bai GH. Clinical significance of FLNA and MMP-9 protein expression in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(21): 3113-3117
- URL: https://www.wjgnet.com/1009-3079/full/v22/i21/3113.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i21.3113
过去的几十年里, 在美国及世界其他地区胃癌的发生率和死亡率戏剧性的有所下降[1], 但胃癌在我国仍然是常见的消化系肿瘤, 居恶性肿瘤死亡的第1位[2]. 尽管胃癌在临床和基础研究中有很多重大进展, 但像其他肿瘤一样, 大量的基因改变可能是其形成的重要原因之一. 因此, 进一步研究将阐明胃癌的发病机制并有可能提供有效治疗的靶分子. 细丝蛋白A(filamin A, FLNA)是非肌性肌动蛋白结合蛋白, 表达广泛, 对哺乳动物的生长发育具有重要的作用, 是重要的信号转导支架蛋白, 涉及多条与肿瘤形成有关的信号转导通路, 参与调节增殖、黏附、迁徙等多种细胞行为, 在肿瘤的发生和发展中具有重要的作用. 基质金属蛋白酶9(matrix metallopeptidase 9, MMP-9)是基质金属蛋白酶家族中的重要一员, 促进肿瘤侵袭转移[3]. FLNA与MMP-9在肿瘤发生、发展的作用及其相互关系在鼻咽癌等恶性肿瘤中有文献[4]报道, 而在较大样本的胃癌组织中未见报道. 本实验通过免疫组织化学方法联合检测胃癌组织中FLNA和MMP-9蛋白的表达, 并分析两者与胃癌临床病理因素之间的关系, 旨在探讨FLNA和MMP-9在胃癌发生、发展中可能发挥的作用及其意义, 亦有助于提高胃癌侵袭转移能力的评估.
收集2006-01-01/2012-12-31于苏州市立医院住院的胃癌患者标本210例; 正常胃黏膜组织(据肿瘤5 cm以上)50例, 患者年龄32-85岁, 中位年龄63.94岁. 患者术前均未进行放疗和化疗, 所有标本均经两位病理专家阅片证实. 一抗FLNA, MMP-9及二抗均购基因公司. 常规石蜡包埋, 4 μm厚连续切片. 采用Envision免疫组织化学法, 实验同时有阴性、阳性对照.
1.2.1 组织芯片的构建: 石蜡组织标本HE染色后, 在显微镜下标记肿瘤或正常组织. 每个蜡块取二块组织芯点, 制成9行×16列(4个蜡块, 肿瘤)和10行×5列(1个蜡块, 正常), 组织芯直径为1.6 mm.
1.2.2 免疫组织化学染色结果判定: FLNA抗体稀释度为1:100; MMP-9抗体为工作液, 二种抗体染色阳性者均主要在细胞浆, 即呈现棕黄色颗粒为阳性信号. 结果判定方法按照Sun[1]方法: 阳性细胞的百分百被分为4个等级: 0分,≤5%阳性细胞; 1分, 5%-25%; 2分, 26%-50%; 和3分,>51%阳性细胞; 染色强度被分为: 0分, 无色; 1分, 弱阳性(浅黄色); 2分, 中度阳性(棕色); 和3分, 强阳性(黄褐色). 最后FLNA和MMP-9的得分综合以上二项: 0分为阴性; +为1-3分; ++为4-6分; +++为7-9分. 阴性对照用PBS代替一抗.
统计学处理 所有实验数据均采用SPSS13.0软件分析. 组间差异比较采用χ2检验, 采用Spearman等级相关分析胃癌组织中FLNA和MMP-9表达的相互关系. P<0.05为差异有统计学意义.
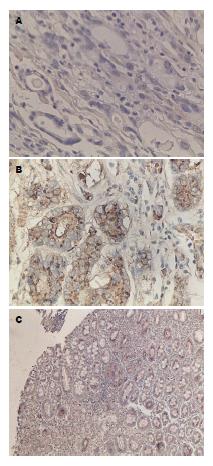
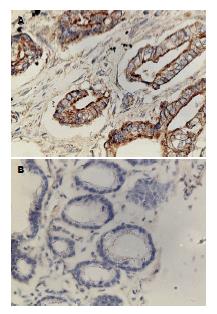
本组实验中210例胃癌组织中FLNA蛋白的表达从阴性到弱阳性而50例胃黏膜组织中FLNA染色从弱阳性到强阳性. FLNA在胃癌组织中的阳性表达率为31%(65/210)低于正常胃黏膜组织的82%(41/50), 区别有统计学意义(P<0.05)(图1).
本组实验中210例胃癌组织中MMP-9蛋白的表达的阳性表达率为62.4%(131/210)高于正常胃黏膜组织的30%(15/50), 差异有统计学意义(P<0.05)(图2).
210例胃癌中, FLNA、MMP-9阳性表达与患者年龄、性别、肿瘤分化程度、Lauren分型均无关(P>0.05), 而与胃癌淋巴结转移、肿瘤TNM分期相关(P<0.05); MMP-9的表达亦与肿瘤浸润深度相关(P<0.05)(表1).
| 临床病理参数 | n | 细丝蛋白A | 基质金属蛋白酶9 | ||||||
| (+)-(+++) | - | χ2值 | P值 | (+)-(+++) | - | χ2值 | P值 | ||
| 年龄(岁) | 0.950 | 0.330 | 0.000 | 0999 | |||||
| <65 | 109 | 37(17.6) | 72(34.3) | 68(32.4) | 41(19.5) | ||||
| ≥65 | 101 | 28(13.3) | 73(34.8) | 63(62.4) | 79(37.6) | ||||
| 性别 | 0.060 | 0.807 | 3.434 | 0.064 | |||||
| 男 | 156 | 49(23.3) | 107(51.0) | 103(49.0) | 53(25.5) | ||||
| 女 | 54 | 16(7.6) | 38(18.1) | 28(13.3) | 26(12.4) | ||||
| 分化程度 | 0.074 | 0.786 | 0.033 | 0.855 | |||||
| 高、中分化 | 116 | 35(16.7) | 81(38.6) | 73(34.8) | 43(20.5) | ||||
| 低分化 | 94 | 30(31.0) | 64(30.5) | 58(27.6) | 36(17.1) | ||||
| 淋巴结转移 | 4.972 | 0.026 | 5.860 | 0.015 | |||||
| 无 | 57 | 11(5.2) | 46(21.9) | 28(13.3) | 29(13.8) | ||||
| 有 | 153 | 54(25.7) | 99(47.1) | 103(49.0) | 50(23.80 | ||||
| 浸润深度 | 4.592 | 0.032 | 0.023 | 0.879 | |||||
| 肌层 | 41 | 7(3.3) | 34(16.2) | 26(12.4) | 15(7.1) | ||||
| 浆膜及外 | 169 | 58(27.6) | 111(52.9) | 105(50.0) | 64(30.5) | ||||
| Lauren's分型 | 0.001 | 0.979 | 0.571 | 0.450 | |||||
| 肠型 | 116 | 36(17.1) | 80(38.1) | 75(35.7) | 41(19.5) | ||||
| 弥漫及混合型 | 94 | 29(13.8) | 65(31.0) | 56(26.7) | 38(18.1) | ||||
| TNM分期 | 8.751 | 0.003 | 7.780 | 0.005 | |||||
| Ⅰ or Ⅱ期 | 76 | 14(6.7) | 62(29.5) | 38(18.1) | 38(18.1) | ||||
| Ⅲ or Ⅳ期 | 134 | 51(24.3) | 83(39.5) | 93(44.3) | 79(37.6) | ||||
FLNA蛋白包括一个肌动蛋白结合结构域和24个串联的重复序列, 中间间隔两个铰链结构, 重复序列二级结构的算术模型显示, 每个重复序列形成多个反向平行的β-片层结构, 并重叠排列形成棒状结构, 具有良好的韧性, 机械性信号通过棒状结构和"铰链"片段而进行传递. FLNA主要分布在细胞浆, 两条多肽链在羧基端的第24个重复序列末端相连, 形成与其功能有关的"V"型同源二聚体[5], 其二聚体亚型相对分子质量为280 kDa, 氨基端的机动蛋白结合结构域能够结合机动结合蛋白并可与机动蛋白交联而形成稳固的细胞骨架, 从而参与细胞运动并作为细胞内重要的信号转导支架干预了多条与肿瘤形成有关的信号转导通路而在肿瘤的侵袭、转移中起重要作用[6-8]. 用免疫组织化学方法本组实验比较了FLNA在胃癌组织和正常胃黏膜组织中的表达及分布情况, 其结果显示: FLNA在胃癌组织中低表达, 与正常胃黏膜的FLNA表达相比具有统计学意义(P<0.05), 提示: FLNA有可能在胃癌细胞中的细胞骨架作用受到破坏而利于肿瘤的发生、发展. 同时, FLNA蛋白在胃癌组织中的表达与患者年龄、性别、肿瘤分化程度均无关, 而与肿瘤淋巴结转移、临床TNM分期、及肿瘤的浸润深度有关(P<0.05), 我们的结果与Sun等[1]的实验结果相同. 进一步猜测: FLNA也参与了胃癌组织的浸润于转移等过程. Sun等[1]的生存分析显示: 低表达FLNA的胃癌患者5年生存率显著降低, 而在乳腺癌、前列腺癌中有相同的结果[9,10]. 浸润性生长是一个恶性的关键属性也是治疗失败的主要原因, 甚至可能导致死亡. 退化细胞外基质的预测被认为是启动了肿瘤细胞的入侵. MMP-9是基质金属蛋白酶家族中的重要一员, 其能水解细胞膜和细胞外基质, 突破基质屏障, 从而促进肿瘤的侵袭和转移. 在结肠癌肝转移过程中MMP-9起了重要作用[11]. 肿瘤细胞的扩散及侵入周围组织需依靠MMP-9参与的基底膜和细胞外基质的降解, MMP-9基因启动子的活化依赖于Ras/MAPK/ERK信号途径, 而MAPK/ERK通路调节细胞的生长、分裂、分化、凋亡、对环境的应激适应和炎性反应等多种重要的细胞生理/病理过程. Merdad等[12]认为MMPS参与了乳腺癌[13]、肝癌[14]、胃癌[15]、肾癌[16]浸润转移的过程. 本组实验中, MMP-9在胃癌组织中的表达高于周围正常胃组织, 说明, 细胞外基质的大量降解促进了肿瘤的发生、发展, 而MMP-9蛋白的表达与胃癌患者的淋巴结转移、临床TNM分期密切相关, 也进一步说明, 细胞膜和细胞外基质被水解, 突破了基质屏障, 从而促进肿瘤的侵袭和转移. 而通过与通路上游分子相互作用, FLNA调节通路的活性, FLNA与Ras-GRF结合, 并通过泛素化使其降解. 因此, Sun等[17]和Zhu等[18]认为, FLNA能够通过抑制Ras/MAPK/ERK级联反应, 降低MMP-9的表达, 最终降低肿瘤细胞的侵袭力. 我们的实验用Spearman等级相关分析结果显示FLNA与MMP-9的蛋白表达在胃癌组织中呈负相关(r = -0.138, P = 0.044), 我们猜测: FLNA的缺失上调了MMP-9蛋白水平而影响了肿瘤的发生和发展[1].
本组实验表明FLNA参与了胃癌组织的扩散、入侵和转移. 然而, 健康的细胞转变成恶性肿瘤细胞是一个复杂的过程, 涉及改变细胞分裂、信号转导和细胞骨架结构等诸多过程. 我们的研究仅说明: FLNA在胃癌组织的下调影响了相关的大量的细胞因子和信号途径而至细胞恶性转变, FLNA几乎覆盖上面提到的所有的功能流程[1]. 未来的研究将继续探索FLNA介导的底层机制肿瘤的发生和胃癌的发展.
细丝蛋白A(filamin A, FLNA)是一种细胞骨架蛋白, 在很多细胞中表达, 可与多种具有不同功能的蛋白结合, 参与细胞的多种生物学行为, 与细胞浸润和转移相关联, 影响肿瘤的发生和发展, 因此推测FLNA可能在胃癌的形成及浸润转移中起重要作用, 有望成为评估预后的指标.
汤华, 研究员, 博士生导师, 重庆医科大学感染性疾病分子生物学重点实验室
抗增殖基因FLNA无论在胃癌组织还是在体外细胞培养中都有调节肿瘤细胞侵袭及转移的作用并具有临床意义.
低表达FLNA的胃癌患者5年生存率显著降低, 而在乳腺癌、前列腺癌中有相同的报道.
本文标本数量较多、临床资料较全面并在组织芯片中进行免疫组织化学染色, 实验条件相对一致, 其结果准确性较高.
FLNA在胃癌组织中与肿瘤侵犯、淋巴结转移、临床TNM分期密切相关, 且与MMP-9呈负相关, 联合检测FLNA与MMP-9蛋白有可能对胃癌患者判断预后起作用.
本文具有一定的临床参考价值.
编辑 田滢 电编 闫晋利
| 1. | Sun GG, Sheng SH, Jing SW, Hu WN. An antiproliferative gene FLNA regulates migration and invasion of gastric carcinoma cell in vitro and its clinical significance. Tumour Biol. 2014;35:2641-2648. [PubMed] |
| 4. | Sun GG, Lu YF, Cheng YJ, Hu WN. Absent expression of FLNA is correlated with poor prognosis of nasopharyngeal cancer. Tumour Biol. 2014;35:2967-2974. [PubMed] [DOI] |
| 5. | Nakamura F, Osborn TM, Hartemink CA, Hartwig JH, Stossel TP. Structural basis of filamin A functions. J Cell Biol. 2007;179:1011-1025. [PubMed] |
| 6. | Zhong Z, Yeow WS, Zou C, Wassell R, Wang C, Pestell RG, Quong JN, Quong AA. Cyclin D1/cyclin-dependent kinase 4 interacts with filamin A and affects the migration and invasion potential of breast cancer cells. Cancer Res. 2010;70:2105-2114. [PubMed] [DOI] |
| 7. | Xu Y, Bismar TA, Su J, Xu B, Kristiansen G, Varga Z, Teng L, Ingber DE, Mammoto A, Kumar R. Filamin A regulates focal adhesion disassembly and suppresses breast cancer cell migration and invasion. J Exp Med. 2010;207:2421-2437. [PubMed] [DOI] |
| 8. | Keshamouni VG, Michailidis G, Grasso CS, Anthwal S, Strahler JR, Walker A, Arenberg DA, Reddy RC, Akulapalli S, Thannickal VJ. Differential protein expression profiling by iTRAQ-2DLC-MS/MS of lung cancer cells undergoing epithelial-mesenchymal transition reveals a migratory/invasive phenotype. J Proteome Res. 2006;5:1143-1154. [PubMed] |
| 9. | Tian HM, Liu XH, Han W, Zhao LL, Yuan B, Yuan CJ. Differential expression of filamin A and its clinical significance in breast cancer. Oncol Lett. 2013;6:681-686. [PubMed] |
| 10. | Bedolla RG, Wang Y, Asuncion A, Chamie K, Siddiqui S, Mudryj MM, Prihoda TJ, Siddiqui J, Chinnaiyan AM, Mehra R. Nuclear versus cytoplasmic localization of filamin A in prostate cancer: immunohistochemical correlation with metastases. Clin Cancer Res. 2009;15:788-796. [PubMed] [DOI] |
| 12. | Merdad A, Karim S, Schulten HJ, Dallol A, Buhmeida A, Al-Thubaity F, Gari MA, Chaudhary AG, Abuzenadah AM, Al-Qahtani MH. Expression of matrix metalloproteinases (MMPs) in primary human breast cancer: MMP-9 as a potential biomarker for cancer invasion and metastasis. Anticancer Res. 2014;34:1355-1366. [PubMed] |
| 13. | Rossé C, Lodillinsky C, Fuhrmann L, Nourieh M, Monteiro P, Irondelle M, Lagoutte E, Vacher S, Waharte F, Paul-Gilloteaux P. Control of MT1-MMP transport by atypical PKC during breast-cancer progression. Proc Natl Acad Sci U S A. 2014;111:E1872-E1879. [PubMed] |
| 14. | Yu HB, Zhang HF, Li DY, Zhang X, Xue HZ, Zhao SH. Matrine inhibits matrix metalloproteinase-9 expression and invasion of human hepatocellular carcinoma cells. J Asian Nat Prod Res. 2011;13:242-250. [PubMed] [DOI] |
| 15. | Zhang M, Zhu GY, Gao HY, Zhao SP, Xue Y. Expression of tissue levels of matrix metalloproteinases and tissue inhibitors of metalloproteinases in gastric adenocarcinoma. J Surg Oncol. 2011;103:243-247. [PubMed] |
| 16. | Yang B, Vohra PK, Janardhanan R, Misra KD, Misra S. Expression of profibrotic genes in a murine remnant kidney model. J Vasc Interv Radiol. 2011;22:1765-72.e1. [PubMed] [DOI] |
| 17. | Sun GG, Lu YF, Zhang J, Hu WN. Filamin A regulates MMP-9 expression and suppresses prostate cancer cell migration and invasion. Tumour Biol. 2014;35:3819-3826. [PubMed] [DOI] |
| 18. | Zhu TN, He HJ, Kole S, D'Souza T, Agarwal R, Morin PJ, Bernier M. Filamin A-mediated down-regulation of the exchange factor Ras-GRF1 correlates with decreased matrix metalloproteinase-9 expression in human melanoma cells. J Biol Chem. 2007;282:14816-14826. [PubMed] |