修回日期: 2014-05-09
接受日期: 2014-05-14
在线出版日期: 2014-07-28
目的: 探讨半胱氨酰白三烯受体1(cysteinyl leukotrienes receptor, CysLTsR1)在肠缺血再灌注(intestinal ischemia-reperfusion, I/R)损伤中的可能作用.
方法: 以I/R大鼠肠I/R损伤模型为研究对象, 并运用不同剂量CysLTsR1拮抗剂孟鲁司特(0.2、2和20 mg/kg)加以干预, 通过免疫组织化学染色方法和RT-PCR法检测大鼠肠组织CysLTsR1蛋白和mRNA表达水平, 并应用光学显微镜观察小肠病理改变、检测小肠质量变化、确定CysLTsR1拮抗剂孟鲁司特对小肠的炎症程度的影响.
结果: 肠I/R可造成肠组织损伤, 小肠含水量增加(模型组78.13 g±1.35 g vs 正常组 78.13 g±1.35 g, P<0.05), 肠I/R时肠组织CysLTsR1蛋白和mRNA表达水平升高(P<0.05); 应用孟鲁司特后, 小肠含水量降低(低、中、高剂量组分别为76.47 g±1.48 g、72.67 g±5.35 g及75.39 g±3.66 g), 肠组织损伤减轻, 肠组织CysLTsR1蛋白表达和mRNA表达水平均减低(P<0.05).
结论: CysLTsR1参与了肠I/R损伤的形成, 孟鲁司特可以减轻肠I/R对肠组织的损伤, CysLTsR1是保护肠I/R损伤的新的作用靶点.
核心提示: 半胱氨酰白三烯受体1(cysteinyl leukotrienes receptor 1, CysLTsR1)参与了肠缺血再灌注(intestinal ischemia-reperfusion, I/R)损伤的形成, 孟鲁司特可以减轻I/R对肠组织的损伤, CysLTsR1是保护I/R损伤的新的作用靶点.
引文著录: 吴深宝, 朱旭星, 金忠海, 童秀萍, 洪小飞, 沈卫东. 半胱氨酰白三烯受体-1在大鼠肠缺血再灌注损伤中的作用. 世界华人消化杂志 2014; 22(21): 3089-3094
Revised: May 9, 2014
Accepted: May 14, 2014
Published online: July 28, 2014
AIM: To explore the role of cysteinyl leukotriene receptor 1 (CysLTsR1) in intestinal ischemia-reperfusion (I/R) injury.
METHODS: Forty rats were divided into 5 groups: a control group, a model group and low-, medium- and high-dose montelukast groups. After treatment, the water content of the small bowel was determined, and the histological changes in the intestinal tissues were assessed by HE staining. Immunohistochemical assessment of the expression of CysLTR1 and 5-lipoxygenase (5-LOX) was also performed.
RESULTS: Intestinal I/R, small bowel water content (model group 78.13 g ± 1.35 g vs normal group 78.13 g ± 1.35 g, P < 0.05), and CysLTR1 protein and mRNA expression significantly increased in the model group compared with the control group. Application of montelukast decreased intestinal water content (low-, medium-, and high-dose groups 76.47 g ± 1.48 g, 72.67 g ± 5.35 g and 75.39 g ± 3.66 g vs model group 78.13 g ± 1.35 g, P < 0.05), relieved the intestinal tissue injury, and reduced CysLTR1 protein and mRNA expression in intestinal tissues (P < 0.05).
CONCLUSION: CysLTR1 participates in the pathogenesis of intestinal ischemia-reperfusion injury, and may be a target for treatment of I/R injury.
- Citation: Wu SB, Zhu XX, Jin ZH, Tong XP, Hong XF, Shen WD. Role of cysteinyl leukotriene receptor 1 in intestinal ischemia-reperfusion injury. Shijie Huaren Xiaohua Zazhi 2014; 22(21): 3089-3094
- URL: https://www.wjgnet.com/1009-3079/full/v22/i21/3089.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i21.3089
肠道缺血再灌注(intestinal ischemia-reperfusion, I/R)是出血性休克、严重烧伤创伤、器官移植、肠系膜血管栓塞和外科急危重病等临床常见的病理生理过程, 是小肠移植的最大障碍, 同时肠缺血疾病又有较高的死亡率. 肠I/R的发生机制较为复杂, 中性粒细胞活化、细胞因子和氧自由基是参与发病的重要机制. 半胱氨酰白三烯(cysteinyl leukotrienes, CysLTs)是CysLTs是直接炎症效应物质, 通过半胱氨酰白三烯受体(CysLTsR)介导平滑肌痉挛、微血管渗漏等反应, 参与炎症、哮喘、脑肾I/R损伤、创伤、肿瘤和休克等多种炎症病理过程[1,2]. 目前关于CysLTs和肠I/R两者之间的研究很少. 本研究在肠I/R损伤前后检测CysLTsR1中的表达, 并应用其受体拮抗剂孟鲁斯特对肠I/R损伤的影响, 探讨CysLTsR1在肠I/R损伤中的作用及其拮抗剂对肠I/R损伤的保护作用.
40只♂Wistar大鼠, 体质量320 g±30 g. 购自中国人民解放军军事医学科学院实验动物中心, 合格证号: SCXK-(军)2007-004. 孟鲁司特(杭州默沙东制药有限公司, 生产批号: 110705); Rabbit polyclonal to CysLTsR1 Antibody购自Abam公司, SP免疫组织化学染色试剂盒(福州迈新生物技术开发有限公司); 高纯总RNA快速提取试剂盒购自Generay公司; 逆转录试剂盒Revert Aid First Strand cDNA synthesis Kit购自Fermentas公司; qPCR试剂IQ SYBR Green Supermix购自Bio-Rad公司.
1.2.1 分组与造模: 40只大鼠按体质量随机分为: 正常对照组(8只)、模型组(8只)、孟鲁司特干预组分3组, 每组各8只(0.2、2和20 mg/kg). 实验大鼠术前禁食12 h, 不禁水. 给药组术前1 h 灌胃给药, 正常对照组和模型组给予等体积生理盐水. 10%水合氯醛(3 mL/kg)腹腔注射麻醉, 仰卧位固定, 腹部皮肤备皮, 常规消毒、铺巾, 上腹部沿正中线切一长4-6 cm切口, 暴露肠系膜前动脉, 距其根部约0.5-0.8 cm, 游离约0.4-0.6 cm肠系膜前动脉, 对照组不夹闭血管, 手术组用小动脉夹夹闭, 并记时, 45 min后松开肠系膜前动脉夹. 在进行肠系膜前动脉夹闭期间, 间断地向腹腔内注射约15-20 mL/kg生理盐水, 以预防松开动脉夹后出现的一过性低血容量反应. 关腹后再向腹腔内追加25-30 mL/kg生理盐水(内含5万单位青霉素钠), 以达到既扩容又预防腹腔操作时污染的目的. 术毕放回鼠笼饲养观察. 一鼠一笼, 自由进食、饮水. 再灌注90 min后处死大鼠.
1.2.2 小肠含水量测定: 取距离盲肠10-20 cm处剪取末端回肠组织2 cm, 取部分小肠标本, 用电子天平称量小肠湿质量, 置90 ℃电热干燥箱内烘烤72 h, 称干质量, 小肠含水量 = (组织湿质量-组织干质量)/组织湿质量×100%.
1.2.3 HE染色: 按操作步骤常规进行脱蜡、脱苯、染色、脱水、透明、封片, 然后观察并拍照, 观察大鼠小肠病理损伤.
1.2.4 免疫组织化学检测I/R大鼠肠组织中CysLTsR1的表达: 操作步骤严格按照SP免疫组织化学染色试剂盒操作; 结果判定: 以细胞染色呈棕色为强阳性结果; 在100倍镜下, 随机选取8-10个视野, 使用Image-Pro-Plus软件进行平均光密度扫描, 然后取均数.
1.2.5 RT-qPCR法测定CysLTsR1 mRNA和5-脂氧合酶(5-lipoxygenase, 5-LOX) mRNA水平: TRIzol-离心柱法提取细胞总RNA. RNA纯度的测定和RNA的定量以相应溶剂为对照(blank), 取2 μL RNA溶液于Merinton SMA4000检测, 观察A260/280、A260/230比值及连续波长吸收峰, 并计算RNA溶液浓度, 判断RNA提取质量: A260/280>2.0且<2.3, 则可以满足后续RT-qPCR所需. 将反应液加入384孔板内, 封膜后, 将384孔板置入7900HT荧光定量PCR仪中, 按以下反应条件进行PCR扩增和荧光定量, 95 ℃ 1 min; 95 ℃ 15 s, 60 ℃ 60 s, 95 ℃ 15 s, 40个循环; 60 ℃ 15 s, 9 ℃ 15 s. 荧光定量数据分析采用参照基因的∆Ct法计算每个样本目的基因的表达值, 为对反应体系中的基因扩增进行均一化处理, 使用管家基因GAPDH作为内参照基因, 目的基因表达值 = 2Ct(GAPDH)-Ct(目的基因).
统计学处理 运用SPSS16.0进行统计分析, 计量资料以mean±SD表示, 组间比较采用单因素方差分析, 组内比较采用配对样本t检验, P<0.05具有统计学意义.
与正常对照组比, 模型对照组大鼠小肠含水量显著增加(P<0.05); 与模型对照组比, 孟鲁司特低、中、高剂量组小肠含水量均显著减少(P<0.05)(表1).
| 分组 | 小肠含水量 |
| 正常对照组 | 78.13±1.35 |
| 模型对照组 | 81.83±2.41a |
| 低剂量组(0.2 mg/kg) | 76.47±1.48c |
| 中剂量组(2 mg/kg) | 72.67±5.35c |
| 高剂量组(20 mg/kg) | 75.39±3.66c |
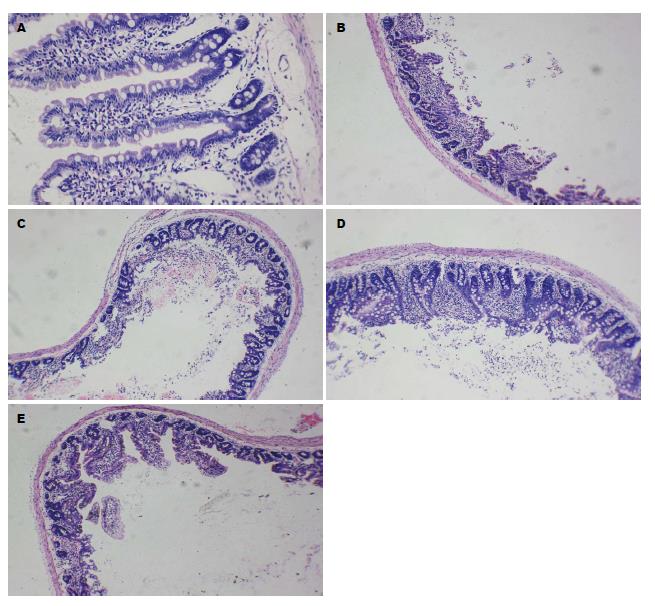
正常组: 显微镜下观察可见, 肠组织由4层结构组成, 黏膜与黏膜下层向管腔内突起, 形成许多皱襞, 黏膜下层无腺体, 绒毛发达, 排列紧密, 无充血、水肿或炎细胞浸润; 肌层由两层平滑肌组成, 浆膜外有脂肪组织, 无明显病变; 模型组: 由4层结构组成, 黏膜下层绒毛皱缩, 出血性坏死, 可见明显炎细胞浸润; 肌层厚度变薄, 有出血现象. 低剂量组: 与模型组相比, 绒毛皱缩程度有所减轻, 绒毛变宽, 可见明显炎细胞浸润; 肌层无明显病变. 中剂量组: 与模型组相比, 绒毛皱缩程度有所减轻, 出血性坏死, 可见明显炎细胞浸润; 肌层无明显病变. 高剂量组: 本变程度有所减轻, 绒毛皱缩程度减轻, 少量绒毛存在出血性坏死; 肌层无明显病变(图1).
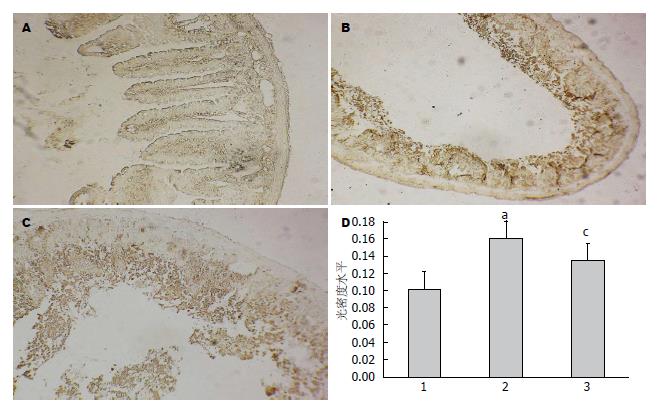
在100倍高倍镜下, 随机选取8-10个阳性表达视野, 使用Image-Pro-Plus软件进行平均光密度扫描显示: 模型组较正常组, CysLTsR1阳性表达显著提高(P<0.05); 中剂量孟鲁斯特治疗组 CysLTsR1阳性表达显著高于正常组, 低于模型组(P<0.05), 说明孟鲁斯特能改善肠I/R损伤现象(图2).
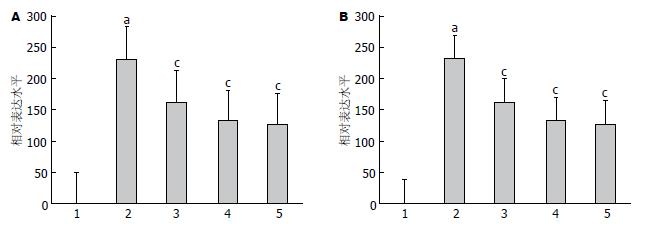
与对照组相比, 模型组CysLTsR1mRNA表达明显升高(P<0.05), 而5-LOX表达无明显升高; 孟鲁斯特各剂量组显著降低CysLTsR1mRNA的表达(P<0.05), 5-LOX mRNA的表达较模型组也明显上升(P<0.05)(图3).
肠I/R是临床常见的病理生理过程. 如何减轻肠I/R损伤是临床上的重点难点之一, 其中对I/R损伤机制的研究是如何治疗的前提. 目前认为氧自由基损伤, 钙离子超载, 微血管损伤和中性粒细胞、巨噬细胞等聚集、活化产生炎性介质和细胞因子等与肠I/R损伤机制有关[3-5].
CysLTs(包括LTC-4、LTD-4和LTE-4)作为5-LOX的代谢产物, 是众多炎症反应的最终直接效应物质, 通过激活CysLTR, 在肾、肝、膀胱I/R损伤中起着重要作用[6-11]. CysLTR属G蛋白偶联受体, 分为CysLTsR1、CysLTR2两型[12]. CysLTsR1在人体多种组织和细胞上表达, 在脾脏、小肠、大肠、心脏、胰腺、肾脏、肝脏和子宫均有表达, 通过原位免疫杂交和免疫组织化学证实在巨噬细胞、单核细胞、微血管内皮细胞上也有表达[13-15]. 我们通过免疫组织化学和RT-PCR检测, 发现在大鼠肠I/R模型中, CysLTsR1蛋白和mRNA水平表达均明显升高. 目前, CysLTs/CysLTsR途径与肠I/R损伤的关系知之甚少.
据报道CysLTs可提高血管渗透性、引起中性粒细胞浸润和引起炎症细胞因子释放CysLTs[16,17]. 研究认为I/R诱导的损伤是中性粒细胞依赖的, 由此推测pranlukast对I/R的保护作用至少部分是通过阻滞CysLTsR1减少炎症反应, 如减少中性粒细胞的浸润[18-20], 而应用CysLTsR1受体拮抗剂pranlukast可减轻吲哚美辛引起的肠黏膜损害程度, 并呈剂量依赖性[21-25].
我们通过大鼠肠I/R模型, 在I/R时小肠含水量增加明显, 而应用孟鲁司特后, 小肠含水量减少, 提示孟鲁司特可减少肠I/R引起的液体渗出; 应用显微镜观察肠I/R前后的形态学改变, 发现大鼠I/R时, 黏膜下层绒毛皱缩, 出血性坏死, 可见明显炎细胞浸润; 肌层厚度变薄, 有出血现象, 表明肠I/R可引起肠黏膜结构的破坏. 另外, 在I/R时小肠含水量增加明显, 而应用孟鲁司特后, 发现肠道病变程度有所减轻, 表现为绒毛皱缩程度有所减轻, 绒毛变宽, 可见明显炎细胞浸润; 肌层无明显病变. 形态学的改变表明孟鲁司特肠I/R的损伤有保护作用.
另外, 通过免疫组织化学光密度扫描显示, 动物模型组肠组织CysLTsR1表现强阳性, 肠组织病理损伤重, 应用孟鲁司特后的大鼠肠组织的CysLTsR1表现明显减弱, 而相应的病理损伤程度也轻, 表明CysLTsR1的表达强度与肠损伤程度密切相关. 荧光定量qPCR检测也表明, 动物模型组CysLTsR1 mRNA表达水平明显高于应用孟鲁司特组的CysLTsR1 mRNA表达水平, 也从基因水平上反映了CysLTsR1的表达强度与肠损伤密切相关, 而在应用了孟鲁司特后, 5-LOX mRNA有所上升, 可能机制为在抑制了CysLTsR1信号后, 5-LOX反馈性升高.
总之, CysLTsR1参与了肠I/R损伤的形成, 孟鲁司特可以减轻肠I/R对肠组织的损伤, CysLTsR1是保护肠I/R损伤的新的作用靶点[26,27].
肠缺血再灌注(intestinal ischemia-reperfusion, I/R)是出血性休克、严重烧伤创伤、器官移植、肠系膜血管栓塞和外科急危重病等临床常见的病理生理过程, 是小肠移植的最大障碍, I/R的发生机制较为复杂, 半胱氨酰白三烯受体1(cysteinyl leukotrienes receptor, CysLTsR1)参与脑肾缺血再灌注损伤; 目前关于CysLTs和肠缺血再灌注两者之间的研究很少.
门秀丽, 教授, 河北联合大学(原华北煤炭医学院)病理生理学教研室
半胱氨酰白三烯受体(CysLTsR)是否参与肠缺血再灌注损伤的病理过程, 研究其在肠I/R损伤中所起的作用.
肠I/R的发生机制较为复杂, 中性粒细胞活化、细胞因子和氧自由基是参与发病的重要机制. 半胱氨酰白三烯(cysteinyl leukotrienes, CysLTs是CysLTs是直接炎症效应物质, 通过半胱氨酰白三烯受体(CysLTsR)介导平滑肌痉挛、微血管渗漏等反应, 参与炎症、哮喘、脑肾缺血再灌注损伤、创伤、肿瘤和休克等多种炎症病理过程. 目前关于CysLTs和肠缺血再灌注两者之间的研究很少.
本研究在肠I/R前后检测CysLTsR1中的表达, 并应用其受体拮抗剂孟鲁斯特对肠I/R的影响, 探讨CysLTsR1在肠I/R中的作用及其拮抗剂对肠I/R的保护作用.
CysLTsR1参与了肠I/R损伤的形成, 孟鲁司特可以减轻肠I/R对肠组织的损伤, CysLTsR1是保护肠I/R损伤的新的作用靶点.
本文对临床防治肠I/R损伤具有一定的指导意义, 研究内容部分由创新性.
编辑 郭鹏 电编 鲁亚静
| 1. | Huang XJ, Zhang WP, Li CT, Shi WZ, Fang SH, Lu YB, Chen Z, Wei EQ. Activation of CysLT receptors induces astrocyte proliferation and death after oxygen-glucose deprivation. Glia. 2008;56:27-37. [PubMed] [DOI] |
| 2. | Pergel A, Kanter M, Yucel AF, Aydin I, Erboga M, Guzel A. Anti-inflammatory and antioxidant effects of infliximab in a rat model of intestinal ischemia/reperfusion injury. Toxicol Ind Health. 2012;28:923-932. [PubMed] [DOI] |
| 3. | Matsuo S, Yang WL, Aziz M, Jacob A, Wang P. Cyclic arginine-glycine-aspartate attenuates acute lung injury in mice after intestinal ischemia/reperfusion. Crit Care. 2013;17:R19. [PubMed] [DOI] |
| 4. | Hagar HH, Abd El Tawab R. Cysteinyl leukotriene receptor antagonism alleviates renal injury induced by ischemia-reperfusion in rats. J Surg Res. 2012;178:e25-e34. [PubMed] [DOI] |
| 5. | Eaton A, Nagy E, Pacault M, Fauconnier J, Bäck M. Cysteinyl leukotriene signaling through perinuclear CysLT(1) receptors on vascular smooth muscle cells transduces nuclear calcium signaling and alterations of gene expression. J Mol Med (Berl). 2012;90:1223-1231. [PubMed] [DOI] |
| 6. | Sala A, Folco G. Neutrophils, endothelial cells, and cysteinyl leukotrienes: a new approach to neutrophil-dependent inflammation? Biochem Biophys Res Commun. 2001;283:1003-1006. [PubMed] [DOI] |
| 7. | Pontell L, Sharma P, Rivera LR, Thacker M, Tan YH, Brock JA, Furness JB. Damaging effects of ischemia/reperfusion on intestinal muscle. Cell Tissue Res. 2011;343:411-419. [PubMed] [DOI] |
| 8. | Lau WK, Chow AW, Au SC, Ko WH. Differential inhibitory effects of CysLT(1) receptor antagonists on P2Y(6) receptor-mediated signaling and ion transport in human bronchial epithelia. PLoS One. 2011;6:e22363. [PubMed] [DOI] |
| 9. | Yan D, Stocco R, Sawyer N, Nesheim ME, Abramovitz M, Funk CD. Differential signaling of cysteinyl leukotrienes and a novel cysteinyl leukotriene receptor 2 (CysLT) agonist, N-methyl-leukotriene C, in calcium reporter and β arrestin assays. Mol Pharmacol. 2011;79:270-278. [PubMed] [DOI] |
| 10. | Isikdemir F, Kurcer Z, Dengiz GO, Sipahi EY, Banoglu ZN, Baba F, Acikgoz S, Kelek S. Effects of montelukast and zileuton on testicular torsion/detorsion injury in rats. Andrologia. 2012; Nov 9. [Epub ahead of print]. [PubMed] [DOI] |
| 11. | Corrigan C, Mallett K, Ying S, Roberts D, Parikh A, Scadding G, Lee T. Expression of the cysteinyl leukotriene receptors cysLT(1) and cysLT(2) in aspirin-sensitive and aspirin-tolerant chronic rhinosinusitis. J Allergy Clin Immunol. 2005;115:316-322. [PubMed] [DOI] |
| 12. | Dengiz GO, Odabasoglu F, Halici Z, Suleyman H, Cadirci E, Bayir Y. Gastroprotective and antioxidant effects of amiodarone on indomethacin-induced gastric ulcers in rats. Arch Pharm Res. 2007;30:1426-1434. [PubMed] [DOI] |
| 13. | Piper HM, Meuter K, Schäfer C. Cellular mechanisms of ischemia-reperfusion injury. Ann Thorac Surg. 2003;75:S644-S648. [PubMed] [DOI] |
| 14. | Ohshima N, Nagase H, Koshino T, Miyamasu M, Yamaguchi M, Hirai K, Yamamoto K, Fujisawa T, Nakagawa N, Kishikawa K. A functional study on CysLT(1) receptors in human eosinophils. Int Arch Allergy Immunol. 2002;129:67-75. [PubMed] [DOI] |
| 15. | Vollmar B, Menger MD. Intestinal ischemia/reperfusion: microcirculatory pathology and functional consequences. Langenbecks Arch Surg. 2011;396:13-29. [PubMed] [DOI] |
| 16. | Rossi A, Cuzzocrea S, Sautebin L. Involvement of leukotriene pathway in the pathogenesis of ischemia-reperfusion injury and septic and non-septic shock. Curr Vasc Pharmacol. 2009;7:185-197. [PubMed] [DOI] |
| 17. | Young CM, Kingma SD, Neu J. Ischemia-reperfusion and neonatal intestinal injury. J Pediatr. 2011;158:e25-e28. [PubMed] [DOI] |
| 18. | Thomaz Neto FJ, Koike MK, Abrahão Mde S, Carillo Neto F, Pereira RK, Machado JL, Montero EF. Ischemic preconditioning attenuates remote pulmonary inflammatory infiltration of diabetic rats with an intestinal and hepatic ischemia-reperfusion injury. Acta Cir Bras. 2013;28:174-178. [PubMed] [DOI] |
| 19. | Deng ZH, Yan GT, Wang LH, Zhang JY, Xue H, Zhang K. Leptin relieves intestinal ischemia/reperfusion injury by promoting ERK1/2 phosphorylation and the NO signaling pathway. J Trauma Acute Care Surg. 2012;72:143-149. [PubMed] [DOI] |
| 20. | Wang Y, Mitchell J, Sharma M, Gabriel A, Moriyama K, Palmer PP. Leukotrienes mediate 5-hydroxytryptamine-induced plasma extravasation in the rat knee joint via CysLT-type receptors. Inflamm Res. 2004;53:66-71. [PubMed] [DOI] |
| 21. | Zhang YJ, Zhang L, Wang SB, Shen HH, Wei EQ. Montelukast modulates lung CysLT(1) receptor expression and eosinophilic inflammation in asthmatic mice. Acta Pharmacol Sin. 2004;25:1341-1346. [PubMed] |
| 22. | Lenaerts K, Ceulemans LJ, Hundscheid IH, Grootjans J, Dejong CH, Olde Damink SW. New insights in intestinal ischemia-reperfusion injury: implications for intestinal transplantation. Curr Opin Organ Transplant. 2013;18:298-303. [PubMed] [DOI] |
| 23. | Okudan N, Belviranlı M, Gökbel H, Oz M, Kumak A. Protective effects of curcumin supplementation on intestinal ischemia reperfusion injury. Phytomedicine. 2013;20:844-848. [PubMed] [DOI] |
| 24. | Ozkan E, Yardimci S, Dulundu E, Topaloğlu U, Sehirli O, Ercan F, Velioğlu-Oğünç A, Sener G. Protective potential of montelukast against hepatic ischemia/reperfusion injury in rats. J Surg Res. 2010;159:588-594. [PubMed] [DOI] |
| 25. | Lafci G, Gedik HS, Korkmaz K, Erdem H, Cicek OF, Nacar OA, Yildirim L, Kaya E, Ankarali H. Efficacy of iloprost and montelukast combination on spinal cord ischemia/reperfusion injury in a rat model. J Cardiothorac Surg. 2013;8:64. [PubMed] [DOI] |
| 26. | Erşahin M, Çevik Ö, Akakın D, Şener A, Özbay L, Yegen BC, Şener G. Montelukast inhibits caspase-3 activity and ameliorates oxidative damage in the spinal cord and urinary bladder of rats with spinal cord injury. Prostaglandins Other Lipid Mediat. 2012;99:131-139. [PubMed] [DOI] |
| 27. | Genovese T, Rossi A, Mazzon E, Di Paola R, Muià C, Caminiti R, Bramanti P, Sautebin L, Cuzzocrea S. Effects of zileuton and montelukast in mouse experimental spinal cord injury. Br J Pharmacol. 2008;153:568-582. [PubMed] [DOI] |