修回日期: 2014-05-10
接受日期: 2014-05-19
在线出版日期: 2014-07-28
目的: 探讨细胞周期调控相关蛋白p53、p21、信号转导子和转录活化因子3(signal transducers and activators of transcription 3, STAT3)和细胞周期蛋白1(Cyclin D1)的表达在异常黑胆质型肝癌病证动物模型肝硬化期的发生发展中的作用.
方法: 根据维吾尔医学理论, 在异常黑胆质载体大鼠模型的基础上, 用二乙基亚硝胺(diethylnirtosamine)诱发建立维吾尔医异常黑胆质型肝癌病证模型肝脏标本用免疫组织化学法检测p53、p21、STAT3和Cyclin D1等基因的表达水平.
结果: p53、p21、STAT3和Cyclin D1等基因的表达水平与对照组相比, 对照肝癌组和异常黑胆质型肝癌病证组均上调, 差异具有统计学意义(P<0.01); 与对照肝癌组相比异常黑胆质型肝癌病证组上调, 差异具有统计学意义(P<0.05).
结论: 异常黑胆质体液可能通过上调p53、p21、STAT3和Cyclin D1等基因的表达水平影响细胞周期调控, 从而促进异常黑胆质型肝癌病证模型肝硬化的发生和发展.
核心提示: 维吾尔医学认为异常黑胆质证是肿瘤、高血压、哮喘、糖尿病等复杂性疾病发生发展过程中的共同病理生理学基础, 异常黑胆质型体液与肿瘤密切相关. 本文研究结果提示异常黑胆质体液可能通过上调p53、p21、信号转导子和转录活化因子3(signal transducers and activators of transcription 3)和细胞周期蛋白1等基因的表达水平影响细胞周期调控, 从而促进异常黑胆质型肝癌病证模型肝硬化的发生和发展.
引文著录: 热斯拉特•艾力木, 热沙来提•阿不都瓦衣特, 哈木拉提•吾甫尔, 王延蛟, 阿尤甫江•阿布都热依木, 依马木•麦麦提依明, 斯坎德尔•白克力. 异常黑胆质型肝癌病证动物模型肝硬化期肝脏中p53、p21、STAT3和Cyclin D1基因的表达. 世界华人消化杂志 2014; 22(21): 3083-3087
Revised: May 10, 2014
Accepted: May 19, 2014
Published online: July 28, 2014
AIM: To investigate the expression of cell-cycle related proteins p53, p21, STAT3 and Cyclin D1 in the cirrhosis phase of hepatocarcinoma in a rat model carrying abnormal savda.
METHODS: According to the theory of Uyghur medicine, a rat model of abnormal savda was created, and on this basis, DEN was used to induce cirrhosis to result in a rat model of hepatocarcinoma carrying abnormal savda. Liver specimens were taken to detect the expression of p53, p21, STAT3 and Cyclin D1 by immunohistochemistry.
RESULTS: Compared with normal control rats, the expression levels of p53, p21, STAT3 and Cyclin D1 were significantly up-regulated in rats with simple hepatocellular carcinoma and those with hepatocarcinoma carrying abnormal savda (P < 0.01). Compared with rats with simple hepatocellular carcinoma, the expression levels of p53, p21, STAT3 and Cyclin D1 were significantly higher in rats with hepatocarcinoma carrying abnormal savda (P < 0.05)
CONCLUSION: Abnormal savda may up-regulate the expression of p53, p21, STAT3 and Cyclin D1 and affect cell cycle progression, thus accelerates the occurrent and development of hepatocirrhosis.
- Citation: Helim•Resalat, Abduwayit•Resalat, Upur•Halmurat, Wang YJ, Abdurhem•Ayupjan, Mamtimin•Imam, Bakri•Iskandar. Expression of p53, p21, STAT3 and Cyclin D1 in cirrhosis phase of hepatocarcinoma in a rat model carrying abnormal savda. Shijie Huaren Xiaohua Zazhi 2014; 22(21): 3083-3087
- URL: https://www.wjgnet.com/1009-3079/full/v22/i21/3083.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i21.3083
原发性肝癌是全球癌症相关性死亡的主要原因之一, 占恶性肿瘤死亡原因的第4位, 占男性恶性肿瘤死亡原因的第3位[1], 严重威胁着人类健康. 其发病过程较为复杂, 其详细的机制尚待研究. 维吾尔医学认为异常黑胆质证是肿瘤、高血压、哮喘、糖尿病等复杂性疾病发生发展过程中的共同病理生理学基础[2]. 维吾尔医学临床研究发现异常黑胆质型肿瘤在恶性肿瘤中占72%[3], 可见异常黑胆质型体液与肿瘤密切相关. 在动物模型形态学等前期研究中发现, 异常黑胆质证在二乙基亚硝胺(diethylnirtosamine, DEN)诱导的异常黑胆质型肝癌病证模型中促进和加快肝硬化的发生发展过程[4], 但其作用机制尚不清楚. 本研究通过检测细胞周期调控相关基因p53、p21、信号转导子和转录活化因子3(signal transducers and activators of transcription 3, STAT3)和细胞周期蛋白1(Cyclin D1)等基因在模型动物肝脏组织中的表达水平, 探讨上述基因在异常黑胆质型肝癌病证模型肝硬化期发生发展中的作用.
清洁级♂Wistar大鼠36只, 体质量150 g±30 g, 由新疆医科大学实验动物中心提供. 在普通鼠饲料中按每kg 7:3的比例加入芫荽子和大麦(两者等比例混合), 制成颗粒状干饲料, 委托新疆维吾尔族自治区医学试验动物中心加工. RQH-350型人工气候箱, JXDT-1型小鼠跳台仪器(上海精宏实验设备有限公司), BS-110型电子天平(北京赛多科斯天平有限公司). 鼠抗p53、p21单克隆抗体购自博士德生物有限公司; STAT3、Cyclin D1单克隆抗体购自美国Cell Signaling公司购买; SP9000通用二抗试剂盒和DAB显色剂均购自北京中杉生物有限公司.
1.2.1 动物分组及喂养: 选取♂Wistar大鼠36只, 体质量150 g±30 g, 稳定饲养3 d后, 分成以下处理: (1)实验组(异常黑胆质型肝癌组12只): 按照文献[5-7]建立维吾尔医学异常黑胆质证载体大鼠模型. 均给予用灭菌食用水配制浓度0.1 mg/mL的DEN溶液以诱发肝癌, 自由饮用, 每天更换1次, 连续饮用15 wk停药. 采用异常黑胆质证造模复合因素第2周强度维持异常黑胆质证; (2)对照组(24只): 正常对照组(12只), 整个实验过程中均饮用灭菌食用水; 对照肝癌组(模型对照肝癌组12只), 用灭菌食用水配制浓度0.1 mg/mL的DEN溶液, 自由饮用, 每天更换1次, 连续饮用15 wk停药. 对照组在室温下25 ℃±3 ℃, 相对湿度60%-80%, 用普通鼠饲料饲养, 未受任何刺激. 实验组和对照组15 wk时处死所有动物, 并立即取出肝脏组织切片成小片部分用40 g/L甲醛固定, 部分在-80 ℃保存备用.
1.2.2 免疫组织化学: 免疫组织化学法来检测p53、p21、STAT3和Cyclin D1基因的表达水平: 组织通过包埋, 切成免疫组织化学石蜡切片. 石蜡切片经过脱蜡脱水, 柠檬酸组织抗体修复, 内源性过氧化物酶的消除, 一抗孵育(p53 1:150, p21 1:200; STAT3 1:150; Cyclin D1 1:50比例稀释), 二抗孵育, 辣根酶标记的链霉卵白素工作液, DAB显色, 苏木素复染, 脱水, 透明, 封片, 光镜观察. 每组试验均以PBS代替一抗作为阴性对照. 在高倍镜下选择10个有代表性高倍镜视野拍照, 并采用image-pro-plus软件检测光密度和(IA SUM) 值.
统计学处理 用SPSS17.0数据分析软件行单因素方差分析(独立样本t检验)数据mean±SD表示, P<0.05为差异具有统计学意义.
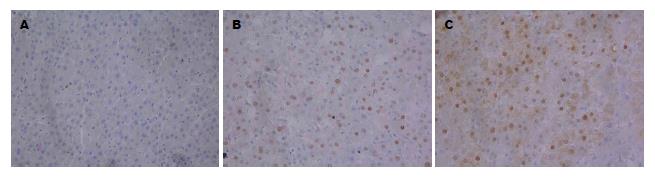
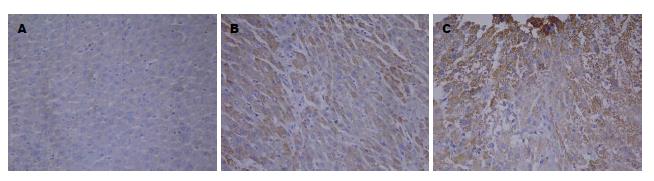
正常对照组p53蛋白表达均为阴性. 对照肝癌组和异常黑胆质型肝癌组p53蛋白阳性表达定位在细胞核, 阳性表达细胞颜色为棕黄色颗粒状, 细胞染色强度明显高于背景(图1).
正常对照组p21蛋白表达均为阴性. 对照肝癌组和异常黑胆质型肝癌组p21蛋白阳性表达定位在细胞核, 阳性表达细胞颜色为棕黄色颗粒状, 细胞染色强度明显高于背景(图2).
正常对照组STAT3表达均为阴性. 对照肝癌组和异常黑胆质型肝癌组STAT3阳性表达定位在细胞质, 阳性表达细胞颜色为棕黄色颗粒状, 细胞染色强度明显高于背景(图3).
正常对照组Cyclin D1表达均为阴性. 对照肝癌组和异常黑胆质型肝癌组Cylin D1阳性表达定位在细胞核, 阳性表达细胞颜色为棕黄色颗粒状, 细胞染色强度明显高于背景(图4).
维吾尔医学理论核心的体液论认为, 异常黑胆质作为胆液质、黏液质、血液质及黑胆质等各种体液"燃烧"的最终产物和表现形式, 其分量重、质地稠, 在组织中容易形成沉淀和刺激, 引起肿瘤等复杂性疾病[8]. 异常黑胆质即是致病因素, 又是病理产物, 反映疾病发生和发展过程中的病理生理状态[2]. DEN诱发大鼠肝癌模型是实验性肝癌研究应用最为广泛的动物模型之一. 80%以上的肝癌发生在肝硬化的基础上. 前期研究中建立维吾尔医异常黑胆质型肝癌病证模型至大鼠发生肝硬化, 在动态观察动物模型肝脏组织的病理结果中发现[9]肝细胞通过损伤、增生、纤维化、假小叶形成、最终发生肝硬化,但与模型对照肝癌组相比, 异常黑胆质型肝癌病症模型组肝硬化程度严重、速度快; 也检测了动物模型血清免疫和内分泌相关指标, 结果发现[10]相关血清指标在异常黑胆质型肝癌病症模型组与模型对照肝癌组差异有统计学意义, 提示异常黑胆质体液促进在异常黑胆质型肝癌病症模型中肝硬化的发生过程, 但其作用机制尚不清楚.
肝癌是多基因参与的, 多阶段的复杂过程, 与多种癌基因的激活和抑癌基因的失活, 表达水平的改变等变化有关, 尤其是细胞周期调控相关基因表达水平的改变起重要作用. 本研究在异常黑胆质载体大鼠模型的基础上, 用DEN诱发建立维吾尔医异常黑胆质型肝癌病证模型大鼠发生肝硬化, 各组肝脏标本用免疫组织化学法检测细胞周期调控相关的p53、p21、STAT3和Cyclin D1等基因的表达水平. 上述基因在对照肝癌组, 尤其是异常黑胆质型肝癌组肝硬化期的表达水平均升高, 与对照组相比具有显著性差异(P<0.01); 与对照肝癌组相比异常黑胆质型肝癌病证组也具有统计学意义(P<0.05). 我们认为异常黑胆质体液可能通过p53、p21、STAT3和Cyclin D1等细胞周期调控相关基因的表达水平的升高而促进异常黑胆质型肝癌病证模型肝硬化的发生和发展.
p53基因与人类肿瘤相关性最高的抑癌基因. 野生型p53(wt-p53)具有抑癌的功能, 他通过调节转录因子以抑制细胞从G1期转化为S期而阻止了肿瘤的发生, 当其发生突变后, 即变成突变型(mt-p53)p53基因, 后者会刺激和促进癌细胞的生长[11], 由抑癌基因转变为癌基因. 廖湘晖等[12]用免疫组织化学方法检测p53在肝癌组织中的表达, 发现从正常组, 肝硬化组到肝癌组逐渐增高的趋势. p21是一种重要的抑癌基因[13], 通过抑制Cyclin依赖蛋白激酶(cyclin-dependent kinases, CDK)来控制细胞从G期进入S期, 抑制DNA的合成, 使细胞停止分化. 当p21表达异常时, 细胞分化增殖调控异常, 从而可导致癌症的发生. p21蛋白在正常组织中未激活, 因而表达量少, 而在肿瘤及癌旁组织中表达率高. 曹岩等[14]转染外源p21基因联合化疗药物可使肝癌细胞株SMMC-7721细胞周期阻滞于G1期, 并可抑制肿瘤细胞的增殖. STAT3是重要的癌基因之一[15], 在许多恶性肿瘤中STAT3的异常表达与肿瘤的发生、发展及转移有关. STAT3在许多肿瘤中处于持续性激活状态, 表达水平明显增强, 具有促进肿瘤细胞增殖, 抑制肿瘤细胞凋亡, 促进侵袭转移及免疫逃逸等重要作用[16,17]. 苟泽鹏等[18]发现STAT3在肝癌中的过表达是肝癌患者生存的危险因素, 随着STAT3表达的升高, 患者生存时间明显下降. Cyclin D1是STAT3的一个下游靶基因, 其作为细胞周期核因子, 通过限制细胞生长的G1/S检控点促进肿瘤发生. 肝细胞癌变过程中Cyclin D1的表达至肝癌早期达到高峰, 然后逐渐下降, 即至肝癌晚期发生Cyclin D1的下调[19,20], 提示Cyclin D1过表达是肝癌发生的早期事件.
有研究显示G1/S期相关的调控通路发生异常时, 对肿瘤的发生和发展具有重要作用[21]. 在细胞周期调控过程中, p53蛋白发挥作用的重要效应是上调下游基因p21的表达[22]. 在p21基因编码区上游2.4 kb和大约8 kb处有2个p53的结合区, 其中激活的p53基因在p21基因上游2.4 kb处表达, 主要发挥抑制p21、Cyclin、CDK, 增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)四聚体的功能. 此四聚体是使增殖信号大量活化, 导致细胞异化和恶变的主要环节. p21表达产物p21WAFI蛋白作为一种CDK抑制剂, 结合位于G1期和S期的Cyclin-CDK复合体, 能够阻滞细胞周期于G1期, 抑制细胞增殖[23-26]. 目前研究表明, p53与STAT3在有些细胞中具有相互调节的作用: 一方面STAT3与p53启动子结合抑制p53基因转录, 抑制p53基因介导的肿瘤细胞凋亡作用; 另一方面p53可以明显的减少STAT3的磷酸化及其与DNA结合的活性, 抑制STAT3依赖的基因转录的活性[27,28].
总之, 在前期工作中发现异常黑胆质型肝癌病症模型组肝硬化程度比对照肝癌组严重. 本研究中, 细胞周期调控相关基因p53、p21、STAT3和Cyclin D1在异常黑胆质型肝癌病症模型组肝脏中的表达水平上调, 并与对照肝癌组相比, 差异有统计学意义, 提示p53、p21、STAT3和Cyclin D1基因可能通过影响细胞周期的调控, 在异常黑胆质型肝癌病症模型中促进肝硬化的发生和发展.
细胞周期调控相关基因表达水平的研究在肝硬化和肝癌发生中具有重要意义, 但在异常黑胆质型肝癌病证研究中尚未见报道.
高英堂, 研究员, 天津市第三中心医院
前期研究中发现, 异常黑胆质证在二乙基亚硝胺(diethylnirtosamine, DEN)诱导的异常黑胆质型肝癌病证模型中促进和加快肝硬化的发生发展过程, 但其作用机制尚不清楚.
国内外有关于细胞周期调控相关基因p53、p21、转录活化因子3(signal transducers and activators of transcription 3, STAT3)和细胞周期蛋白1(Cyclin D1)在肝硬化和肝癌发生, 发展的相关报道. DEN是建立诱发性肝癌动物模型中广泛被应用的致癌物. 异常黑胆质证是肿瘤、高血压、哮喘、糖尿病等复杂性疾病发生发展过程中的共同病理生理学基础. 维吾尔医学临床研究发现异常黑胆质型肿瘤在恶性肿瘤中占72%.
本文以维吾尔医学异常黑胆质型肝癌病证模型肝硬化期大鼠肝脏标本为研究对象, 应用免疫组织化学方法检测p53、p21、STAT3和Cyclin D1等细胞周期调控相关基因的表达水平, 探讨异常黑胆质体液在异常黑胆质型肝癌病证模型肝硬化的发生和发展中的作用.
本研究结果显示异常黑胆质体液可能通过上调p53、p21、STAT3和Cyclin D1基因的表达水平影响细胞周期调控, 从而促进异常黑胆质型肝癌病证模型肝硬化的发生和发展. 为异常黑胆质型肝癌的发病机制和维吾尔医药异常黑胆质成熟剂抗肝癌作用的进一步研究提供实验依据.
本文具有一定的科学价值, 有一定指导意义.
编辑 田滢 电编 都珍珍
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 3. | 张莉, 哈木拉提•吾甫尔, 玛依努尔•艾力, 阿依努尔•买提斯迪克, 张建清. 恶性肿瘤的维医分型及其神经内分泌免疫网络紊乱研究. 中国中医基础医学杂志. 2008;14:119-121. |
| 4. | 玉苏甫•吐尔逊, 斯坎德尔•白克力, 哈木拉提•吾甫尔, 阿不都卡德尔•库尔班, 阿布力孜•阿卜杜扎依尔, 阿地里江•阿布力米提. 异常黑胆质性肝癌病证模型肝硬化期的肝脏形态学研究. 科技导报. 2010;28:82-88. |
| 6. | Palermo-Neto J, de Oliveira Massoco C, Robespierre de Souza W. Effects of physical and psychological stressors on behavior, macrophage activity, and Ehrlich tumor growth. Brain Behav Immun. 2003;17:43-54. [PubMed] |
| 7. | Beaufour CC, Ballon N, Le Bihan C, Hamon M, Thiébot MH. Effects of chronic antidepressants in an operant conflict procedure of anxiety in the rat. Pharmacol Biochem Behav. 1999;62:591-599. [PubMed] |
| 8. | 努尔买买提•艾买提, 哈木拉提•吾甫尔, 阿迪力, 阿依努尔•买提斯迪克. 异常黑胆质载体动物模型免疫学本质的研究. 中国中医基础医学杂志. 2006;12:903-907. |
| 9. | 阿布力孜•阿卜杜扎依, 哈木拉提•吾甫尔, 玉苏甫•吐尔逊, 阿不都卡德尔•库尔班, 斯坎德尔•白克力. 异常黑胆质成熟剂对异常黑胆质性癌病证模型肝硬化期的肝脏形态学的影响. 科技导报. 2011;29:68-73. |
| 10. | 张有辉, 玉苏甫•吐尔逊, 哈木拉提•吾甫尔, 阿不都卡德尔•库尔班, 阿布力孜•阿卜杜扎依尔, 斯坎德尔•白克力. 异常黑胆质性肝癌病证模型肝硬化期免疫、内分泌紊乱状态. 科技导报. 2010;28:39-42. |
| 13. | 胡 嘏, 陈 忠, 吴 嘉, 张 勇, 徐 华, 杨 为民, 叶 章群. 小分子双链RNA对人类细胞中抑癌基因p21表达的上调作用. 华中科技大学学报(医学版). 2012;41:660-664. |
| 15. | Zhang X, Yue P, Fletcher S, Zhao W, Gunning PT, Turkson J. A novel small-molecule disrupts Stat3 SH2 domain-phosphotyrosine interactions and Stat3-dependent tumor processes. Biochem Pharmacol. 2010;79:1398-1409. [PubMed] [DOI] |
| 17. | 王 晓玲. D类细胞周期素在细胞周期中的作用. 国外医学分子生物学分册. 2002;24:44-46. |
| 19. | 卫 莹, 周 颖, 李 敏, 彭 程, 冯 定庆, 吴 大宝, 肖 卫华, 凌 斌. 信号转导和转录激活因子3在子宫颈脱落细胞的表达及临床意义. 现代妇产科进展. 2009;18:504-506. |
| 20. | Groner B, Lucks P, Borghouts C. The function of Stat3 in tumor cells and their microenvironment. Semin Cell Dev Biol. 2008;19:341-350. [PubMed] [DOI] |
| 22. | Abbas T, Dutta A. p21 in cancer: intricate networks and multiple activities. Nat Rev Cancer. 2009;9:400-414. [PubMed] [DOI] |
| 23. | Gartel AL. p21(WAF1/CIP1) and cancer: a shifting paradigm? Biofactors. 2009;35:161-164. [PubMed] [DOI] |
| 24. | Fotedar R, Bendjennat M, Fotedar A. Functional analysis of CDK inhibitor p21WAF1. Methods Mol Biol. 2004;281:55-71. [PubMed] |
| 25. | Helt CE, Staversky RJ, Lee YJ, Bambara RA, Keng PC, O'Reilly MA. The Cdk and PCNA domains on p21Cip1 both function to inhibit G1/S progression during hyperoxia. Am J Physiol Lung Cell Mol Physiol. 2004;286:L506-L513. [PubMed] [DOI] |
| 26. | Hohla F, Buchholz S, Schally AV, Seitz S, Rick FG, Szalontay L, Varga JL, Zarandi M, Halmos G, Vidaurre I. GHRH antagonist causes DNA damage leading to p21 mediated cell cycle arrest and apoptosis in human colon cancer cells. Cell Cycle. 2009;8:3149-3156. [PubMed] [DOI] |
| 27. | Niu G, Wright KL, Ma Y, Wright GM, Huang M, Irby R, Briggs J, Karras J, Cress WD, Pardoll D. Role of Stat3 in regulating p53 expression and function. Mol Cell Biol. 2005;25:7432-7440. [PubMed] [DOI] |