修回日期: 2014-05-26
接受日期: 2014-06-11
在线出版日期: 2014-07-28
目的: 通过观察清醒状态热射病(conscious heat stroke, CHS)大鼠胃肠黏膜腺体形态学改变, 探讨其胃肠动力与血浆胃泌素(gastrin, GAS)、胃动素(motilin, MTL)含量的变化.
方法: 首先使用人工实验环境模拟舱模拟清醒状态热射病大鼠模型, 光镜下观察胃肠黏膜腺体的形态学改变; 胃肠内标志物法测定大鼠胃排空率(gastric emptying rates, GERS)、小肠推进率(small intestinal propulsion rates, SIPRS), 使用ELISA法检测清醒状态热射病(conscious heat stroke, CHS)大鼠血液和胃肠组织中GAS、MTL含量; 应用免疫组织化学技术观察胃肠黏膜腺细胞GAS、MTL的表达情况.
结果: (1)与正常对照组相比, 模型组GERS、SIPRS明显降低(P<0.05), 大鼠血清GAS、MTL显著升高(P<0.05), 16 h时达峰值后迅速下降; 而胃组织GAS峰值前移至8 h, 十二指肠组织MTL随致热时间延长明显降低(P<0.05); (2)形态学方面: 与正常大鼠相比, 模型组大鼠随致热时间延长, 大鼠胃肠黏膜腺体结构紊, 腺上皮排列不规整、浊肿、脱落、腺腔狭小或缺失, 腺体结构消失, 腺体胞浆内褐色颗粒表达物由深染、大小不一、分布不均匀转化为量少、淡染.
结论: 血中MTL、GAS含量变化测定既可作为判断CHS大鼠胃肠动力障碍的指标, 亦可作为判断大鼠热射病发生、发展的指标.
核心提示: 血中胃泌素(gastrin)、胃动素(motilin)含量变化测定既可作为判断清醒状态热射病(conscious heat stroke)大鼠胃肠动力障碍的指标, 亦可作为判断大鼠热射病发生、发展的指标.
引文著录: 周秋娟, 聂占国, 代忠明, 张新, 董翔. 清醒状态下热射病大鼠胃肠动力与胃泌素、胃动素的变化. 世界华人消化杂志 2014; 22(21): 3003-3010
Revised: May 26, 2014
Accepted: June 11, 2014
Published online: July 28, 2014
AIM: To establish a conscious heat stroke (HS) rat model to investigate heat stroke-induced gastrointestinal motility and changes of serum motilin (MTL) and gastrin (GAS).
METHODS: A conscious HS rat model was established using artificial experimental environment simulation cabin (AEESC). The changes of gastric mucosal gland morphology was observed by light microscopy. The blue Sephadex-2000 marker was used to determine the rates of gastric emptying (GAS) and small intestinal transit (SIT). Serum and gastrointestinal contents of MTL and GAS were detected by ELISA, and expression of GAS and MT in the gastrointestinal mucosa gland was observed by the immunohistochemical technique.
RESULTS: Compared with normal controls, the rates of GE and SIP were significantly lower in HS rats, while serum GAS and MTL levels were significantly higher (P < 0.05). Serum GAS and MTL peaked at 16 h and then rapidly decreased, while gastric GAS peaked at 8 h. The longer the thermal stimulation time, the lower the concentration of MTL in the duodenum (P < 0.05). With the increase of thermal stimulation time, the rats showed gastric mucosal gland structure disturbance, glandular epithelial disarrangement, cloudy swelling, and glandular cavity narrowing or missing. Finally, glandular epithelial degeneration and gland structure destruction were observed, and the size, color and distribution of granules in the cytoplasm of gland cells were significantly changed.
CONCLUSION: The changes of serum MTL and GAS may be indicators to judge abnormal gastrointestinal motility in conscious heat stroke rats.
- Citation: Zhou QJ, Nie ZG, Dai ZM, Zhang X, Dong X. Gastrointestinal motility and changes of serum motilin and gastrin in conscious heat stroke rats. Shijie Huaren Xiaohua Zazhi 2014; 22(21): 3003-3010
- URL: https://www.wjgnet.com/1009-3079/full/v22/i21/3003.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i21.3003
热射病(heat stroke, HS)是最严重的中暑类型, 具有发病急、病死率高等特点, 近年来临床报道, 虽经迅速降温、液体支持等治疗, 但仍有约30%的患者出现永久性神经系统损伤后遗症及外周组织损伤表现[1,2], 其发病机制可能与热细胞毒性、凝血紊乱和继发于胃肠道的全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)及其介导多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)复杂相互作用有关[3,4], 胃肠道作为体内最大的"贮菌所"和"内毒素库", 被认为是促发SIRS和MODS的始动器官与重要靶位之一[5,6]. 胃泌素(gastrin, GAS)、胃动素(motilin, MTL)是同时存在于中枢神经系统和消化系统的一种活性肽类激素又称为"脑肠肽", 是调控胃肠运动的重要因素, 关于清醒状态热射病(conscious heat stroke, CHS)大鼠胃肠动力及胃肠激素的研究目前国内报道甚少. 结合新疆地区干、热气候特点, 本实验将模拟极热干燥CHS大鼠模型, 并通过观察该模型大鼠胃肠黏膜腺体形态学改变, 探讨CHS大鼠胃肠动力与血浆GAS、MTL含量的变化关系.
人工实验环境模拟舱(中航工业贵州风雷公司); 721分光光度计(上海菁华科技仪器有限公司); RT-6000全自动酶标仪(美国雷杜公司生产); Powlab/8sp生理记录仪(Ad instruments公司, 澳大利亚); 大鼠直肠温度传感器(RET-2, 北京渠道科学器材有限公司); MTL、GAS一抗(Uscn Life Science Inc提供); 葡聚糖蓝-2000(瑞典-Pharmacia公司).
1.2.1 实验动物分组及模型制备: ♂SD大鼠60只[由新疆维吾尔族自治区实验动物研究中心提供, 许可证号: SCXY(新)2011-0001], 体质量280 g±10.6 g, 适应性饲养7 d, 随机分为正常对照组10只(0 h组)和模型组50只. 两组动物均于实验前禁食不禁水24 h, 实验期间两组大鼠均自由饮水. 依据前期多次预实验观察大鼠致热24 h时肛温、死亡数变化, 选取变化显著的8、16、24 h作为观察点, 运用随机数字表法将模型组分为8 h组10只、16 h组15只、24 h组25只3个亚组, 出舱模型组样本量以最终存活数为准, 为排除麻醉下有创血压检测对胃肠动力的影响, 每个观察点样本平均分为两部分, 一部分用于胃肠动力检测, 另一部分用于血压测量、血样采集及取胃肠组织.
1.2.2 实验环境: SPF实验室环境平均温度21 ℃±1.50 ℃, 平均相对湿度54.6%±1.4%, 适应性饲养室温27 ℃±2.3 ℃, 平均相对湿度50.6%±1.4%, 模型组模拟新疆塔克拉玛干沙漠7月下旬至8月初空气温度[7], 舱内空气温度41.2 ℃±0.5 ℃, 平均相对湿度22.3%±1.30%.
1.2.3 指标检测: (1)生命体征检测: 使用温度计测大鼠核心体温(core temperature, Tr)、手工记录大鼠呼吸频率(respiratory rate, RR); 3%戊巴比妥钠30 mg/kg腹腔麻醉后, 左股动脉穿刺连接生理记录仪测量大鼠平均动脉压(mean arterial pressure, MAP)和心率(heart rate, HR); (2)大鼠血液MTL、GAS含量测定: 股动脉采血3-5 mL/只, 置于已加入30 μL抑肽酶EDTA二钠采血管中混匀, 4 ℃离心取血浆, -70 ℃冰箱保存待检; (3)大鼠胃排空率(gastric emptying rates, GERS), 小肠推进率(small intestinal propulsion rates, SIPRS)测定: 大鼠出舱前30 min给予2%葡聚蓝-2000, 0.4 mL/只灌胃, 出舱后立刻脱颈处死、剖腹, 参照张猛等[8]与李选举等[9]测量计算方法, 检测大鼠GERS、SIPRS.
1.2.4 胃肠组织免疫组织化学、病理切片及匀浆液制备: 大鼠采血后, 剖腹取大鼠胃窦、十二指肠组织各2份, 生理盐水洗涤干净, 一部分用于制备HE染色及免疫组织化学染色切片; 另一部分参照潘巧玲等[10]方法制备胃肠组织匀浆液.
1.2.5 胃肠组织中GAS、MTL平均光密度(mean optical density, MOD)测定: 采用双盲法观察结果, 每个观察点组选取大鼠样本5只, 每例胃肠组织标本在高倍镜下选取5个视野(×400), 运用Image-Pro Plus6.0图像处理软件分析GAS、MTL的MOD, 校正光密度(incident level): 240.
统计学处理 运用SPSS17.0软件进行处理,计量数据用mean±SD表示, 多组资料组间比较釆用单因素方差分析检验(One-way ANOVA), P<0.05为差异具有统计学意义.
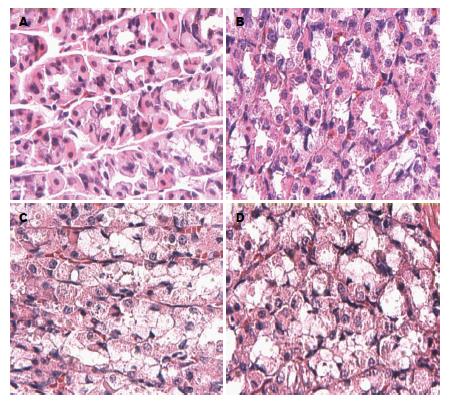
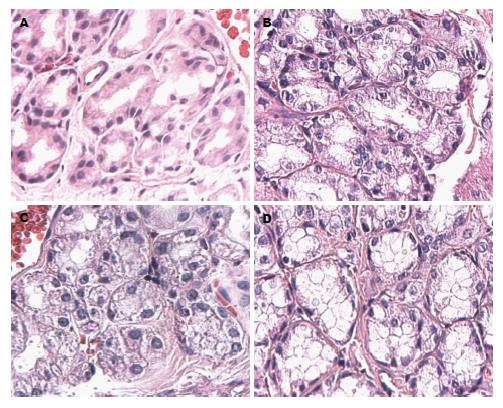
光镜下, 0 h组胃肠黏膜腺体结构正常, 排列规则, 腺腔明显, 腺上皮结构完整(图1A, 图2A), 模型组大鼠胃肠黏膜腺体结构紊乱, 腺上皮排列不规正, 轻度水肿, 腺腔狭小(图1B), 部分腺上皮轻度浊肿, 腺腔消失(图1C), 可见少量杯状细胞(图2B), 24 h时腺体结构消失, 腺上皮高度浊肿、变性、脱落(图1D), 肠黏膜深层腺体上皮明显水肿、胞核变性、脱落、管腔消失(图2D).
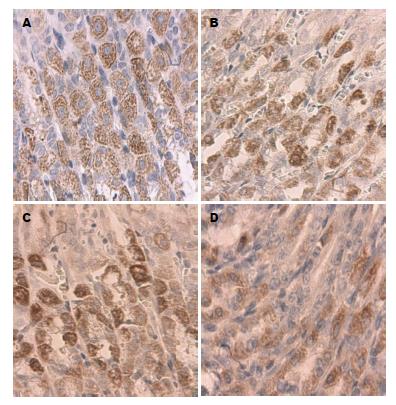
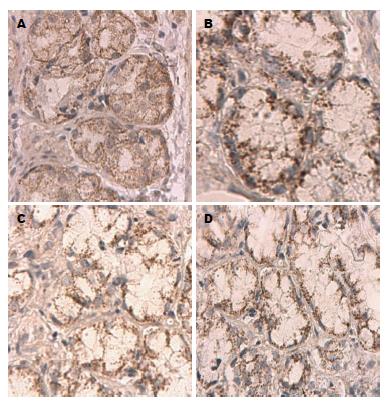
0 h组胞浆内分布大小、染色均一的细颗粒状表达物, 胞核未见表达(图3A, 图4A), 胃肠黏膜腺体8 h组、胃腺体16 h组胞浆内表达物颗粒大、着色深, 少量胞核表达(图3B, C, 图4B), 24 h时胞浆内细颗粒状表达物量少而着色浅(图3D, 图4D); 运用图像处理软件分析GAS、MTL的MOD发现, 与0 h组相比, 胃组织GAS升高, 峰值移至8 h(P<0.05), 8-16 h呈现缓慢下降期, 16 h后快速下降, 肠组织MTL明显降低(P<0.05)(表1).
与0 h组相比, 模型组大鼠HR、RR明显升高(P<0.05)直至达最大值, Tr在0-8 h内迅速升高(P<0.05), 8-16 h内表现为类似平台缓解期, 此后快速升高, 24 h时达最大核心体温42.17 ℃±0.84 ℃, MAP与Tr的变化特点相似, 16 h达峰值后迅速下降(P<0.05)(表2).
模型组大鼠GERS、SIPRS与0 h组相比较, 在8 h时显著降低(P<0.05), 8-16 h内表现缓慢下降期, 此后快速下降, 24 h时GERS, SIPRS达最小值, 抑制程度显著(P<0.01)(表3).
目前临床上有关热射病的诊断标准包括: 核心体温升高(≥40 ℃), 皮肤干热、潮红, 同时伴有严重的神经系统障碍(神经错乱、癫痫、昏迷等)[11-13], 但上述临床表现难以应用到实验动物模型研究中. Tr、SBP的动态变化是评价热射病发生、发展以及严重程度的主要指标, Bouchama等[11]提出以核心体温超过41 ℃和SBP从峰值下降作为诊断实验性热射病的标准. 我们选择在大鼠清醒状态下测定不同时间点Tr、RR值, 且能够有效的避免高温下麻醉对体温调节反应的抑制[14,15]、大鼠通过饮水排尿散热的生理行为及股动脉穿刺结扎所致心脏负荷改变等干扰, CHS大鼠模型更接近于大鼠的生理状态机制, 为胃肠道研究奠定了基础. 结果发现, 与0 h组相比, 模型组HR、RR持续升高, Tr呈三相式变化模式, 即表现为初始阶段快速上升, 随后表现为类似于平台的缓升期, 最后再次进入快速增长期, 直至达到最大Tr值, MAP水平也呈现类似的变化特点, 16 h时达最大值后迅速下降. 该结果与目前国内外研究结果相一致[6,16].
正常情况下, 肠黏膜上皮细胞具有屏障作用, 可防止肠道内细菌和内毒素侵入血液循环[17], 然而有证据表明, 热射病是由热应激及高热下运动增加肠道黏膜通透性, 促进内毒素进入血液循环, 导致内毒素血症而触发[18,19], 岳慧等[20]、耿焱等[21]发现热损伤能够使大鼠小肠上皮紧密连接occludin蛋白表达减少、上皮细胞内钙超载诱发系列细胞损伤破坏肠黏膜上皮屏障, 肠道通透性和细胞凋亡成正相关[22]. 胃肠动力障碍也是肠道细菌过度生长及内毒素移位的重要因素之一, 然而, 热射病条件下胃肠动力屏障的变化在目前的研究中尚未见报道. 本实验结果显示, 模型组大鼠GERS、SIPRS较0 h组显著抑制, 其表现形式与MAP相似, 即初期快速下降期, 高温应激使机体迅速进入警觉期, 通过中枢神经/胃肠神经通路, 破坏边缘系统与下丘脑间相互平衡, 使交感神经兴奋, 迷走神经张力及环形肌收缩力降低, 胃肠收缩频率和传导速度减慢, 导致胃肠动力障碍; 清醒状态下大鼠能够通过大量饮水、排尿、排汗等加强蒸发散热, 缓解热损伤, 机体进入应激抵抗期, 胃肠动力平台样缓慢降低; 持续强烈的高热刺激将耗竭机体的抵抗能力, 内环境明显失衡, 研究表明, 热暴露24-48 h时肝损伤达其峰值[23-25], 肝功能障碍时, 胃排空延迟, 胃肠黏膜屏障作用被削弱受损, 肠道细菌移位、内毒素吸收增加[26,27]. 观察CHS大鼠胃肠黏膜腺体形态学发现: 随致热时间延长, 胃肠黏膜腺体结构紊乱, 腺上皮排列不规正、浊肿, 腺腔狭小或缺失, 腺体结构消失; 足够的热暴露在细胞水平上, 可以导致细胞膜完整性、细胞骨架、细胞核的损伤, 最终细胞死亡, 也有人认为过热提高了机体细胞的化学酶促反应速率, 引起代谢紊乱导致细胞损坏[28].
胃泌素主要由分布在胃窦和十二指肠的G细胞分泌, 在中枢神经系统、延髓的迷走神经背核中也有少量存在, 胃动素主要分布于十二指肠和近端空肠黏膜陷窝及绒毛中, 中枢神经组织也有存在, 如: 垂体、下丘脑、大脑皮质等, 这种同时存在于两个系统的肽类激素又称为"脑肠肽", 是一种调控胃肠运动的重要因素, 可直接与相应受体结合发挥效应, 也可调节其他神经递质释放和传递; 通过迷走神经介导, 在中枢和外周水平上对胃肠运动进行精细的调节[29]; 目前关于热射病大鼠模型脑肠肽变化的研究相关报道甚少.
为明确胃肠黏膜腺体损伤对GAS、MTL表达的影响, 我们首先对胃肠组织中GAS、MTL含量进行检测, 同时运用免疫组织化学染色法对GAS、MTL表达进行形态学观察并计算GAS、MTL的MOD进一步验证, 结果表明, 模型组胃组织中GAS峰值前移至8 h, 肠组织MTL随致热时间延长显著降低, 与GAS、MTL的MOD变化一致, 致热初期胞浆颗粒着色深、大小不一、分布不均匀, 最终表达物呈现少量而淡染; 血浆GAS、MTL含量检测结果发现, 模型组大鼠血清GAS、MTL显著升高, 与GERS、SIPRS、Tr、MAP具有相似的变化模式且峰值下降时间点相同, 上述结果揭示: 血浆MTL、GAS含量变化既可作为判断热射病大鼠动力障碍程度的指标, 又能反应大鼠热射病发生、发展的过程.
CHS大鼠血浆MTL、GAS变化特点机制可能为: (1)大鼠胃肠动力抑制使肠道明显扩张, 大量液体、气体积聚, 肠壁充血、水肿、张力增加反馈性使MTL分泌增加, 以促进胃肠运动和内容物的运行, 同时肠道某些毒素或代谢产物的蓄积亦可抑制肠道平滑肌MTL受体的敏感性, 可能导致血中MTL水平反馈性增高; (2)高热应激反应机体可释放大量应激激素[30], 如促肾上腺皮质激素、肾上腺素等, 肾上腺素能促进GAS释放, 同时应激状态下也可引起GAS分泌增加, 高促胃液素亦可能刺激Mo细胞释放MTL, 而GAS持续增高使幽门括约肌张力下降, 十二指肠液及胆汁返流入胃, 使胃窦部的pH值升高, 刺激G细胞进一步分泌GAS[31]. 持续强烈的高热刺激, 最终使HS大鼠胃肠黏膜腺体严重损伤, 分泌衰竭, 血浆GAS、MTL显著降低.
总之, 本实验成功模拟了极热干燥环境下CHS大鼠模型, 通过观察CHS大鼠胃肠道黏膜腺体形态学改变, 结果表明: 热损害使胃肠黏膜腺体严重损伤, 胃肠动力显著抑制, 称呈三相式变化模式, 血浆MTL、GAS含量测定既可作为判断CHS大鼠胃肠动力障碍的指标, 作为判断大鼠热射病进程的指标.
近几年, 随着夏季气温的不断飙升, "热射病"的发病率也逐年增加, 常常导致多器官功能障碍(multiple organ dysfunction, MOD), 致死事件层出不穷, 发病机制错综复杂, 而有关热射病胃肠动力及胃肠激素的研究目前国内尚未见报道, 临床上更是缺少有效的预防及治疗手段.
张庆瑜, 教授, 主任医师, 天津医科大学总医院科研处; 肖恩华, 教授, 中南大学湘雅二医院放射教研室
在炎热的夏季, 热射病是一种常见的急症, 主要以发病率、致死率高为特点, 常伴有全身多系统损伤, 其发病机制与胃肠道密不可分.但其具体作用机制尚不明确. 本文主要探究清醒状态下热射病大鼠胃肠动力与胃泌素(gastrin, GAS)、胃动素(motilin, MTL)的变化特点.
岳慧、耿焱等发现热损伤能够使大鼠小肠上皮紧密连接occludin蛋白表达减少、上皮细胞内钙超载诱发系列细胞损伤破坏肠黏膜上皮屏障, 使肠上皮通透性的增高, 导致内毒素血症及全身炎性介质反应, 触发热射病.
本文测定了清醒状态热射病大鼠胃排空率、小肠推进率, 并检测了调节胃肠动力的GAS、MTL含量变化, 结合胃肠黏膜腺体及GAS、MTL表达形态学改变, 从而对胃肠道在热射病进展中的作用及热射病对胃肠道损伤有了进一步的认识, 为后续的研究提供了依据.
本研究通过观察清醒状态(conscio-us heat stroke, CHS)大鼠胃肠道黏膜腺体形态学改变, 并综合分析比较大鼠血液、胃肠组织中GAS、MTL含量与大鼠胃肠动力障碍及生命体征变化特点, 结果表明: 血浆GAS、MTL含量测定既可作为判断CHS大鼠胃肠动力障碍的指标, 作为判断热射病进程的指标, 进一步为热射病的发病机制提供理论基础.
热射病: 由高温引起的体温调节功能失调, 表现为核心体温高于40 ℃, 伴有皮肤干燥灼热以及中枢神经系统异常, 如谵妄、惊厥或昏迷, 常见并发症为急性呼吸窘迫综合征, 弥散内血管内凝血, 休克, 横纹肌溶解, 肾衰, 脑水肿, 抽搐及肝功能不全.
本文清醒状态热射病大鼠模型血中GAS、MTL含量测定既可作为判断热射病大鼠胃肠动力障碍的指标, 亦可作为判断大鼠热射病发生、发展的指标, 具有较好的临床应用前景, 为热射病的发病机制研究奠定了基础.
编辑 郭鹏 电编 闫晋利
| 1. | Argaud L, Ferry T, Le QH, Marfisi A, Ciorba D, Achache P, Ducluzeau R, Robert D. Short- and long-term outcomes of heatstroke following the 2003 heat wave in Lyon, France. Arch Intern Med. 2007;167:2177-2183. [PubMed] [DOI] |
| 2. | Dematte JE, O'Mara K, Buescher J, Whitney CG, Forsythe S, McNamee T, Adiga RB, Ndukwu IM. Near-fatal heat stroke during the 1995 heat wave in Chicago. Ann Intern Med. 1998;129:173-181. [PubMed] [DOI] |
| 3. | Leon LR, Helwig BG. Role of endotoxin and cytokines in the systemic inflammatory response to heat injury. Front Biosci (Schol Ed). 2010;2:916-938. [PubMed] [DOI] |
| 4. | Huisse MG, Pease S, Hurtado-Nedelec M, Arnaud B, Malaquin C, Wolff M, Gougerot-Pocidalo MA, Kermarrec N, Bezeaud A, Guillin MC. Leukocyte activation: the link between inflammation and coagulation during heatstroke. A study of patients during the 2003 heat wave in Paris. Crit Care Med. 2008;36:2288-2295. [PubMed] [DOI] |
| 6. | Olden KW. Diagnosis of irritable bowel syndrome. Gastroenterology. 2002;122:1701-1714. [PubMed] [DOI] |
| 11. | Bouchama A, Knochel JP. Heat stroke. N Engl J Med. 2002;346:1978-1988. [PubMed] [DOI] |
| 12. | Leon LR, Helwig BG. Heat stroke: role of the systemic inflammatory response. J Appl Physiol (1985). 2010;109:1980-1988. [PubMed] |
| 13. | Staals JE, de Krom MC, van der Geest S. [The hot summer of 2003: heat stroke in Maastricht]. Ned Tijdschr Geneeskd. 2004;148:1269-1272. [PubMed] |
| 14. | Støen R, Sessler DI. The thermoregulatory threshold is inversely proportional to isoflurane concentration. Anesthesiology. 1990;72:822-827. [PubMed] |
| 15. | Washington DE, Sessler DI, Moayeri A, Merrifield B, McGuire J, Prager M, Belani K, Hudson S, Schroeder M. Thermoregulatory responses to hyperthermia during isoflurane anesthesia in humans. J Appl Physiol (1985). 1993;74:82-87. [PubMed] |
| 17. | Bouchama A, Parhar RS, el-Yazigi A, Sheth K, al-Sedairy S. Endotoxemia and release of tumor necrosis factor and interleukin 1 alpha in acute heatstroke. J Appl Physiol (1985). 1991;70:2640-2644. [PubMed] |
| 22. | Leng YF, Zhang Y, Zhang Y, Xue X, Wang T, Kang YQ. Ischemic post-conditioning attenuates the intestinal injury induced by limb ischemia/reperfusion in rats. Braz J Med Biol Res. 2011;44:411-417. [PubMed] [DOI] |
| 23. | Giercksky T, Boberg KM, Farstad IN, Halvorsen S, Schrumpf E. Severe liver failure in exertional heat stroke. Scand J Gastroenterol. 1999;34:824-827. [PubMed] [DOI] |
| 24. | Busto Bea V, García-Alonso FJ, Moreira Vicente V. [Liver damage in heatstroke]. Med Clin (Barc). 2012;138:361-365. [PubMed] [DOI] |
| 25. | Leon LR. Heat stroke and cytokines. Prog Brain Res. 2007;162:481-524. [PubMed] [DOI] |
| 26. | Kalaitzakis E, Sadik R, Holst JJ, Ohman L, Björnsson E. Gut transit is associated with gastrointestinal symptoms and gut hormone profile in patients with cirrhosis. Clin Gastroenterol Hepatol. 2009;7:346-352. [PubMed] [DOI] |
| 27. | Thor PJ, Krolczyk G, Gil K, Zurowski D, Nowak L. Melatonin and serotonin effects on gastrointestinal motility. J Physiol Pharmacol. 2007;58 Suppl 6:97-103. [PubMed] |
| 28. | Roberts WO. Exertional heat stroke during a cool weather marathon: a case study. Med Sci Sports Exerc. 2006;38:1197-1203. [PubMed] [DOI] |
| 29. | Grundy D, Al-Chaer ED, Aziz Q, Collins SM, Ke M, Taché Y, Wood JD. Fundamentals of neurogastroenterology: basic science. Gastroenterology. 2006;130:1391-1411. [PubMed] [DOI] |