修回日期: 2014-04-28
接受日期: 2014-04-30
在线出版日期: 2014-07-18
目的: 观察新型顺铂植入剂(cisplatin for injection)与常规顺铂注射液在人胃癌裸鼠移植瘤模型中促肿瘤细胞凋亡以及对脾酪氨酸激酶(spleen tyrosine kinase, SYK)、人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)、黏附分子CD44的变异体6(CD44v6)、人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(phosphate and tension homology deleted on chromsome ten, PTEN)、含半胱氨酸的天冬氨酸蛋白水解酶3(cysteinyl aspartate specific protease 3, Caspase3)、存活素或凋亡抑制基因(Survivin)在胃癌组织中表达水平的影响差异, 探讨新型顺铂植入剂在胃癌发生发展过程中的治疗优势.
方法: 用人胃癌SGC7901细胞株建立Balb/c裸鼠皮下移植瘤模型, 随机分4组: PBS尾静脉注射组(A组)、顺铂尾静脉注射组(B组)、顺铂瘤内注射组(C组), 顺铂植入剂植入组(D组), 每组5只. 经药物干预后, 记录瘤质量, 计算抑瘤率, 并对瘤体进行HE染色, 通过免疫组织化学法检测SYK、HER2、CD44v6、PTEN、Caspase3、Survivin表达水平, 流式细胞术检测各组细胞凋亡情况.
结果: 与对照组比较后发现新型顺铂植入剂能显著抑制移植瘤生长, 促进其凋亡并能较显著提高SYK、PTEN、Caspase3的表达: SYK的表达[D组与C组比较(73.42±4.92 vs 30.42±3.92), 差异有统计学意义(P<0.05); 而B组与A组比较(14.14±2.84 vs 5.06±2.96), 差异有统计学意义(P<0.05)], PTEN的表达[D组与C组比较(62.46±4.36 vs 29.82±2.22), 差异有统计学意义(P<0.05); 而B组与A组比较(16.06±4.26 vs 6.44±2.84), 差异有统计学意义(P<0.05)]、Caspase3的表达[D组与C组比较(77.58±6.28 vs 31.26±4.76), 差异有统计学意义(P<0.05); 而B组与A组比较(15.24±4.64 vs 10.82±2.72), 差异有统计学意义(P<0.05)], 降低HER2、CD44v6、Survivin表达. HER2的表达[D组与C组比较(16.32±4.82 vs 34.82±7.32), 差异有统计学意义(P<0.05); 而B组与A组比较(45.8±6.60 vs 77.34±9.04), 差异有统计学意义(P<0.05)], CD44v6的表达[D组与C组比较(28.7±8.10 vs 48.88±9.28), 差异有统计学意义(P<0.05); 而B组与A组比较(65.74±6.34 vs 80.48±8.18), 差异有统计学意义(P<0.05)], Survivin的表达[D组与C组比较(18.42±4.62 vs 31.3±9.50), 差异有统计学意义(P<0.05); 而B组与A组比较(69.66±9.46 vs 84.64±5.04), 差异有统计学意义(P<0.05)].
结论: 新型顺铂植入剂能更显著下调HER2、CD44v6、Survivin或上调SYK、PTEN、Caspase3的表达来抑制肿瘤生长, 减少不良反应以达到靶向治疗的目的, 为临床胃癌早期预防、进展期治疗及预后提供新思路.
核心提示: 本研究通过对比观察脾酪氨酸激酶(spleen tyrosine kinase)、人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(phosphate and tension homology deleted on chromsome ten)、Caspase3、人表皮生长因子受体2(human epidermal growth factor receptor 2)、CD44v6、Survivin等与胃癌的早期、进展期、凋亡及预后密切相关的蛋白表达情况和细胞凋亡情况的流式细胞术散点图发现在胃癌的发生发展过程中顺铂植入剂能更为高效地抑制胃癌细胞增殖, 促进其凋亡. 这很可能是由于顺铂植入剂在用药部位使药物浓度呈现稳定持续的高水平状态从而达到抑制癌细胞增殖, 促进其凋亡, 杀灭微小转移灶及游离癌细胞, 明显降低胃癌转移侵袭的机率, 显著改善预后, 提高生活质量的目的, 这一发现对肿瘤的早期预防, 进展期治疗以及预后均提出了新思路.
引文著录: 蔡婷婷, 颜丽萍, 李弘, 石晓萍, 梁勇, 申美荣. 顺铂植入剂对裸鼠人胃癌模型的抗肿瘤作用. 世界华人消化杂志 2014; 22(20): 2817-2825
Revised: April 28, 2014
Accepted: April 30, 2014
Published online: July 18, 2014
AIM: To assess the antitumor effects of cisplatin implants vs common cisplatin injection in a xenograft nude mouse model of human gastric cancer.
METHODS: A xenograft nude mouse model of human gastric cancer was established by subcutaneously injecting SGC7901 cells in Balb/c nude mice. The model mice were divide into four groups randomly: A (intravenous injection of PBS via the tail vein), B (intravenous injection of cisplatin via the tail vein), C (intratumor injection of cisplatin), and D (cisplatin implantation). After drug intervention, tumor weight and volume were calculated. Tumor tissues were observed by HE staining. The protein expression of spleen tyrosine kinase (SYK)/human epidermal growth factor receptor 2 (HER2), phosphate and tension homology deleted on chromsome ten (PTEN)/the sixth variant form of adhesion molecule CD44 (CD44v6) and cysteinyl aspartate specific protease 3 (Caspase3)/Survivin in tumor tissue was detected by immunohistochemistry. Cell apoptosis was detected by flow cytometry.
RESULTS: Sustained-release cisplatin significantly promoted apoptosis, suppressed tumor growth, enhanced the expression of SYK (group D: 73.42 ± 4.92 vs group C: 30.42 ± 3.92, P < 0.05; group B: 14.14 ± 2.84 vs group A: 5.06 ± 2.96, P < 0.05), PTEN (group D: 62.46 ± 4.36 vs group C: 29.82 ± 2.22, P < 0.05; group B: 16.06 ± 4.26 vs group A: 6.44 ± 2.84, P < 0.05) and Caspase3 (group D: 77.58 ± 6.28 vs group C: 31.26 ± 4.76, P < 0.05; group B: 15.24 ± 4.64 vs group A: 10.82 ± 2.72, P < 0. 05), and reduced the expression of HER2 (group D: 16.32 ± 4.82 vs group C: 34.82 ± 7.32, P < 0.05; group B: 45.8 ± 6.60 vs group A: 77.34 ± 9.04, P < 0.05), CD44v6 (group D: 4.60 ± 1.40 vs group C: 10.32 ± 1.72, P < 0.05; group B: 28.10 ± 5.60 vs group A: 69.02 ± 1.52, P < 0.05) and Survivin (group D: 18.42 ± 4.62 vs group C: 31.3 ± 9.50, P < 0.05; group B: 69.66 ± 9.46 vs group A: 84.64 ± 5.04, P < 0.05).
CONCLUSION: Cisplatin implants exert anticancer effects against human gastric cancer in nude mice by promoting apoptosis and altering the expression of SYK, PTEN, Caspase3, HER2, CD44v6, and Survivin.
- Citation: Cai TT, Yan LP, Li H, Shi XP, Liang Y, Shen MR. Antitumor effects of cisplatin implants against human gastric cancer in nude mice. Shijie Huaren Xiaohua Zazhi 2014; 22(20): 2817-2825
- URL: https://www.wjgnet.com/1009-3079/full/v22/i20/2817.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i20.2817
胃癌是常见的恶性肿瘤之一, 发病率17.6/100000, 在消化系恶性肿瘤排行中居首位[1-5]. 我国胃癌发生率远高于世界平均水平, 每年有26万多例死于胃癌, 占所有肿瘤死亡的23.93%, 其病程较短, 恶性程度高, 胃癌患者尤其当病情进展到中晚期时死亡率极高, 生存率低, 生活质量也受到严重影响. 新型植入用顺铂是长效抗肿瘤制剂, 能明显改善恶性肿瘤如肝癌、食管癌等预后, 其优势在临床实验方面已有相关报道[6,7]. 但有关其治疗胃癌的基础实验方面研究较少. 本研究旨在探讨新型制剂顺铂植入剂对人胃癌裸鼠皮下种植瘤的抑制效果, 并验证其在抗肿瘤方面的优势, 为该缓释药物的临床应用提供实验依据.
Balb/c裸鼠20只, SPF级, ♀10只, ♂10只, 4周龄, 体质量18-20 g, 购自桂林医学院实验动物中心; SGC7901细胞系购自广西医科大学. RPMI 1640培养基及胎牛血清(Hyclone公司); 兔抗人脾酪氨酸激酶(spleen tyrosine kinase, SYK)多克隆抗体(博士德公司); 鼠抗人c-erbB-2单克隆抗体(北京中杉金桥生物技术有限公司); 兔抗人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(phosphate and tension homology deleted on chromsome ten, PTEN)多克隆抗体(北京中杉金桥生物技术有限公司); 鼠抗人CD44v6单克隆抗体(北京中杉金桥生物技术有限公司); 兔抗人生存素(Survivin)多克隆抗体(福州迈新生物技术开发有限公司); 兔抗人半胱氨酸天冬氨酸特异性蛋白酶3(Caspase3)多克隆抗体(北京中山金桥生物技术有限公司); 流式细胞凋亡Annexin/PI双染试剂(购自eBioscience公司). 检测仪器采用美国BD公司生产FACSAriaTM Ⅲ型流式细胞仪; 顺铂(cis-diamine dichloroplatinum, CDDP)注射液(上海旭东海普药业有限公司, 25 mg/mL); 顺铂缓释制剂(生产厂家: 安徽丰原中人药业公司, 剂型: 植入剂; 规格: 20 mg, 批号: 20120403).
1.2.1 动物模型的建立与干预: 细胞培养, 在对数期收集细胞并制成浓度约为1.5×108/mL的细胞悬液, 裸鼠右前肢腋下注射0.2 mL的细胞悬液(约3.0×107个/只), 10 d左右肿瘤长至直径约5 mm表明致瘤成功, 5只一组, 随机分为4组: PBS 尾静脉注射组(A组)、顺铂尾静脉注射组(B组)、顺铂瘤内注射组(C组), 顺铂植入剂植入组(D组). 于15、20、25 d给予A组PBS(1 mg/kg)、B组CDDP(1 mg/kg)、C组CDDP(1 mg/kg)相应处理, D组仅在成瘤后5 d植入顺铂缓释剂(0.4 mg/kg). 30 d后, 处死裸鼠测瘤体大小并称质量, 测出肿瘤的最长径(a)和最短径(b), 瘤体体积V(mm3) = 0.5×a×b2, 抑瘤率 = [1-实验组平均瘤质量(B、C、D组为实验组)/A组平均瘤质量]×100%. 40%甲醛固定瘤体, 经石蜡包埋, 常规HE染色及免疫组织化学检测SYK/人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)、CD44v6/PTEN、Caspase3/Survivin的表达. 免疫组织化学法严格按照试剂盒的操作步骤进行.
1.2.2 SP免疫组织化学法检测SYK/HER2、CD44v6/PTEN、Caspase3 /Survivin蛋白表达: 石蜡切片经脱蜡水化后, 用PBS(pH 7.4)冲洗3次, 间隔3 min; 对组织抗原进行相应的修复; 每张切片50 μL 13%H2O2室温孵育10 min. PBS冲洗3次, 间隔3 min; 弃去PBS液, 每张切片滴加50 μL相应抗体(SYK/HER2, CD44v6/PTEN, Caspase3/Survivin), 室温孵育60 min, PBS冲洗3次, 间隔3 min; 弃去PBS液, 滴加1滴即用型MaxvisionTM快捷免疫组织化学试剂, 室温孵育10 min, PBS冲洗3次, 间隔3 min; 除去PBS液, 滴100 μL DAB, 冲洗, 苏木精复染, PBS冲洗反蓝, 脱水干燥, 二甲苯透明, 晾干封片, 干燥, 镜检计数.
1.2.3 免疫组织化学结果判定: Caspase3、Survivin和PTEN蛋白阳性染色以细胞浆出现棕黄色颗粒为主, 而SYK、HER2和CD44v6蛋白阳性染色均以细胞膜出现棕黄色颗粒为主. 在400倍镜下染色最强区域中, 每张组织切片选10个视野, 使用目镜网格微尺计数1000个细胞, 阳性细胞率 = 阳性细胞数/肿瘤细胞数×100%.
1.2.4 流式细胞术检测细胞凋亡情况: 用4个组的肿瘤组织制成的细胞混悬液经PBS洗涤1次, 弃上清, 用100 μL 1×buffer混悬至1×106分别装于4个1.5 mL的EP管内, 加5 μL Annexin V, 室温避光放置30 min, 经1×的buffer洗涤后用200 μL 1×的buffer制成细胞混悬液, 加入5 μL Propidium lodides, 2 ℃-8 ℃避光孵育10 min, 过滤上机.
统计学处理 应用 SPSS11.0统计软件进行分析, 所有数据描述用mean±SD表示, 采用实验组与对照组、顺铂植入组与常规顺铂注射组两样本组间的t检验, 各组之间用方差分析F检验, P<0.05为差异有统计学意义.
20只裸鼠均在10 d左右成瘤, 成瘤率100%. 体积: PBS尾静脉注射组(A组)1564 mm3±180 mm3、顺铂尾静脉注射组(B组)883 mm3±46 mm3、顺铂瘤内注射组(C组)584 mm3±91 mm3、顺铂植入剂植入组(D组)296 mm3±146 mm3. D组体积与A、B、C组比较, 差异均有统计学意义(P<0.05, F = 160.568), D组瘤质量与A、B、C组比较均降低, 差异有统计学意义(P<0.05), D组抑瘤率明显高于A组(表1).
| 分组 | SYK(%) | HER2(%) | PTEN(%) | CD44v6(%) | Survivin(%) | Caspase3(%) | 瘤质量(mg) | 抑瘤率(%) |
| A组 | 5.06±2.96 | 77.34±9.04 | 6.44±2.84 | 80.48±8.18 | 84.64±5.04 | 10.82±2.72 | 1.53±0.17 | - |
| B组 | 14.14±2.84a | 45.80±6.60a | 16.06±4.26a | 65.74±6.34a | 69.66±9.46a | 15.24±4.64a | 1.12±0.17a | 27.1a |
| C组 | 30.42±3.92a | 34.82±7.32a | 29.82±2.22a | 48.88±9.28a | 31.30±9.50a | 31.26±4.76a | 0.64±0.05a | 43.0a |
| D组 | 73.42±4.92a | 16.32±4.82a | 62.46±4.36a | 28.70±8.10a | 18.42±4.62a | 77.58±6.28a | 0.23±0.12a | 63.8a |
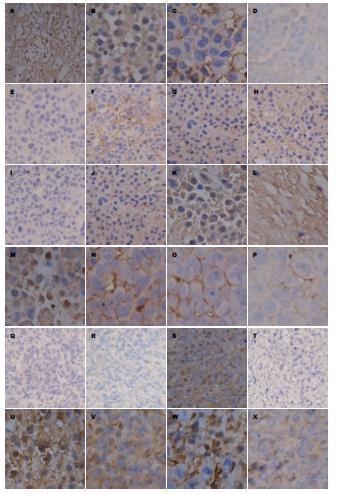
由图1可见, 在PBS尾静脉注射组、顺铂尾静脉注射组、顺铂瘤内注射组, 顺铂植入剂植入组中, HER2(图1A-D)、CD44v6(图1M-P)、Survivin(图1U-X)的阳性表达均呈逐渐下降的趋势, 顺铂植入剂植入组中的HER2、CD44v6、Survivin的阳性表达都是最低的, 而SYK(图1E-H), PTEN(图1I-L), Caspase3(图1Q-T)的阳性表达则与之相反, 呈逐渐升高趋势, 而最高的阳性表达均在顺铂植入剂植入组(表1, 图1).
由表1可知, PBS尾静脉注射组(A组)、顺铂尾静脉注射组(B组)、顺铂瘤内注射组(C组), 顺铂植入剂植入组(D组)中HER2、CD44v6、Survivin的表达呈逐渐下降的趋势, 阳性表达率分别是: HER2表达率依次为77.34±9.04、45.8±6.60、34.82±7.32、16.32±4.82; CD44v6表达率依次为80.48±8.18、65.74±6.34、48.88±9.28、28.7±8.10; Survivin表达率依次为84.64±5.04、69.66±9.46、31.3±9.50、18.42±4.62 , 这一结果与图1中HER2、CD44v6、Survivin的阳性表达趋势一致; 而SYK、PTEN、Caspase3的表达趋势则与之相反, 逐渐升高, 阳性表达率分别是: SYK表达率依次为5.06±2.96、14.14±2.84、30.42±3.92、73.42±4.92; PTEN表达率依次为6.44±2.84, 16.06±4.26、29.82±2.22、62.46±4.36; Caspase3表达率依次为10.82±2.72、15.24±4.64、31.26±4.76、77.58±6.28, 这也与图1中的SYK、PTEN、Caspase3表达趋势一致.
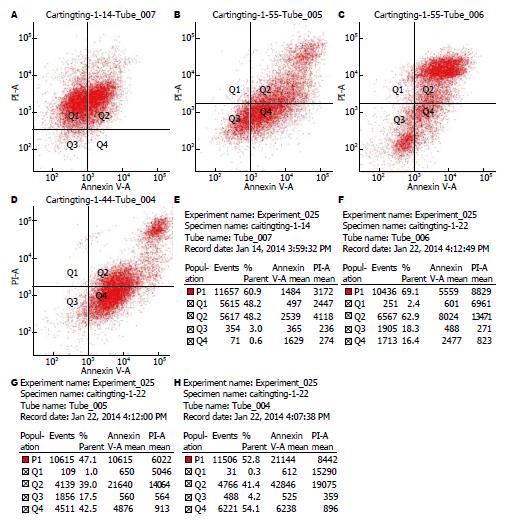
通过对比分析图2的细胞凋亡散点图中Q2与Q4期散点数之和所代表的细胞凋亡程度, 可见PBS尾静脉注射组、顺铂尾静脉注射组、顺铂瘤内注射组, 顺铂植入剂植入组中肿瘤组织的细胞凋亡呈逐渐升高趋势, 并且由图2的细胞凋亡结果明细表可知具体的细胞凋亡率分别是: 48.8%、79.3%、81.5%、95.5%, 该结果与散点图的变化趋势一致(图2).
细胞凋亡调控失衡对肿瘤发生发展有重要影响[8]. 顺铂因具有促肿瘤细胞凋亡的作用成为临床治疗肿瘤的常用药[9,10], 但由于常规注射用顺铂会引起全身多个系统的不良反应, 所以在很大程度上限制了顺铂的应用. 而新型制剂顺铂植入剂通过靶向给药能明显降低全身不良反应, 提高顺铂利用率和化疗效果[7]. 本实验从与肿瘤生长相关的蛋白表达方面对经顺铂植入剂和常规顺铂制剂分别干预后胃癌细胞凋亡、侵袭、转移及预后情况的变化进行研究, 结果表明与常规顺铂制剂相比, 顺铂植入剂在抑制肿瘤生长、降低复发及转移率、减少不良反应、改善预后具有明显优势, 这可能因为缓释给药系统使药物能够达到较高的浓度, 且作用持久[6]. 将其用于胃癌术后的植入, 对促肿瘤凋亡、抑制转移、改善预后以及提高生存质量方面有显著疗效, 是晚期或不适宜手术治疗的患者较为理想的一种选择.
Survivin/Caspase3是近几年来最受关注的与细胞凋亡关系紧密的一对基因[11,12]. 经多位专家研究发现在细胞凋亡途径中Caspase3起了决定性的促进作用, Caspase3是细胞凋亡过程中的终末效应蛋白酶[12,13]. 而Survivin能够直接抑制Caspase的活性来阻断细胞凋亡, 促进细胞增殖, 该基因在正常细胞中几乎不表达, 但在多种肿瘤细胞中呈现高表达状态[14-17]. 因此, 通过对肿瘤组织局部植入缓释抗肿瘤药物来干预Survivin可以显著抑制肿瘤细胞的增殖. 图1U-X可见Survivin的表达呈现逐渐下降的趋势, 经显微镜下计数(400倍镜下, 每张切片选10个视野, 使用目镜网格微尺计数1000个细胞)再根据阳性细胞率的计算公式(即阳性细胞率 = 阳性细胞数/肿瘤细胞数×100%)可得出阳性率分别是: 84.64%±5.04%、69.66%±9.46%、31.3%±9.50%、18.42%±4.62%(可见顺铂植入组图1X中的Survivin阳性表达率最低), 减少了Survivin的抑制作用后Caspase3的表达逐渐升高(顺铂植入组Caspase3表达最高), 再结合图2的流式细胞凋亡散点图和细胞凋亡结果明细表(顺铂植入组的细胞凋亡率最高, 图2)可以进一步证实顺铂植入剂组比对照组更能有效的抑制胃癌细胞的凋亡.
SYK基因的启动子在肿瘤早期即呈现甲基化状态, 导致SYK失表达, 其表达与癌细胞凋亡呈明显的负相关[18-20]. 由此可知在胃癌早期SYK就会呈现出失表达的状态, 因此可以作为胃癌早期诊断的敏感指标之一. Mahabeleshwar等[19]、Toyama等[20]经研究发现SYK可通过抑制HER2的表达而发挥抑癌作用. HER2是原癌基因, 具有致瘤作用, 其作用机制为抑制凋亡, 促进增殖, 增加肿瘤细胞的侵袭能力, 促进肿瘤血管新生和淋巴管新生[21-28]. HER2不仅是诊断胃黏膜细胞恶变的标志, 同时也是胃癌靶向治疗的靶点. 在正常组织中SYK高表达, HER2则正好相反; 而在癌组织中HER2高表达, SYK低表达. 图1A-H中HER2、SYK的表达趋势说明顺铂植入剂在胃癌早期就能更为高效的清除癌变细胞, 与对照组相比有明显优势. 这一研究结果也为胃癌的早期预防, 检测和治疗提供了新的思路.
CD44v6是目前公认的促肿瘤转移基因. 他在肿瘤侵袭转移的3个关键过程中都起到了促进的作用. 研究发现, CD44v6的高表达是肿瘤高侵袭、易转移的指标[29-35]. 尤其是胃癌中CD44v6的高表达使得癌细胞具有较强的侵袭和转移的能力, 因此CD44v6可作为预测胃癌侵袭转移以及预后的有效的指标[31-33]. PTEN在多种进展期肿瘤中缺失, 因此也被称为多发性进展期癌变基因. Zheng等[36]、Yang等[37]及Zheng等[38]发现PTEN蛋白有双重磷酸酶活性, 在细胞凋亡的3种途径即PIP3途径、FAK途径、MAPK途径中PTEN蛋白均能发挥去磷酸化的作用来诱导细胞凋亡[39-44]. 免疫组织化学结果图1中PTEN(图1I, K, L)和CD44v6(图1M-P)的表达呈现截然相反的趋势(CD44v6逐渐下降而PTEN逐渐上升), 表明顺铂植入剂组更能有效地抑制进展期胃癌的发展, 降低转移率, 改善预后, 对胃癌的临床治疗有良好的指导作用.
本研究通过采用不同的干预方式对裸鼠荷瘤进行处理后, 发现顺铂植入剂均能有效抑制原癌基因HER2、CD44v6、Survivin的蛋白表达, 提高原癌基因SYK、PTEN、Caspase3的蛋白表达, 这一结果暗示了顺铂植入剂在胃癌的早期和进展期均能有效的促进胃癌细胞凋亡, 其机制有可能是通过下调HER2、CD44v6、Survivin的表达、上调SYK、 PTEN、Caspase3的表达来实现抗瘤作用的. 同时, 与对照组相比, 顺铂植入组呈现出更高的SYK、PTEN、Caspase3表达水平, 这与其维持局部较高的药物浓度密切相关, 提示其促凋亡作用与剂量相关. 图2中的细胞凋亡散点图和细胞凋亡结果明细表进一步证明顺铂植入剂能更有效的促进细胞凋亡. 因此, 我们认为, 顺铂植入剂能在用药部位使药物浓度呈现稳定持续的高水平状态从而达到抑制癌细胞增殖, 促进其凋亡, 杀灭微小转移灶及游离癌细胞, 明显降低胃癌转移侵袭的机率, 显著改善预后, 提高生活质量的目的, 对肿瘤的早期预防, 进展期治疗以及预后均提出了新思路.
早期胃癌症状不明显易被忽略, 确诊时常已属晚期. 所以胃癌治疗的基础和临床研究一直深受关注. 顺铂便是首选化疗药物之一. 但常规注射用顺铂引起的多种不良反应极大限制了其应用范围. 新型制剂顺铂植入剂改变顺铂给药途径、减少不良反应, 为临床治疗胃癌提供了新思路. 因此顺铂植入剂治疗胃癌的基础研究对指导临床用药意义重大.
蒋敬庭, 教授, 常州市第一人民医院(苏州大学附属第三医院)肿瘤生物诊疗中心
顺铂植入剂具备良好的药物代谢动力学研究, 但在胃癌早期、进展期, 顺铂植入剂是否均能比常规顺铂注射液更加有效地抑制肿瘤生长至关重要, 因此经顺铂不同剂型干预后对比观察相关蛋白表达变化成为研究热点, 尤其是与胃癌早期、进展期密切相关的蛋白表达.
研究报道顺铂植入剂具备良好的药物代谢动力学研究, 具有稳定维持局部药物高浓度的特点, 减少了全身不良反应, 在临床肿瘤的治疗中操作简单宜行.
本研究从与肿瘤发生发展密切相关的多种蛋白表达角度比较分析顺铂植入剂与常规顺铂注射液在抗肿瘤方面差异.
对于临床医生来说, 确诊为胃癌的患者可通过在癌变局部植入适量顺铂植入颗粒进行治疗, 减少不良反应, 操作简单易行; 对于病理医生而言, 应充分认知与胃癌早期和进展期密切联系的相关因子评分标准, 准确判断, 为临床医生判断顺铂植入剂的用量提供确切依据.
文章通过肿瘤凋亡、侵袭性相关基因的表达变化来探讨顺铂缓释粒子对胃癌裸鼠模型的抗肿瘤效应, 结果明确, 并有一定的新颖性和创新性, 具有重要的指导价值.
编辑 郭鹏 电编 鲁亚静
| 1. | Gordon MA, Gundacker HM, Benedetti J, Macdonald JS, Baranda JC, Levin WJ, Blanke CD, Elatre W, Weng P, Zhou JY. Assessment of HER2 gene amplification in adenocarcinomas of the stomach or gastroesophageal junction in the INT-0116/SWOG9008 clinical trial. Ann Oncol. 2013;24:1754-1761. [PubMed] [DOI] |
| 2. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 3. | Jemal A, Center MM, DeSantis C, Ward EM. Global patterns of cancer incidence and mortality rates and trends. Cancer Epidemiol Biomarkers Prev. 2010;19:1893-1907. [PubMed] [DOI] |
| 4. | Shin HR, Masuyer E, Ferlay J, Curado MP. Cancer in Asia - Incidence rates based on data in cancer incidence in five continents IX (1998-2002). Asian Pac J Cancer Prev. 2010;11 Suppl 2:11-16. [PubMed] |
| 5. | D'Angelica M, Gonen M, Brennan MF, Turnbull AD, Bains M, Karpeh MS. Patterns of initial recurrence in completely resected gastric adenocarcinoma. Ann Surg. 2004;240:808-816. [PubMed] [DOI] |
| 11. | O'Connor DS, Schechner JS, Adida C, Mesri M, Rothermel AL, Li F, Nath AK, Pober JS, Altieri DC. Control of apoptosis during angiogenesis by survivin expression in endothelial cells. Am J Pathol. 2000;156:393-398. [PubMed] [DOI] |
| 12. | Shin S, Sung BJ, Cho YS, Kim HJ, Ha NC, Hwang JI, Chung CW, Jung YK, Oh BH. An anti-apoptotic protein human survivin is a direct inhibitor of caspase-3 and -7. Biochemistry. 2001;40:1117-1123. [PubMed] [DOI] |
| 13. | Jindal P, Chopra G, Chaudhary A, Rizvi AA, Sharma JP. Taylor's approach in an ankylosing spondylitis patient posted for percutaneous nephrolithotomy: A challenge for anesthesiologists. Saudi J Anaesth. 2009;3:87-90. [PubMed] [DOI] |
| 14. | Tamm I, Wang Y, Sausville E, Scudiero DA, Vigna N, Oltersdorf T, Reed JC. IAP-family protein survivin inhibits caspase activity and apoptosis induced by Fas (CD95), Bax, caspases, and anticancer drugs. Cancer Res. 1998;58:5315-5320. [PubMed] |
| 15. | Muchmore SW, Chen J, Jakob C, Zakula D, Matayoshi ED, Wu W, Zhang H, Li F, Ng SC, Altieri DC. Crystal structure and mutagenic analysis of the inhibitor-of-apoptosis protein survivin. Mol Cell. 2000;6:173-182. [PubMed] [DOI] |
| 16. | Sun YS, Ye ZY, Zhao ZS, Shi D, Zou SC. [Expression of vascular endothelial growth factor C and survivin in gastric carcinoma and their clinical implications]. Zhonghua Weichang Waike Zazhi. 2006;9:264-267. [PubMed] |
| 17. | Li F. Survivin study: what is the next wave? J Cell Physiol. 2003;197:8-29. [PubMed] [DOI] |
| 18. | Sada K, Takano T, Yanagi S, Yamamura H. Structure and function of Syk protein-tyrosine kinase. J Biochem. 2001;130:177-186. [PubMed] [DOI] |
| 19. | Mahabeleshwar GH, Kundu GC. Syk, a protein-tyrosine kinase, suppresses the cell motility and nuclear factor kappa B-mediated secretion of urokinase type plasminogen activator by inhibiting the phosphatidylinositol 3'-kinase activity in breast cancer cells. J Biol Chem. 2003;278:6209-6221. [PubMed] [DOI] |
| 20. | Toyama T, Iwase H, Yamashita H, Hara Y, Omoto Y, Sugiura H, Zhang Z, Fujii Y. Reduced expression of the Syk gene is correlated with poor prognosis in human breast cancer. Cancer Lett. 2003;189:97-102. [PubMed] [DOI] |
| 21. | Ross JS, McKenna BJ. The HER-2/neu oncogene in tumors of the gastrointestinal tract. Cancer Invest. 2001;19:554-568. [PubMed] |
| 22. | Siddiqa A, Long LM, Li L, Marciniak RA, Kazhdan I. Expression of HER-2 in MCF-7 breast cancer cells modulates anti-apoptotic proteins Survivin and Bcl-2 via the extracellular signal-related kinase (ERK) and phosphoinositide-3 kinase (PI3K) signalling pathways. BMC Cancer. 2008;8:129. [PubMed] [DOI] |
| 23. | Tapia C, Glatz K, Novotny H, Lugli A, Horcic M, Seemayer CA, Tornillo L, Terracciano L, Spichtin H, Mirlacher M. Close association between HER-2 amplification and overexpression in human tumors of non-breast origin. Mod Pathol. 2007;20:192-198. [PubMed] [DOI] |
| 24. | Ananiev J, Gulubova MV, Manolova IM. Prognostic significance of CD83 positive tumor-infiltrating dendritic cells and expression of TGF-beta 1 in human gastric cancer. Hepatogastroenterology. 2011;58:1834-1840. [PubMed] [DOI] |
| 25. | Yan SY, Hu Y, Fan JG, Tao GQ, Lu YM, Cai X, Yu BH, Du YQ. Clinicopathologic significance of HER-2/neu protein expression and gene amplification in gastric carcinoma. World J Gastroenterol. 2011;17:1501-1506. [PubMed] [DOI] |
| 26. | Begnami MD, Fukuda E, Fregnani JH, Nonogaki S, Montagnini AL, da Costa WL, Soares FA. Prognostic implications of altered human epidermal growth factor receptors (HERs) in gastric carcinomas: HER2 and HER3 are predictors of poor outcome. J Clin Oncol. 2011;29:3030-3036. [PubMed] [DOI] |
| 27. | Cho EY, Srivastava A, Park K, Kim J, Lee MH, Do I, Lee J, Kim KM, Sohn TS, Kang WK. Comparison of four immunohistochemical tests and FISH for measuring HER2 expression in gastric carcinomas. Pathology. 2012;44:216-220. [PubMed] [DOI] |
| 28. | Im SA, Kim JW, Kim JS, Kim MA, Jordan B, Pickl M, Han SW, Oh DY, Lee HJ, Kim TY. Clinicopathologic characteristics of patients with stage III/IV (M(0)) advanced gastric cancer, according to HER2 status assessed by immunohistochemistry and fluorescence in situ hybridization. Diagn Mol Pathol. 2011;20:94-100. [PubMed] [DOI] |
| 29. | Heider KH, Dämmrich J, Skroch-Angel P, Müller-Hermelink HK, Vollmers HP, Herrlich P, Ponta H. Differential expression of CD44 splice variants in intestinal- and diffuse-type human gastric carcinomas and normal gastric mucosa. Cancer Res. 1993;53:4197-4203. [PubMed] |
| 30. | Miwa T, Watanabe A, Yamada Y, Shino Y, Yamada T, Yamashita J, Matsuda M, Nakano H. Progression in gastric carcinoma relative to the ratio of CD44 epithelial variant transcript to CD44 hematopoietic variant transcript. Cancer. 1996;77:25-29. [PubMed] [DOI] |
| 31. | Xin Y, Grace A, Gallagher MM, Curran BT, Leader MB, Kay EW. CD44v6 in gastric carcinoma: a marker of tumor progression. Appl Immunohistochem Mol Morphol. 2001;9:138-142. [PubMed] |
| 32. | Yamaguchi A, Goi T, Yu J, Hirono Y, Ishida M, Iida A, Kimura T, Takeuchi K, Katayama K, Hirose K. Expression of CD44v6 in advanced gastric cancer and its relationship to hematogenous metastasis and long-term prognosis. J Surg Oncol. 2002;79:230-235. [PubMed] [DOI] |
| 33. | Kai-hong Huang, Ying Wu, Yin-ting Chen, Hui Deng, Guo-da Lian, Xin-tao Shuai. PEI-PEG as a siRNA genetic vector demonstrating interference in the expression of CD44v6 protein in gastric cancer cells. Clin Oncol Cancer Res. 2010;73:187-192. [DOI] |
| 34. | Yu P, Zhou L, Ke W, Li K. Clinical significance of pAKT and CD44v6 overexpression with breast cancer. J Cancer Res Clin Oncol. 2010;136:1283-1292. [PubMed] [DOI] |
| 35. | Zhou ZJ, Dai Z, Zhou SL, Fu XT, Zhao YM, Shi YH, Zhou J, Fan J. Overexpression of HnRNP A1 promotes tumor invasion through regulating CD44v6 and indicates poor prognosis for hepatocellular carcinoma. Int J Cancer. 2013;132:1080-1089. [PubMed] [DOI] |
| 36. | Zheng HC, Sun JM, Li XH, Yang XF, Zhang YC, Xin Y. Role of PTEN and MMP-7 expression in growth, invasion, metastasis and angiogenesis of gastric carcinoma. Pathol Int. 2003;53:659-666. [PubMed] [DOI] |
| 37. | Yang L, Kuang LG, Zheng HC, Li JY, Wu DY, Zhang SM, Xin Y. PTEN encoding product: a marker for tumorigenesis and progression of gastric carcinoma. World J Gastroenterol. 2003;9:35-39. [PubMed] |
| 38. | Zheng HC, Li YL, Sun JM, Yang XF, Li XH, Jiang WG, Zhang YC, Xin Y. Growth, invasion, metastasis, differentiation, angiogenesis and apoptosis of gastric cancer regulated by expression of PTEN encoding products. World J Gastroenterol. 2003;9:1662-1666. [PubMed] |
| 39. | Li J, Yen C, Liaw D, Podsypanina K, Bose S, Wang SI, Puc J, Miliaresis C, Rodgers L, McCombie R. PTEN, a putative protein tyrosine phosphatase gene mutated in human brain, breast, and prostate cancer. Science. 1997;275:1943-1947. [PubMed] [DOI] |
| 40. | Steck PA, Pershouse MA, Jasser SA, Yung WK, Lin H, Ligon AH, Langford LA, Baumgard ML, Hattier T, Davis T. Identification of a candidate tumour suppressor gene, MMAC1, at chromosome 10q23.3 that is mutated in multiple advanced cancers. Nat Genet. 1997;15:356-362. [PubMed] [DOI] |
| 41. | Li DM, Sun H. TEP1, encoded by a candidate tumor suppressor locus, is a novel protein tyrosine phosphatase regulated by transforming growth factor beta. Cancer Res. 1997;57:2124-2129. [PubMed] |
| 42. | Stambolic V, Suzuki A, de la Pompa JL, Brothers GM, Mirtsos C, Sasaki T, Ruland J, Penninger JM, Siderovski DP, Mak TW. Negative regulation of PKB/Akt-dependent cell survival by the tumor suppressor PTEN. Cell. 1998;95:29-39. [PubMed] [DOI] |
| 43. | Maehama T, Dixon JE. The tumor suppressor, PTEN/MMAC1, dephosphorylates the lipid second messenger, phosphatidylinositol 3,4,5-trisphosphate. J Biol Chem. 1998;273:13375-13378. [PubMed] [DOI] |
| 44. | Gu J, Tamura M, Yamada KM. Tumor suppressor PTEN inhibits integrin- and growth factor-mediated mitogen-activated protein (MAP) kinase signaling pathways. J Cell Biol. 1998;143:1375-1383. [PubMed] [DOI] |