修回日期: 2013-11-17
接受日期: 2013-11-18
在线出版日期: 2014-01-18
目的: 比较溃疡性结肠炎(ulcerative colitis, UC)患者与结直肠癌患者肠黏膜核因子κB(nuclear factor κB, NF-κB) p65表达差异, 探讨其临床意义.
方法: 12例无器质性肠道疾病志愿者、16例溃疡性结肠炎(ulcerative colitis, UC)患者及18例结直肠腺癌患者被纳入实验, 电子结肠镜下取活检获得新鲜的结肠黏膜组织. RT-PCR检测各组肠黏膜NF-κB p65 mRNA的表达, 免疫组织化学法检测各组肠黏膜NF-κB p65蛋白表达强度, 单因素方差分析三组之间的差异.
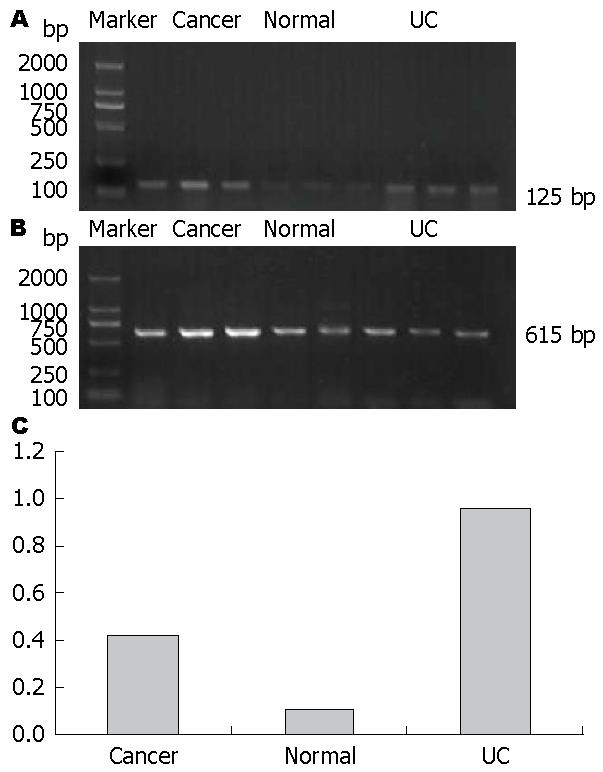
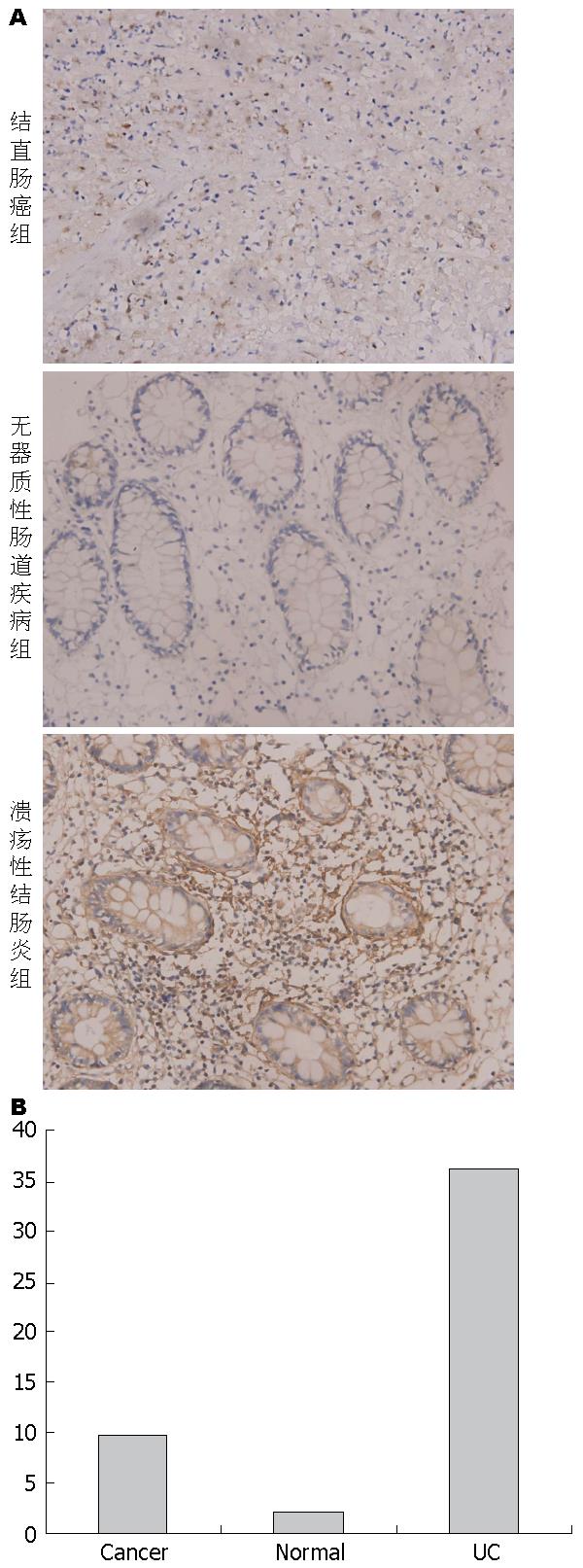
结果: 无器质性肠道疾病志愿者肠黏膜NF-κB p65基因与蛋白表达量分别为0.10%±0.03%、2.06%±0.70%, UC患者肠黏膜NF-κB p65基因与蛋白表达量分别为0.96%±0.11%、36.16%±6.99%, 结直肠癌患者肠黏膜NF-κB p65基因与蛋白表达量分别为0.42%±0.77%、9.54%±2.77%, 3组之间差异具有统计学意义(P<0.01).
结论: 尽管炎症与肿瘤存在某种联系已在学界达成共识, 课题组也观察到结直肠癌患者肠黏膜NF-κB p65的表达较无器质性肠道疾病患者肠黏膜增加, 但其表达强度并非之前文献报道的那么高, 课题组认为抑制NF-κB p65的表达可能是治疗UC的较好思路, 但不认为抑制NF-κB p65的表达能从根本上治疗结直肠癌.
核心提示: 尽管前人认为核因子κB(nuclear factor κB, NF-κB)在结直肠癌的发生发展中起重要作用, 但其表达强度并非之前文献报道的那么高, 也远不如溃疡性结肠炎(ulcerative colitis, UC)患者肠黏膜表达强度, 认为NF-κB p65为治疗UC的较好靶点, 但不认为抑制NF-κB p65的表达能从根本上治疗结直肠癌.
引文著录: 加秀凤, 沈霖, 范恒, 谢纪文, 曾宇阳, 陈曦, 朱锐. NF-κB p65在溃疡性结肠炎与结直肠癌患者肠黏膜中的表达差异与意义. 世界华人消化杂志 2014; 22(2): 279-285
Revised: November 17, 2013
Accepted: November 18, 2013
Published online: January 18, 2014
AIM: To investigate the expression of nuclear factor κB (NF-κB) p65 protein in the colon mucosa of patients with ulcerative colitis (UC) or colorectal adenocarcinoma (CA) and healthy volunteers.
METHODS: Specimens were obtained from 12 healthy volunteers, 16 patients with UC and 18 patients with CA. Fresh colonic tissues were obtained by endoscopic punch biopsies. The diagnosis was confirmed pathologically. Reverse transcription-polymerase chain reaction and immunohistochemistry were used to examine the expression of NF-κB p65 at both mRNA and protein levels in the colon mucosa of different groups.
RESULTS: The expression rate of NF-κB p65 mRNA and protein was 0.10% ± 0.03% and 2.06%±0.70% in the normal colon mucosa, 0.96% ± 0.11% and 36.16% ± 6.99% in UC, and 0.42% ± 0.77% and 9.54% ± 2.77% in CA, respectively. The expression of NF-κB p65 was significantly higher in UC than in CA and normal mucosa (all P < 0.01). Although the expression of NF-κB p65 in CA was higher than that in normal colon mucosa at both mRNA and protein levels, the expression intensity was not as strong as that reported in the literature.
CONCLUSION: Increased expression of NF-κB p65 may play an important role in the pathogenesis of UC, and anti-NF-κB therapy should be examined further for use as a potential therapy. NF-κB p65 may also be involved in the pathogenesis of CA.
- Citation: Jia XF, Shen L, Fan H, Xie JW, Zeng YY, Chen X, Zhu R. Significance of NF-κB p65 expression in ulcerative colitis and colorectal adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(2): 279-285
- URL: https://www.wjgnet.com/1009-3079/full/v22/i2/279.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i2.279
溃疡性结肠炎(ulcerative colitis, UC)主要在北欧和北美国家流行, 近年受"西洋化"生活方式的影响, 亚洲、欧洲南部及大多数发展中国家该类疾病发病率与患病率日趋增加. 在美国, 炎症性肠病困扰大约140万人口, 每年用于治疗该病的医疗费用达20亿美元[1].
目前的资料认为UC患者罹患结直肠癌(结直肠癌是世界第三大恶性肿瘤疾病, 每年大约新增病例954000例, 492000例因该病失去生命[2])的风险较高, UC病程达10、20、30年的患者的罹患结直肠癌的风险分别为2%、8%、18%[3], 危险因素包括UC病程及病变范围、有无原发性硬化性胆管炎病史、有无大肠癌家族史(患UC 20年以上的患者及有原发性硬化性胆管炎的患者罹患大肠癌的风险分别高达20%与50%), 尽管预防性直肠或/和结肠切除术可从根本上消除此风险, 然而大多数患者和内科大夫都选择定期检查以监控病情[4].
近年有文献报道核因子κB(nuclear factor κB, NF-κB)除了作为炎症反应的关键因子外, 人类罹患多种恶性肿瘤(特别是淋巴瘤)与Rel/NF-κB信号转导途径的活化相关, 于是学者们逐渐把目光转移到NF-κB与炎症相关性癌症的关系上来[5-7].
本实验基于此探讨结直肠癌患者肠黏膜NF-κB p65的表达, 并与UC患者及正常人作比较, 探讨其临床意义.
12例无器质性肠道疾病志愿者(46.13岁±12.05岁, 男女各半), 16例UC患者(50.42岁±10.43岁, 男10例, 女6例)及18例结直肠癌患者(59.00岁±10.07岁, 男10例, 女8例)被纳入试验(UC与结直肠癌诊断标准参照全国高等学校内科学教材), 新鲜的结肠黏膜组织通过电子结肠镜下取活检获得, 患者在病变明显处取材, 无器质性肠道疾病志愿者在乙状结肠处取材, 每例取活检5块, 2块标本置于多聚甲醛固定后石蜡包埋切片, 另外3块-80 ℃保存作RT-PCR用.
1.2.1 RT-PCR法检测各组肠黏膜NF-κB p65 mRNA的表达: 室温状态下, 用高温高压灭菌并经DEPC水处理的匀浆器将100 μg肠黏膜组织匀浆(匀浆器中加入0.5 mL TRIzol液)→匀浆后液体收集于EP管中→4 ℃, 12000 r/min离心10 min→取上清200 μL→加0.1 mL氯仿→快速震荡摇匀15 s→4 ℃, 12000 r/min离心10 min→取上层水相之上清→加异丙醇100 μL→颠倒摇匀→-20 ℃静置30 min→4 ℃, 12000 r/min离心10 min→去上清→加0.5 mL 750 mL/L 乙醇→震荡机震荡→4 ℃, 8000 r/min离心10 min→去上清, 自然凉干→加入15 μL DEPC水溶解RNA→逆转录总反应体系为20 μL: 溶解RNA的DEPC水6 μL, oligdT 1 μL, DEPC水5.5 μL三者混匀短暂离心, 70 ℃预变性5 min, 冰浴5 min; 加入MMLV逆转录酶1 μL, RNasin 0.5 μL, 10 mm dNTP 2 μL, 5×buffer缓冲液4 μL, 以上混合液37 ℃逆转录60 min, 94 ℃灭活逆转录酶5 min. PCR引物系列、反应条件及扩增产物大小如表1, PCR总反应体系为20 μL: 双蒸水16.6 μL, 上游引物0.2 μL, 下游引物0.2 μL, cDNA 2 μL, 10×buffer缓冲液2.5 μL, 25 mmol MgCl2 2 μL, 10 mmol dNTP 1 μL, Taq酶0.5 μL. 取PCR产物3 μL于含有溴化乙锭的琼脂糖凝胶(1.2%)中电泳, 运用JS-380自动凝胶图像分析仪记录条带, 用SensiAnsys凝胶图像分析软件分析条带相对灰度值(目标基因灰度值/β-actin灰度值).
1.2.2 免疫组织化学法检测各组肠黏膜NF-κB p65的表达: 活检获得的肠组织置于4%的多聚甲醛中固定→梯度乙醇脱水(750 mL/L无水乙醇浸泡5 min, 950 mL/L无水乙醇浸泡5 min, 无水乙醇浸泡5 min)→二甲苯透明(二甲苯中浸泡2次, 每次15 min)→常规石蜡包埋→切片(切片前载玻片先用多聚左旋赖氨酸行防脱片处理)→二甲苯脱蜡(3次, 每次15 min)→梯度乙醇水化(无水乙醇浸泡5 min, 950 mL/L无水乙醇浸泡5 min, 750 mL/L无水乙醇浸泡5 min)→PBS溶液洗涤玻片(3次, 每次5 min)→微波修复抗原(将玻片放入装有pH值为6.0的0.01 mmol/L枸橼酸钠溶液的抗原修复盒中后置于微波炉中, 高火微波修复3 min后将玻片置于室温自然冷却)→PBS溶液洗涤玻片(3次, 每次5 min)→玻片上滴加0.3%过氧化氢甲醇溶液避光反应30 min(过氧化氢甲醇溶液可消除内源性过氧化物酶的影响、使DAB显色及降低非特异性染色)→PBS溶液洗涤玻片(3次, 每次5 min)→滴加羊血清封闭液, 孵育30 min(将载有玻片的湿盒置于37度恒温床中, 此步骤可降低非特异性染色), 滴加1:150稀释的兔抗人NF-κB p65抗体, 4 ℃孵育过夜→复温(将载有玻片的湿盒置于37 ℃恒温床中10 min)→PBS溶液洗涤玻片(3次, 每次5 min)→滴加二抗(将载有玻片的湿盒置于37 ℃恒温床中40 min)→PBS溶液洗涤玻片(3次, 每次5 min)→滴加HRP标记链亲和素(将载有玻片的湿盒置于37 ℃恒温床中30 min)→PBS溶液洗涤玻片(3次, 每次5 min)→滴加DAB显色液(1 mL蒸馏水中混入DAB显色试剂盒中A、B、C试剂各1滴, 混匀后滴加至波片, 玻片在镜下可见棕黄色即用蒸馏水充分洗涤)→苏木素复染(5 s)→盐酸酒精分化→PBS溶液洗涤玻片(3次, 每次5 min)→乙醇脱水(750 mL/L无水乙醇浸泡5 min, 950 mL/L无水乙醇浸泡5 min, 无水乙醇浸泡5 min)→透明(二甲苯中浸泡2次, 每次15 min)→中性树胶封片→显微镜下观察拍照后运用显微图像分析系统分析试验结果(高倍显微镜下每张切片随机选取5个视野, 用MAPIS-500病理彩色分析系统分析各视野下阳性染色面积与总场面积的比值后取均值).
统计学处理 应用SPSS12.0统计软件统计分析, 计量资料以mean±SD表示, 单因素方差分析无器质性肠道疾病志愿者、UC患者与结直肠癌患者肠黏膜NF-κB p65基因与蛋白表达量差异, P<0.05为差异有统计学意义.
Ekbom等[10]1986-12-31统计分析1965-1983年瑞典Uppsala地区确诊的2509例UC患者的相对生存率发现: 患者10年生存率达96%, 其中溃疡性直肠炎、左半结肠炎及全结肠炎患者相对生存率分别为98%、96%和93%, 结直肠癌是两类患者主要的死亡原因.
2002年Coussens等[11]与Karin等[12]于Nature发文称: 炎症是肿瘤发生发展的关键因素, 许多癌症起源于感染、慢性刺激与炎症反应. 肿瘤微环境里的炎性细胞是肿瘤形成、增殖、存活与迁移必不可少的参与者. 抗炎治疗可能是肿瘤治疗的新途径.
转录因子NF-κB是由p50、p52、p65(-RelA)、RelB及c-Rel组成的同源或异源二聚体复合物, p50- p65复合物为为其主要组成部分, 他是先天与获得性免疫系统中一个关键的多效转录因子, 可调控多种促炎症因子的表达(如细胞因子、黏附分子等). 其功能主要受IκB调控(IκB家族有包括IκBα、IκBβ、IκBγ、IκBε、Bcl3及前体蛋白p100和p105 7个成员, 可阻止NF-κB的核聚集, 妨碍NF-κB与DNA结合), 当细胞受到促炎细胞因子、微生物产物等刺激时, IκB便在IκB激酶的诱导下发生磷酸化而降解, 此时Iκ与NF-κB解离, NF-κB转入核内而发挥其生物学效应[13].
学者们认为NF-κB参与肿瘤发生发展可能基于以下原因: (1)Rel/NF-κB转录因子家族成员之一c-rel最初被鉴认为致癌基因v-rel的同系物, 这提示我们该转录因子家族其他成员也可能是潜在的致癌基因; (2)肿瘤微环境可诱导NF-κB活化. 例如Szlosarek等[14]学者发现与正常人相比较, 多种癌症患者血清或组织的肿瘤坏死因子α(tumour necrosis factor-α, TNF-α)表达明显增高; (3)肿瘤细胞中通常可见NF-κB的表达. 例如Wang等[15]利用免疫组织化学、蛋白质印迹、RNA印迹、电泳迁移率分析和氯霉素乙酰转移酶检测等方法比较胰腺癌与正常胰腺组织的NF-κB活性发现: 大约67%(16/24)的胰腺癌患者胰脏组织NF-κB被组成性激活, 在正常组织中则未见此现象; Tai等[16]用免疫组织化学法比较比较65例肝细胞癌患者与9例正常人肝组织NF-κB p65及IκB的表达差异, 发现癌组织中这两个指标明显高于正常组织; Skrzycki等[17]用免疫印迹法比较胃癌及肝癌患者癌组织与癌旁组织NF-κB的表达差异, 发现癌组织较癌旁组织NF-κB的表达明显增高; (4)活化的NF-κB一方面能促进诸如IAPs等抗凋亡蛋白的表达, 另一方面他能抑制延长JNK的活化从而导致活性氧族的聚集, 从而阻断细胞凋亡、促进细胞增殖. 例如Lindholm等[18-21]研究发现活化的NF-κB可增强前列腺癌细胞PC-3的增殖能力; (5)几种参与肿瘤发生发展和转移的基因表达都受NF-κB的调控. 例如作为NF-κB的重要靶基因CyclinD1、cMyc在细胞生长和增殖过程中起重要作用的; 一些血管新生的重要因子: 血管内皮生长因子(vascular endothelial growth factor, VEGF)、白介素-8(interleukin-8, IL-8)等均直接或间接地受NF-κB调控[22,23]; (6)多数治疗肿瘤药物可下调NF-κB的活性. 例如Ban等[24]实验证实大蒜提取物可通过抑制癌细胞NF-κB的活性而影响细胞生长, 且能增加癌细胞对化疗药物的敏感性. Kim等[25]利用人参皂苷Rg3作为干预药物也得到类似的实验结果[24,25]; (7)提高NF-κB的活性可诱导癌症的发生. 例如Greten等[26]实验证实敲除肠上皮细胞IκKβ基因可明显降低结肠炎相关性癌症(colitis-associated cancer, CAC)发生率; Zhang等[27]发现敲除Cylindromatosis基因(NF-κB活性高)小鼠更容易诱发结肠炎相关性癌症; (8)NF-κB的活化可致癌并诱导化疗抵抗. 例如Wang等[28]实验证实NF-κB的活化能保护肿瘤细胞在电离辐射和柔红霉素(一种抗肿瘤抗生素)的干预下免于死亡; Lind等[29]通过体外实验证实抑制NF-κB可增强抗肿瘤药物吉西他滨的抗癌活性, 体内实验发现结直肠癌患者癌组织NF-κB表达较癌旁组织明显增加. 所有这些现象都提示NF-κB可作为癌症治疗的可能靶点[30-33].
关于NF-κB与结直肠癌关系方面, 前人也做了一些研究. Yu等[34]应用免疫组织化学法比较10例正常人与52例结直肠癌患者NF-κB/RelA, VEGF与CD34表达差异, 结果显示: 结直肠癌NF-κB/RelA与VEGF表达明显增加, NF-κB/RelA与VEGF的表达呈线性关系, 且二者表达量与微血管密度呈正相关, 但这三个指标与患者临床表现无明显相关性. 此结果表明NF-κB/RelA对结直肠癌肿瘤血管新生具有重要意义[34].
Aranha等[35]收集结直肠腺瘤、腺癌及正常肠组织共48例, 用免疫组织化学法检测各组NF-κB的表达, 结果显示: 癌组织较癌旁组织NF-κB的表达明显增加, 且其表达高低与病理学恶化程度正相关.
Lü等[36]课题组采用免疫组织化学法分析359例结直肠癌患者癌组织NF-κB p65的表达, 发现NF-κB p65的阳性表达细胞数达67.7%, 分析成功随访的198例患者资料后发现高表达NF-κB p65的患者术后5年生存率较低.
Lee等[37]利用免疫组织化学法分析正常肠黏膜(20例)、低分化管状腺瘤(20例)、高分化管状腺瘤(20例)及腺癌(64例)组织NF-κB p65表达差异, 发现腺癌组织较其他组织NF-κB p65表达显著增加, 且NF-κB p65的表达与肿瘤分化程度呈负相关.
Kwon等[38]采用免疫组织化学法检测148例结直肠癌患者NF-κB及VEGF的表达发现: NF-κB表达与VEGF的表达呈正相关, NF-κB高表达的结直肠癌患者较低表达患者5年生存率低(55.8 mo vs 76.9 mo, P = 0.012).
尽管前人认为NF-κB在结直肠癌的发生发展中起重要作用, 课题组也观察到结直肠癌患者肠黏膜NF-κB p65的表达较无器质性肠道疾病患者肠黏膜增加, 但其表达强度并非之前文献报道的那么高, 也远不如UC患者肠黏膜表达强度, 课题组认为NF-κB p65为治疗UC的较好靶点, 但不认为抑制NF-κB p65的表达能从根本上治疗结直肠癌.
本文观察到结直肠癌患者肠黏膜核因子κB(nuclear factor κB, NF-κB)的表达较正常人肠黏膜增加, 但其表达强度并非之前文献报道的那么高, 且低于溃疡性结肠炎(ulcerative colitis, UC)患者, 因此课题组认为抑制NF-κB p65的表达可能是治疗UC的较好思路, 但不认为抑制NF-κB p65的表达能从根本上治疗结直肠癌.
刘杰民, 副主任医师, 贵州省人民医院消化内镜科
近年因受"西洋化"生活方式的影响, UC发病率与患病率日趋增加, 资料显示UC患者罹患结直肠癌的风险较高. 为降低UC恶变风险, 改善预后, 我们在前人的基础上研究NF-κB在UC与结直肠癌治疗中的意义.
Aranha等及Lü等研究显示结直肠癌组织较癌旁组织NF-κB的表达明显增加, 且其表达高低与病理学恶化程度正相关且与预后相关. NF-κB对指导结直肠癌治疗有价值.
NF-κB除了作为炎症反应的关键因子其在结直肠癌治疗中到底有多大的价值值得进一步研究从而指导临床应用.
NF-κB p65为治疗UC的较好靶点, 但不认为抑制NF-κB p65的表达能从根本上治疗结直肠癌.
本文为指导临床治疗, 提供了依据, 具有一定指导意义.
编辑:田滢 电编:闫晋利
| 1. | Loftus EV. Clinical epidemiology of inflammatory bowel disease: Incidence, prevalence, and environmental influences. Gastroenterology. 2004;126:1504-1517. [PubMed] [DOI] |
| 2. | Davies RJ, Miller R, Coleman N. Colorectal cancer screening: prospects for molecular stool analysis. Nat Rev Cancer. 2005;5:199-209. [PubMed] [DOI] |
| 3. | Itzkowitz SH, Harpaz N. Diagnosis and management of dysplasia in patients with inflammatory bowel diseases. Gastroenterology. 2004;126:1634-1648. [PubMed] [DOI] |
| 4. | Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut. 2001;48:526-535. [PubMed] [DOI] |
| 5. | Gilmore TD, Kalaitzidis D, Liang MC, Starczynowski DT. The c-Rel transcription factor and B-cell proliferation: a deal with the devil. Oncogene. 2004;23:2275-2286. [PubMed] [DOI] |
| 6. | Lee SY, Cho JS, Yuk DY, Moon DC, Jung JK, Yoo HS, Lee YM, Han SB, Oh KW, Hong JT. Obovatol enhances docetaxel-induced prostate and colon cancer cell death through inactivation of nuclear transcription factor-kappaB. J Pharmacol Sci. 2009;111:124-136. [PubMed] [DOI] |
| 7. | Fantini MC, Pallone F. Cytokines: from gut inflammation to colorectal cancer. Curr Drug Targets. 2008;9:375-380. [PubMed] [DOI] |
| 9. | 王全胜, 张晓丽, 王玉梅, 张阿丽, 邓安国, 朱忠华, Florian Lang, 冯玉锡. 高糖通过血清和糖皮质激素诱导的蛋白激酶1通路促进人近端肾小管上皮细胞合成纤连蛋白. 中华肾脏病杂志. 2005;21:218-222. |
| 10. | Ekbom A, Helmick CG, Zack M, Holmberg L, Adami HO. Survival and causes of death in patients with inflammatory bowel disease: a population-based study. Gastroenterology. 1992;103:954-960. [PubMed] |
| 12. | Karin M, Cao Y, Greten FR, Li ZW. NF-kappaB in cancer: from innocent bystander to major culprit. Nat Rev Cancer. 2002;2:301-310. [PubMed] [DOI] |
| 13. | Häcker H, Karin M. Regulation and function of IKK and IKK-related kinases. Sci STKE. 2006;2006:re13. [PubMed] |
| 14. | Szlosarek P, Charles KA, Balkwill FR. Tumour necrosis factor-alpha as a tumour promoter. Eur J Cancer. 2006;42:745-750. [PubMed] [DOI] |
| 15. | Wang W, Abbruzzese JL, Evans DB, Larry L, Cleary KR, Chiao PJ. The nuclear factor-kappa B RelA transcription factor is constitutively activated in human pancreatic adenocarcinoma cells. Clin Cancer Res. 1999;5:119-127. [PubMed] |
| 16. | Tai DI, Tsai SL, Chang YH, Huang SN, Chen TC, Chang KS, Liaw YF. Constitutive activation of nuclear factor kappaB in hepatocellular carcinoma. Cancer. 2000;89:2274-2281. [PubMed] [DOI] |
| 17. | Skrzycki M, Scibior-Bentkowska D, Podsiad M, Czeczot H. [Protein level of transcription factors AP-1 and NF-kappaB in selected human gastrointestinal tract tumors]. Pol Merkur Lekarski. 2008;25:510-515. [PubMed] |
| 18. | Kucharczak J, Simmons MJ, Fan Y, Gélinas C. To be, or not to be: NF-kappaB is the answer--role of Rel/NF-kappaB in the regulation of apoptosis. Oncogene. 2003;22:8961-8982. [PubMed] [DOI] |
| 19. | Luo JL, Kamata H, Karin M. IKK/NF-kappaB signaling: balancing life and death--a new approach to cancer therapy. J Clin Invest. 2005;115:2625-2632. [PubMed] |
| 20. | Skrzycki M, Majewska M, Podsiad M, Czeczot H. Expression and activity of superoxide dismutase isoenzymes in colorectal cancer. Acta Biochim Pol. 2009;56:663-670. [PubMed] |
| 21. | Lindholm PF, Bub J, Kaul S, Shidham VB, Kajdacsy-Balla A. The role of constitutive NF-kappaB activity in PC-3 human prostate cancer cell invasive behavior. Clin Exp Metastasis. 2000;18:471-479. [PubMed] |
| 22. | Wang S, Liu Z, Wang L, Zhang X. NF-kappaB signaling pathway, inflammation and colorectal cancer. Cell Mol Immunol. 2009;6:327-334. [PubMed] |
| 23. | Karin M. NF-kappaB and cancer: mechanisms and targets. Mol Carcinog. 2006;45:355-361. [PubMed] |
| 24. | Ban JO, Lee HS, Jeong HS, Song S, Hwang BY, Moon DC, Yoon do Y, Han SB, Hong JT. Thiacremonone augments chemotherapeutic agent-induced growth inhibition in human colon cancer cells through inactivation of nuclear factor-{kappa}B. Mol Cancer Res. 2009;7:870-879. [PubMed] [DOI] |
| 25. | Kim SM, Lee SY, Yuk DY, Moon DC, Choi SS, Kim Y, Han SB, Oh KW, Hong JT. Inhibition of NF-kappaB by ginsenoside Rg3 enhances the susceptibility of colon cancer cells to docetaxel. Arch Pharm Res. 2009;32:755-765. [PubMed] [DOI] |
| 26. | Greten FR, Eckmann L, Greten TF, Park JM, Li ZW, Egan LJ, Kagnoff MF, Karin M. IKKbeta links inflammation and tumorigenesis in a mouse model of colitis-associated cancer. Cell. 2004;118:285-296. [PubMed] [DOI] |
| 27. | Zhang J, Stirling B, Temmerman ST, Ma CA, Fuss IJ, Derry JM, Jain A. Impaired regulation of NF-kappaB and increased susceptibility to colitis-associated tumorigenesis in CYLD-deficient mice. J Clin Invest. 2006;116:3042-3049. [PubMed] [DOI] |
| 28. | Wang CY, Mayo MW, Baldwin AS. TNF- and cancer therapy-induced apoptosis: potentiation by inhibition of NF-kappaB. Science. 1996;274:784-787. [PubMed] |
| 29. | Lind DS, Hochwald SN, Malaty J, Rekkas S, Hebig P, Mishra G, Moldawer LL, Copeland EM, Mackay S. Nuclear factor-kappa B is upregulated in colorectal cancer. Surgery. 2001;130:363-369. [PubMed] [DOI] |
| 30. | Yoshihara H, De France JF. Deep temporal lobe projections to the nucleus of the diagonal band of Broca. Experientia. 1976;32:55-57. [PubMed] [DOI] |
| 31. | Rayet B, Gélinas C. Aberrant rel/nfkb genes and activity in human cancer. Oncogene. 1999;18:6938-6947. [PubMed] |
| 32. | Wang CY, Cusack JC, Liu R, Baldwin AS. Control of inducible chemoresistance: enhanced anti-tumor therapy through increased apoptosis by inhibition of NF-kappaB. Nat Med. 1999;5:412-417. [PubMed] [DOI] |
| 33. | Schottelius AJ, Dinter H. Cytokines, NF-kappaB, microenvironment, intestinal inflammation and cancer. Cancer Treat Res. 2006;130:67-87. [PubMed] [DOI] |
| 34. | Yu HG, Zhong X, Yang YN, Luo HS, Yu JP, Meier JJ, Schrader H, Bastian A, Schmidt WE, Schmitz F. Increased expression of nuclear factor-kappaB/RelA is correlated with tumor angiogenesis in human colorectal cancer. Int J Colorectal Dis. 2004;19:18-22. [PubMed] |
| 35. | Aranha MM, Borralho PM, Ravasco P, Moreira da Silva IB, Correia L, Fernandes A, Camilo ME, Rodrigues CM. NF-kappaB and apoptosis in colorectal tumourigenesis. Eur J Clin Invest. 2007;37:416-424. [PubMed] [DOI] |
| 36. | Lü Y, Liu L, Zhao P. [Expression of nuclear factor-kappa-B/P65 and fragile histidine triad in colorectal carcinoma and clinical significance thereof]. Zhonghua Yixue Zazhi. 2008;88:610-614. [PubMed] |
| 37. | Lee SD. [Immunohistochemical analysis of nuclear factor, p38, and cyclin D1 proteins in premalignant lesions and carcinomas of the colorectal mucosa]. Korean J Gastroenterol. 2008;52:359-367. [PubMed] |
| 38. | Kwon HC, Kim SH, Oh SY, Lee S, Kwon KA, Lee JH, Choi HJ, Park KJ, Lee HS, Roh MS. Clinicopathological significance of nuclear factor-kappa B, HIF-1 alpha, and vascular endothelial growth factor expression in stage III colorectal cancer. Cancer Sci. 2010;101:1557-1561. [PubMed] [DOI] |