修回日期: 2013-11-24
接受日期: 2013-11-29
在线出版日期: 2014-01-18
目的: 探讨蛋白激酶Cα(protein kinase Cα, PKCα)与核转录因子-κB(nuclear factor-kappaB, NF-κB)相关蛋白p50、p65在食管鳞癌(esophageal squamous cell carcinoma, ESCC)组织中的表达、临床意义以及两者之间的相关性.
方法: 应用组织芯片免疫组织化学检测50例食管鳞癌及配对的癌旁正常组织中PKCα、p50、p65蛋白的表达情况.
结果: 在新疆哈萨克族食管鳞癌组织中PKCα、NF-κB p50/p65的高表达率高于癌旁正常组织[PKCα: 23(46.0%) vs 4(8.0%); p50: 41(82.0%) vs 24(48.0%); p65: 28(56.0%) vs 18(36.0%), P = 1.9×10-5, 3.7×10-4, 0.045], PKCα的表达与分化有关(P = 0.030), p50与淋巴结转移有关(P = 0.042), p65的表达与食管癌的分化及浸润深度有关(P = 0.015, 0.042). 进一步分析发现PKCα与p50、p65在食管鳞癌中的表达呈正相关(p50: r = 0.435, P = 4.5×10-6; p65: r = 0.626, P = 1×10-6).
结论: 在新疆哈萨克族食管癌中PKCα与NF-κB的激活及其相互作用并可能通过炎症促进食管癌的浸润和转移.
核心提示: 本研究发现蛋白激酶Cα(protein kinase Cα, PKCα)、核转录因子-κB(nuclear factor-κB, NF-κB)相关蛋白p50、p65在新疆哈萨克族食管癌组织中的表达均明显高于癌旁正常组织. PKCα蛋白的高表达与中低分化食管癌组织有关; p50蛋白的高表达与食管癌组织淋巴结转移有关; p65与食管癌组织中低分化及深层浸润有关. PKCα蛋白表达与p50及p65蛋白表达为正相关系.
引文著录: 庞雪莲, 崔晓宾, 李肃, 金静, 梁伟华, 李锋, 陈云昭. PKCα与NF-κB p50/p65在哈萨克族食管癌中的表达及意义. 世界华人消化杂志 2014; 22(2): 227-232
Revised: November 24, 2013
Accepted: November 29, 2013
Published online: January 18, 2014
AIM: To analyze the expression of protein kinase Cα (PKCα) and nuclear factor-kappa B (NF-κB) p50/p65 proteins in esophageal squamous cell carcinoma (ESCC) in Kazakh patients and to analyze their clinical significance.
METHODS: Immunohistochemistry was used to detect the expression of PKCα and NF-κB p50/p65 in 50 ESCC specimens and matched tumor-adjacent normal tissues.
RESULTS: The positive rates of PKCα and NF-κB p50/p65 proteins in ESCC were significantly higher than those in adjacent normal tissues (PKCα: 46.0% vs 8.0%; p50: 82.0% vs 48.0%; p65: 56.0% vs 36.0%, P = 1.9 × 10-5, 3.7 × 10-4 and 0.045, respectively). The expression of PKCα protein was closely correlated with ESCC differentiation (P = 0.030), p50 expression was correlated with metastasis (P = 0.042), and p65 expression was significantly correlated with differentiation and invasion (P = 0.015 and 0.042, respectively). PKCα expression had a positive correlation with p50 and p65 expression in ESCC (p50: r = 0.435, P = 4.5 × 10-6; p65: r = 0.626, P = 1 × 10-6).
CONCLUSION: The interaction of PKCα with NF-κB signal pathway may be involved in the invasion and metastasis of ESCC in Kazakh patients.
- Citation: Pang XL, Cui XB, Li S, Jin J, Liang WH, Li F, Chen YZ. Clinical significance of expression of PKCα and NF-κB p50/p65 in esophageal squamous cell carcinoma in Kazakh patients. Shijie Huaren Xiaohua Zazhi 2014; 22(2): 227-232
- URL: https://www.wjgnet.com/1009-3079/full/v22/i2/227.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i2.227
食管癌是一种世界范围内常见的消化系统恶性肿瘤, 我国是食管癌高发国家, 也是死亡率最高的国家. 食管癌的发病率及死亡率具有明显的民族差异, 哈萨克族食管癌的检出率明显高于同地区的汉族、维族等其他民族, 食管癌的发生与吸烟、饮酒、饮食习惯及基因多态性密切相关[1]. 因此, 研究哈萨克族食管癌患者的基因表达, 对其发病机制阐明具有重要意义. 蛋白激酶C(protein kinase C, PKC)是存在于哺乳动物细胞胞浆内的脂质依赖性丝氨酸/苏氨酸蛋白激酶, 至少包括12种亚型, PKCα是经典型PKC家族成员, PKC与多个细胞信号通路相关, 对细胞的增殖、分化和生存具有重要调控作用[2], 并且能被食管癌的易感基因PLCE1[3]间接激活[4,5]. 另外, 核转录因子-κB(nuclear factor-κB, NF-κB)是一类关键性的核转录因子, 通常以二聚体非活性形式存在于几乎所有类型的细胞中, p50和p65是组成NF-κB重要的二聚体成员, 当刺激IKK磷酸化之后, 使IκB降解导致NF-κB激活, 从而调节细胞的增殖、转移及血管生成[6,7]. 在经过CD3和CD28刺激的T淋巴细胞中PKCα通过调节PKCθ使IKK活化, 随之激活NF-κB[8]. 又有研究报道, 在293T细胞和Hela细胞中抑制PKCδ表达可抑制NF-κB的激活[9]. 基于以上的研究, 我们提出: 在新疆哈萨克族食管癌的发生发展中, 是否也存在PKCα与NF-κB的相互作用并通过炎症促进食管癌的浸润和转移. 因此我们检测PKCα与NF-κB相关蛋白p50、p65在新疆哈萨克族食管癌中的表达情况, 并分析三者蛋白表达与食管癌临床病理特征间的关系, 以及PKCα、p50和p65蛋白表达之间的相关性, 为深入研究食管癌的发生、发展机制提供理论依据.
选择石河子大学医学院第一附属医院、伊犁友谊医院、自治区人民医院1984-2010年50例术前未经任何治疗的食管癌手术标本, 选取距离癌组织边缘≥5 cm处食管组织切缘标本作为"正常"对照, 由两名资深病理医生确诊. 按TNM标准对肿瘤进行病理分型. 50例全部为食管鳞癌组织, 其中病理分型高分化14例, 中低分化36例, 有淋巴结转移29例, 肿瘤浸润深度超过深肌层24例(表1). 免疫组织化学SP试剂盒及Envision试剂盒均购自北京中杉金桥公司; DAB显色剂购自Dako公司; PKCα、NF-κB p65/p50抗体分别为: 鼠抗人PKCα单抗(1:50稀释, Santa Cruz公司); 兔抗人p50多抗(1:50稀释, 福州迈新公司); 鼠抗人p65单抗(1:50稀释, Santa Cruz公司).
| 临床特征 | 患者 |
| n | 50 |
| 性别n(%) | |
| 男 | 33(66.0) |
| 女 | 17(34.0) |
| 年龄(岁)n(%) | |
| <65 | 31(62.0) |
| ≥65 | 19(38.0) |
| 中位年龄(岁) | 59 |
| 年龄范围(岁) | 36-75 |
| 分化n(%) | |
| 高分化 | 14(28.0) |
| 中低分化 | 36(72.0) |
| 浸润深度n(%) | |
| T1-T2 | 26(52.0) |
| T3-T4 | 24(48.0) |
| 淋巴结转移n(%) | |
| 无 | 21(42.0) |
| 有 | 29(58.0) |
| TNM分期n(%) | |
| I/II | 32(64.0) |
| III/IV | 18(36.0) |
应用免疫组织化学SP法及Envision法进行染色. Minicore组织芯片仪(法国Alphelys 公司)制作组织芯片, 4-5 μm连续切片, 60 ℃烘箱烤片3 h. 切片常规二甲苯脱蜡, 梯度乙醇水化, 3%甲醛H2O2溶液消除内源性过氧化物酶活性, Tris-EDTA微波抗原修复, 滴加150 μL一抗(空白对照组滴加PBS), 放入4 ℃冰箱过夜. p50实验组滴加Envision工作液, PKCα及p65实验组滴加SP工作液(各步间隔PBS缓冲液震洗2次×5 min). DAB(二氨基联苯胺)显色, 苏木素复染, 酸乙醇分化, 脱水、透明、中性树胶封片. 阳性细胞为明显可辨的黄色或棕黄色. 由两位资深病理医师采用双盲法分别观察着色范围和染色强度. 光学显微镜下全视野观察, 按阳性细胞范围在肿瘤细胞内所占比例分为4个分值, 染色比例<5%视为0分, 5%-25%为1分, 26%-50%为2分; 50%-75%为3分, >75%者为4分. 染色强度判定: 不显色或显色不清为0分, 浅黄色为1分, 棕黄色为2分, 深棕色为3分. 综合积分按公式计算: 综合积分 = 染色面积分数×染色强度分数. 评分<4分为低表达, ≥4分为高表达[10].
统计学处理 采用SPSS13.0软件对全部数据进行统计处理, 阳性率的比较采用χ2检验, 相关性分析采用Spearman相关分析. P<0.05为差异有统计学意义.
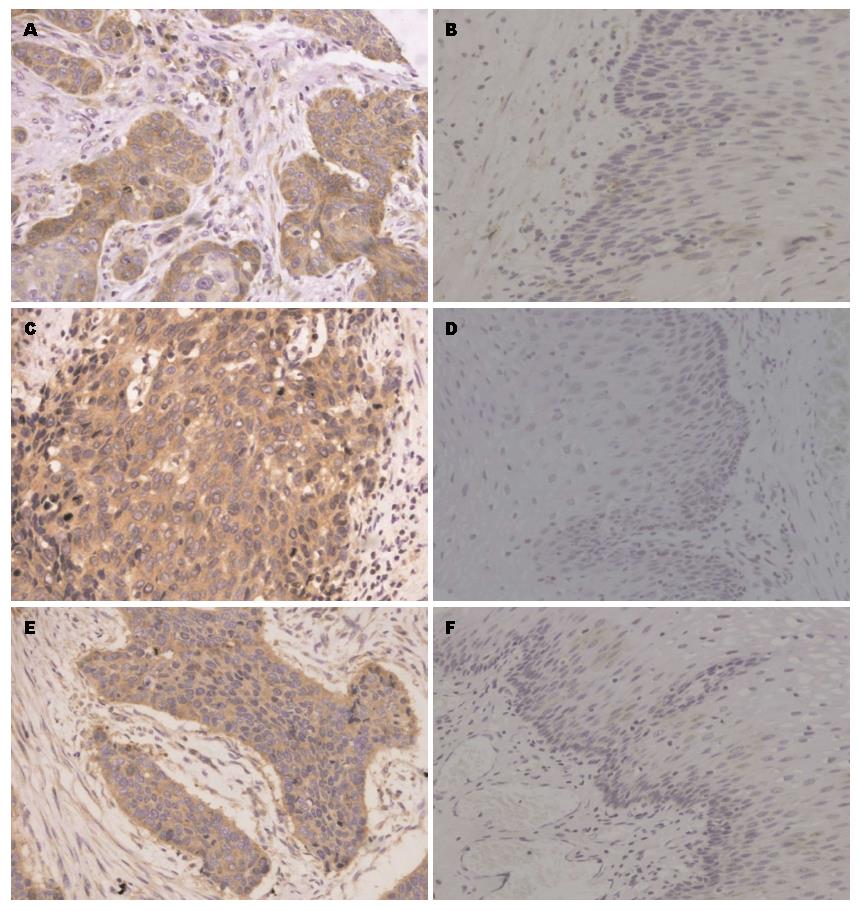
PKCα和p65阳性主要位于胞浆, p50阳性位于胞浆和/或胞核(图1). PKCα在癌组织中的高表达率为46.0%, 而在癌旁正常组织仅为8%, P = 1.9×10-5; 同样的, p50在癌组织中高表达率的82.0%, 而在癌旁正常组织仅为48.0%, P = 3.7×10-4; 另外, p65在癌组织的高表达率为56.0%, 在癌旁正常组织仅为36.0%, P = 0.045. 结果表明PKCα、p65和p50在食管癌组织中高表达率均高于癌旁正常组织(表1).
利用SPSS13.0软件分析PKCα、p50和p65的蛋白表达与食管癌临床病理参数之间的关系, 结果表明PKCα高表达与食管癌组织中低分化有关P = 0.030; p50的高表达与食管癌组织淋巴结转移有关P = 0.042; p65的高表达与食管癌组织中低分化及深层浸润有关P = 0.015和0.042; 提示PKCα与NF-κB p50/p65与食管癌的分化转移有密切关系(表2).
| n | 高表达 | |||
| PKCα | p50 | p65 | ||
| 食管癌组织 | 50 | 23(46.0) | 41(82.0) | 28(56.0) |
| 癌旁正常组织 | 50 | 4(8.0)b | 24(48.0)b | 18(36.0)a |
| 临床病理特征 | ||||
| 性别 | ||||
| 男 | 33 | 15(45.5) | 28(84.8) | 18(54.5) |
| 女 | 17 | 8(47.1) | 13(76.5) | 10(58.8) |
| 年龄(岁) | ||||
| <65 | 31 | 12(38.7) | 26(83.9) | 15(48.4) |
| ≥65 | 19 | 11(57.9) | 15(78.9) | 13(68.4) |
| 分化 | ||||
| 高分化 | 14 | 3(21.4) | 10(71.4) | 4(28.6) |
| 中低分化 | 36 | 20(55.6)c | 31(86.1) | 24(66.7)c |
| 浸润深度 | ||||
| 浅层 | 26 | 13(50.0) | 20(76.9) | 11(42.3) |
| 深层 | 24 | 10(41.7) | 21(87.5) | 17(70.8)g |
| 淋巴结转移 | ||||
| 无 | 21 | 8(38.1) | 14(66.7) | 10(47.6) |
| 有 | 29 | 15(51.7) | 27(93.1)e | 18(62.1) |
| TNM分期 | ||||
| TNMI/II | 32 | 17(53.1) | 27(84.4) | 18(56.3) |
| TNMIII/IV | 18 | 6(33.3) | 14(77.8) | 10(55.6) |
食管癌的发生涉及多因素、多阶段、多基因变异积累及相互作用的复杂过程. 有研究报道, 食管接受刺激后首先发生炎症反应, 紧接着炎症增生, 进一步炎症非典型增生, 最终发展为食管癌[11-13]. NF-κB是炎症相关肿瘤的重要调节因子, 其激活后参与炎症肿瘤的发生; NF-κB除了能被TNF-α、IL-1β及IL-8等炎症相关因子激活[14], 还能被PKC激活[15,16], PKC是佛波酯(12-O-tetradecanoylphorbol-13-acetate, TPA)发挥炎症作用的重要靶标之一, 从而导致TPA诱导的炎症相关肿瘤[17]; 可见PKC与NF-κB都是参与炎症肿瘤的重要因子, 但是目前关于PKC-NF-κB在食管癌中的激活机制研究中的尚未见报道. 我们的实验首次证明了PKCα与NF-κB在新疆哈萨克族食管癌中同时被激活, 并且PKCα蛋白表达与NF-κB相关蛋白表达存在显著的正相关关系, 我们推测食管癌发生中存在PKCα-NF-κB通路的激活.
我们的实验结果表明PKCα在食管癌组织中高表达率高于癌旁正常组织, 与此蛋白在肺癌细胞中的表达一致[18]. 此外, PKCα高表达与食管癌组织中、低分化有关, 证明PKCα参与调控食管癌细胞的增殖, 与Liu等[2]的研究结果一致, 他们研究发现敲除食管癌细胞PKC表达后促进了细胞凋亡, 并抑制了细胞的侵袭和转移能力. 在Barrett食管中PKC能激活Na+/H+(NHE)交换, 促进细胞的过度增殖反应[19]. 在膀胱平滑肌细胞中PKC通过缓慢上调c-Jun NH2-terminal kinase(JNK), 促进细胞增殖[20]. 表明在食管癌组织及其他组织细胞中PKC对增殖和转移具有促进作用.
本实验中p50和p65蛋白在食管癌组织中的高表达率明显高于癌旁正常组织, 并且p50的高表达与有淋巴结转移有关, p65的高表达与中低分化及浸润深度较深的组织有关. Kang等[21]的研究也表明NF-κB p50/p150在食管组织中的阳性率高于癌旁正常组织. 同样的, 在食管癌细胞系Ec109和Ec9706也存在p50及p65在胞质的表达[22]. 这些研究均证明NF-κB在食管癌中是被激活的. Su等[10]的研究结果显示NF-κB在食管癌组织中的高表达与淋巴结转移有关, 并且与Notch1的表达呈负相关. 在食管癌细胞中下调p65和IκB的磷酸化水平, 会导致Bcl2、MMP9的下调并伴随Bax和Caspase3蛋白的活化, 最终导致细胞侵袭能力减弱、增殖受抑制[23]. NF-κB p50/65在基底细胞增生、间变、原位癌和鳞状细胞癌均出现不同程度的阳性表达, 并随病变进展, 阳性表达率明显升高[24]. 以上研究证明NF-κB在食管癌组织中是被激活的并促进食管癌的发展.
我们课题组先前的实验已经证明了PLCE1在哈萨克族食管癌组织组织中高表达[25], 并且PLCE1是哈萨克族食管癌的易感基因[3], PLCE1是PLC家族成员之一, 其能够水解成生成肌醇1,4,5-三磷酸(inositol 1,4,5-trisphosphate, IP3)和甘油二脂(diacylglycerol, DAG)他们共同作用并通过IP3R可以激活PKC[4,5]. 然而, PLCE1也能够促进皮肤及结直肠癌肿瘤中炎症相关因子CXCL1/KC、CXCL1/2、COX-2的激活进一步促进肿瘤的发生[26,27]. 在血管平滑肌细胞中通过激活PKCα-TRAF6(tumor necrosis factor receptor-associated factor-6)-TAK1(tumor growth factor β-activating kinase-1)能促进IKKβ快速磷酸化进一步使NF-κB激活, 促进血管炎症发生[28]. 然而, NF-κB是调节炎症及先天性免疫一个关键因子, 已经在许多癌症中观察到存在异常的NF-κB调节[29]. 我们推测在食管癌组织中PLCE1通过PKC间接激活了NF-κB, PKCα与NF-κB相互作用并过炎症促进食管癌的浸润和转移.
总之, 在新疆哈萨克族食管癌中存在PKCα与NF-κB的激活及相互作用并可能通过炎症促进食管癌的浸润和转移. 在食管癌发生发展过程中可能存PLCE1-PKCα-NF-κB的激活, 共同促进食管癌的进展. PKCα、NF-κB可能成为食管癌预防和治疗的一个靶点.
新疆哈萨克族是食管癌的高发民族, 食管癌的发生与炎症密切相关. 核转录因子-κB(nuclear factor-κB, NF-κB)是炎症相关肿瘤的重要调节因子, 通常以非活性形式存在细胞中, 在T淋巴细胞中蛋白激酶Cα(protein kinase C, PKCα)能使NF-κB激活, 随之调节细胞的增殖、转移及血管生成并参与炎症相关肿瘤的发生.
程英升, 教授, 上海交通大学附属第六人民院放射科
食管癌的发生机制及其参与的信号通路是近几年的研究热点. NF-κB是炎症相关肿瘤的重要调节因子, PKC与包括NF-κB在内的多个信号通路相关, 那么食管癌中是否存在PKC-NF-κB通路激活促进食管癌的发生发展亟待研究.
刘曙光等证实在食管癌细胞中PKC1能够促进食管癌细胞的增殖、侵袭及转移.食管癌的易感基因PLCE1能够间接激活PKC. 在经过CD3和CD28刺激的T淋巴细胞中PKCα通过调节PKCθ使IKK活化, 随之激活NF-κB. 但是在哈萨克族食管癌中尚未见报道PKCα与NF-κB信号通路分子相关性的报道.
已有研究证明NF-κB除了能被TNF-α、白介素1β(interleukin-1β, IL-1β)及IL-8等炎症相关因子激活, 在T细胞中还能被PKC激活. 目前关于PKC-NF-κB在食管癌中的激活机制研究中的尚未见报道. 我们的研究首次证明了PKCα与NF-κB在新疆哈萨克族食管癌中同时被激活, 并且两者蛋白表达存在显著的正相关关系.
在新疆哈萨克族食管癌中可能存在PKCα与NF-κB的共同激活及相互作用并可能通过炎症作用促进食管癌的浸润和转移. 依据本实验的研究结果, 通过多中心大样本验证, PKC、NF-κB可作为诊断及判断食管癌预后的标志物.
本文选题新颖, 统计合理, 方法科学, 结论可靠, 具有一定指导意义.
编辑: 田滢 电编:闫晋利
| 1. | 刘 晓燕, 陈 卫刚, 郑 勇, 齐 翠花, 赵 强, 韩 玉胜, 窦 玉勤. 新疆伊犁哈萨克族自治州10年食管癌内镜诊断476例. 世界华人消化杂志. 2013;21:899-903. [DOI] |
| 2. | Liu SG, Wang BS, Jiang YY, Zhang TT, Shi ZZ, Yang Y, Yang YL, Wang XC, Lin DC, Zhang Y. Atypical protein kinase Cι (PKCι) promotes metastasis of esophageal squamous cell carcinoma by enhancing resistance to Anoikis via PKCι-SKP2-AKT pathway. Mol Cancer Res. 2011;9:390-402. [PubMed] [DOI] |
| 3. | Cui XB, Chen YZ, Pang XL, Liu W, Hu JM, Li SG, Yang L, Zhang WJ, Liu CX, Cao YW. Multiple polymorphisms within the PLCE1 are associated with esophageal cancer via promoting the gene expression in a Chinese Kazakh population. Gene. 2013;530:315-322. [PubMed] |
| 4. | Kelm MK, Weinberg RJ, Criswell HE, Breese GR. The PLC/IP 3 R/PKC pathway is required for ethanol-enhanced GABA release. Neuropharmacology. 2010;58:1179-1186. [PubMed] [DOI] |
| 6. | Mercurio F, Zhu H, Murray BW, Shevchenko A, Bennett BL, Li J, Young DB, Barbosa M, Mann M, Manning A. IKK-1 and IKK-2: cytokine-activated IkappaB kinases essential for NF-kappaB activation. Science. 1997;278:860-866. [PubMed] |
| 7. | Guo JL, Zheng SJ, Li YN, Jie W, Hao XB, Li TF, Xia LP, Mei WL, Huang FY, Kong YQ. Toxicarioside A inhibits SGC-7901 proliferation, migration and invasion via NF-κB/bFGF signaling. World J Gastroenterol. 2012;18:1602-1609. [PubMed] |
| 8. | Trushin SA, Pennington KN, Carmona EM, Asin S, Savoy DN, Billadeau DD, Paya CV. Protein kinase Calpha (PKCalpha) acts upstream of PKCtheta to activate IkappaB kinase and NF-kappaB in T lymphocytes. Mol Cell Biol. 2003;23:7068-7081. [PubMed] [DOI] |
| 9. | Ashida H, Nakano H, Sasakawa C. Shigella IpaH0722 E3 ubiquitin ligase effector targets TRAF2 to inhibit PKC-NF-κB activity in invaded epithelial cells. PLoS Pathog. 2013;9:e1003409. [PubMed] [DOI] |
| 10. | Su C, Chen Z, Luo H, Su Y, Liu W, Cai L, Wang T, Lei Y, Zhong B. Different patterns of NF-κB and Notch1 signaling contribute to tumor-induced lymphangiogenesis of esophageal squamous cell carcinoma. J Exp Clin Cancer Res. 2011;30:85. [PubMed] [DOI] |
| 11. | Wang LD, Yang HH, Fan ZM, Lü XD, Wang JK, Liu XL, Sun Z, Jiang YN, He X, Zhou Q. Cytological screening and 15 years' follow-up (1986-2001) for early esophageal squamous cell carcinoma and precancerous lesions in a high-risk population in Anyang County, Henan Province, Northern China. Cancer Detect Prev. 2005;29:317-322. [PubMed] |
| 12. | Cui X, Chen Y, Liu L, Li L, Hu J, Yang L, Liang W, Li F. Heterozygote of PLCE1 rs2274223 increases susceptibility to human papillomavirus infection in patients with esophageal carcinoma among the Kazakh populations. J Med Virol. 2013; Oct 11. [Epub ahead of print]. [PubMed] [DOI] |
| 13. | Wen DG, Wang SJ, Zhang LW, Zhou W, Yu WF, Wang XL. Natural history of esophageal and gastric cardia precursor by repetitive endoscope screening with 425 adults in a high-risk area in China. Cancer Epidemiol. 2009;33:108-112. [PubMed] [DOI] |
| 14. | Kuno K, Sukegawa K, Ishikawa Y, Orii T, Matsushima K. Acid sphingomyelinase is not essential for the IL-1 and tumor necrosis factor receptor signaling pathway leading to NFkB activation. Int Immunol. 1994;6:1269-1272. [PubMed] |
| 15. | Park KA, Byun HS, Won M, Yang KJ, Shin S, Piao L, Kim JM, Yoon WH, Junn E, Park J. Sustained activation of protein kinase C downregulates nuclear factor-kappaB signaling by dissociation of IKK-gamma and Hsp90 complex in human colonic epithelial cells. Carcinogenesis. 2007;28:71-80. [PubMed] [DOI] |
| 16. | Karin M. Signal transduction from cell surface to nucleus in development and disease. FASEB J. 1992;6:2581-2590. [PubMed] |
| 17. | Ikuta S, Edamatsu H, Li M, Hu L, Kataoka T. Crucial role of phospholipase C epsilon in skin inflammation induced by tumor-promoting phorbol ester. Cancer Res. 2008;68:64-72. [PubMed] |
| 19. | Fitzgerald RC, Omary MB, Triadafilopoulos G. Altered sodium-hydrogen exchange activity is a mechanism for acid-induced hyperproliferation in Barrett's esophagus. Am J Physiol. 1998;275:G47-G55. [PubMed] |
| 20. | Wazir R, Luo DY, Dai Y, Yue X, Tian Y, Wang KJ. Expression and proliferation profiles of PKC, JNK and p38MAPK in physiologically stretched human bladder smooth muscle cells. Biochem Biophys Res Commun. 2013;438:479-482. [PubMed] |
| 21. | Kang MR, Kim MS, Kim SS, Ahn CH, Yoo NJ, Lee SH. NF-kappaB signalling proteins p50/p105, p52/p100, RelA, and IKKepsilon are over-expressed in oesophageal squamous cell carcinomas. Pathology. 2009;41:622-625. [PubMed] [DOI] |
| 22. | Tian F, Zang WD, Hou WH, Liu HT, Xue LX. Nuclear factor-kB signaling pathway constitutively activated in esophageal squamous cell carcinoma cell lines and inhibition of growth of cells by small interfering RNA. Acta Biochim Biophys Sin (Shanghai). 2006;38:318-326. [PubMed] |
| 23. | Han Y, Guo XH, Zheng QF, Zhu YL, Fan YY, Zhang XY. Down-regulation of platelet-derived growth factor-D expression blockades NF-κB pathway to inhibit cell proliferation and invasion as well as induce apoptosis in esophageal squamous cell carcinoma. Mol Biol Rep. 2013;40:2473-2483. [PubMed] [DOI] |
| 24. | 李 健, 杜 芳, 齐 义军, 郭 涛, 冯 常炜, 秦 豫培, 何 欣, 范 宗民, 高 珊珊, 郭 花芹. 食管癌及癌前病变中NF-κBp65/p50蛋白的表达. 临床与实验病理学杂志. 2006;5:560-562. |
| 25. | Chen YZ, Cui XB, Hu JM, Zhang WJ, Li SG, Yang L, Shen XH, Liu CX, Pan QF, Yu SY. Overexpression of PLCE1 in Kazakh esophageal squamous cell carcinoma: implications in cancer metastasis and aggressiveness. APMIS. 2013;121:908-918. [PubMed] [DOI] |
| 26. | Li M, Edamatsu H, Kitazawa R, Kitazawa S, Kataoka T. Phospholipase Cepsilon promotes intestinal tumorigenesis of Apc(Min/+) mice through augmentation of inflammation and angiogenesis. Carcinogenesis. 2009;30:1424-1432. [PubMed] [DOI] |
| 27. | Oka M, Edamatsu H, Kunisada M, Hu L, Takenaka N, Sakaguchi M, Kataoka T, Nishigori C. Phospholipase Cε has a crucial role in ultraviolet B-induced neutrophil-associated skin inflammation by regulating the expression of CXCL1/KC. Lab Invest. 2011;91:711-718. [PubMed] |
| 28. | Doyon P, Servant MJ. Tumor necrosis factor receptor-associated factor-6 and ribosomal S6 kinase intracellular pathways link the angiotensin II AT1 receptor to the phosphorylation and activation of the IkappaB kinase complex in vascular smooth muscle cells. J Biol Chem. 2010;285:30708-30718. [PubMed] [DOI] |