修回日期: 2013-11-27
接受日期: 2013-11-29
在线出版日期: 2014-01-18
目的: 研究第10号染色体缺失的磷酸酶张力蛋白同源物基因(phosphatase and tensin homologue deleted on chromosome ten, PTEN)/磷脂酰肌醇3-激酶(phosphoinositide 3-kinase, PI3K)在肝缺血再灌注损伤中的调控作用及可能的机制.
方法: 夹闭C57BL/6J小鼠的肝动脉和门静脉以阻断肝脏向头侧肝叶血供90 min, 随后取下血管夹恢复血供, 建立肝缺血再灌注损伤模型. 实验分为四组: 正常对照组(sham)、缺血再灌注模型组(IR)、PTEN抑制剂bpv(HOpic)干预组(BPV+IR)、PI3K抑制剂wortmannin干预组(WM+IR). 检测小鼠血清ALT水平, 行肝组织病理检查, 以评估抑制PTEN/PI3K对肝脏IRI的影响. 采用Western blot法检测p-AKT、p-GSK3β的表达, 分析抑制PTEN/PI3K对其下游关键效应分子AKT/GSK3β磷酸化的调控. 采用定量PCR法检测炎性因子IL-12p40、IL-10及TNF-α的基因表达, 分析抑制PTEN/PI3K对TLR4介导的炎症反应的影响.
结果: 血清ALT及肝组织学改变均提示, 抑制PTEN使IR诱导的肝损害明显减轻, 相反, 抑制PI3K则使IRI加剧. 随着再灌注的发生, 缺血期去磷酸化的AKT/GSK3β逐渐恢复其磷酸化活性. 抑制PTEN增强了再灌注触发的AKT/GSK3β磷酸化, 而阻断PI3K则使其明显削弱. 阻断PTEN抑制了促炎基因IL-12p40、TNF-α的表达, 并使IL-12/IL-10比值下调, 该结果与抑制PI3K产生的效应完全相反.
结论: PTEN/PI3K在肝缺血再灌注损伤中发挥重要的调控作用, PTEN抑制和/或PI3K活化可能通过上调p-AKT/p-GSK3β以及抑制炎症反应明显减轻肝缺血再灌注损伤.
核心提示: 第10号染色体缺失的磷酸酶张力蛋白同源物基因(phosphatase and tensin homologue deleted on chromosome ten, PTEN)/磷脂酰肌醇3-激酶(phosphoinositide 3-kinase, PI3K)通过对再灌注触发的保护性自我调节的削弱或加强在肝缺血再灌注损伤中发挥关键的调控作用. 抑制PTEN和/或上调PI3K活性可显著增强AKT/GSK3生存信号, 抑制炎症反应, 减轻肝缺血再灌注损伤(hepatic ischemia reperfusion injury).
引文著录: 白丽, 任锋, 郑素军, 张晶, 陈煜, 段钟平. PTEN/PI3K在小鼠肝缺血再灌注损伤中的调控作用及机制. 世界华人消化杂志 2014; 22(2): 203-209
Revised: November 27, 2013
Accepted: November 29, 2013
Published online: January 18, 2014
AIM: To investigate the regulatory role of phosphatase and tensin homologue deleted on chromosome ten (PTEN)/phosphoinositide 3-kinase (PI3K) in hepatic ischemia-reperfusion injury (IRI) and the possible mechanism involved.
METHODS: C57BL6/J mice were subjected to 90 minutes of ischemia in the left/middle liver lobe followed by 6 hours of reperfusion. To investigate the role of PTEN/PI3K in hepatic ischemia-reperfusion injury in mice, specific PTEN inhibitor BPV (HOpic) and PI3K inhibitor wortmannin (WM) were injected intraperitoneally prior to the ischemia insult. Serum alanine aminotransferase (sALT) levels and histological changes of the liver were used to assess the liver damage. To explore the regulatory mechanism of PTEN/PI3K, we analyzed the phosphorylation of AKT and GSK3β, the key downstream effector molecules of PTEN/PI3K, by Western blot. In light of the importance of TLR4-triggered inflammatory response in IRI, we compared the gene expression of inflammatory cytokines IL-12p40, TNF-α and IL-10 before and after pretreatment.
RESULTS: Inhibition of PTEN protected the liver against ischemia-reperfusion injury, whereas liver damage was aggravated markedly by the administration of PI3K inhibitor, which were evidenced by sALT and liver histology [Salt IR: 7673 U/L ± 738.2 U/L, BPV+IR: 2682 U/L ± 367.0 U/L, WM+IR: 12670 U/L ± 1027.0 U/L, P < 0.01]. The dephosphorylated AKT/GSK3β by ischemia itself restored their phosphorylation activity during the reperfusion phase. Loss of PTEN enhanced the phosphorylation of AKT/GSK3β triggered by reperfusion, which was quite opposite to the effects induced by PI3K inhibition (p-AKT/Actin: IR, 0.52 ± 0.02; BPV+IR, 0.89 ± 0.05; WM+IR, 0.19 ± 0.01; p-GSK3β/GSK3β: IR, 0.61 ± 0.01; BPV+IR, 0.90 ± 0.03; WM+IR, 0.32 ± 0.03). PTEN blockade suppressed the gene expression of pro-inflammatory cytokines IL-12p40 and TNF-α, and the IL-12 p40/IL-10 ratio was reduced significantly. Conversely, PI3K inhibition boosted pro-inflammatory response strikingly.
CONCLUSION: PTEN inhibition and/or PI3K activation protect the liver against IRI via the up-regulation of AKT/GSK3β phosphorylation and the inhibition of the inflammatory response, which provides a new strategy for the treatment of liver IRI.
- Citation: Bai L, Ren F, Zheng SJ, Zhang J, Chen Y, Duan ZP. Regulatory role of PTEN/PI3K in hepatic ischemia-reperfusion injury in mice. Shijie Huaren Xiaohua Zazhi 2014; 22(2): 203-209
- URL: https://www.wjgnet.com/1009-3079/full/v22/i2/203.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i2.203
肝缺血再灌注损伤(hepatic ischemia reperfusion injury, HIRI)多见于休克、需要阻断肝脏血流的外科手术以及肝移植术等过程中, 是肝脏外科手术中常见的病理生理过程. 肝脏IRI包括缺血和再灌注两个时相, 涉及到肝实质细胞的凋亡/坏死、枯否细胞和中性粒细胞的活化、细胞因子和趋化因子的产生、活性氧(reactive oxygen species, ROS)的生成等, 其发生机制复杂, 迄今尚无明确认识[1-4]. 第10号染色体缺失的磷酸酶张力蛋白同源物基因(phosphatase and tensin homologue deleted on chromosome ten, PTEN)是迄今发现的第一个具有双重磷酸酶活性的抑癌基因, 是磷脂酰肌醇3激酶(phosphoinositide 3-kinase, PI3K)介导的信号转导通路的关键负反馈调节子. PTEN与PI3K协调作用, 影响着细胞的生长、分化、增殖、凋亡[5-10]. 近年来的研究表明, PTEN/PI3K与心、脑、肺等多种器官缺血再灌注损伤的发生有着广泛而密切的关系[11-15]. 然而, PTEN/PI3K在肝脏IRI中是否发挥关键作用及其可能通过何种途径调节着IRI还尚未明确. 本研究分别应用特异性PTEN抑制剂bpv(HOpic)和PI3K抑制剂wortmannin进行干预, 观察抑制PTEN/PI3K对IR诱导的肝损害的影响; 并分析了抑制PTEN/PI3K对其下游关键信号分子AKT、糖原合成酶3β(glycogen synthase kinase-3β, GSK3β)的磷酸化以及对Toll样受体-4(Toll-like receptor-4, TLR- 4)介导的炎症反应的调节作用.
健康♂C57BL/6J小鼠, 8-12周龄, 购自军事医学科学院实验动物中心. 普通饲养, 实验前12 h和实验期间禁食, 自由饮水. PTEN抑制剂bpv(HOpic)购自美国EMD Chemicals公司; PI3K抑制剂wortmannin购自Sigma公司; LPS购自Sigma公司; p-AKT、p-GSK3β、GSK3β、β-actin等兔抗鼠单克隆抗体以及辣根过氧化酶(horseradish peroxidase, HPR)偶联的羊抗兔多克隆抗体均购自美国Cell Signaling公司; ECL发光试剂盒购自美国Thermo Fisher Scientific公司; TRIzol、SuperScriptTM Ⅲ First-Strand Synthesis System、SYBR Green qPCR试剂盒均购自美国Invitrogen公司, 蛋白定量试剂盒购自美国Bio-Rad公司.
1.2.1 小鼠肝缺血再灌注损伤模型的建立: 参照文献[16]建立小鼠肝脏暖缺血再灌注损伤模型. C57BL/6J小鼠经异氟烷麻醉后, 注射肝素. 打开腹腔, 用无创性微血管夹夹闭肝动脉和门静脉以阻断肝脏左/中肝叶的血供. 缺血90 min后, 取下血管夹恢复血供. 于再灌注不同时间点处死小鼠, 收集肝组织标本以供分析.
1.2.2 实验分组: C57BL/6J小鼠随机分为假手术组(Sham)(6只)、IRI模型组(IR)(8只)、PTEN抑制剂bpv(HOpic)干预组(BPV+IR)(10只)以及PI3K抑制剂wortmannin干预组(WM+IR)(10只). PTEN抑制剂bpv(HOpic)溶于生理盐水中, 给药剂量为1 mg/kg, 于缺血前2 h腹腔注射. Wortmannin溶于DMSO/PBS中, 给药剂量为1 mg/kg, 于缺血前1 h腹腔注射. 于再灌注6 h处死小鼠, 收集血液和肝组织标本以供分析.
1.2.3 Western blot检测: 将约100 mg肝组织置于1 mL预冷的组织裂解液中, 立即利用电动组织匀浆器彻底匀浆, 然后于冰上静置30 min, 4 ℃、12000 r/min离心20 min, 收集上清液. 采用Bio-Rad Dc蛋白定量试剂盒测定上清液中的蛋白浓度, 按说明书进行操作. 取20 μg蛋白裂解液上样, 于12%的SDS-PAGE胶中分离蛋白. 转PVDF膜, 于一抗稀释液(1:1000稀释)中4 ℃孵育过夜. TBST洗膜3次, 每次10 min, 然后于二抗稀释液(1:2000稀释)中室温孵育1 h. TBST洗膜3次, ECL显影, 压片曝光. 利用Image J软件对Western blot条带进行量化处理.
1.2.4 实时荧光定量PCR检测: 采用TRIzol试剂提取肝组织总RNA, 利用分光光度计测定其浓度并定量. 利用SuperScriptTM Ⅲ First-Strand Synthesis System将2.5 μg总RNA逆转录为cDNA, 随后进行SYBR Green实时荧光定量PCR检测. 具体操作步骤按照试剂盒说明书进行. 所应用的引物序列见表1.
| 基因 | 方向 | 引物序列 |
| HPRT | 正向 | 5'-TCAACGGGGGACATAAAAGT-3' |
| 反向 | 5'-TGCATTGTTTTACCAGTGTCAA-3' | |
| IL-12p40 | 正向 | 5'-CAGCTTCTTCATCAGGGACAT-3' |
| 反向 | 5'-CTTGAGGGAGAAGTAGGAATGG-3' | |
| IL-10 | 正向 | 5'-ACTGCACCCACTTCCCAGT-3' |
| 反向 | 5'-TGTCCAGCTGGTCCTTTGTT-3' | |
| TNF-α | 正向 | 5'-GCCTCTTCTCATTCCTGCTTGT-3' |
| 反向 | 5'-TTGAGATCCATGCCGTTG-3' |
1.2.5 肝细胞损害检测: 采用全自动生化分析仪检测反映肝细胞损害程度的指标血清转氨酶水平.
统计学处理 所有数据以mean±SD表示, 采用One-way ANOVA或者Student t检验进行分析, 利用Graphpad Prism5.0软件包处理数据. P<0.05为差异有统计学意义.
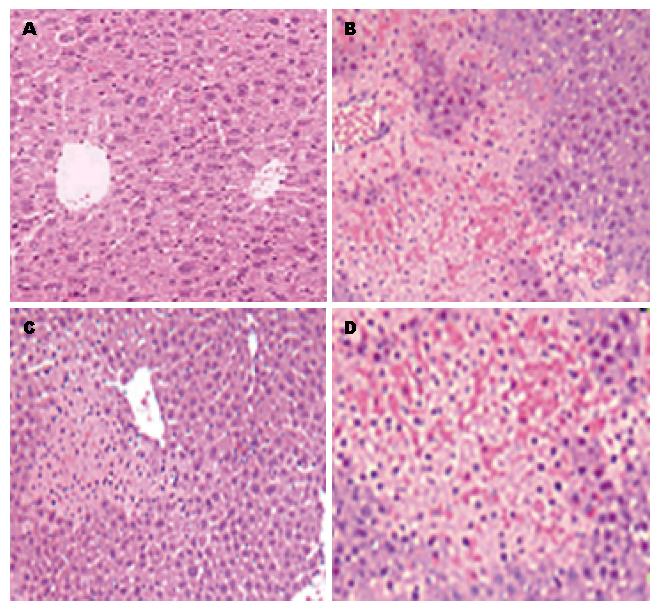
缺血再灌注可引起明显的肝损害, 使IR模型组小鼠的血清转氨酶水平升高至7673 U/L±738.2 U/L; 采用PTEN抑制剂bpv(HOpic)进行干预后, 小鼠的sALT水平较模型组出现明显回落, 可降至2682 U/L±367.0 U/L; 而PI3K抑制剂的应用则使小鼠的sALT水平较IR模型组显著升高, 达12670 U/L±1027.0 U/L; 各组差异均具有统计学意义(P<0.01)(表2). 从肝组织学改变也可以看出, 抑制PTEN后缺血再灌注诱导的肝损害明显减轻, 而抑制PI3K则使肝损害明显加剧(图1).
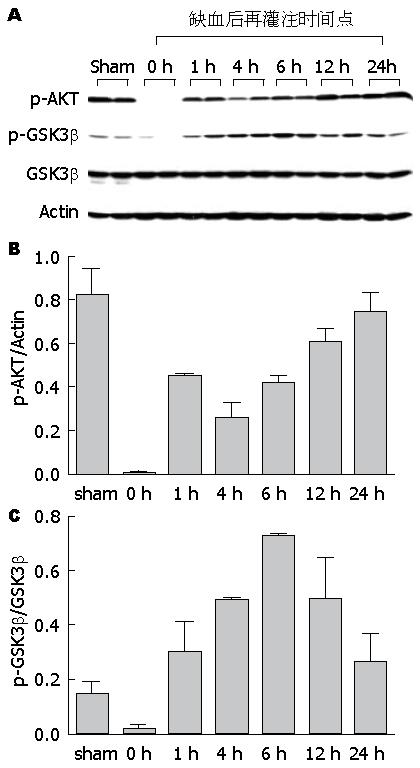
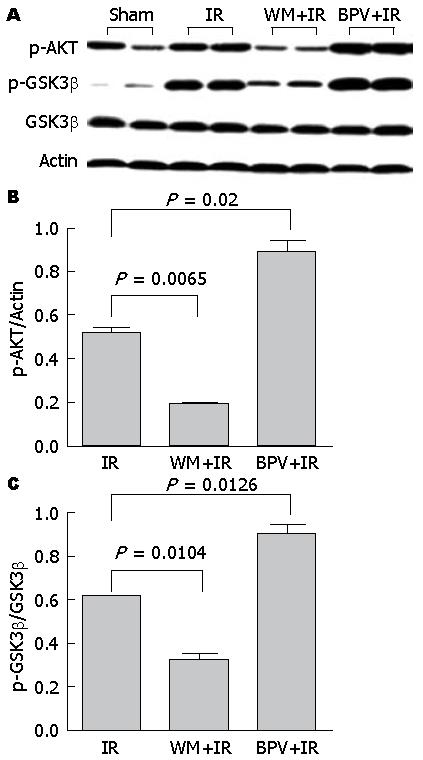
为探讨PTEN/PI3K调控肝缺血再灌注损伤的机制, 我们对其下游的关键效应分子AKT/GSK3β的磷酸化进行了分析. 将IRI模型组小鼠按照再灌注时间点分为0(即缺血期)、1、4、6、12、24 h六个亚组. 如图2中Western blot结果所示, 与假手术组相比, 缺血本身可致p-AKT表达显著降低, 但随着再灌注的发生, p-AKT表达逐渐增强, 至再灌注24 h时, p-AKT表达水平基本恢复到正常. 与p-AKT的表达类似, p-GSK3β水平也于缺血期降低, 于再灌注期逐渐升高, 其表达高峰在再灌注后6 h, 之后略有降低. 该结果表明, 肝缺血损伤可致AKT失活, GSK3β去磷酸化活化, 而在再灌注期, AKT活性呈逐渐恢复趋势, 而GSK3β则维持磷酸化失活状态. 分别应用PTEN抑制剂bpv(Hopic)以及PI3K抑制剂wortmannin进行体内干预后, 我们发现, BPV+IR干预组p-AKT和p-GSK3β的蛋白表达水平明显高于IR模型组, 与之相反, WM+IR干预组的p-AKT和p-GSK3β表达则明显低于IR模型组(IR、BPV+IR、WM+IR三组的p-AKT/Actin分别为: 0.52±0.02、0.89±0.05、0.19±0.01; p-GSK3β/GSK3β: 0.61±0.01、0.90±0.03、0.32±0.03)(图3). 这就表明, 抑制PTEN后AKT及其下游的GSK3β磷酸化均明显增强, 而抑制PI3K则对两个信号分子的磷酸化产生相反的影响. 因此, PTEN和PI3K很可能通过对磷酸化的控制对其下游关键信号分子AKT/GSK3β的活性产生相反的调控作用.
的表达; B, C: 利用Image J软件半定量p-AKT、p-GSK3β的表达.
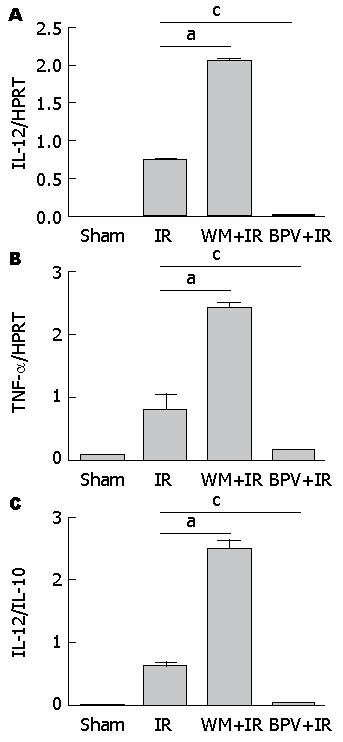
鉴于TLR4介导的炎症信号在肝缺血再灌注损伤中的重要作用, 我们还分析了PTEN/PI3K对肝组织炎症反应的影响. 定量PCR结果显示, 与IR组相比, 抑制PTEN可使肝组织中促炎基因IL-12p40、TNF-α的表达明显下调, IL-12p40/IL-10比值显著降低, 说明抑制PTEN后肝组织中的炎症反应向抗炎方向倾斜. 与之相反, 给予PI3K抑制剂wortmannin后, IL-12p40和TNF-α表达较干预前急剧升高, IL-12p40/IL-10比值明显上升, 说明抑制PI3K加强了炎症反应. 以上各组差异均有统计学意义(P<0.05)(图4).
肝脏IRI属于一个动态的发展进程, 主要包括两个阶段, 即局部缺血性攻击以及炎症介导的再灌注损伤. IRI的两个不同阶段具有独特的肝损害机制: 缺血性损伤是由糖原消耗、氧供缺乏及ATP耗竭引起的一种局灶性细胞代谢障碍过程, 可致实质细胞死亡; 而再灌注损伤中不仅存在代谢障碍, 还存在显著的炎性免疫反应, 涉及到直接及间接细胞毒性损伤[1,2]. 无论是缺血引起的细胞死亡还是再灌注诱导的细胞损伤均涉及到细胞生理平衡的破坏及功能的紊乱, 致使细胞的生长、增殖功能受抑, 而凋亡/坏死急剧增加. 因此, 促使功能失衡的细胞尽可能恢复生理平衡对于延缓或阻止肝脏IRI的发生具有重要的意义及临床应用价值.
磷酸化和脱磷酸化是调节细胞生长和增殖的主要机制, 保持这一过程正常的关键是维持激酶的平衡. PI3K是一种进化上保守的脂质磷酸激酶, 活化的PI3K可催化PIP2磷酸化为PIP3, 进而激活AKT. 磷酸化活化的p-AKT通过激活或抑制其下游多种靶蛋白, 如GSK3、NF-κB、mTOR等促进细胞生存、增殖, 因此, PI3K/AKT介导的信号通路被认为是重要的生存信号转导通路[8-10,17,18]. PI3K/AKT/GSK3信号转导通路受多种因子的调节, 其中PTEN为一个至关重要的负性调节因子[5-7]. PTEN的脂质磷酸酶活性可使PIP3去磷酸化转变为PIP2而失活, 继而降低AKT的磷酸化, 从而逆转并拮抗PI3K的作用. 因此, PTEN/PI3K之间的平衡在很大程度上决定着PIP3的水平以及对细胞生长、增殖的调控走向. PTEN抑制和/或PI3K活化使细胞内PIP3积聚, AKT持续活化, 从而促进细胞生存、增殖, 反之亦然[5-10,19-21].
鉴于PTEN/PI3K在维持细胞功能稳态方面的重要作用, 本研究分别采用PTEN抑制剂bpv(HOpic)和PI3K抑制剂wortmannin进行干预, 观察阻断PTEN/PI3K对肝缺血再灌注损伤的影响. 血清ALT和肝组织病理改变均提示, 抑制PTEN可使IR诱导的肝损伤明显缓解, 而抑制PI3K则产生与之截然相反的效应. 目前国内外关于PTEN在肝脏IRI中的作用及机制的报道还很少见. 我们的研究结果与国外Kamo等[22]的报道类似. 该研究发现, 利用小干扰RNA抑制PTEN可增强AKT/β-catenin/Foxo1信号, 促进细胞生存, 减轻肝脏IRI. 而PI3K抑制剂LY294002与PTEN siRNA联合应用则废除了后者引发的肝脏保护效应. 因此, 抑制PTEN和/或激活PI3K对于减轻或防止缺血再灌注诱导的肝损伤具有重要的意义.
为进一步分析PTEN/PI3K在肝脏IRI中的调控作用以及可能的机制, 我们对PTEN/PI3K的关键下游信号分子AKT及GSK3β的磷酸化活性变化进行了分析. 在我们的缺血再灌注肝损伤小鼠模型中, 缺血期去磷酸化的AKT于再灌注过程中逐渐恢复其磷酸化活性, 这就说明, 再灌注触发了一种"自我调控"机制, 这种保护性自身反应的功能是尽可能维持细胞的生理平衡, 从而缓解或抑制肝损伤. 近年来的研究已经证实了抑制GSK3β(使其磷酸化失活)所具有的肝脏保护效应[16,23,24]. 本研究中, AKT下游的关键效应分子GSK3β的磷酸化水平于再灌注过程中显著增强, 进一步证明了PI3K/AKT介导的生存信号所具有的肝脏保护作用.
应用PTEN抑制剂bpv(HOpic)后, AKT及其下游的GSK3β的磷酸化较IR组显著增强, 而给予PI3K抑制剂wortmannin后, AKT/GSK3β的磷酸化活性则明显减弱, 表明抑制PTEN可通过促使下游关键效应分子AKT及GSK3β磷酸化而大大加强再灌注触发的保护性自我调控机制. 与之相反, 抑制PI3K后阻断了AKT/GSK3β的磷酸化, 进而破坏了肝脏的自我调控功能, 加重了缺血再灌注诱导的肝损伤. 该结果对于肝脏IRI的预防及治疗具有重要的价值, 因为虽然IR过程中可以触发保护性的自我调控机制, 但这种代偿性的PI3K/AKT/GSK3信号较弱, 当损伤程度超过其可以代偿的范围时, 则无法抵御再灌注所引起的肝损害.
肝脏IRI, 尤其是再灌注损伤过程与炎性免疫反应密切相关. TLR4活化是触发肝脏IR免疫反应的关键事件[1,2,25,26]. 而抑制PTEN活性, 从而促使PI3K/AKT信号上调, 可提供一种负性TLR4调节反馈, 以抑制NF-κB/IRF3活性, 最终抑制肝脏促炎基因表达[27,28]. 本研究中, 我们发现, 抑制PTEN后, 促炎基因IL-12p40、TNF-α的表达较IR组明显降低, 并且IL-12p40/IL-10的平衡向抗炎方向倾斜; 反之, 抑制PI3K则使促炎基因的表达急剧升高, IL-12p40/IL-10的平衡明显倾向于促炎方向. 因此, 利用药物或者其他干预措施下调PTEN或者上调PI3K/AKT活性, 可致TLR4/NF-κB的表达受阻、巨噬细胞介导的促炎反应减轻.
总之, PTEN/PI3K在肝缺血再灌注损伤中发挥关键的调控作用, 抑制PTEN可能通过上调促生存信号PI3K/AKT/GSK3的活性以及抑制炎症反应而减轻缺血再灌注损伤. 虽然再灌注可触发挽救性生存信号PI3K/AKT/GSK3的活化, 然而如无药物调控, 较弱的保护性自我调控功能并不足以抵抗再灌注损伤. 因此, 通过抑制PTEN和/或上调PI3K活性使失衡的PTEN/PI3K重新恢复平衡为肝脏IRI的治疗开辟了新的方向. 随着对PTEN/PI3K上游调控信号和下游底物分子的进一步阐明, PTEN/PI3K信号转导通路与肝脏IRI的关系也将更加明朗化, 将有助于我们更深入地理解肝脏IRI发生发展的本质, 为其治疗提供新的策略.
磷脂酰肌醇3-激酶(phosphoinositide 3-kinase, PI3K)/AKT是细胞内重要的生存信号转导通路, 第10号染色体缺失的磷酸酶张力蛋白同源物基因(phosphatase and tensin homologue deleted on chromosome ten, PTEN)为该通路的关键负反馈调节子. 近年来的研究表明, PTEN/PI3K与肝缺血再灌注损伤(hepatic ischemia reperfusion injury, HIRI)的发生密切相关. 然而, PTEN/PI3K在肝脏IRI中的调控作用及其可能的机制尚未明确.
门秀丽, 教授, 河北联合大学(原华北煤炭医学院)病理生理学教研室
肝缺血再灌注损伤包括缺血和再灌注两个时相, 发病机制非常复杂, 且缺乏特异、有效的治疗手段. 因此, 深入探讨肝脏IRI发生的细胞和分子机制, 以期寻求有效治疗策略成为该领域研究的重心及热点.
Kamo等报道, 利用小干扰RNA抑制PTEN可上调AKT介导的生存信号, 减轻肝脏IRI. 而PI3K抑制剂LY294002与PTEN siRNA联合应用则废除了后者引发的肝脏保护效应.
本文从维持细胞生理平衡的角度研究PTEN/PI3K在肝缺血再灌注损伤中的调控作用及可能的机制. 研究结果为肝脏IRI发病机制和治疗研究提供了新的方向.
除肝移植外, 目前尚无针对肝缺血再灌注损伤的确切有效的干预措施. 通过干预PTEN/PI3K信号(抑制PTEN和/或上调PI3K活性)可促进细胞生存、增殖, 抑制炎症反应, 减轻肝缺血再灌注损伤. 重新使失衡的PTEN/PI3K恢复平衡为肝脏IRI的治疗开辟了新的方向.
本文内容较新颖, 实验证据较充足, 结论准确, 可为临床防治肝脏缺血再灌注损伤提供一定的实验依据.
编辑: 田滢 电编:闫晋利
| 1. | Zhai Y, Busuttil RW, Kupiec-Weglinski JW. Liver ischemia and reperfusion injury: new insights into mechanisms of innate-adaptive immune-mediated tissue inflammation. Am J Transplant. 2011;11:1563-1569. [PubMed] [DOI] |
| 2. | Zhai Y, Petrowsky H, Hong JC, Busuttil RW, Kupiec-Weglinski JW. Ischaemia-reperfusion injury in liver transplantation--from bench to bedside. Nat Rev Gastroenterol Hepatol. 2013;10:79-89. [PubMed] [DOI] |
| 3. | Tsung A, Klune JR, Zhang X, Jeyabalan G, Cao Z, Peng X, Stolz DB, Geller DA, Rosengart MR, Billiar TR. HMGB1 release induced by liver ischemia involves Toll-like receptor 4 dependent reactive oxygen species production and calcium-mediated signaling. J Exp Med. 2007;204:2913-2923. [PubMed] |
| 4. | Lentsch AB, Kato A, Yoshidome H, McMasters KM, Edwards MJ. Inflammatory mechanisms and therapeutic strategies for warm hepatic ischemia/reperfusion injury. Hepatology. 2000;32:169-173. [PubMed] |
| 5. | Chung JH, Eng C. Nuclear-cytoplasmic partitioning of phosphatase and tensin homologue deleted on chromosome 10 (PTEN) differentially regulates the cell cycle and apoptosis. Cancer Res. 2005;65:8096-8100. [PubMed] |
| 6. | Mocanu MM, Yellon DM. PTEN, the Achilles' heel of myocardial ischaemia/reperfusion injury? Br J Pharmacol. 2007;150:833-838. [PubMed] |
| 8. | Vivanco I, Sawyers CL. The phosphatidylinositol 3-Kinase AKT pathway in human cancer. Nat Rev Cancer. 2002;2:489-501. [PubMed] |
| 9. | Song G, Ouyang G, Bao S. The activation of Akt/PKB signaling pathway and cell survival. J Cell Mol Med. 2005;9:59-71. [PubMed] |
| 10. | Carracedo A, Pandolfi PP. The PTEN-PI3K pathway: of feedbacks and cross-talks. Oncogene. 2008;27:5527-5541. [PubMed] [DOI] |
| 11. | Keyes KT, Xu J, Long B, Zhang C, Hu Z, Ye Y. Pharmacological inhibition of PTEN limits myocardial infarct size and improves left ventricular function postinfarction. Am J Physiol Heart Circ Physiol. 2010;298:H1198-H1208. [PubMed] [DOI] |
| 12. | Ruan H, Li J, Ren S, Gao J, Li G, Kim R, Wu H, Wang Y. Inducible and cardiac specific PTEN inactivation protects ischemia/reperfusion injury. J Mol Cell Cardiol. 2009;46:193-200. [PubMed] [DOI] |
| 13. | Shi GD, OuYang YP, Shi JG, Liu Y, Yuan W, Jia LS. PTEN deletion prevents ischemic brain injury by activating the mTOR signaling pathway. Biochem Biophys Res Commun. 2011;404:941-945. [PubMed] [DOI] |
| 14. | Lai JP, Bao S, Davis IC, Knoell DL. Inhibition of the phosphatase PTEN protects mice against oleic acid-induced acute lung injury. Br J Pharmacol. 2009;156:189-200. [PubMed] [DOI] |
| 15. | Tu Y, Wan L, Fan Y, Wang K, Bu L, Huang T, Cheng Z, Shen B. Ischemic postconditioning-mediated miRNA-21 protects against cardiac ischemia/reperfusion injury via PTEN/Akt pathway. PLoS One. 2013;8:e75872. [PubMed] [DOI] |
| 16. | Ren F, Duan Z, Cheng Q, Shen X, Gao F, Bai L, Liu J, Busuttil RW, Kupiec-Weglinski JW, Zhai Y. Inhibition of glycogen synthase kinase 3 beta ameliorates liver ischemia reperfusion injury by way of an interleukin-10-mediated immune regulatory mechanism. Hepatology. 2011;54:687-696. [PubMed] [DOI] |
| 17. | Li B, Desai SA, MacCorkle-Chosnek RA, Fan L, Spencer DM. A novel conditional Akt 'survival switch' reversibly protects cells from apoptosis. Gene Ther. 2002;9:233-244. [PubMed] |
| 18. | François S, El Benna J, Dang PM, Pedruzzi E, Gougerot-Pocidalo MA, Elbim C. Inhibition of neutrophil apoptosis by TLR agonists in whole blood: involvement of the phosphoinositide 3-kinase/Akt and NF-kappaB signaling pathways, leading to increased levels of Mcl-1, A1, and phosphorylated Bad. J Immunol. 2005;174:3633-3642. [PubMed] |
| 19. | Günzl P, Schabbauer G. Recent advances in the genetic analysis of PTEN and PI3K innate immune properties. Immunobiology. 2008;213:759-765. [PubMed] [DOI] |
| 20. | Stocker H, Andjelkovic M, Oldham S, Laffargue M, Wymann MP, Hemmings BA, Hafen E. Living with lethal PIP3 levels: viability of flies lacking PTEN restored by a PH domain mutation in Akt/PKB. Science. 2002;295:2088-2091. [PubMed] |
| 22. | Kamo N, Ke B, Busuttil RW, Kupiec-Weglinski JW. PTEN-mediated Akt/β-catenin/Foxo1 signaling regulates innate immune responses in mouse liver ischemia/reperfusion injury. Hepatology. 2013;57:289-298. [PubMed] [DOI] |
| 23. | 任 锋, 张 海燕, 朴 正福, 郑 素军, 陈 煜, 武 志明, 段 钟平. 糖原合成酶激酶-3β在肝脏热缺血再灌注损伤中的作用及其干预. 中华肝脏病杂志. 2011;19:547-551. |
| 24. | 任 锋, 张 海燕, 朴 正福, 郑 素军, 陈 煜, 陈 德喜, 段 钟平. 抑制糖原合成酶激酶3活性对Toll样受体4介导肝脏炎症反应的调节作用. 中华肝脏病杂志. 2012;20:693-697. |
| 25. | Zhai Y, Shen XD, O'Connell R, Gao F, Lassman C, Busuttil RW, Cheng G, Kupiec-Weglinski JW. Cutting edge: TLR4 activation mediates liver ischemia/reperfusion inflammatory response via IFN regulatory factor 3-dependent MyD88-independent pathway. J Immunol. 2004;173:7115-7119. [PubMed] |
| 26. | Tsung A, Sahai R, Tanaka H, Nakao A, Fink MP, Lotze MT, Yang H, Li J, Tracey KJ, Geller DA. The nuclear factor HMGB1 mediates hepatic injury after murine liver ischemia-reperfusion. J Exp Med. 2005;201:1135-1143. [PubMed] |
| 27. | Fukao T, Koyasu S. PI3K and negative regulation of TLR signaling. Trends Immunol. 2003;24:358-363. [PubMed] |