修回日期: 2013-11-23
接受日期: 2013-11-29
在线出版日期: 2014-01-18
目的: 探讨前列腺素E1(prostaglandin E1, PGE1)在家兔肝纤维化模型基础上行肝动脉栓塞后肝纤维化进展的防治.
方法: 选取四氯化碳(CCl4)肝纤维化动物模型家兔30只, 模拟肝癌行肝右动脉碘化油栓塞, 随机分为3组: A组经导管向肝右动脉注入生理盐水1 mL; B组经导管向肝右动脉注入碘化油1 mL; C组经导管向肝右动脉注入碘化油1 mL+PGE1 0.2 mL, 术后第2、4、6、8天抽取静脉血行肝纤维化血清学检测, 术后第8天处死动物行肝组织病理学检测.
结果: 建立家兔肝纤维化模型, 行肝动脉栓塞术中加入PGE1显著降低血清学透明质酸(hyaluronic acid, HA)、层粘连蛋白(laminin, LN)、Ⅲ型前胶原(procollagen Ⅲ, PCⅢ)及Ⅳ型胶原(collagen Ⅳ, Ⅳ-C)水平及减轻肝组织病理学损伤.
结论: PGE1对肝纤维化肝动脉碘化油栓塞术后肝纤维化进展具有保护作用.
核心提示: 成功建立CCl4家兔肝纤维化动物模型并模拟肝癌行肝动脉化疗栓塞术(transcatheter arterial chemoembolization), 术中加入前列腺素E1(prostaglandin E1, PGE1). 根据血清学、病理学结果显示, PGE1能显著降低血清透明质酸、层粘连蛋白Ⅳ型胶原、Ⅲ型前胶原水平及减轻肝组织病理损伤. 因此PGE1对肝纤维化肝动脉碘化油栓塞术后肝纤维化进展具有保护作用.
引文著录: 陈宝祥, 曹海利, 郭若涵, 金书强, 白彬. 前列腺素E1对肝动脉栓塞后肝纤维化进展的防治. 世界华人消化杂志 2014; 22(2): 164-170
Revised: November 23, 2013
Accepted: November 29, 2013
Published online: January 18, 2014
AIM: To investigate whether prostaglandin E1 (PGE1) has preventive and therapeutic effects on liver fibrosis progression after transcatheter hepatic arterial embolization in a rabbit model.
METHODS: Thirty rabbits were used to induce liver fibrosis with carbon tetrachloride (CCl4), and transcatheter right hepatic arterial embolization was performed. The rabbits were divided into three groups randomly (groups A, B and C) and infused with 1 mL of 0.9% saline, 1 mL of lipiodol and 1 ml of lipiodol plus 0.2 mL of PGE1 via the right hepatic artery, respectively. Serum levels of hyaluronic acid (HA), laminin (LN), procollagen Ⅲ (PCⅢ), and collagen Ⅳ (Ⅳ-C) on postoperative days 2, 4, 6 and 8 were measured, and the animals were killed on postoperative day 8 to detect pathological changes in liver tissues.
RESULTS: Liver fibrosis was successfully induced in rabbits, and addition of PGE1 in hepatic arterial embolization significantly reduced serum levels of HA, LN, PCⅢ and Ⅳ-C, and alleviated hepatic histological abnormalities.
CONCLUSION: PGE1 can prevent liver fibrosis progression in rabbits after transcatheter hepatic arterial embolization with lipiodol.
- Citation: Chen BX, Cao HL, Guo RH, Jin SQ, Bai B. Prostaglandin E1 for prevention and treatment of liver fibrosis progression after hepatic arterial embolization in a rabbit model. Shijie Huaren Xiaohua Zazhi 2014; 22(2): 164-170
- URL: https://www.wjgnet.com/1009-3079/full/v22/i2/164.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i2.164
肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)已经成为治疗中晚期肝癌的重要治疗方法, 但随着介入治疗次数增加, 不可避免发生栓塞剂和化疗药物进入非肿瘤区, 栓塞正常区血管, 阻断血液供应, 引起或加重肝损伤, 导致肝纤维化和肝硬化进一步发展[1-3]. 而有关TACE术后肝纤维化、肝硬化进展机制及预防措施研究较少. 近些年研究发现[4-8], 肝纤维化是可逆的, 若能得到及时的治疗, 便可以阻止向肝硬化的发展. 本课题拟通过建立家兔肝纤维化模型基础上模拟TACE术, 在术中加入前列腺素E1(prostaglandin E1, PGE1)进行干预, 观察血清肝纤维化指标和病理的变化, 探讨肝癌TACE术后预防肝纤维化进展的有效治疗措施.
选取健康新西兰大白兔, 体质量2.5-3.0 kg, 5月龄, 由哈尔滨医科大学附属第二医院动物实验中心提供. CCl4购自海建信化工有限公司试剂厂;前列地尔注射液(PGE1, 凯时)(2 mL: 10 μg)(北京泰德制药股份有限公司); 碘比醇注射液(30 gI/100 mL, 法国Guerl); 超液化碘化油(10 mL/支, 法国加柏公司); 血清学四项指标透明质酸(hyaluronic acid, HA)、层黏连蛋白(laminin, LN)、Ⅲ型前胶原(procollagen Ⅲ, PCⅢ)及Ⅳ型胶原(collagen Ⅳ, Ⅳ-C)ELISA试剂盒(上海沪宇生物科技有限公司); 微导管(2.6 F, 日本ASAJ);微导丝(日本泰尔茂公司); 血管造影机(digital subtraction angiography, DSA)数字减影机(Siemens Angiostr-100 mA)(德国).
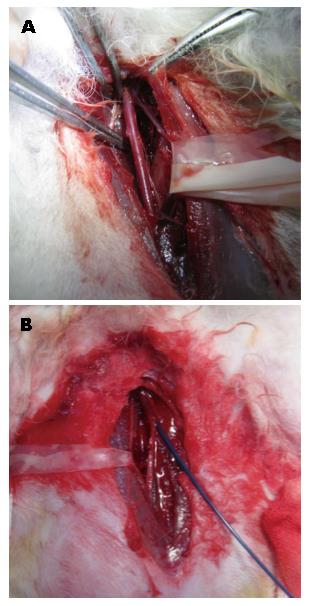
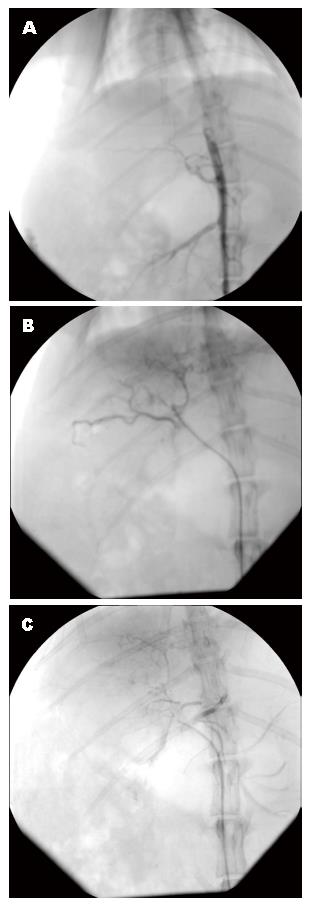
1.2.1 手术: 选取肝功能正常家兔. 随机分为对照组10只和模型组40只; 模型组给予背部皮下注射40%CCl4橄榄油溶液, 对照组注射等量生理盐水. 共计16 wk, 剂量从0.2 mL/kg逐渐增加到1.5 mL/kg, 分别于造模前及造模第4、8、12、16周随机处死1只家兔, 留取肝组织行病理学检查. 造模结束后模型组家兔存活30只, 造模期处死5只, 死亡5只, 死亡原因主要为急性肝坏死或对药物的耐受性差[9]; 对照组家兔全部存活. 将模型建立成功的30只家兔随机分为A、B、C 3组, 每组各10只. 采用速眠新Ⅱ 0.2 mL/kg, 肌肉注射麻醉, 仰卧位固定于介入DSA上, 腹股沟区备皮, 常规消毒, 铺单, 无菌操作逐层切开, 暴露并分离股动脉长约2-3 cm, 用5 mL注射器针头为穿刺针穿刺股动脉, 见鲜血喷出, 沿穿刺针送入微导丝、2.6 F微导管进入股动脉, 将导管头置于胸12、腰1椎体附近造影. 在DSA"路图"下导管经腹主动脉、腹腔动脉、胃肝动脉超选择进入肝右动脉[10], 再次造影观察肝右动脉位置及其分支走行. 在DSA透视下向导管分别推注如下药物: A组生理盐水1 mL; B组碘化油1 mL; C组碘化油1 mL+PGE1 0.2 mL. 推注完毕, 重复造影见肝右动脉及其分支未见显影, 退出导管, 局部止血缝合切口, 术后肌注青霉素, 预防感染.
1.2.2 肝纤维化指标检测: 造模期16 wk内每2 wk抽血1次, 介入栓塞术后第2、4、6、8天各抽血1次, 每次抽取耳缘静脉血4 mL, 抽血前家兔禁食6 h、不禁水, 送至哈尔滨医科大学附属第二医院检验科. 采集的血液以3500 r/min的速度离心10 min, 将上层血清平均分为2份, 贴上标签, 放入-80 ℃冰箱中保存. 等所有血标本集齐后检测HA、LN、PCⅢ及Ⅳ-C四项指标血清水平.
1.2.3 动物处死情况、标本病理学检查: 术后第8天末次采血后采用耳缘静脉空气栓塞法处死全部存活的家兔, 剖取肝脏. 于肝右叶相同部位取样, 40 g/L甲酫溶液浸泡固定. 常规固定24-48 h后行病理取材, 取材大小约为1.5 cm×1.5 cm×0.5 cm, 脱水, 石蜡包埋, 切片采用苏木精-伊红染色(HE)和胶原纤维染色(Masson)作肝脏病理组织学检查. 光镜下观察肝细胞变性、坏死、炎症反应程度以及胶原增生情况.
统计学处理 应用SPSS13.0统计软件包. 计量资料采用mean±SD表示, 进行单因素方差分析及LSD检验, 计数资料组间比较采用χ2检验, P<0.05为差异有统计学意义.
3组家兔均一次性穿刺右侧股动脉成功(图1), 均超选择进入肝右动脉(图2); 术中因麻醉意外和失血过多B、C组各死亡一只, A组全部存活; 术后至第8天采血完毕3组家兔均存活, 无死亡.
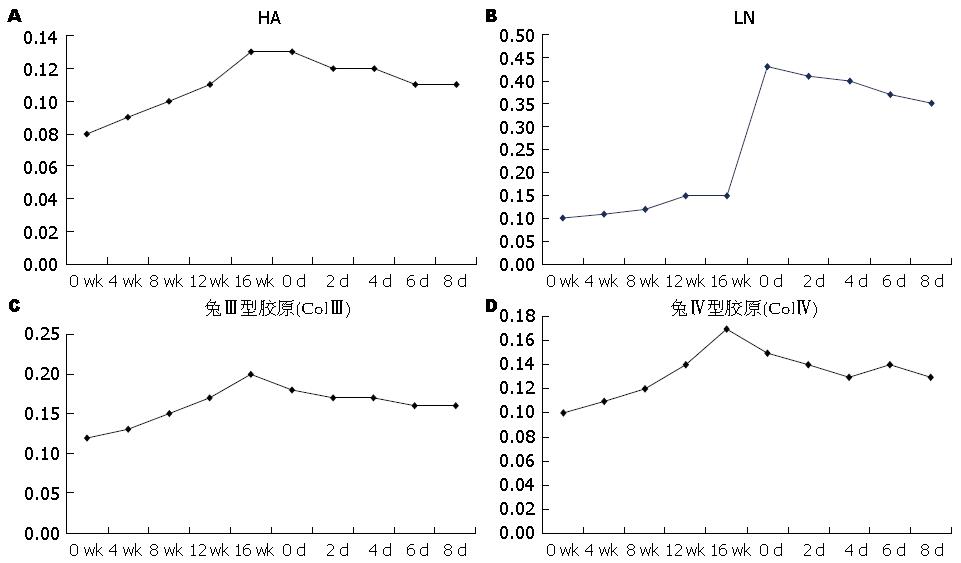
在造模期间肝纤维化四项指标血清含量随着肝纤维化程度加重均逐渐上升; 行TACE术中加入PGE1后, HA、LN、PCⅢ、Ⅳ-C四项指标血清含量均降低(图3).
2.3.1 大体观察及肝纤维化分期: 对照组肝脏呈鲜红色, 质地柔软, 有光泽. 模型组随着肝纤维化程度逐渐加重, 肝脏呈灰褐色、灰白色; 质韧; 无光泽; 体积增大、被膜肿胀; 边缘圆钝. 各组肝纤维化分期, 按照分期评判标准[11], A组: S2期7例, 占70.0%, S3期3例, 占30.0%; B组: S2期2例, 占22.2%, S3期7例, 占77.8%; C组: S2期6例, 占66.7%, S3期3例, 占33.3%; 对照组: S0期9例, S1期1例. C组与B组比较S3期肝纤维化率降低(P<0.05), 与A组比较差异无统计学意义(P>0.05).
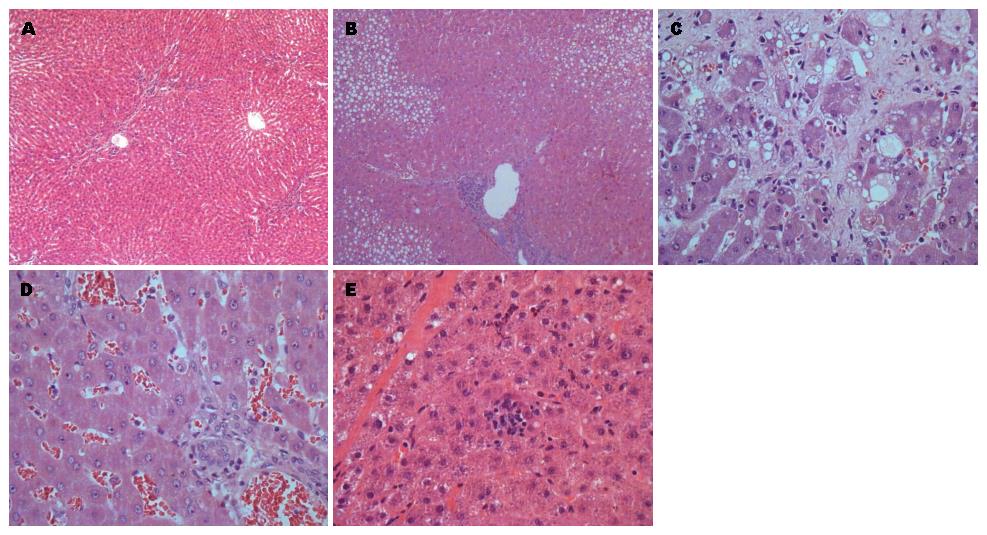
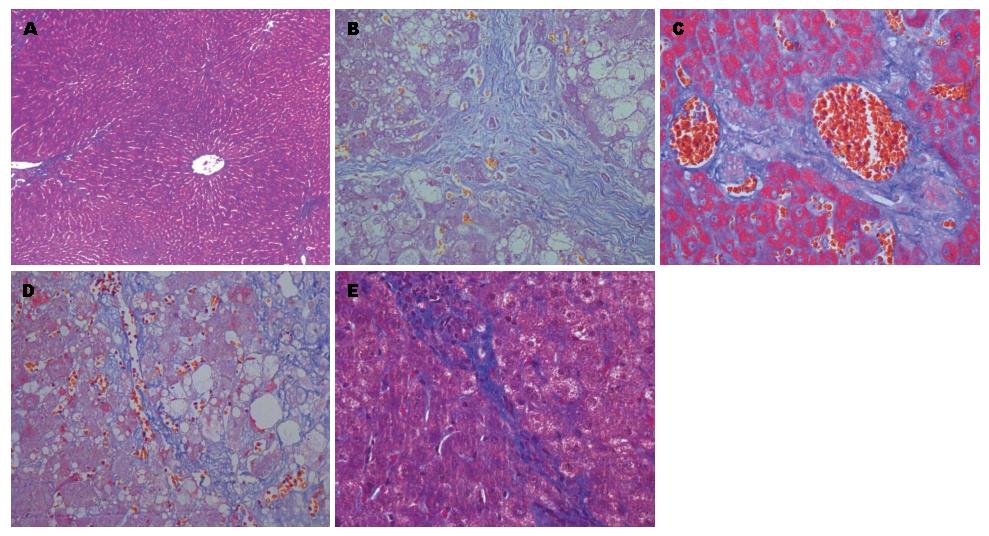
2.3.2 HE染色: 对照组肝小叶结构形态正常, 肝细胞大小一致, 围绕中央静脉呈放射状排列(图4A); 模型组16 wk时, 随给药时间延长、浓度增大, 肝细胞脂肪变性、坏死、汇管区炎性细胞浸润逐渐加重, 肝小叶结构破坏, 周围细胞可见透亮脂滴, 肝纤维化形成(图4B). 介入术后, A组肝细胞变性坏死明显, 排列紊乱, 肝小叶结构破坏, 坏死区周围见炎症细胞浸润和纤维组织增生, 纤维间隔形成(图4C); B组大片肝细胞变性坏死, 坏死区周围见炎症细胞浸润和纤维组织增生进一步加重, 并向小叶内伸展(图4D); C组肝细胞水肿、空泡样变性伴少量点灶状坏死, 汇管区少量炎细胞浸润(图4E).
2.3.3 Masson染色: 对照组汇管区有极少量胶原纤维存在, 肝小叶间未见纤维组织增生(图5A); 模型组16 wk时大量的胶原纤维存在, 纤维组织增生, 形成纤维间隔交织成网分布并包绕肝小叶(图5B). 介入术后, A组汇管区出现大量胶原纤维, 纤维组织增生形成纤维间隔分割包绕肝小叶, 肝小叶结构被破坏(图5C); B组大量纤维增生, 粗大的纤维间隔分布, 并向小叶内伸展, 可见假小叶形成(图5D); C组少量的胶原纤维存在, 纤维组织增生及纤维间隔形成减少, 肝小叶结构破坏程度减轻, 坏死肝细胞及炎性细胞减少(图5E).
选用家兔作为建立肝纤维化动物模型, 因其肝脏代谢方式与人类相同, 都是脂类代谢, 肝纤维化发病机制相似[12]; 家兔性情温顺、费用低廉, 肝脏体积大小适中、便于操作, 血容量相对较多, 作为中等动物模型能满足一般的化验、影像检查需要[13], 更适用于介入治疗研究; 而其他动物如小鼠、大鼠存在肝脏体积较小, 血容量少、操作不便等[14,15], 大型动物如犬、猪、狒狒等存在肝脏体积较大、价格昂贵、手术难以操控等众多缺点.
对于家兔肝脏选择何种DSA血管造影方法显得尤其重要, 兔肝动脉插管主要有两种方法:一种是经股动脉超选至肝动脉插管法; 另一种是开腹直视下肝动脉插管法. 开腹直视下肝动脉插管法由于家兔肝动脉血管细小, 在插管操作过程中容易造成血管痉挛、闭塞, 甚至离断, 出血量多, 插管成功率低, 对正常肝脏血管的解剖及血运破坏较严重; 而经股动脉插管法在实际操作中相对简单、容易掌握、而且成功率较高, 适用于经肝动脉灌注药物或细胞悬液对肝脏进行研究[16]. 另外此方法术中对血管和肝脏的创伤小, 术后能够保持完整的血管解剖位置及良好的肝脏血运状况, 当一侧股动脉因血管破坏严重不能进行穿刺插管操作时, 可选用对侧股动脉进行手术操作, 故被广泛采用. 江雄鹰等[17]实验证实肝左动脉插管较肝右动脉容易, 但我们为模拟人类肝癌好发于肝右叶, 并且在家兔模型上成功复制TACE术这一过程, 尽可能将导管插管至肝右动脉. Lee等[18]报道经股动脉引入4 F导管鞘, 再经鞘管引入2.5 F微导管, 经腹腔动脉能够超选择进入肿瘤供血动脉, 而我们采用2.6 F微导管直接插管至肝右动脉. 用5 mL注射器针头作为穿刺针穿刺暴露的股动脉, 沿针头引入微导丝, 再引入微导管, 利用导丝导管配合超选择至肝右动脉行碘化油栓塞, 操作时要求技术娴熟、尽量做到一次穿刺插管成功, 将对血管的损伤程度减少到最低. 超选困难时, 将微导管头端塑形、改变其原始形状等办法, 均成功超选到位进行肝右动脉碘油栓塞, 最终在家兔肝纤维化模型基础上成功复制TACE术这一过程, 本实验采用栓塞肝右动脉, 目的是防止大面积肝坏死和肝功能衰竭, 降低死亡率.
研究发现PGE1具有抑制免疫反应、防止肝细胞坏死、减少肝细胞变性、促进肝细胞再生、改善肝脏微循环等保肝、抗纤维化作用[19-24]. 而HA、LN、PCⅢ、Ⅳ-C在肝纤维形成过程中又是重要的生物标志物[25,26], 这四项指标在血清中的浓度变化, 直接反应肝纤维化的严重程度, 同时也是检测肝纤维化程度的重要血液学指标. 从实验的结果显示来看, 在造模期间肝纤维化四项指标HA、LN、PCⅢ、Ⅳ-C血清含量均随着肝纤维化程度加重而逐渐上升, 行TACE术中加入PGE1后, HA、LN、PCⅢ、Ⅳ-C四项指标血清含量均随肝纤维化程度减轻而逐渐降低. 从病理学HE和MASSON染色结果来看, 行TACE术中加入PGE1干预后C组与B组比较, 肝细胞水肿和肝细胞坏死减少, 仅有少量空泡样变性及点灶状坏死, 坏死区周围炎症细胞浸润减轻, 少量的胶原纤维存在, 纤维组织增生及纤维间隔形成明显减少, 肝小叶结构破坏程度减轻. 并且C组与B组比较S3期肝纤维化率明显降低(P<0.05). 以上说明PGE1对TACE术后肝纤维化进展起到了抗纤维化的作用. TACE术中碘化油与PGE1的联合应用, 一方面碘化油不仅栓塞肿瘤供血动脉, 还不可避免的栓塞正常的肝组织, 从而加重肝纤维程度, 甚至造成大量肝细胞坏死及急性肝衰竭, 而PGE1在TACE术后12 h通过调节细胞周期蛋白及基因方面有效的预防肝衰竭的发生[27]; TACE术后少部分残留于瘤周组织和非瘤区的碘化油可达数月之久才能被完全消除, 在此期间内均能造成肝组织缺血、缺氧加重[28], 同时化疗药物对肝细胞的直接损害[29], 这些因素都将进一步加重肝纤维化的程度; 另一方面碘化油也作为PGE1药物的一种载体, 增加了PGE1在受损肝脏供血动脉内的药物浓度, 并在栓塞区域内被逐渐缓慢释放, PGE1再通过激活抗氧化应激的防御系统来减少脂质过氧化反应和抗氧化的作用[30-32], 发挥抗纤维化的作用. 因此, PGE1本身抗纤维化的药效作用对于TACE术中、术后碘化油和化疗药物对肝脏造成的肝损伤具有拮抗作用, 阻止肝纤维化的进一步发展, 最终达到治疗肝纤维化进展保护肝脏的作用.
总之, PGE1作为一个单独干预药物, 在预防TACE术后肝纤维化的进展方面有着深远的意义, 我们通过设计这个实验仅仅是从血液学和病理学结果, 直观的观察PGE1的抗纤维化作用. 还有微观分子水平的实验研究去观察PGE1的抗纤维化作用, 有待于更多的研究发现.
感谢谭妙欣、周德杰、史中兴及徐伟在本试验中给予的大力帮助.
肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)已经成为治疗中晚期肝癌的重要方法, 但是随着介入次数的增加, 栓塞剂和化疗药物不可避免的进入非肿瘤区, 导致原有的肝纤维化和肝硬化加重, 而相关的预防研究措施较少. 我们选用家兔作为建立肝纤维化动物模型并模拟TACE术, 术中加入前列腺素E1(prostaglandin E1, PGE1)来预防TACE术后肝纤维化和肝硬化的进展, 对于介入术后肝损伤的防治研究具有十分重要的意义.
李涛, 副主任医师, 北京大学人民医院肝胆外科
随着介入诊疗技术的不断发展, 寻求有效的药物治疗来预防TACE术后纤维化及硬化的进展, 以及选取适合的实验动物肝纤维化模型并在此模型上行TACE术显得尤其重要, 而这方面相关详细的研究报道较少, 不能满足当前实验研究的需要.
家兔与人类肝脏都是脂类代谢, 肝纤维化发表机制相似, 其肝脏体积和血容量都是行TACE术实验动物模型中最优的选择. 经股动脉插管技术较直视下外科手术肝动脉插管容易, 国外研究报道经股动脉引入4 F导管鞘, 再经鞘管引入2.5 F微导管能够超选进入肝脏肿瘤供血动脉. 而PGE1在介入术后12 h通过调节细胞周期蛋白及基因方面能有效的预防碘化油和化疗药物对肝脏造成的肝衰竭.
本实验选择PGE1作为TACE术后抗纤维化进展的药物, 股动脉穿刺方法用5 mL注射器针头为穿刺针, 用2.6 F微导管利用导丝导管配合超选至肝右动脉行碘化油栓塞, 在肝纤维化家兔模型上成功复制TACE术这一过程, 实验证实PGE1能明显发挥TACE术后抗纤维化和硬化的作用. 此实验完成过程中获得的经验本文都做了详细的阐述, 对于在家兔身上进行肝动脉插管及选择药物控制TACE术后纤维化和硬化进展的实验研究人员来说提供了一个有价值的参考.
PGE1能有效的预防TACE术后纤维化和硬化进展, 发挥抗纤维化作用. 对于临床工作中肝癌介入治疗术后, 有效地控制肝纤维化和肝硬化的进展提供一个可行的治疗方法.
本文阐述的观点很好, 具有一定的创新性, 研究工作量也比较大, 具有一定指导意义.
编辑: 田滢 电编:闫晋利
| 1. | Chan AO, Yuen MF, Hui CK, Tso WK, Lai CL. A prospective study regarding the complications of transcatheter intraarterial lipiodol chemoembolization in patients with hepatocellular carcinoma. Cancer. 2002;94:1747-1752. [PubMed] [DOI] |
| 2. | Artinyan A, Nelson R, Soriano P, Chung V, Retseck J, Reynolds J, Marx H, Kim J, Wagman L. Treatment response to transcatheter arterial embolization and chemoembolization in primary and metastatic tumors of the liver. HPB (Oxford). 2008;10:396-404. [PubMed] [DOI] |
| 3. | Farinati F, De Maria N, Marafin C, Herszènyi L, Del Prato S, Rinaldi M, Perini L, Cardin R, Naccarato R. Unresectable hepatocellular carcinoma in cirrhosis: survival, prognostic factors, and unexpected side effects after transcatheter arterial chemoembolization. Dig Dis Sci. 1996;41:2332-2339. [PubMed] [DOI] |
| 5. | Popov Y, Schuppan D. Targeting liver fibrosis: strategies for development and validation of antifibrotic therapies. Hepatology. 2009;50:1294-1306. [PubMed] [DOI] |
| 6. | Friedman SL. Evolving challenges in hepatic fibrosis. Nat Rev Gastroenterol Hepatol. 2010;7:425-436. [PubMed] [DOI] |
| 7. | Schuppan D, Pinzani M. Anti-fibrotic therapy: lost in translation? J Hepatol. 2012;56 Suppl 1:S66-S74. [PubMed] [DOI] |
| 8. | Friedman SL, Sheppard D, Duffield JS, Violette S. Therapy for fibrotic diseases: nearing the starting line. Sci Transl Med. 2013;5:167sr1. [PubMed] [DOI] |
| 9. | Mao YL, Zhang T, Sang XT, Li F, Ba JT, Lu X, Yang ZY, Zhong SX, Huang JF. [Three-dimensional assessment of the remnant hepatic function following surgery using single photon emission computed tomography in an animal model]. Zhonghua Waike Zazhi. 2007;45:609-612. [PubMed] |
| 11. | Hepatic Fibrosis Study Group Of Chinese Liver Diseases Association. [Consensus on evaluation of the diagnosis and efficacy of hepatic fibrosis]. Zhonghua Ganzangbing Zazhi. 2002;10:327-328. [PubMed] |
| 12. | Hawes BE, O'neill KA, Yao X, Crona JH, Davis HR, Graziano MP, Altmann SW. In vivo responsiveness to ezetimibe correlates with niemann-pick C1 like-1 (NPC1L1) binding affinity: Comparison of multiple species NPC1L1 orthologs. Mol Pharmacol. 2007;71:19-29. [PubMed] [DOI] |
| 13. | Bravo E, D'Amore E, Ciaffoni F, Mammola CL. Evaluation of the spontaneous reversibility of carbon tetrachloride-induced liver cirrhosis in rabbits. Lab Anim. 2012;46:122-128. [PubMed] [DOI] |
| 14. | Ogawa T, Fujii H, Yoshizato K, Kawada N. A human-type nonalcoholic steatohepatitis model with advanced fibrosis in rabbits. Am J Pathol. 2010;177:153-165. [PubMed] [DOI] |
| 15. | Bailey SA, Zidell RH, Perry RW. Relationships between organ weight and body/brain weight in the rat: what is the best analytical endpoint? Toxicol Pathol. 2004;32:448-466. [PubMed] [DOI] |
| 18. | Lee KH, Liapi EA, Cornell C, Reb P, Buijs M, Vossen JA, Ventura VP, Geschwind JF. Doxorubicin-loaded QuadraSphere microspheres: plasma pharmacokinetics and intratumoral drug concentration in an animal model of liver cancer. Cardiovasc Intervent Radiol. 2010;33:576-582. [PubMed] [DOI] |
| 19. | Riquet FB, Lai WF, Birkhead JR, Suen LF, Karsenty G, Goldring MB. Suppression of type I collagen gene expression by prostaglandins in fibroblasts is mediated at the transcriptional level. Mol Med. 2000;6:705-719. [PubMed] |
| 20. | Cattaneo MG, Pola S, Dehò V, Sanguini AM, Vicentini LM. Alprostadil suppresses angiogenesis in vitro and in vivo in the murine Matrigel plug assay. Br J Pharmacol. 2003;138:377-385. [PubMed] [DOI] |
| 21. | Hanazaki K, Kajikawa S, Fujimori Y, Nakata S, Shimozawa N, Koide N, Adachi W, Amano J. Effects of prostaglandin E1 administration during hepatectomy for cirrhotic hepatocellular carcinoma. Hepatogastroenterology. 2000;47:461-464. [PubMed] |
| 22. | Zou WL, Yang Z, Zang YJ, Li DJ, Liang ZP, Shen ZY. Inhibitory effects of prostaglandin E1 on activation of hepatic stellate cells in rabbits with schistosomiasis. Hepatobiliary Pancreat Dis Int. 2007;6:176-181. [PubMed] |
| 23. | Kubo S, Tanaka H, Shuto T, Takemura S, Uenishi T, Tanaka S, Hirohashi K. [Hepatic failure after liver resection in patients with cirrhosis]. Nihon Geka Gakkai Zasshi. 2004;105:669-673. [PubMed] |
| 24. | Hafez T, Moussa M, Nesim I, Baligh N, Davidson B, Abdul-Hadi A. The effect of intraportal prostaglandin E1 on adhesion molecule expression, inflammatory modulator function, and histology in canine hepatic ischemia/reperfusion injury. J Surg Res. 2007;138:88-99. [PubMed] [DOI] |
| 25. | Kaneda H, Hashimoto E, Yatsuji S, Tokushige K, Shiratori K. Hyaluronic acid levels can predict severe fibrosis and platelet counts can predict cirrhosis in patients with nonalcoholic fatty liver disease. J Gastroenterol Hepatol. 2006;21:1459-1465. [PubMed] |
| 26. | Li CH, Pan LH, Yang ZW, Li CY, Xu WX. Preventive effect of Qianggan-Rongxian Decoction on rat liver fibrosis. World J Gastroenterol. 2008;14:3569-3573. [PubMed] [DOI] |
| 27. | Ishibe A, Togo S, Kumamoto T, Watanabe K, Takahashi T, Shimizu T, Makino H, Matsuo K, Kubota T, Nagashima Y. Prostaglandin E1 prevents liver failure after excessive hepatectomy in the rat by up-regulating Cyclin C, Cyclin D1, and Bclxl. Wound Repair Regen. 2009;17:62-70. [PubMed] [DOI] |
| 28. | Chung J, Yu JS, Chung JJ, Kim JH, Kim KW. Haemodynamic events and localised parenchymal changes following transcatheter arterial chemoembolisation for hepatic malignancy: interpretation of imaging findings. Br J Radiol. 2010;83:71-81. [PubMed] [DOI] |
| 29. | Wang Y, Xiong B, Liang B, Zhao H, Li H, Qian J, Liang HM, Feng GS, Zheng CS. Hepatic parenchymal changes following transcatheter embolization and chemoembolization in a rabbit tumor model. PLoS One. 2013;8:e70757. [PubMed] [DOI] |
| 31. | Otogawa K, Kinoshita K, Fujii H, Sakabe M, Shiga R, Nakatani K, Ikeda K, Nakajima Y, Ikura Y, Ueda M. Erythrophagocytosis by liver macrophages (Kupffer cells) promotes oxidative stress, inflammation, and fibrosis in a rabbit model of steatohepatitis: implications for the pathogenesis of human nonalcoholic steatohepatitis. Am J Pathol. 2007;170:967-980. [PubMed] [DOI] |
| 32. | Jia C, Dai C, Bu X, Peng S, Xu F, Xu Y, Zhao Y. Co-administration of prostaglandin E1 with somatostatin attenuates acute liver damage after massive hepatectomy in rats via inhibition of inflammatory responses, apoptosis and endoplasmic reticulum stress. Int J Mol Med. 2013;31:416-422. [PubMed] [DOI] |