修回日期: 2014-04-26
接受日期: 2014-04-30
在线出版日期: 2014-07-08
目的: 探讨应用小发卡RNA(small hairpin RNA, shRNA)干扰技术敲低Smad4基因对结肠癌细胞阿霉素(doxorubicin)化疗敏感性的影响.
方法: 应用shRNA干扰技术敲低人结肠癌HCT116细胞Smad4基因, 分空白细胞对照Control组, shRNA阴性对照RNAi-NC组和shRNA干扰RNAi-Smad4组, 采用终浓度为50 nmoL/L doxorubicin用7 d, 蛋白免疫印迹和逆转录聚合酶链反应鉴定Smad4敲低效果. MTT检测细胞存活率. 酶联免疫吸附测定检测转化生长因子β(transforming growth factor beta 1, TGF-β1)的表达水平. 蛋白免疫印迹检测多药耐药基因糖蛋白(multi drugs resistance gene plasma membrane glycoprotein, MDR P-gp), 上皮细胞间质细胞样转化相关的标志物E-cadherin. Vimentin和相关的转录因子Snail、Slug、Smad2/3和磷酸化Smad2/3的蛋白表达.
结果: Smad4 shRNA能够显著敲低Smad4基因的表达. MTT结果显RNAi-Smad4组较RNAi-NC组的细胞存活率降低, 且呈时间依赖性. 50 nmoL/L阿霉素作用于癌细胞7 d后, ELISA结果提示阿霉素能显著提高RNAi-Smad4组和RNAi-NC组的TGF-β1的表达(P<0.05). 蛋白免疫印迹提示MDR p-gp、Vimentin、Snail和Slug的表达RNAi-NC组较对照组升高而RNAi-Smad4能抑制这种高表达, E-cadherin蛋白RNAi-NC组较对照组减低而RNAi-Smad组则能升高该蛋白的表达; 阿霉素处理后不影响Smad2/3的表达, 但提高了RNAi-Smad4组和RNAi-NC组的磷酸化Smad2/3的表达.
结论: 敲低Smad4基因以阻断TGF-β/Smad4信号通路可提高结肠癌的阿霉素化疗敏感性.
核心提示: 低剂量的阿霉素长时间处理人结肠癌HCT116细胞株, 可诱导其产生阿霉素化疗耐药性, 其大体机制可能与阿霉素诱导了转化生长因子β(transforming growth factor beta 1)/Smad4信号通路的激活, 进一步导致癌细胞发生上皮细胞间质细胞样转化, 联合应用Smad4基因沉默载体可提高阿霉素的作用敏感性.
引文著录: 李金鹏, 刘昊, 于皆平, 于红刚. Smad4基因敲低对结肠癌阿霉素化疗敏感性的影响. 世界华人消化杂志 2014; 22(19): 2746-2751
Revised: April 26, 2014
Accepted: April 30, 2014
Published online: July 8, 2014
AIM: To evaluate whether small hairpin RNA (shRNA)-mediated knockdown of the Smad4 gene influences resistance of colon cancer cells to doxorubicin in vitro.
METHODS: An Smad4 shRNA was stably transfected into human colon cancer HCT116 cells to silence the Smad4 gene. Cells were basically divided into three groups: shRNA-negative control cells (RNAi-NC), shRNA-Smad4 cells (RNAi-Smad4) and HCT116 cells untreated by doxorubicin (CONTROL). Doxorubicin (50 nmoL/L) was applied to treat cells for 7 d. The expression of Smad4 was examined by Western blot and RT-PCR to test shRNA transfection efficiency. Cell viability was determined by MTT assay, the concentration of transforming growth factor beta 1 (TGF-β1) was measured by ELISA, and expression of multidrug resistance gene plasma membrane glycoprotein (MDR P-gp), epithelial mesenchymal transition (EMT) related markers E-cadherin and vimentin, related transcription factors Snail and Slug, Smad2/3 and phosphorylation of Smad2/3 expression were detected by Western blot.
RESULTS: The protein and mRNA levels of Smad4 were significantly reduced after Smad4 shRNA transfection. After doxorubicin (50 nmoL/L) administration for 7 d, MTT assay showed that cell viability ratio in the RNAi-Smad4 group was lower than that in the RNAi-NC group, and declined in a time dependent manner. ELISA assay revealed that TGF-β1 concentration in the RNAi-Smad4 and RNAi-NC groups were significantly augmented by doxorubicin (P < 0.05). Western blot results indicated that protein expression of MDRP-gp, vimentin, Snail and Slug in the RNAi-NC group was higher than that in the CONTROL group, but RNAi-Smad4 inhibited such increases. In contrast, expression of E-cadherin in the RNAi-NC group was lower than that in the CONTROL group, but RNAi-Smad4 enhanced its expression. Doxorubicin administration did not change the expression of Smad2/3 but enhanced phosphorylation of Smad2/3 expression in the RNAi-Smad4 and RNAi-NC groups.
CONCLUSION: Smad4 gene knockdown to block the TGF-β/Smad4 signal pathway increases chemosensitivity of colon cancer cells to doxorubicin.
- Citation: Li JP, Liu H, Yu JP, Yu HG. Smad4 gene knockdown enhances chemosensitivity of colon cancer cells to doxorubicin. Shijie Huaren Xiaohua Zazhi 2014; 22(19): 2746-2751
- URL: https://www.wjgnet.com/1009-3079/full/v22/i19/2746.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i19.2746
本课题组的前期研究显示, 低剂量阿霉素(doxorubicin)长时间作用于人结肠癌HCT116细胞能诱导对阿霉素的作用不敏感现象, 并上调了上皮细胞间质细胞样转化(epithelial-mesenchymal transition, EMT)相关的标志物和转录因子的表达, 我们推测阿霉素可能诱导了结肠癌细胞发生了间质细胞样转化. 很多研究表明转化生长因子β(transforming growth factor beta, TGF-β)参与了多种癌细胞的上皮细胞间质细胞样转化过程[1,2]. 本研究拟应用RNA干扰技术敲低结肠癌HCT116细胞Smad4基因以阻断TGF-β/Smad4信号通路, 加以低剂量阿霉素长时间作用, 观察细胞存活率、耐药蛋白和EMT相关蛋白的表达情况, 拟探讨TGF-β/Smad4信号通路是否在结肠癌的阿霉素化疗不敏感中起调节作用.
结肠癌HCT116细胞购自中科院上海细胞库, 并由湖北省消化系疾病重点实验室传代保存. RPMI 1640培养基来源于美国Gibco公司; 多药耐药基因糖蛋白(multi drugs resistance gene plasma membrane glycoprotein, MDR P-gp)抗体, E-cadherin、vimentin抗体和Snail、Slug抗体钩自Santa Cruz公司; 四甲基偶氮唑盐MTT[3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐], 二甲基亚砜购自美国Sigma公司; doxorubicin购自美国Alex公司; 逆转录试剂盒购自加拿大Fermentas公司; PCR试剂盒和TGF-β1 ELISA试剂盒购自上海美轩生物科技有限公司; TRIzol购自美国Invitrogen公司; 提取总蛋白试剂盒及Western blot所需其他试剂购自上海碧云天生物技术研究所.
1.2.1 细胞转染: 由季国忠教授团队课题组前期构建[3]并赠予的Smad4 RNA干扰(RNA interference, RNAi)慢病毒载体, 经包装、浓缩及检测病毒滴度后人结肠癌HCT116细胞, 筛选出一组Smad4干扰效率高的细胞, 即RNAi-Smad4组, 对照组为HCT116细胞Control组和感染慢病毒空载体的HCT116细胞RNAi-NC组.
1.2.2 细胞培养: 传代培养Control组, RNAi-NC组和RNAi-Smad4组的结肠癌HCT116细胞于含100 mL/L小牛血清的RPMI 1640培养液中, 50 mL/L CO2浓度, 37 ℃培养环境下培养. 经胰酶消化, 传代, 取对数生长期细胞进行下列实验.
1.2.3 Smad4基因敲低的鉴定: 分别应用Western blot和逆转录聚合酶链反应(RT-PCR)检测Smad4基因敲低后Smad4蛋白和mRNA的表达. 蛋白部分: 提取稳定转染后的细胞总蛋白, BCA法测定各组蛋白浓度, 根据浓度上样行电泳后转膜至PVDF膜上, 5%脱脂奶粉的TBST封闭1 h, 加一抗(1:500)4 ℃杂交过夜, TBST漂洗, 加二抗(1:1000)室温孵育2 h, TBST漂洗, 化学发光试剂检测蛋白条带. mRNA部分: 提取稳定转染后的细胞总mRNA, 用PBS洗涤各组细胞3次, 每孔中加入1 mL TRIzol RNA提取液, 按说明书步骤提取总RNA, 紫外分光光度仪测A260/280比值, 重复3次, 计算RNA浓度. 将RNA逆转录为cDNA后进行循环扩增. PCR引物由美国Invitrogen公司上海分公司合成, 引物序列: Smad4上游引物5'-GGGCTGGAACTGTATCTG-3'和下游引物5'-CATCATGGTATCCCGATT-3'. β-actin上游引物5'-ATCGTGCGTGACATTAAGGAGAAG-3'和下游引物5'-AGGAAGGAAGGCTGGAAGAGTG-3'. 反应条件为: 95 ℃, 3 min预变性; 94 ℃ 30 s; 48 ℃ 30 s; 72 ℃ 1 min, 35个循环, 72 ℃终末延伸5 min. PCR产物经15 g/L琼脂糖凝胶电泳, 凝胶图像扫描系统成像并进行灰度扫描.
1.2.4 MTT检测细胞增殖: 用含100 mL/L胎牛血清的培养液将贴壁细胞配成单个细胞悬液,浓度为10000-20000/mL, 每孔体积200 μL细胞接种到96孔板. 细胞贴壁后即加药. 三组均设5个孔. 采用50 nmoL/L的阿霉素终浓度作用各组细胞7 d, 隔天更换培养液, 并再次加入等量的阿霉素继续处理, 检测每天癌细胞的存活率. 阿霉素均混匀于无血清培养基后再加入到相应孔中. 作用既定的时间后, 每孔加MTT溶液(5 g/L用PBS配制, pH 7.4)10 μL继续孵育4 h后终止培养, 小心吸弃孔内培养上清液, 每孔加100 μL DMSO, 置摇床上低速振荡10 min, 使结晶物充分融解. 然后选择490 nm波长在酶联免疫监测仪上测定各孔吸光度值, 记录结果并计算细胞存活率. 细胞存活率 = (各浓度组吸光度值均值/空白组吸光度值均值)×100%, 并绘制直方图.
1.2.5 孔板加药处理: 将传代培养的细胞重悬后种植于6孔板, Control组设2个孔(不加任何药物), 处理组RNAi-NC组和RNAi-Smad4组(均使阿霉素终浓度为50 nmoL/L)各2个孔, 以细胞长至80%-90%孔域并处于对数生长期开始加药, 作用7 d后提取各组总蛋白(期间于隔天更换培养液, 并再次加入相同用量的阿霉素继续培养). 行Western blot检测各组目的蛋白(以β-actin为内对照).
1.2.6 酶联免疫吸附测定: 加药方式同上述"孔板加药处理", 然后按照TGF-β1 ELISA试剂盒提供的方法逐步操作, 分别检测3组TGF-β1的浓度.
统计学处理 实验均重复3次, 用SPSS17.0软件进行统计分析, 定量结果采用mean±SD表示, 多组均数间比较采用单因素方差分析, 两两组间比较采用组间q检验, 以P<0.05为差异有统计学意义.
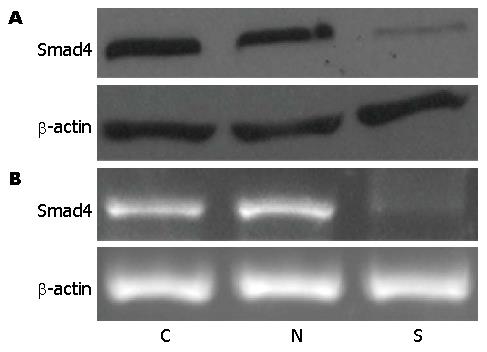
将稳定转染后的细胞分别提取总蛋白和总mRNA进行Western blot和RT-PCR检测Smad蛋白和mRNA水平的表达. 结果发现应用特异性设计的Smad4 shRNA转染进入HCT116细胞后能够显著地降低Smad4蛋白(图1A)和mRNA(图1B)的表达, 说明转染成功.
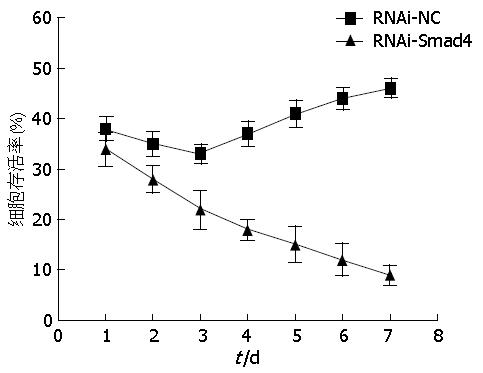
终浓度50 nmoL/L的阿霉素作用于RNAi-NC组和RNAi-Smad4组细胞7 d, 检测每天癌细胞的存活率. 从折线图(图2)中可以发现, RNAi-NC组第1天到第3天细胞存活率逐渐下降, 而从第4天开始到第7天细胞存活率呈缓慢上升趋势. RNAi-Smad4组每天的细胞存活率均较RNAi-NC组降低, 且呈时间依赖性下降. 说明敲低Smad4联合应用阿霉素能够有效地抑制癌细胞的生长.
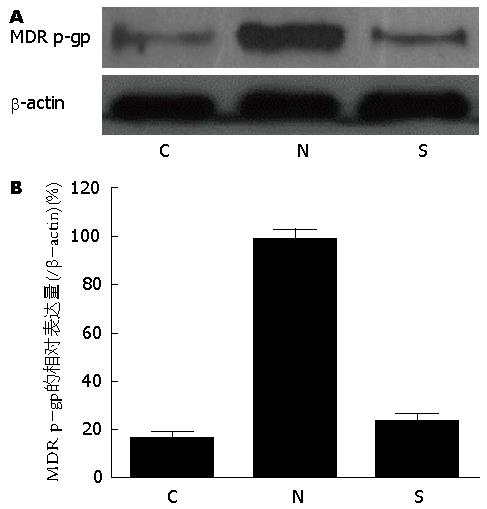
阿霉素处理细胞7 d后检测各组多药耐药基因糖蛋白MDR p-gp的表达, 从Western blot结果(图3)可以看到, RNAi-NC组MDR p-gp表达量较对照组明显增加, 而RNAi-Smad4组则能抑制这种高表达, 说明敲低Smad4基因有利于减低阿霉素的用药抵抗.
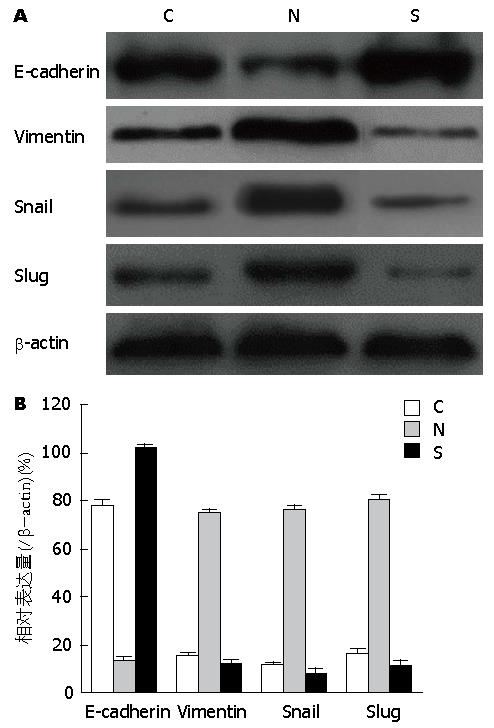
阿霉素处理细胞7 d后检测各组EMT相关标志物E-cadherin、vimentin和EMT相关转录因子Snail, Slug的表达. 从Western blot结果(图4)可以看到vimentin、Snail和Slug的表达RNAi-NC组较对照组升高而RNAi-Smad4能抑制这种高表达, E-cadherin蛋白RNAi-NC组较对照组减低而RNAi-Smad组则能升高该蛋白的表达.
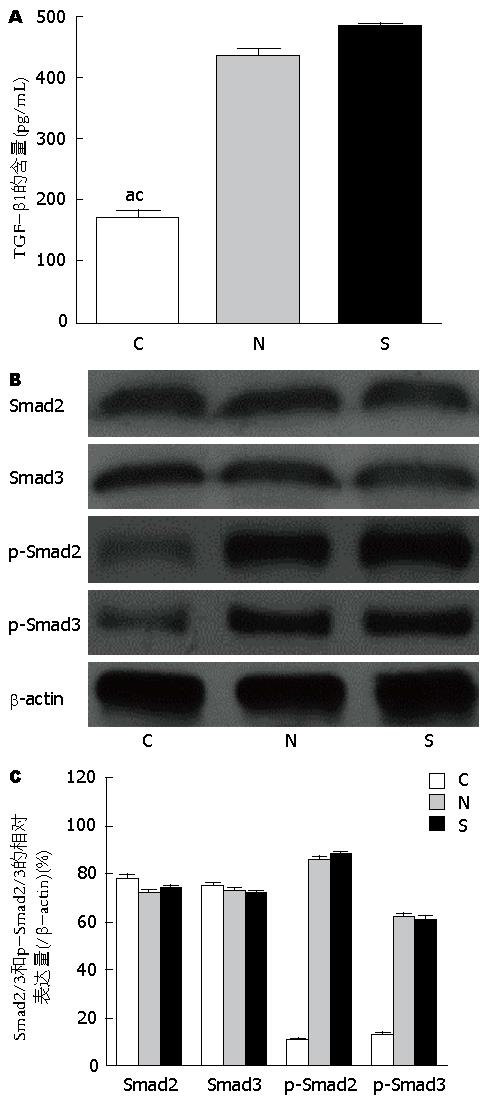
阿霉素处理后分别检测TGF-β1的含量和Smad2/3蛋白及磷酸化Smad2/3(p-Smad2/3)的表达水平. ELISA结果(图5A)显示RNAi-NC组和RNAi-Smad4组的TGF-β1浓度均明显高于Control组(P<0.05). 免疫印迹结果(图5B和图5C)显示阿霉素长时间作用并没有改变Smad2/3的蛋白水平, 但提高了RNAi-NC组和RNAi-Smad4组的p-Smad2/3水平. 本组结果表明, 长时间低剂量的阿霉素作用于HCT116细胞通过提高TGF-β1和p-Smad2/3的水平来调节TGF-β/Smad信号通路. 正像预期的那样, 敲低Smad4基因没有显著影响Smad2/3和p-Smad2/3水平.
我们的前期研究发现长时间低剂量的阿霉素(50 nmoL/L)作用于人结肠癌HCT116细胞后, 阿霉素对细胞的杀伤效力逐渐减弱, 且诱导了多药耐药基因糖蛋白MDR p-gp的表达上调. 还发现这一过程可能与EMT过程有关, 因为阿霉素同时上调了EMT相关的标志物vimentin及转录因子Snail和Slug的表达. 许多研究表明TGF-β参与了癌细胞的EMT过程, 并起调节作用[4,5].
RNAi或RNA沉默(RNA silencing)是指采用一段特异性的非编码RNA序列结合靶基因的mRNA, 形成细胞核内复合物以阻止目的基因表达的一项分子生物学技术[6]. 本次实验我们采用了慢病毒载体基因沉默的方法转染特异的shRNA来敲低TGF-β/Smad信号通路中的Smad4基因(RNAi-Smad4组)以阻断该通路, 并以空慢病毒载体作为转染对照(RNAi-NC组), 不加阿霉素作用的空细胞作为内对照(Control组). 应用低剂量的阿霉素(50 nmoL/L)长时间地(7 d)作用于上述3组人结肠癌HCT116细胞, RNAi-NC组连同阿霉素作用后癌细胞的存活率起初下降, 随着作用时间的延长, 存活率呈缓慢上升的趋势. MDR p-gp蛋白和EMT相关的标志和转录因子vimentin、Snail、Slug在RNAi-NC组较Control组升高, 这提示随着作用时间的延长, 阿霉素处理的细胞发生了某种改变. 阿霉素连同RNAi-Smad4组作用, 细胞存活率呈时间依赖性下降, 且都较RNAi-NC组降低, vimentin、Snail、Slug在RNAi-Smad4组较RNAi-NC升高, 这提示阿霉素长时间作用于HCT116细胞, 诱导了细胞的耐药, 并可能发生上皮细胞间质细胞样转化过程.
TGF-β是一种广泛存在的多效性的生长因子, 调节细胞增殖、分化和凋亡等多种细胞内过程[7]. TGF-β有TGF-β1、TGF-β2和TGF-β3三个亚型, 通过结合细胞表面的受体发挥生物学效应. 细胞表面有3种受体TGF-β受体即受体Ⅰ、受体Ⅱ和受体Ⅲ. 受体Ⅱ是一类持续活性的丝氨酸/苏氨酸激酶, 与配体结合磷酸化受体Ⅱ使其发挥效应, 继而磷酸化Smad2/Smad3, 随后与Smad4结合形成复合物, 进入细胞核以细胞特异性的方式启动TGF-β靶基因的转录[8]. 有研究显示信号通路TGF-β/Smad4在阿霉素的耐药方面发挥着调节作用, TGF-β可诱导EMT过程, 增强癌细胞的运动和侵袭能力, 使细胞间的连接丧失, 失去极性和细胞骨架重塑, 导致化疗药物对癌细胞的不敏感[9]. Vimentin在胚胎发生和肿瘤转移中被广泛用作于EMT的标志物, 有研究人员Melissa[10]报到指出, 上皮细胞被vimentin或vimentin cDNA作用后能够迅速地获得间质细胞样特性, Snail和Slug等EMT相关的转录因子在广泛的环境下参与了EMT的调控和进程[11,12], Vuoriluoto等[13]、Chaw等[14]和Argast等[15]研究发现vimentin还可通过Slug基因调控乳腺癌细胞的EMT过程, 可见EMT的标志物和相关转录因子能够发生相互作用, 共同调控EMT的发生发展.
在上述实验发现的基础上我们应用TGF-β1 ELISA试剂盒检测了阿霉素处理后TGF-β1的含量变化, 发现RNAi-NC组和RNAi-Smad4组的TGF-β1都较Control组增高(P<0.05). 我们还发现阿霉素还上调了RNAi-NC组和RNAi-Smad4组的磷酸化Smad2/3的表达, 但并没有显著改变Smad2/3的表达. 据此我们推测人结肠癌HCT116细胞对阿霉素的不敏感可能与癌细胞发生了上皮细胞间质细胞样转化过程有关, 可能是由于阿霉素上时间的应用诱导了TGF-β1含量的升高, 并上调了Smad2/3的磷酸化水平, 进而诱导了EMT过程. 而应用基因沉默技术干扰Smad4基因的表达来阻断TGF-β/Smad4信号通路, 进而逆转了EMT过程, 增加了阿霉素对HCT116细胞的敏感性.
总之, 我们推测, 低剂量的阿霉素长时间处理人结肠癌HCT116细胞株, 可诱导其产生阿霉素化疗耐药性, 其大体机制可能与阿霉素诱导了TGF-β/Smad4信号通路的激活, 进一步导致癌细胞发生上皮细胞间质细胞样转化, 联合应用Smad4基因沉默载体可提高阿霉素的作用敏感性, 这为明确阿霉素的化疗耐药的具体机制提出了一条新的思路. 但其中的确切分子生物化学机制, 尤其是启动子水平的研究尚待进一步探索和发现.
本课题组的前期研究显示, 低剂量阿霉素长时间作用于人结肠癌HCT116细胞能诱导对阿霉素的作用不敏感现象, 并上调了上皮细胞间质细胞样转化相关的标志物和转录因子的表达,我们推测阿霉素可能诱导了结肠癌细胞发生了间质细胞样转化. 很多研究表明转化生长因子β参与了多种癌细胞的上皮细胞间质细胞样转化过程.
李家平, 教授, 主任医师, 中山大学附属第一医院肿瘤介入科
RNA干扰[RNAi或RNA沉默(RNA silencing)]是指采用一段特异性的非编码RNA序列结合靶基因的mRNA, 形成细胞核内复合物以阻止目的基因表达的一项分子生物学技术. 有研究报道癌细胞获得耐药性与细胞分化过程中的表观遗传学改变有关, 上皮细胞间质细胞样转化过程(epithelial to mesenchymal transitions, EMT)可能参与了这一过程. EMT过程在近年来很多研究中发现其参与了癌细胞的侵袭,转移和耐药性的产生.
Melissa等报到指出, 上皮细胞被vimentin或vimentin cDNA作用后能够迅速地获得间质细胞样特性. Snail和Slug等EMT相关的转录因子在广泛的环境下参与了EMT的调控和进程. Vuoriluoto等研究发现vimentin还可通过Slug基因调控乳腺癌细胞的EMT过程, 可见EMT的标志物和相关转录因子能够发生相互作用, 共同调控EMT发生发展.
敲低Smad4基因以阻断TGF-β/Smad4信号通路可提高结肠癌的阿霉素化疗敏感性.
敲低Smad4基因用于基因治疗, 以阻断TGF-β/Smad4信号通路, 可能提高结肠癌的阿霉素化疗敏感性, 增强阿霉素的用量, 较少毒性作用和提高杀伤肿瘤细胞的效果. 本研究成果将为设计新的肿瘤化疗方案或开发新型抗肿瘤药物提供新的思路.
本研究通过体外实验发现敲低Smad4基因以阻断TGF-β/Smad4信号通路可提高结肠癌的阿霉素化疗敏感性, 具有一定的创新性, 实验设计科学合理, 为设计新的肿瘤治疗方法的或开发新型抗肿瘤药物提供新的思路.
编辑: 郭鹏 电编:鲁亚静
| 1. | Naber HP, Drabsch Y, Snaar-Jagalska BE, ten Dijke P, van Laar T. Snail and Slug, key regulators of TGF-β-induced EMT, are sufficient for the induction of single-cell invasion. Biochem Biophys Res Commun. 2013;435:58-63. [PubMed] [DOI] |
| 2. | Katsuno Y, Lamouille S, Derynck R. TGF-β signaling and epithelial-mesenchymal transition in cancer progression. Curr Opin Oncol. 2013;25:76-84. [PubMed] [DOI] |
| 3. | 韩 香, 黄 晓丹, 薛 慧婷, 黄 曙, 张 发明, 季 国忠. Smad4通过fascin和cortactin影响肝癌细胞SMMC-7721迁移的研究. 医学研究生学报. 2011;24:676-682. |
| 4. | Wendt MK, Schiemann BJ, Parvani JG, Lee YH, Kang Y, Schiemann WP. TGF-β stimulates Pyk2 expression as part of an epithelial-mesenchymal transition program required for metastatic outgrowth of breast cancer. Oncogene. 2013;32:2005-2015. [PubMed] [DOI] |
| 5. | Taylor MA, Davuluri G, Parvani JG, Schiemann BJ, Wendt MK, Plow EF, Schiemann WP, Sossey-Alaoui K. Upregulated WAVE3 expression is essential for TGF-β-mediated EMT and metastasis of triple-negative breast cancer cells. Breast Cancer Res Treat. 2013;142:341-353. [PubMed] [DOI] |
| 6. | Maillard PV, Ciaudo C, Marchais A, Li Y, Jay F, Ding SW, Voinnet O. Antiviral RNA interference in mammalian cells. Science. 2013;342:235-238. [PubMed] [DOI] |
| 7. | Jain M, Rivera S, Monclus EA, Synenki L, Zirk A, Eisenbart J, Feghali-Bostwick C, Mutlu GM, Budinger GR, Chandel NS. Mitochondrial reactive oxygen species regulate transforming growth factor-β signaling. J Biol Chem. 2013;288:770-777. [PubMed] [DOI] |
| 8. | Zhang L, Zhou F, ten Dijke P. Signaling interplay between transforming growth factor-β receptor and PI3K/AKT pathways in cancer. Trends Biochem Sci. 2013;38:612-620. [PubMed] [DOI] |
| 9. | Yeung TL, Leung CS, Wong KK, Samimi G, Thompson MS, Liu J, Zaid TM, Ghosh S, Birrer MJ, Mok SC. TGF-β modulates ovarian cancer invasion by upregulating CAF-derived versican in the tumor microenvironment. Cancer Res. 2013;73:5016-5028. [PubMed] [DOI] |
| 10. | Mendez MG, Kojima S, Goldman RD. Vimentin induces changes in cell shape, motility, and adhesion during the epithelial to mesenchymal transition. FASEB J. 2010;24:1838-1851. [PubMed] [DOI] |
| 11. | Lander R, Nordin K, LaBonne C. The F-box protein Ppa is a common regulator of core EMT factors Twist, Snail, Slug, and Sip1. J Cell Biol. 2011;194:17-25. [PubMed] [DOI] |
| 12. | Wettstein G, Bellaye PS, Kolb M, Hammann A, Crestani B, Soler P, Marchal-Somme J, Hazoume A, Gauldie J, Gunther A. Inhibition of HSP27 blocks fibrosis development and EMT features by promoting Snail degradation. FASEB J. 2013;27:1549-1560. [PubMed] [DOI] |
| 13. | Vuoriluoto K, Haugen H, Kiviluoto S, Mpindi JP, Nevo J, Gjerdrum C, Tiron C, Lorens JB, Ivaska J. Vimentin regulates EMT induction by Slug and oncogenic H-Ras and migration by governing Axl expression in breast cancer. Oncogene. 2011;30:1436-1448. [PubMed] [DOI] |
| 14. | Chaw SY, Majeed AA, Dalley AJ, Chan A, Stein S, Farah CS. Epithelial to mesenchymal transition (EMT) biomarkers--E-cadherin, beta-catenin, APC and Vimentin--in oral squamous cell carcinogenesis and transformation. Oral Oncol. 2012;48:997-1006. [PubMed] [DOI] |
| 15. | Argast GM, Krueger JS, Thomson S, Sujka-Kwok I, Carey K, Silva S, O'Connor M, Mercado P, Mulford IJ, Young GD. Inducible expression of TGF-β, snail and Zeb1 recapitulates EMT in vitro and in vivo in a NSCLC model. Clin Exp Metastasis. 2011;28:593-614. [PubMed] [DOI] |