修回日期: 2014-04-11
接受日期: 2014-05-29
在线出版日期: 2014-07-08
目的: 观察大鼠在非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)形成过程中肝细胞钙联蛋白(calnexin, CNX)及葡萄糖调节蛋白78(glucose regulated protein 78, GRP78)的表达变化, 旨在探讨CNX及GRP78在非酒精性脂肪肝发生发展中的作用.
方法: ♂SD大鼠20只, 随机分为正常组和NAFLD组, 每组各10只. NAFLD组大鼠采用高脂高糖饮食制备非酒精性脂肪肝动物模型, 正常组大鼠则给予普通饲料喂养, 造模时间为12 wk. 测定各组大鼠血清甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)、低密度脂蛋白(low-density lipoprotein, LDL)、高密度脂蛋白(high-density lipoprotein, HDL)及游离脂肪酸(free fatty acids, FFA)的含量; 采用实时荧光定量PCR检测肝组织中CNX和GRP78 mRNA的表达变化; 采用Western blot检测肝组织中CNX、GRP78、CCATT/增强子结合蛋白同源蛋白(CCATT/enhancer-binding protein homology protein, CHOP)及磷酸化JNK(p-JNK)蛋白的表达变化; 同时采用TUNEL法检测肝细胞凋亡情况.
结果: 与正常组比较, NAFLD组大鼠血清中TG、TC、LDL、FFA含量明显增高(P<0.05或P<0.01), 而HDL则明显下降(P<0.01); Western blot结果显示NAFLD组大鼠肝组织中CNX、GRP78、CHOP及p-JNK蛋白的表达显著高于正常组大鼠; 实时荧光定量PCR结果显示, 与正常组大鼠比较, NAFLD组大鼠肝脏中CNX及GRP78 mRNA水平明显增高(P<0.05); 同时, TUNEL法检测肝细胞凋亡发现NAFLD组大鼠肝细胞凋亡数目较正常组大鼠显著增加(P<0.01).
结论: 钙联蛋白及GRP78表达上调可能参与了非酒精性脂肪肝的发生发展过程.
核心提示: 内质网应激参与了非酒精性脂肪性肝病的发生发展过程, 其介导肝细胞损伤的机制可能与内质网应激时凋亡信号通路中CHOP和p-JNK的表达增加有关.
引文著录: 胡晓霞, 王艳, 王晋星一. Calnexin及GRP78在大鼠非酒精性脂肪肝细胞凋亡中的作用. 世界华人消化杂志 2014; 22(19): 2740-2745
Revised: April 11, 2014
Accepted: May 29, 2014
Published online: July 8, 2014
AIM: To observe the changes in calnexin and GRP78 expression in nonalcoholic fatty liver disease (NAFLD) induced with a high-fat, high-sugar diet and to explore their role in hepatocyte apoptosis in rats with nonalcoholic fatty liver disease.
METHODS: Twenty male SD rats were randomly divided into either a normal control group or an NAFLD group. The rats of the NAFLD group were given a high-fat, high-sugar diet for 12 wk to induce NAFLD, while the rats of normal control group were given an ordinary diet. Triglyceride (TG), total cholesterol (TC), low-density lipoprotein (LDL), high-density lipoprotein (HDL) and free fatty acids (FFA) were evaluated. Real-time fluorescence quantitative PCR was applied to detect the mRNA expression of calnexin and GRP78 in liver tissues, and Western blot was applied to detect the protein expression of calnexin, GRP78, CHOP and p-JNK. Meanwhile, cell apoptosis in the liver was detected by TUNEL assay.
RESULTS: Compared with the control group, serum levels of TG, TC, LDL and FFA significantly increased in the NAFLD group (P < 0.05 or P < 0.01), while the level of HDL was decreased (P < 0.01). Western blot analysis showed that the expression of calnexin, GRP78, CHOP and p-JNK proteins in the NAFLD group was significantly higher than that in the control group. Compared with the control group, the mRNA expression of calnexin and GRP78 was also increased in the NAFLD group (P < 0.05). TUNEL assay showed that the apoptosis of hepatocytes in the NAFLD group was significantly elevated (P < 0.01).
CONCLUSION: The up-regulation of calnexin and GRP78 may be involved in the pathogenesis of NAFLD.
- Citation: Hu XX, Wang Y, Wang JXY. Role of calnexin and GRP78 in hepatocyte apoptosis in rats with nonalcoholic fatty liver disease. Shijie Huaren Xiaohua Zazhi 2014; 22(19): 2740-2745
- URL: https://www.wjgnet.com/1009-3079/full/v22/i19/2740.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i19.2740
随着人们饮食结构、生活方式的改变, 日常膳食中以脂肪为代表的高热量食物所占比例明显增加, 因此伴随与代谢异常密切相关的非酒精性脂肪肝病(nonalcoholic fatty liver disease, NAFLD)的发病率大幅上升, 已成为21世纪全球重要的公共健康问题之一. NAFLD是一种与饮酒无关、由多种病因引起的以肝细胞内脂质蓄积过多为病理特征的疾病, 病情由轻到重包括单纯性脂肪肝、非酒精性脂肪性肝炎及脂肪性肝硬化[1,2]. 在我国, NAFLD是仅次于病毒性肝炎的常见肝脏疾病, 但目前关于NAFLD的发病机制尚未完全阐明. 近年来研究人员对内质网应激(endoplasmic reticulum stress, ERS)信号通路在代谢综合征中的作用进行了大量研究[3,4], 但ERS与NAFLD的相关研究鲜有报道. 钙联蛋白(calnexin, CNX)及葡萄糖调节蛋白78(glucose regulated protein 78, GRP78) 均为内质网分子伴侣, 在ERS时CNX及GRP78的表达上调, 以维持内质网的稳定, 但如果ERS持续存在, 也可介导细胞凋亡的发生, 从而导致组织的损伤[5,6]. 本研究以非酒精性脂肪肝大鼠为对象, 观察在非酒精性脂肪肝发生过程中CNX及GRP78的表达变化, 并探讨他们在非酒精性脂肪肝发生发展中的可能作用.
健康清洁级SD大鼠购自贵阳医学院实验动物中心[许可证号: SCXK-(黔)2002-0001]; 兔抗大鼠多克隆CNX、GRP78、CCATT/增强子结合蛋白同源蛋白(CCATT/enhancer-binding protein homology protein, CHOP)及p-JNK抗体购自美国Santa Cruz公司; 甘氨酸、十二烷基硫酸钠、丙烯酰胺、三羟甲基氨基甲烷、过硫酸铵均购自北京鼎国昌盛生物技术有限公司; PVDF膜及ECL化学发光试剂盒购自美国Millipore公司; 逆转录试剂盒及SYBR Green购自大连宝生物工程有限公司; 原位末端标记法(TUNEL)检测试剂盒由碧云天试剂公司提供; CNX、GRP78及内参β-actin引物委托上海生工设计合成. 引物序列如下: CNX: 上游引物5'-CCTCTGCCGCTGTCTCCACT-3'; 下游引物5'-AAAGCACTTGAGGTCATTCT-3'. GRP78: 上游引物5'-TGGAATCTTCACCTCAGAGTG-3'; 下游引物5'-ATATCCAAGGTGAACACACAC-3'. β-actin: 上游引物5'-TCCTCCTGAGCGCAAGTACTCT-3'; 下游引物5'-GCTCAGTAACAGTCCGCCTAGA-3'.
1.2.1 动物分组及动物模型复制: 健康♂SD大鼠20只, 体质量160-180 g, 在恒温(25 ℃)、光照周期12-12 h环境中适应性饲养1 wk后进行实验. 将实验动物随机分为2组: 正常对照组和非酒精性脂肪肝组(NAFLD组), 每组各10只. NAFLD组大鼠给予高脂高糖饲料(78%基础饲料, 15%猪油, 5%蔗糖, 2%胆固醇)喂养, 造模时间为12 wk; 正常对照组大鼠则给予普通饲料喂养. 造模结束后股动脉放血处死大鼠, 留取血液及全部肝脏组织, 肝组织保存于-80 ℃低温冰箱以备进行Western blot及PCR检测; 血液1000 r/min离心15 min后将血清分装置于-80 ℃低温冰箱保存.
1.2.2 肝组织病理学检查: 新鲜肝组织于4%多聚甲醛溶液中固定48 h后, 经石蜡包埋、切片及HE染色后在显微镜下观察肝组织的病理学改变.
1.2.3 血清生化指标检测: 血清甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)、低密度脂蛋白(low-density lipoprotein, LDL)、高密度脂蛋白(high-density lipoprotein, HDL)及游离脂肪酸(free fatty acid, FFA)的含量采用日立7170A全自动生化分析仪测定.
1.2.4 实时荧光定量PCR检测肝组织中CNX和GRP78 mRNA的表达: 按试剂盒说明书提取肝组织总RNA, 逆转录合成cDNA; 以合成的cDNA为模板进行实时荧光定量PCR检测, 反应体系为25 μL: 2×SYBR GreenⅠ12.5 μL, 10 μmol/L上、下游引物各1.0 μL, 反转录产物 2 μL, DEPC H2O补足体积. 反应条件为50 ℃ 2 min, 95 ℃ 10 min, 95 ℃ 15 s, 60 ℃ 1 min, 最后两步重复40个循环. 以每例标本组织的目的片段与内参β-actin的循环值的比值作为该样本的基因表达的相对数值.
1.2.5 Western blot检测肝组织中CNX、GRP78、CHOP及p-JNK蛋白的表达情况: 按试剂盒说明书提取肝组织总蛋白, 采用BCA法进行蛋白定量, 蛋白样品(含80 μg总蛋白)经SDS-PAGE电泳后, 采用半干电转移将蛋白质分子从聚丙烯酰胺凝胶转移到PVDF膜上, 电转移结束后PVDF膜置于封闭缓冲液中室温下封闭1 h. 封闭完成后洗膜缓冲液洗膜3次, 然后将PVDF膜与一抗稀释液(CNX、GRP78、CHOP稀释比例为1:1000, p-JNK稀释比例为1:500)4 ℃封闭过夜. 次日早上用洗膜缓冲液洗膜3次后, PVDF膜与二抗稀释液(1:3000)在室温下孵育1 h. 洗膜缓冲液洗膜3次后加入化学发光试剂, 室温下与PVDF膜孵育1 min, 然后在暗室中用Kodak胶片进行放射自显影.
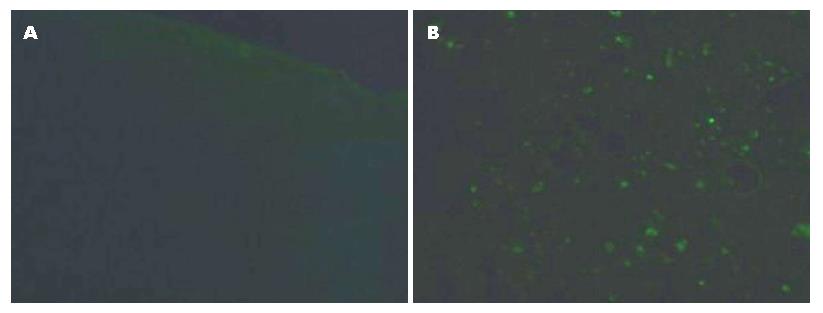
1.2.6 TUNEL法检测肝组织中肝细胞凋亡情况: 严格按照试剂盒说明书进行操作. 在显微镜下观察凋亡的细胞, 以胞核被标记上绿色荧光的细胞作为凋亡细胞, 并计算凋亡指数. 凋亡指数 = (凋亡细胞数/细胞总数)×100%.
统计学处理 计量资料以mean±SD表示, 用SPSS13.0版进行组间方差分析. P<0.05为差异有统计学意义.
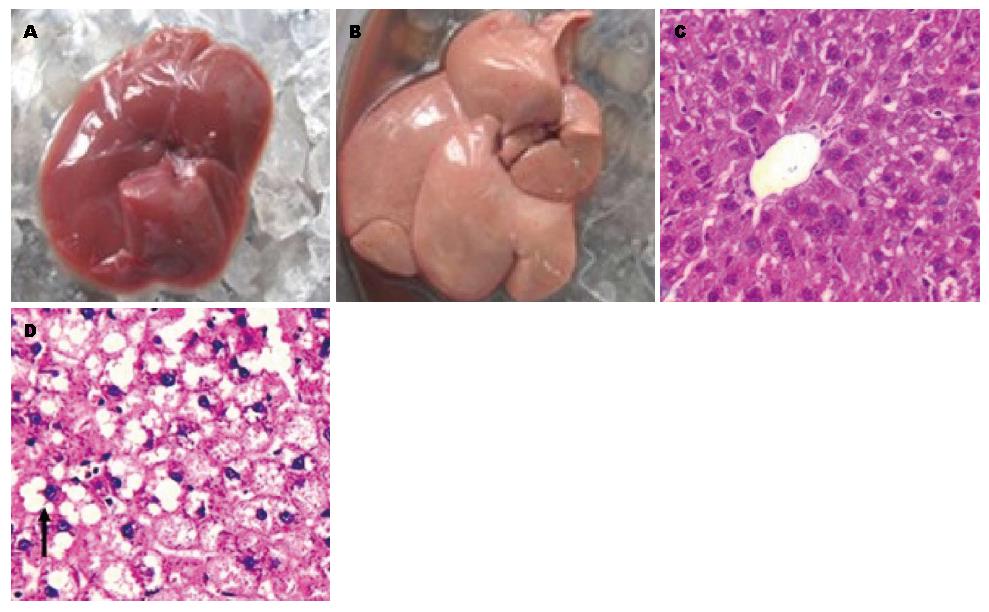
如图1所示, 正常组大鼠肝脏外观为暗红色, 表面光滑; NAFLD组大鼠肝脏体积较正常组大鼠有所增大, 且包膜紧张, 肝脏颜色呈乳黄色, 触之有油腻感; 肝组织切片经HE染色后在光学显微镜下观察发现, 正常组大鼠肝细胞以中央静脉为中心呈放射状排列, 肝细胞分界清晰, 大小较一致, 肝窦排列规则, 汇管区清晰, 无炎症反应. NAFLD组大鼠肝小叶结构明显紊乱, 肝细胞发生肿大, 胞质内充满大量大小不等的圆形脂滴, 肝细胞发生明显的空泡样变性, 呈中重度单纯性脂肪肝改变.
与正常对照组大鼠比较, NAFLD组大鼠血清TG、TC、LDL与FFA浓度均显著增加, 而HDL水平则明显降低, 差异具有统计学意义. 各组大鼠血清TG、TC、LDL、HDL及FFA结果如表1.
实时荧光定量PCR结果显示, 与正常对照组比较, NAFLD组大鼠肝组织中CNX及GRP78 mRNA表达明显增高, 差异具有显著性(P<0.05). 各组大鼠肝组织中CNX及GRP78 mRNA表达情况如表2.
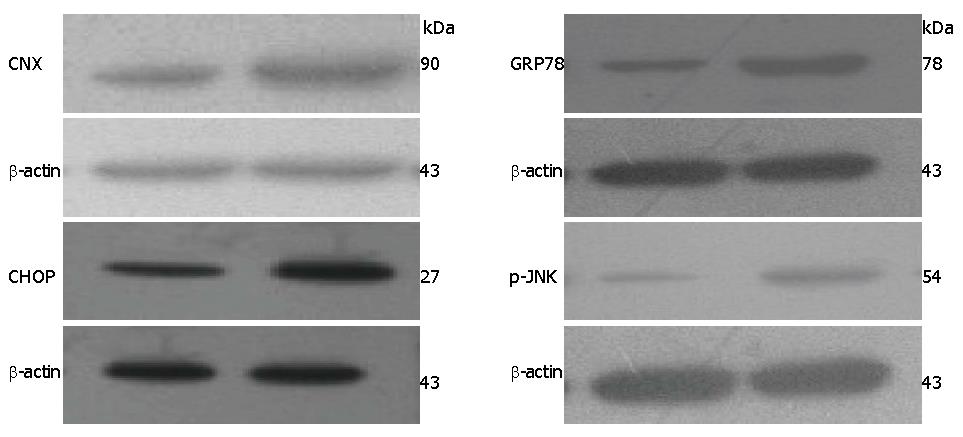
Western blot结果显示, 正常肝组织内有少量CNX、GRP78、CHOP及p-JNK蛋白表达, 而NAFLD组大鼠肝组织中CNX、GRP78、CHOP及p-JNK的表达均显著增加. 各组大鼠肝组织中CNX、GRP78、CHOP及p-JNK蛋白表达情况如图2.
肝脏是脂类代谢的重要场所, 大量研究表明高脂血症是导致脂肪肝的主要原因之一. NAFLD患者临床上常存在着明显的脂质代谢紊乱, 提示NAFLD与血脂异常存在着密切的关系[7,8]. 本实验采用高脂高糖饮食喂养大鼠, 12 wk后NAFLD组大鼠发生了明显的脂质代谢紊乱及高脂血症, 血清生化检查结果表明大鼠血清TG、TC、LDL、FFA水平明显高于正常组, 而HDL水平则较正常组显著降低. 同时, 肝组织病理学检查也发现NAFLD组大鼠肝脏呈现单纯性脂肪肝改变, 上述实验结果表明非酒精性脂肪肝大鼠动物模型的复制是成功的.
内质网是真核细胞内重要的亚细胞器, 具有调节细胞内蛋白质合成后的折叠与聚集、细胞的应激反应以及维持细胞内钙离子水平等功能[9], 同时内质网也参与脂类的代谢过程. 内质网应激(endoplasmic reticulum stress, ERS)是指在多种生理或病理条件下细胞内质网钙稳态失衡或蛋白质加工运输障碍、生理功能发生紊乱的一种亚细胞器的病理过程[10]. CNX是内质网中的Ⅰ型跨膜蛋白, 是一种重要的类凝集素分子伴侣, 参与细胞内的许多重要生物学功能, 如辅助新合成肽链的折叠、装配和转位等[11,12]. 关于CNX与非酒精性脂肪性肝病的研究国内外鲜有报道. GRP78同样是分布于内质网的分子伴侣, 其主要作用与CNX类似, 也是协助蛋白质的折叠, 装配和运输. 在ERS条件下, CNX和GRP78的表达会显著增加, 故他们可以作为ERS的标志蛋白[13]. 本次研究发现, 给予高脂高糖饮食诱导NAFLD 12 wk后, 大鼠肝组织中CNX和GRP78在蛋白及基因水平的表达显著增高, 说明在NAFLD的发生发展过程中存在内质网应激反应. 适当的ERS有利于细胞内环境稳态的恢复和维持细胞存活, 是细胞启动的一种自我保护反应机制, 但长期持续的ERS则可以损伤内质网的功能, 此时细胞将启动内质网相关的凋亡程序[14]. ERS 触发细胞凋亡的机制有以下几条途径: (1)活化Caspase12; (2)JNK磷酸化; (3)转录产生CHOP增多, 通过上述3条途径使肝细胞凋亡增加, 从而导致肝细胞损伤[15]. 在本次研究中发现, 高脂高糖饮食诱导大鼠NAFLD 12 wk后, 大鼠肝组织中CHOP及p-JNK的表达显著高于正常组大鼠, 这一结果与曹洁等[16]在软脂酸钠诱导的脂肪变性肝细胞凋亡中的研究结果一致. 此外, 我们采用TUNEL法检测发现NAFLD组大鼠肝细胞凋亡较正常对照组显著增加, 提示在NAFLD的发生发展过程中不仅发生了明显的ERS反应, 同时还启动了ERS相关的凋亡程序. ERS发生时可能通过上调CHOP和p-JNK的表达介导脂肪变性的肝细胞发生凋亡, 从而导致肝组织的损伤, 这可能是NAFLD发生的重要机制之一.
非酒精性脂肪性肝病是肝硬化和肝癌的重要病因, 近年来其发病率不断上升, 在我国它已成为仅次于病毒性肝炎的常见肝病. 目前非酒精性脂肪性肝病的发生机制尚未完全阐明, 因此关于其发病机制的研究一直是肝病研究的热点.
郭永红, 副主任医师, 西安交通大学医学院第二附属医院感染科
内质网应激是指由于某种病因引起内质网的生理功能发生紊乱, 从而导致大量错误折叠或未折叠的蛋白质在内质网腔内聚集的一种亚细胞器的病理过程. 近年来关于内质网应激信号通路在代谢综合征中的研究十分广泛, 但其与非酒精性脂肪性肝病发病机制之间的关系鲜有报道.
有研究人员发现用软脂酸钠诱导体外培养的肝细胞发生脂肪变性的过程中存在内质网应激反应, 且内质网应激时可通过上调CHOP和p-JNK的表达介导脂肪变性的肝细胞发生凋亡.
本次研究发现, 在非酒精性脂肪性肝病大鼠肝组织中GRP78及calnexin的表达增加, 进一步证实了在非酒精性脂肪肝的发生过程中有内质网应激的参与, 且内质网应激可能通过上调CHOP和p-JNK的表达介导脂肪变性的肝细胞发生凋亡, 导致肝组织的损伤, 这可能是非酒精性脂肪性肝病重要的发病机制之一.
内质网应激是非酒精性脂肪性肝病发生发展过程中一个重要的环节. 减少内质网应激导致的肝细胞凋亡有望成为防治非酒精性脂肪性肝病的有效途径之一.
本文对内质网应激在非酒精性脂肪性肝病中的作用进行了初步探讨, 具有一定的学术价值.
编辑: 田滢 电编:鲁亚静
| 2. | Kim CH, Younossi ZM. Nonalcoholic fatty liver disease: a manifestation of the metabolic syndrome. Cleve Clin J Med. 2008;75:721-728. [PubMed] |
| 4. | Marciniak SJ, Ron D. Endoplasmic reticulum stress signaling in disease. Physiol Rev. 2006;86:1133-1149. [PubMed] |
| 6. | Guérin R, Arseneault G, Dumont S, Rokeach LA. Calnexin is involved in apoptosis induced by endoplasmic reticulum stress in the fission yeast. Mol Biol Cell. 2008;19:4404-4420. [PubMed] [DOI] |
| 9. | Hosoi T, Ozawa K. Endoplasmic reticulum stress in disease: mechanisms and therapeutic opportunities. Clin Sci (Lond). 2010;118:19-29. [PubMed] [DOI] |
| 10. | 温 韬, 张 海燕, 卢 静, 李 胜利, 王 晶晶, 朴 正福. 内质网应激在四氯化碳致大鼠急性肝损伤中的作用探讨. 胃肠病学和肝病学杂志. 2008;17:786-789. |
| 12. | Powers-Fletcher MV, Jambunathan K, Brewer JL, Krishnan K, Feng X, Galande AK, Askew DS. Impact of the lectin chaperone calnexin on the stress response, virulence and proteolytic secretome of the fungal pathogen Aspergillus fumigatus. PLoS One. 2011;6:e28865. [PubMed] [DOI] |
| 13. | Inokuchi Y, Nakajima Y, Shimazawa M, Kurita T, Kubo M, Saito A, Sajiki H, Kudo T, Aihara M, Imaizumi K. Effect of an inducer of BiP, a molecular chaperone, on endoplasmic reticulum (ER) stress-induced retinal cell death. Invest Ophthalmol Vis Sci. 2009;50:334-344. [PubMed] [DOI] |
| 14. | Prins D, Michalak M. Endoplasmic reticulum proteins in cardiac development and dysfunction. Can J Physiol Pharmacol. 2009;87:419-425. [PubMed] [DOI] |