修回日期: 2014-05-10
接受日期: 2014-05-19
在线出版日期: 2014-07-08
目的: 研究内源性一氧化氮(nitric oxide, NO)/一氧化氮合酶(nitricoxide synthase, NOS)体系及一氧化碳(carbonic oxide, CO)/血红素合酶(heme oxygenase, HO-1)体系对肝硬化大鼠门静脉压力的影响, 探讨NO/NOS体系及CO/HO-1体系在大鼠肝硬化门静脉高压中的作用.
方法: 将SD大鼠随机分为4组: 正常对照组(NC组)、正常对照+左旋硝基精氨酸甲酯(L-NAME)+锌原卟啉-Ⅸ(Znpp-Ⅸ)组(NC+L-NAME+ ZnPP-Ⅸ组)、肝硬化模型组(CIRM组)、肝硬化模型+左旋硝基精氨酸甲酯(L-NAME)+锌原卟啉-Ⅸ(Znpp-Ⅸ)组(CIRM+L-NAME+ZnPP-Ⅸ组). 均用插管法测定门静脉压力, 用硝酸还原酶法测定血浆中NO含量, 联二亚硫酸盐还原法测定血浆CO含量, 运用蛋白免疫印迹技术(Western blot)测定肝组织中内皮细胞一氧化氮合酶(endothelial nitricoxide synthase, eNOS)、诱导型一氧化氮合酶(inducible nitricoxide synthase, iNOS)及HO-1蛋白的表达情况.
结果: 与NC组相比, CIRM组血浆NO、CO含量明显升高(160.12 μmol/L±4.18 μmol/L, 111.12 μmol/L±2.26 μmol/L vs 81.11 μmol/L±2.91 μmol/L, 70.51 μmol/L±3.10 μmol/L, 均P<0.01), 门静脉压力明显升高(16.08 mmHg±1.16 mmHg vs 9.85 mmHg±1.10 mmHg, P<0.01), 肝组织中iNOS及HO-1蛋白含量明显升高(165.69±1.17, 155.79±1.29 vs 135.22±0.54, 125.44±0.94, 均P<0.01), 但eNOS在肝组织的表达却明显降低(118.65±1.29 vs 160.77±2.12, P<0.01), 而NC+L-NAME+ZnPP-Ⅸ组NO、CO含量则明显降低(52.06 μmol/L±3.17 μmol/L, 52.51 μmol/L±2.63 μmol/L, 均P<0.01), 门静脉压力无统计学意义, 肝组织中eNOS、iNOS及HO-1蛋白含量亦明显降低(130.83±1.57, 120.81±1.47, 111.03±1.45, 均P<0.01); 与CIRM组相比, CIRM+L-NAME+ZnPP-Ⅸ组血浆NO、CO含量明显降低(100.24 μmol/L±3.80 μmol/L, 83.73 μmol/L±1.78 μmol/L, 均P<0.01), 门静脉压力明显降低(14.13 mmHg±0.56 mmHg, P<0.01), 肝组织中eNOS、iNOS及HO-1蛋白含量明显降低(87.50±1.07, 150.66±1.42, 139.88±1.73, 均P<0.01).
结论: NO、CO作为新型气体信号分子, 与肝硬化门静脉压力的变化密切相关, 而NO、CO抑制剂的干预研究则进一步证明了内源性NO/NOS体系及CO/HO-1体系对肝硬化门静脉高压的形成具有重要的调节作用.
核心提示: 内源性一氧化氮(nitric oxide)/一氧化氮合酶(nitricoxide synthase)体系及一氧化碳(carbonic oxide)/血红素合酶(Heme oxygenase)体系参与了肝硬化门静脉高压的形成, 对门静脉压力具有重要的调节作用.
引文著录: 宋丽秀, 陈卫刚, 郑勇, 张宁, 齐翠花. 内源性一氧化氮/一氧化氮合酶体系及一氧化碳/血红素合酶体系对大鼠肝硬化门静脉压力的影响. 世界华人消化杂志 2014; 22(19): 2686-2691
Revised: May 10, 2014
Accepted: May 19, 2014
Published online: July 8, 2014
AIM: To assess the effect of endogenous nitric oxide/nitric oxide synthase (NO/NOS) and carbon monoxide/heme oxygenase-1 (CO/HO-1) on the portal pressure (PP) in rats with hepatic cirrhosis, and to explore the role of NO/NOS and CO/HO-1 system in the development of portal hypertension (PH).
METHODS: Sprague-Dawley rats were randomly divided into three groups: a normal control group (NC), a cirrhosis model group (CIRM), and a cirrhosis model + L-NAME + ZnPP-Ⅸ group (CIRM + L-NAME + ZnPP-Ⅸ). PP was measured using indwelling catheters. Plasma concentration of NO was detected using the nitrate reductase method, and the plasma CO was measured using the Chalmers method. The expression and localization of endothelial NOS (eNOS), inducible NOS (iNOS) and HO-1 in endothelial cells of the portal vein (PV) were studied by immunohistochemistry. Western blot was used to analyze hepatic tissue eNOS, iNOS and HO-1 protein expression.
RESULTS: Compared with the NC group, the CIRM group had significant increases in plasma NO and CO (160.12 μmol/L ± 4.18 μmol/L, 111.12 μmol/L ± 2.26 μmol/L vs 81.11 μmol/L ± 2.91 μmol/L, 70.51 μmol/L ± 3.10 μmol/L, P < 0.01), PP (16.08 mmHg ± 1.16 mmHg vs 9.85 mmHg ± 1.10 mmHg, P < 0.01), and the expression of eNOS, iNOS and HO-1 (165.59 ± 1.71, 164.66 ± 1.34, 166.38 ± 1.17, P < 0.01), but a significant decrease in hepatic expression of eNOS (118.65 ± 1.29 vs 160.77 ± 2.12, P < 0.01); however, the NC + L-NAME + ZnPP-Ⅸ group showed significant decreases in plasma NO and CO (52.06 μmol/L ± 3.17 μmol/L vs 52.51 μmol/L ± 2.63 μmol/L, P < 0.01), and the hepatic expression of eNOS, iNOS and HO-1 (130.83 ± 1.57, 120.81 ± 1.47, 111.03 ± 1.45, P < 0.01), although the PP showed no significant difference. Compared with the CIRM group, the CIRM + L-NAME + ZnPP-Ⅸ group had significant decreases in plasma NO and CO (100.24 μmol/L ± 3.80 μmol/L, 83.73 μmol/L ± 1.78 μmol/L, P < 0.01), PP (14.13 mmHg ± 0.56 mmHg, P < 0.01), and hepatic expression of eNOS, iNOS, and HO-1 (87.50 ± 1.07, 150.66 ± 1.42, 139.88 ± 1.73, P < 0.01).
CONCLUSION: NO and CO as new messengers may have a very close correlation with the PH, and the NO/NOS and CO/HO-1 system serve as an important regulatory system for the PH.
- Citation: Song LX, Chen WG, Zheng Y, Zhang N, Qi CH. Effect of endogenous nitric oxide/nitric oxide synthase and carbon monoxide/heme oxygenase-1 on portal pressure in rats with hepatic cirrhosis. Shijie Huaren Xiaohua Zazhi 2014; 22(19): 2686-2691
- URL: https://www.wjgnet.com/1009-3079/full/v22/i19/2686.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i19.2686
门静脉高压症是以门静脉系统血流动力学异常为特征, 而高动力循环是肝硬化门脉高压的特征性改变, 这种高动力循环的状态的发生机制中, 目前国内外的研究结果已经达成共识, 即内脏及外周血管广泛扩张是其主要原因所在. 气体信号分子一氧化氮(nitric oxide, NO)、一氧化碳(carbonic oxide, CO)是近几年发现的血管活性物质, 参与血管张力的调节, 在肝硬化门静脉高压中的形成中具有重要的作用. 本研究通过抑制内源性NO、CO的产生, 观察肝硬化大鼠门静脉压力变化, 测定NO、CO相关酶学的含量, 以探讨内源性一氧化氮(nitric oxide, NO)/一氧化氮合酶(nitricoxide synthase, NOS)体系及一氧化碳(carbonic oxide, CO)/血红素合酶(heme oxygenase, HO-1)体系在肝硬化门静脉高压的形成中的作用.
左旋硝基精氨酸甲酯(L-NAME)、锌原卟啉-Ⅸ(Znpp-Ⅸ)购自Sigma公司; 即用型NO测定试剂盒购自南京建成生物工程研究院, 内皮细胞一氧化氮合酶(endothelial nitricoxide synthase, eNOS)、诱导型一氧化氮合酶(inducible nitricoxide synthase, iNOS)、HO-1多克隆抗体购自Santa Cruz公司; 其他试剂均为市售化学纯. T1800紫外分光光度计、美国BIOPAC公司MP150型多导生理仪、凝胶图像系统(BIO-RAD Gel 2000)等.
1.2.1 肝硬化模型的制备: 给实验组大鼠皮下注射40%的四氯化碳植物油溶液, 首次注射0.5 mL/100 g, 以后4 d/次, 每次0.3 mL/100 g, 用30%的乙醇溶液代替饮用水, 前2 wk用20%猪油+80%玉米面饲养, 后用0.5%胆固醇粉+玉米面饲养. 对照组大鼠皮下注射生理盐水, 频度及剂量同实验组, 采用标准饲养法. 根据本课题组以往造模经验, 在造模52 d时, 大鼠可形成典型的肝硬化表现.
1.2.2 实验动物分组: 将SD大鼠随机分为4组: 正常对照组(NC组, n = 6)、正常对照+左旋硝基精氨酸甲酯(L-NAME)+锌原卟啉-Ⅸ(Znpp-Ⅸ)组(NC+L-NAME+ZnPP-Ⅸ组, n = 6)、肝硬化模型组(CIRM组, n = 8)、肝硬化模型+左旋硝基精氨酸甲酯(L-NAME)+锌原卟啉-Ⅸ(Znpp-Ⅸ)组(CIRM+L-NAME+ZnPP-Ⅸ组, n = 8). NC+L-NAME+ZnPP-Ⅸ组和CIRM+L-NAME+ZnPP-Ⅸ组在造模52 d后给予腹腔注射L-NAME(5 mg/kg)、皮下注射Znpp-Ⅸ(20 μmol/kg), 1次/d, 共7 d; 同等方式、同等剂量予NC组、CIRM组生理盐水, 1次/d, 共7 d.
1.2.3 门静脉压力测定: 用10%的水合氯醛腹腔麻醉(0.35 mL/100 g), 门静脉插管(本课题组改良此方法, 利用头皮针穿刺测定). 将头皮针一端连接于生理多导仪的三通管测压端, 三通管的侧端连接一5 mL注射器, 注射器内充满肝素钠, 推动注射器, 使注射器内的肝素钠充满头皮针管腔, 以防血液凝固, 并排除头皮针管腔内气泡, 以免影响门静脉压力的测定结果. 将大鼠固定在手术台上, 于大鼠腹中线部位剪开皮肤和腹肌, 然后再剪开大鼠侧面的皮肤和肌肉, 以充分暴露腹腔, 寻找门静脉主干, 钝性分离门静脉, 然后用眼科镊的柄端固定门静脉, 将连接于多导生理仪上的头皮针倾斜5度向大鼠尾端刺入, 使头皮针在门静脉中处于悬浮状态, 观察大鼠门静脉压力的变化, 待计算机上的压力曲线趋于稳定时, 记录此时门静脉压力数据.
1.2.4 血浆NO、CO的检测: 大鼠处死前抽取门静脉血, 硝酸还原酶法测定血浆中NO含量, 联二亚硫酸盐还原法测定血浆CO含量[1].
1.2.5 形态学观察: 肝组织用40 g/L的甲醛溶液固定, 常规制成石蜡切片, 行苏木精-伊红染色, 光镜下观察肝脏形态学改变.
1.2.6 Western blot检测分析: 取制备好的组织蛋白提取液行Western blot分析, 测定肝组织中eNOS、iNOS、HO-1蛋白的表达. 用凝胶成像系统测定曝光后条带的灰度值(A), 以相应区带的A值相对于对照组的倍数表示, 并用β-actin作为内参校正上样量.
统计学处理 采用SPSS13.0统计学软件包, 数据以mean±SD表示, 多组间比较采用完全随机设计方差分析法(One-way ANOVA). P<0.05为差异有统计学意义.
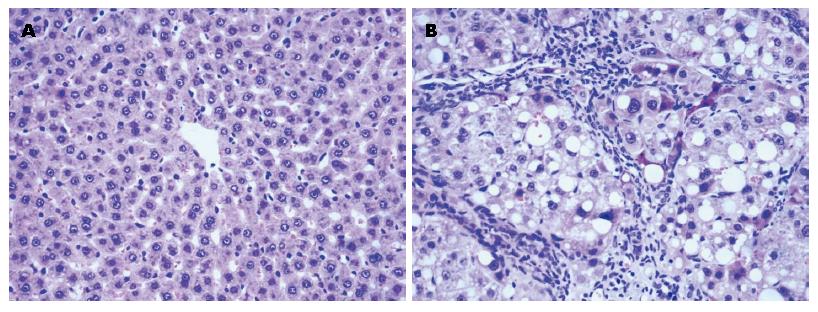
肝硬化大鼠肝脏变形, 表面凹凸不平呈结节状, 质地硬, 镜下见肝细胞再生, 脂肪变性、纤维结缔组织增生及假小叶形成(图1).
与NC组相比, CIRM组门静脉压力明显升高(16.08 mmHg±1.16 mmHg vs 9.85 mmHg±1.10 mmHg, P<0.01), NC+L-NAME+ZnPP-Ⅸ组门静脉压力则无明显差异; 与CIRM组相比, CIRM+L-NAME+ZnPP-Ⅸ组门静脉压力明显降低(14.13 mmHg±0.56 mmHg)(P<0.01)(表1).
CIRM组血浆NO、CO含量与NC组相比明显升高(160.12 μmol/L±4.18 μmol/L, 111.12 μmol/L±2.26 μmol/L vs 81.11 μmol/L±2.91 μmol/L, 70.51 μmol/L±3.10 μmol/L(均P<0.01); 与CIRM组相比, CIRM+L-NAME+ZnPP-Ⅸ组血浆NO、CO含量明显降低(100.24 μmol/L±3.80 μmol/L, 83.73 μmol/L±1.78 μmol/L(均P<0.01)(表2).
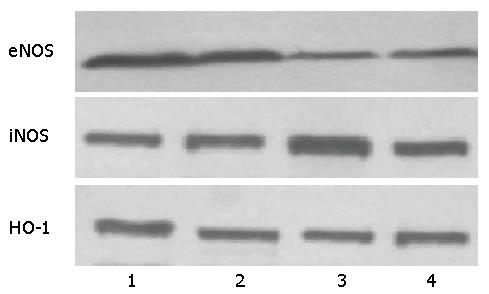
测定CIRM组肝组织中iNOS及HO-1蛋白含量较NC组明显升高(165.69±1.17, 155.79±1.29 vs 135.22±0.54, 125.44±0.94, 均P<0.01), 但eNOS在肝组织的表达却明显降低(118.65±1.29 vs 160.77±2.12, P<0.01), NC+L-NAME+ZnPP-Ⅸ组肝组织中eNOS、iNOS及HO-1蛋白含量亦明显降低(130.83±1.57, 120.81±1.47, 111.03±1.45, 均P<0.01); 与CIRM组相比, CIRM+L-NAME+ZnPP-Ⅸ组肝组织中eNOS、iNOS及HO-1蛋白含量明显降(87.50±1.07, 150.66±1.42, 139.88±1.73, 均P<0.01)(表3, 图2).
肝硬化门静脉高压症发生发展存在两种因素, 一种是启动因素即门静脉流出道血管阻力增高, 主要由各种病因导致的肝硬化所致; 另一种是维持和发展因素即高动力循环状态, 对其发生机制, 可能与血管扩张物质增多、缩血管物质相对减少以及血管对内源性缩血管物质反应性降低有关[2,3]. 参与门静脉高压高动力循环的因子主要有NO、CO、肿瘤坏死因子、内毒素和内皮素等. NO在许多生理系统和病理生理状态中具有介质、信使或细胞功能调节因子的功能, 是一种很活跃的自由基, 他是由左旋精氨酸通过NOS的催化与氧结合而成的. 有研究表明[4,5]肝硬化时NO合成酶的活性降低, 导致肝窦内皮细胞NO产生减少, 使星状细胞收缩性增强从而使肝内血管阻力增加, 造成门静脉高压. 所以, NO/NOS体系是高动力循环形成和维持的关键. CO也是重要的扩血管物质, 对保持门脉血管的松弛状态, 尤其是保持肝窦的舒张状态起着极其重要的作用, 血红素氧合酶(heme oxygenase, HO)的生理降解为CO的主要来源. 在肝硬化门静脉高压时, HO的表达明显增强, 全血CO水平也明显升高[6-8], 当用ZnPP(HO抑制剂)消除内源性CO, 能引起肝血管阻力的明显升高[9], 门静脉压力显著降低, 但对正常大鼠只能引起平均动脉压轻度升高, 这表明了门静脉高压时大鼠CO生成增多, 在门静脉高血流高动力循环状态中发挥了重要的作用[10], 主要机制是通过作用于肝窦周围的肝星状细胞而发挥的[11,12].
NOS与HO目前证明在门静脉中有表达, 且多存在于内皮细胞中. NO、CO虽然均为扩血管物质, 对肝脏的血液循环有重要的调节作用, 但两者对肝脏微循环的作用是不同的: NO主要为肝动脉扩张剂, 对门脉血管床影响较小, 但CO是肝血管阻力的主要调节者, 对维持门脉舒张、保持肝窦松弛状态有着重要的作用.
本课题组以往研究[13]发现, 在大鼠肝硬化发展的不同阶段, 血浆NO、CO含量是不同的, 郑勇等[4]、赵海峰[14]通过对肝硬化患者进行门静脉压力及血浆NO、CO含量的测定, 均说明了NO、CO在肝硬化门静脉高压的形成和维持中发挥了重要的作用. 本研究发现, 在肝硬化发生发展过程中, NO、CO的含量明显升高, 这与目前的研究报道相一致. Pannen等[9]用ZnPP消除内源性CO, 能引起肝血管阻力的明显升高, 而L-NAME则仅能引起肝血管阻力的轻微上升. 本研究同时抑制了内源性NO和CO的产生, 通过Western blot法测定了肝组织中eNOS、iNOS、 HO-1蛋白的含量, 结果发现iNOS、HO-1蛋白在肝组织中的表达较NC组明显升高, 而CIRM+L-NAME+ZnPP-Ⅸ组各项观察指标则较CIRM组明显降低, 这同目前的研究报道以及本课题组以往的研究一致, 这说明了通过外源性给予NO和CO的抑制剂, 可以改变与其相关的酶的变化, 进而改变血浆中NO和CO含量. 在实验过程中, 还发现了eNOS在肝组织中的表达却是相反的, CIRM组的蛋白表达明显低于NC组, 结果说明了肝硬化血浆中NO的过量生成主要是iNOS高表达所致.
除此之外, 本研究最重要的一项是观察了各组大鼠门静脉压力的变化, 从而更直接的说明了NO和CO对门静脉压力的影响. 结果发现: CIRM组门静脉压力明显高于NC组, NC+L-NAME+ZnPP-Ⅸ组与NC组相比, 门静脉压力无明显改变, 而CIRM+L-NAME+ZnPP-Ⅸ组的压力则明显低于CIRM组, 说明了NO和CO对门静脉压力具有重要的影响.
总之, 本研究结果表明NO/NOS体系及CO/HO-1体系参与了肝硬化门静脉高压的形成, 对门静脉压力具有重要的调节作用, 而其具体的作用机制还有待进一步的研究.
一氧化氮(nitric oxide, NO)、一氧化碳(carbonic oxide, CO)作为气体信号分子在门静脉高压发病过程中发挥着重要的生物学作用, 具体机制尚不明确.
杨家和, 教授, 中国人民解放军第二军医大学附属东方肝胆外科医院综合治疗三科
国内外研究发现NO、CO参与了门静脉高压的形成与发展, 两者相互作用共同发挥复杂的生物学作用.
外源性给予NO、CO抑制剂后观察门静脉压力变化及肝组织中eNOS、iNOS及HO-1蛋白的表达, 目前在肝硬化门静脉高压研究中报告甚少.
本文立意新颖, 具有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Chalmers AH. Simple, sensitive measurement of carbon monoxide in plasma. Clin Chem. 1991;37:1442-1445. [PubMed] |
| 2. | Erario MA, Gonzales S, Romay S, Eizayaga FX, Castro JL, Lemberg A, Tomaro ML. Role of heme oxygenase/carbon monoxide pathway on the vascular response to noradrenaline in portal hypertensive rats. Clin Exp Pharmacol Physiol. 2005;32:196-201. [PubMed] [DOI] |
| 3. | Bolognesi M, Di Pascoli M, Verardo A, Gatta A. Splanchnic vasodilation and hyperdynamic circulatory syndrome in cirrhosis. World J Gastroenterol. 2014;20:2555-2563. [PubMed] [DOI] |
| 7. | Gonzales S, Perez MJ, Perazzo JC, Tomaro ML. Antioxidant role of heme oxygenase-1 in prehepatic portal hypertensive rats. World J Gastroenterol. 2006;12:4149-4155. [PubMed] |
| 8. | Tran TT, Martin P, Ly H, Balfe D, Mosenifar Z. Carboxyhemoglobin and its correlation to disease severity in cirrhotics. J Clin Gastroenterol. 2007;41:211-215. [PubMed] [DOI] |
| 9. | Pannen BH, Köhler N, Hole B, Bauer M, Clemens MG, Geiger KK. Protective role of endogenous carbon monoxide in hepatic microcirculatory dysfunction after hemorrhagic shock in rats. J Clin Invest. 1998;102:1220-1228. [PubMed] [DOI] |
| 10. | Yang SP, Guo JS, Wang JY, Lin L, Shi RH. [The role of HO-CO system in the hemodynamic disturbance of cirrhotic rats]. Zhonghua Ganzangbing Zazhi. 2011;19:174-177. [PubMed] |
| 11. | Suematsu M, Kashiwagi S, Sano T, Goda N, Shinoda Y, Ishimura Y. Carbon monoxide as an endogenous modulator of hepatic vascular perfusion. Biochem Biophys Res Commun. 1994;205:1333-1337. [PubMed] [DOI] |
| 12. | Goda N, Suzuki K, Naito M, Takeoka S, Tsuchida E, Ishimura Y, Tamatani T, Suematsu M. Distribution of heme oxygenase isoforms in rat liver. Topographic basis for carbon monoxide-mediated microvascular relaxation. J Clin Invest. 1998;101:604-612. [PubMed] [DOI] |