修回日期: 2014-04-15
接受日期: 2014-04-24
在线出版日期: 2014-07-08
目的: 探讨Smoothened(Smo)小干扰RNA(small interfering RNA, siRNA)对食管癌的CAES-17细胞的凋亡及凋亡相关基因Bcl-2表达的影响.
方法: Smo siRNA转染食管癌CAES-17细胞, 采用逆转录聚合酶链反应(RT-PCR)检测各组食管癌CAES-17细胞中Smo、Bcl-2 mRNA的表达; 采用Western blot检测各组食管癌CAES-17细胞中Smo、Bcl-2的蛋白表达; 采用TUNEL及流式细胞术检测CAES-17细胞的凋亡情况.
结果: 与各对照组相比, Smo siRNA转染细胞24、48和72 h Smo、Bcl-2蛋白及mRNA的表达均明显降低, 其中Smo siRNA的mRNA转录水平为0.524±0.011、0.422±0.008和0.332±0.019; Bcl-2 mRNA的转录水平为0.571±0.024、0.512±0.017和0.492±0.011, 具有明显下调(P<0.05); 转染72 h后, Smo siRNA和Bcl-2蛋白翻译水平与对照相比, 分别为0.330±0.016和0.391±0.019, 差异均有显著性(P<0.05); 各实验组凋亡细胞数与对照组相比均明显增多(P<0.05).
结论: Smo siRNA可能通过抑制CAES-17细胞中Smo基因表达, 进而下调Bcl-2表达, 促进CAES-17细胞凋亡.
核心提示: Smoothened(Smo)小干扰RNA(small interfering RNA)可能通过抑制CAES-17细胞中Smo基因表达, 进而下调Bcl-2表达, 促进CAES-17细胞凋亡. 为食管癌的治疗提供临床参考价值.
引文著录: 刘山, 张倬, 陈天佑. Smo小干扰RNA对人食管癌CAES-17细胞凋亡的影响. 世界华人消化杂志 2014; 22(19): 2671-2678
Revised: April 15, 2014
Accepted: April 24, 2014
Published online: July 8, 2014
AIM: To investigate the effect of transfection with small interfering RNA (siRNA) targeting smoothened (Smo) on the expression of Bcl-2 in esophageal cancer CAES-17 cells.
METHODS: Smo siRNA was transfected into CAES-17 cells. Reverse transcription-polymerase chain reaction (RT-PCR) and Western blot were used to detect the levels of Smo and Bcl-2 mRNAs and proteins. TUNEL assay and flow cytometry were used to detect cell apoptosis.
RESULTS: Compared with the control groups, after transfection with Smo siRNA for 24, 48 and 72 h, the levels of Smo mRNA were significantly down-regulated (0.524 ± 0.011, 0.422 ± 0.008, 0.332 ± 0.019, P < 0.05 for all). After transfection with Smo siRNA for 72 h, the levels of Smo and Bcl-2 proteins were also significantly lower compared with the control groups (0.330 ± 0.016, 0.391 ± 0.019, P < 0.05 for all). The number of apoptotic cells was greatly increased after Smo siRNA transfection.
CONCLUSION: Smo gene may play an important role in the apoptosis of esophageal cancer cells. Smo may be used as a novel biomarker for the treatment of esophageal carcinoma.
- Citation: Liu S, Zhang Z, Chen TY. Transfection with small interfering RNA targeting smoothened promotes cell apoptosis in human esophageal carcinoma cell line CAES-17. Shijie Huaren Xiaohua Zazhi 2014; 22(19): 2671-2678
- URL: https://www.wjgnet.com/1009-3079/full/v22/i19/2671.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i19.2671
Hedgehog(Hh)信号通路是调控细胞增殖和组织分化的重要信号通路, Smoothened(Smo)蛋白是Hh信号通路上的膜蛋白, 他是Hh信号通路的转换器, 把细胞外的Hh信号转换成细胞内的Gli信号, 进而激活Hh相应基因Bcl-2等的转录, 影响细胞凋亡[1]. 本研究应用小干扰RNA(small interference RNA, siRNA)沉默Smo基因, 观察其对人食管癌CAES-17中凋亡相关基因Bcl-2表达及细胞凋亡的影响, 为食管癌的基因治疗提供了理论依据.
人食管鳞癌CAES-17细胞株由中国学科学院肿瘤研究所分子肿瘤学国家重点实验室赠送. LipofectamineTM 2000及TRNzol试剂盒购自美国Invitrogen公司; Revert AidTM First Strand cDNA Synthesis Kit购自Fermentas公司; Quant cDNA第一链合成试剂盒; Smo、Bcl-2、β-actin引物由上海生工生物工程有限公司合成; RPMI 1640培养液由北京索莱宝科技有限公司提供. TUNEL试剂盒购自瑞士Roche公司. Smo一抗、β-actin一抗及Bcl-2兔抗人多克隆抗体购自美国Santa Cruz公司. Smo siRNA(包括3条不同的Smo siRNA、阴性对照siRNA、阴性对照FAM-siRNA)由上海吉玛公司合成. 序列如表1.
| Smo目的基因 | siRNA |
| Smo siRNA-1 | 5'-UUUGAAGGAAGUGUGCCAGTT-3' |
| 5'-CUGGCACACUUCCUUCAAATT-3' | |
| Smo siRNA-2 | 5'-GGAGUCAUGACUCUGUUCUTT-3' |
| 5'-AGAACAGAGUCAUGACUCCTT-3' | |
| Smo siRNA-3 | 5'-GGGACUAUGUGCUAUGUCATT-3' |
| 5'-UGACAUAGCACAUAGUCCCTT-3' | |
| 阴性对照FAM-siRNA | 5'-UUCUCCGAACGUGUCACGUTT-3' |
| 5'-ACGUGACACGUUCGGAGAATT-3' | |
| 阴性对照siRNA | 5'-UUCUCCGAACGUGUCACGUTT-3' |
| 5'-ACGUGACACGUUCGGAGAATT-3' |
1.2.1 细胞培养: 将人食管癌CAES-17细胞于RPMI 1640培养液(含10%胎牛血清, 青霉素100 U/mL, 链霉素100 U/mL), 37 ℃、5%CO2孵箱内贴壁培养.
1.2.2 转染: 将CAES-17细胞以4.5×105的密度接种于6孔板中, 细胞覆盖率达到30%-50%时进行转染. 将10 µL siRNA加入250 µL无血清无抗生素的RPMI 1640培养液中; 在250 µL无血清无抗生素的培养液中加入5 µL LipofectamineTM 2000, 室温孵育5 min后, 把两者轻轻混均, 室温再孵育20 min为了形成siRNA/RNAi-Mate复合物, 逐滴加入孔中, 前后轻轻晃动6孔板使混合均匀. 在37 ℃、5%CO2培养箱中继续培养, 5 h后更换含血清含抗生素的RPMI 1640培养液.
1.2.3 Smo siRNA转染浓度的筛选: 采用浓度为33、66、99 nmol/L的FAM-siRNA转染人的食管癌CAES-17细胞24 h后, 荧光显微镜下观察, 浓度为99 nmol/L的siRNA转染效率最高, 将99 nmol/L的siRNA作为后续实验浓度.
1.2.4 最佳siRNA序列筛选: 共分6组: Smo siRNA-1组、Smo siRNA-2组、Smo siRNA-3组、无关序列组、转染试剂组、细胞对照组. 在3条特异的序列中筛选抑制效率最好的Smo siRNA-3序列用于后续实验.
1.2.5 细胞分组: 分为4组: Smo siRNA-3组、无关序列组、转染试剂组, 细胞对照组, 在不同的转染时间点上又分3组: 24 h组、48 h组、72 h组.
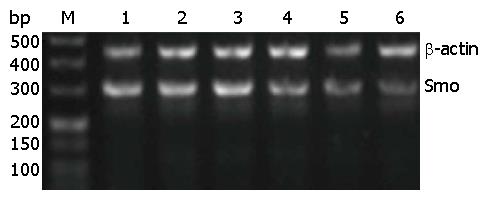
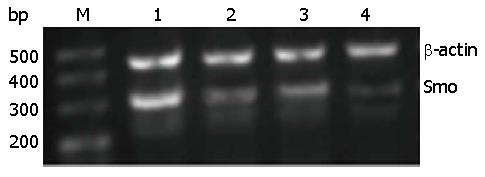
1.2.6 RT-PCR检测Smo、Bcl-2 mRNA表达: 用TRNzol提取转染后各组总RNA, 用紫外分光光度仪测量A值, 所有A260/280值都在1.9-2.1之间. 按照逆转录合成cDNA试剂盒说明书合成cDNA. Smo上游引物序列为5'-CGCTACCCTGCTGTTATTCTCT-3', 下游引物序列为5'-CAGGTGGAAGTAGGAGGTCTTG-3'; Bcl-2上游引物序列为5'-AACTCGAGTGACAAGCCCGATG-3', 下游引物序列为5'-GTACCACCAGTTGGTTGTCTTTGA-3'; β-actin上游引物序列为5'-CCTAGAAGCATTTGCGGTGG-3', 下游引物序列为5'-GAGCTACGAGCTGCTGCCTGACG-3'. Smo、Bcl-2、β-actin反应条件为: 95 ℃预变性5 min; 95 ℃, 变性30 s, 63 ℃/68 ℃/67 ℃退火45 s, 72 ℃延伸45 s, 共30个循环; 72 ℃终延伸5 min, Smo、Bcl-2、β-actin扩增产物大小为306、201、416 bp. RT-PCR产物经2%琼脂糖凝胶电泳, Alpha多功能凝胶成像系统成像, 用Alpha View软件图像分析, 分别以Smo、Bcl-2与β-actin的电泳条带吸光度(A)值之比来表示Smo、Bcl-2 mRNA的相对表达量.
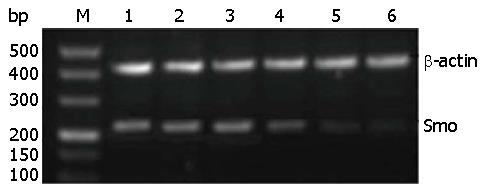
1.2.7 Western blot法检测Smo、Bcl-2蛋白的表达: 经转染处理过的细胞用胰酶消化离心, 分别收集各组细胞, 并在冰上裂解, 提取各组蛋白质, 采用BCA法用酶标仪在96孔板中测定波长562 nm时的A值, 并绘制标准曲线, 计算蛋白浓度. 用SDS聚丙烯酰氨凝胶电泳分离蛋白, 各组蛋白上样量为55 μg/孔, 蛋白Marker为5 μg/孔, 先100 V, 后120 V恒压电泳, 用半干式电转仪将蛋白转于PVDF膜上. TBST洗后, 用含5%脱脂奶粉的TBST封闭2 h. PVDF膜与一抗结合Smo和Bcl-2、β-actin抗体(1:1000稀释), 在4 ℃反应过夜, TBST洗过之后, 二抗结合(1:5000稀释)室温孵育1 h, TBST洗过之后, 用二氨基联苯胺(DAB)显色. 用Alpha多功能凝胶成像系统采集图像, 用Alpha View软件分析, 用目的条带与β-actin的A值之比来表示目的蛋白的相对表达量.
1.2.8 流式细胞仪检测细胞凋亡: 收集转染后各组细胞, 保证每组细胞密度>1×106/mL. PBS洗涤3遍, 用100 μL预冷的1×Binding Buffer重悬细胞, 加入5 μL FITC Annexin V和5 μL PI混匀避光孵育15 min, 再加入400 μL 1×Binding Buffer混匀后, 用流式细胞仪检测各组凋亡细胞比例.
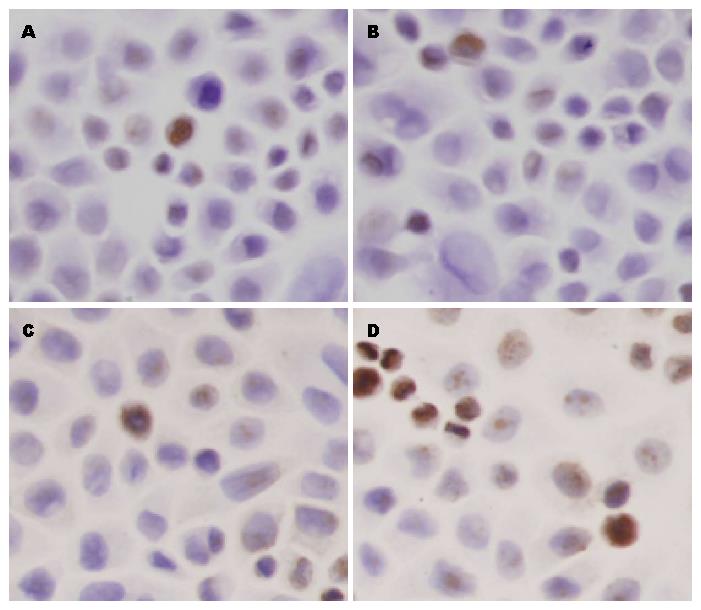
1.2.9 原位末端标记法(TUNEL)检测细胞凋亡: 转染处理的细胞爬片, PBS洗3次, 4%多聚甲醛固定20 min, 用中行树胶固定在载玻片上. PBS洗3次, 0.3%TritonX-100冰上通透液30 min; PBS洗3次, 加3%H2O2孵育10 min; PBS洗3次, 把试剂1(Enzyme Solution)50 μL加入到450 μL试剂2(Label Solution)中, 轻轻混匀, 配制成TUNEL反应混合液; 滴加50 μL TUNEL反应混合液37 ℃避光孵预1 h; PBS洗3次, 滴加试剂3(converter-POD)50 μL, 37 ℃避光孵预; PBS洗3次, 用DAB显色, 镜下控制显色时间; 自来水充分冲洗、苏木素复染、1%盐酸乙醇分化、脱水、透明、封片.
统计学处理 采用SPSS17.0统计软件进行统计学处理, 计量结果, 符合正态分布的计量资料采用mean±SD, 多组均数的比较使用单因素方差分析(ANVOA), 对有显著性差异的计量资料, 使用LSD-t检验进行多组均数间的两两比较, 检验水准采取α = 0.05. P<0.05为差异具有统计学意义.
3条Smo siRNA(siRNA-1、siRNA-2、siRNA-3)转染食管癌CAES-17细胞后, 各转染组Smo mRNA表达水平均明显低于各对照组(P<0.05), 其中Smo siRNA-3抑制效率最高(P<0.05). 后续实验采用Smo siRNA-3进行, 各对照组(无关序列组、转染试剂组、细胞对照组)间Smo mRNA的表达差异无显著性(P>0.05)(图1).
Smo siRNA-3转染细胞24、48和72 h与各对照组细胞相比, Smo和Bcl-2 mRNA表达水平均降低, 以转染72 h最为显著, 且各组间差异有统计学意义(P<0.05)(表2, 图2, 图3).
Western blot检测结果显示, 与对照组细胞相比, Smo siRNA-3转染细胞24、48和72 h, Smo和Bcl-2 mRNA表达水平均降低, 以转染72 h最为显著, 且各组间差异有统计学意义(P<0.05)(表3, 图4).
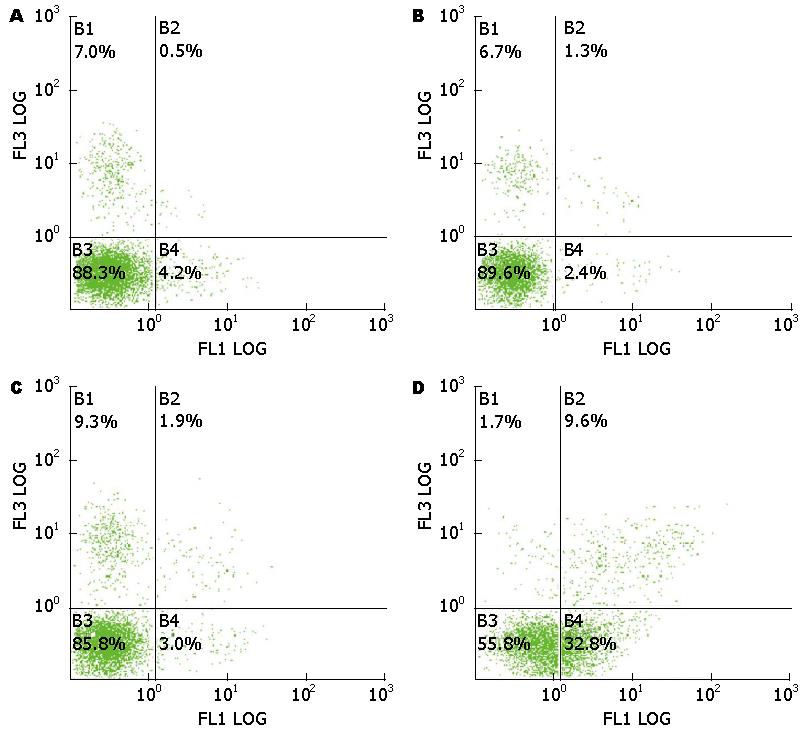
结果显示: 细胞对照组、转染试剂组、无关序列组凋亡指数(apoptotic index, AI)分别为3.00%±1.58%、3.80%±1.92%、4.20%±1.92%, 转染Smo siRNA-3后48 h组细胞凋亡指数为20.40%±3.61%, 转染Smo siRNA-3后48 h组与各对照组相比, 细胞凋亡指数上升有统计学意义(F = 66.27, P<0.05), 各对照组之间比较细胞凋亡指数均无统计学意义(表4, 图5).
Hh信号通路是调控细胞增殖和组织分化的重要信号通路. 近年来的研究表明, 多种肿瘤的发生和发展与Hh信号通路的异常激活及过表达有着密切的关系, 如肺小细胞癌[2,3]、基底细胞癌[4,5]、膀胱癌[6,7]、胰腺癌[8,9]、髓母细胞瘤[10-12]、肝癌[13,14]、前列腺癌[15,16]、胃癌[17,18]、乳腺癌[19-21]等.
Smo基因位于7q31-7q32染色体, 编码一个含有1024个氨基酸的蛋白. Smo基因是原癌基因, Smo蛋白有3个区域: 一个细胞内的羧基端区域、一个细胞外氨基端区域和7个疏水跨膜区[22]. 当Hh蛋白不存在时, 受体蛋白Ptch抑制Smo蛋白的活性, 进而阻断Hh信号通路[23]. 当Hh蛋白存在时, HH蛋白与Ptch蛋白结合, 解除了对Smo蛋白的抑制, 激活的Smo蛋白可以把细胞外的Hh信号转换成细胞内的Gli信号, 进而激活Hh相应基因的转录, 包括Hhip、ptch、Gli1、cyclinD、Bmi1、Bcl-2等[24].
近年来, 通过抑制Hh信号转导通路关键基因进而抑制肿瘤细胞增殖, 诱导肿瘤细胞凋亡已成为研究热点. 相关研究表明[25-29], 通过siRNA抑制胃癌MGC803细胞、乳腺癌MCF-7细胞、肝癌Huh-7细胞、胰腺癌PANC-1细胞中Smo和Gli1的表达, 可以抑制肿瘤细胞的增殖, 诱导细胞凋亡, 增强对化疗药物的敏感性, 表明Smo可能是肿瘤基因治疗的有效靶点.
本课题组前期研究表明[30,31], Smo在人食管鳞癌组织及裸鼠食管癌移植瘤中高表达, Smo siRNA可通过下调裸鼠食管癌细胞中Smo基因的表达, 进而体内诱导裸鼠食管癌移植瘤细胞的凋亡. 本实验采用3条Smo siRNA(siRNA-1、siRNA-2、siRNA-3)转染食管癌CAES-17细胞后, 各转染组Smo mRNA表达水平均明显低于各对照组(P<0.05), 其中Smo siRNA-3抑制效率最高(P<0.05). 后续实验采用Smo siRNA-3转染CAES-17细胞后, Western blot及RT-PCR检测结果显示, Smo siRNA-3可有效在蛋白和mRNA水平上显著抑制Smo和Bcl-2的表达. Smo siRNA-3转染细胞24、48和72 h与各对照组细胞相比, Smo和Bcl-2蛋白及mRNA表达水平均降低, 以转染72 h最为显著, 且各组间差异有统计学意义(P<0.05). TUNEL法及流式细胞术检测结果显示在Smo和Bcl-2蛋白、mRNA表达水平下调的同时, 可诱导CAES-17细胞凋亡. 引导细胞凋亡的可能机制是通过Smo siRNA沉默Smo表达, 下调Gli表达, 进而抑制Hh相应基因Bcl-2的转录实现的.
食管癌为食道肿瘤, 存在许多亚型. 食道的肿瘤长会导致吞咽困难(dysphagia), 疼痛和不舒服, 并需要通过活组织切片检查做诊断. 小的且没有转移的肿瘤可靠外科手术治疗. 而侵犯性强的肿瘤则须靠化学疗法、放射线疗法或合并使用治疗. 此病的预后要看病症不同的程度而定, 但普遍来说都是极差的.
黄缘, 教授, 南昌大学第二附属医院消化内科, 江西省分子医学重点实验室
RNAi技术的应用, 不仅能大大推动人类后基因组计划(蛋白组学) 的发展, 还有可能设计出RNAi芯片, 高通量地筛选药物靶基因, 逐条检测人类基因组的表达抑制情况来明确基因的功能,并且他还将应用于基因治疗、新药开发、生物医学研究等领域.
目前, 国内外相关RNA干扰(RNA interfering, RNAi)用于疾病的治疗已有大量报道, 均充分肯定了RNAi在肿瘤治疗方面的价值, 在临床上具有较高的应用价值.
用RNAi 技术来抑制基因的异常表达, 为治疗癌症、遗传病等疾病开辟了新的途径.
在疾病治疗方面, 双链小分子RNA或siRNA已被用于临床测试用于几种疾病治疗, 如老年视黄斑退化、肌肉萎缩性侧索硬化症、类风湿性关节炎、肥胖症等. 在抗病毒治疗方面, 帕金森病等神经系统疾病已经开始初步采用RNA干扰疗法. 肿瘤治疗方面也已经取得了一些成果.
构建了一种Smo siRNA作用于食管癌, 研究结果表明, 该系统在食管癌的治疗中疗效显著. 为进一步用于临床提供了理论价值.
编辑: 郭鹏 电编:鲁亚静
| 1. | Jiang J, Hui CC. Hedgehog signaling in development and cancer. Dev Cell. 2008;15:801-812. [PubMed] [DOI] |
| 2. | Watkins DN, Berman DM, Burkholder SG, Wang B, Beachy PA, Baylin SB. Hedgehog signalling within airway epithelial progenitors and in small-cell lung cancer. Nature. 2003;422:313-317. [PubMed] |
| 3. | 黄 淑红, 张 红卫. Sonic hedgehog信号通路及其在肺癌中的研究进展. 国外医学(肿瘤学分册). 2004;31:618-620. |
| 4. | Caro I, Low JA. The role of the hedgehog signaling pathway in the development of basal cell carcinoma and opportunities for treatment. Clin Cancer Res. 2010;16:3335-3339. [PubMed] |
| 5. | Takebe N, Harris PJ, Warren RQ, Ivy SP. Targeting cancer stem cells by inhibiting Wnt, Notch, and Hedgehog pathways. Nat Rev Clin Oncol. 2011;8:97-106. [PubMed] |
| 6. | Shin K, Lee J, Guo N, Kim J, Lim A, Qu L, Mysorekar IU, Beachy PA. Hedgehog/Wnt feedback supports regenerative proliferation of epithelial stem cells in bladder. Nature. 2011;472:110-114. [PubMed] [DOI] |
| 7. | Fei DL, Sanchez-Mejias A, Wang Z, Flaveny C, Long J, Singh S, Rodriguez-Blanco J, Tokhunts R, Giambelli C, Briegel KJ. Hedgehog signaling regulates bladder cancer growth and tumorigenicity. Cancer Res. 2012;72:4449-4458. [PubMed] |
| 8. | Thayer SP, di Magliano MP, Heiser PW, Nielsen CM, Roberts DJ, Lauwers GY, Qi YP, Gysin S, Fernández-del Castillo C, Yajnik V. Hedgehog is an early and late mediator of pancreatic cancer tumorigenesis. Nature. 2003;425:851-856. [PubMed] |
| 9. | Kelleher FC. Hedgehog signaling and therapeutics in pancreatic cancer. Carcinogenesis. 2011;32:445-451. [PubMed] [DOI] |
| 10. | Kelleher FC, Cain JE, Healy JM, Watkins DN, Thomas DM. Prevailing importance of the hedgehog signaling pathway and the potential for treatment advancement in sarcoma. Pharmacol Ther. 2012;136:153-168. [PubMed] [DOI] |
| 11. | Yang L, Xie G, Fan Q, Xie J. Activation of the hedgehog-signaling pathway in human cancer and the clinical implications. Oncogene. 2010;29:469-481. [PubMed] [DOI] |
| 12. | Li Y, Maitah MY, Ahmad A, Kong D, Bao B, Sarkar FH. Targeting the Hedgehog signaling pathway for cancer therapy. Expert Opin Ther Targets. 2012;16:49-66. [PubMed] [DOI] |
| 13. | Sicklick JK, Li YX, Jayaraman A, Kannangai R, Qi Y, Vivekanandan P, Ludlow JW, Owzar K, Chen W, Torbenson MS. Dysregulation of the Hedgehog pathway in human hepatocarcinogenesis. Carcinogenesis. 2006;27:748-757. [PubMed] |
| 14. | Huang S, He J, Zhang X, Bian Y, Yang L, Xie G, Zhang K, Tang W, Stelter AA, Wang Q. Activation of the hedgehog pathway in human hepatocellular carcinomas. Carcinogenesis. 2006;27:1334-1340. [PubMed] |
| 15. | Karhadkar SS, Bova GS, Abdallah N, Dhara S, Gardner D, Maitra A, Isaacs JT, Berman DM, Beachy PA. Hedgehog signalling in prostate regeneration, neoplasia and metastasis. Nature. 2004;431:707-712. [PubMed] |
| 16. | Berman DM, Desai N, Wang X, Karhadkar SS, Reynon M, Abate-Shen C, Beachy PA, Shen MM. Roles for Hedgehog signaling in androgen production and prostate ductal morphogenesis. Dev Biol. 2004;267:387-398. [PubMed] |
| 17. | Yoo YA, Kang MH, Lee HJ, Kim BH, Park JK, Kim HK, Kim JS, Oh SC. Sonic hedgehog pathway promotes metastasis and lymphangiogenesis via activation of Akt, EMT, and MMP-9 pathway in gastric cancer. Cancer Res. 2011;71:7061-7070. [PubMed] [DOI] |
| 18. | Song Z, Yue W, Wei B, Wang N, Li T, Guan L, Shi S, Zeng Q, Pei X, Chen L. Sonic hedgehog pathway is essential for maintenance of cancer stem-like cells in human gastric cancer. PLoS One. 2011;6:e17687. [PubMed] |
| 19. | Moraes RC, Zhang X, Harrington N, Fung JY, Wu MF, Hilsenbeck SG, Allred DC, Lewis MT. Constitutive activation of smoothened (SMO) in mammary glands of transgenic mice leads to increased proliferation, altered differentiation and ductal dysplasia. Development. 2007;134:1231-1242. [PubMed] |
| 20. | Jiao X, Wood LD, Lindman M, Jones S, Buckhaults P, Polyak K, Sukumar S, Carter H, Kim D, Karchin R. Somatic mutations in the Notch, NF-KB, PIK3CA, and Hedgehog pathways in human breast cancers. Genes Chromosomes Cancer. 2012;51:480-489. [PubMed] [DOI] |
| 21. | Souzaki M, Kubo M, Kai M, Kameda C, Tanaka H, Taguchi T, Tanaka M, Onishi H, Katano M. Hedgehog signaling pathway mediates the progression of non-invasive breast cancer to invasive breast cancer. Cancer Sci. 2011;102:373-381. [PubMed] [DOI] |
| 22. | Fiaschi M, Rozell B, Bergström A, Toftgård R. Development of mammary tumors by conditional expression of GLI1. Cancer Res. 2009;69:4810-4817. [PubMed] [DOI] |
| 23. | Liao X, Siu MK, Au CW, Wong ES, Chan HY, Ip PP, Ngan HY, Cheung AN. Aberrant activation of hedgehog signaling pathway in ovarian cancers: effect on prognosis, cell invasion and differentiation. Carcinogenesis. 2009;30:131-140. [PubMed] [DOI] |
| 24. | Watson S, Serrate C, Vignot S. [Sonic Hedgehog signaling pathway: from embryology to molecular targeted therapies]. Bull Cancer. 2010;97:1477-1483. [PubMed] [DOI] |
| 25. | Li SH, Fu J, Watkins DN, Srivastava RK, Shankar S. Sulforaphane regulates self-renewal of pancreatic cancer stem cells through the modulation of Sonic hedgehog-GLI pathway. Mol Cell Biochem. 2013;373:217-227. [PubMed] [DOI] |
| 26. | Wang XD, Inzunza H, Chang H, Qi Z, Hu B, Malone D, Cogswell J. Mutations in the hedgehog pathway genes SMO and PTCH1 in human gastric tumors. PLoS One. 2013;8:e54415. [PubMed] [DOI] |
| 27. | Agyeman A, Mazumdar T, Houghton JA. Regulation of DNA damage following termination of Hedgehog (HH) survival signaling at the level of the GLI genes in human colon cancer. Oncotarget. 2012;3:854-868. [PubMed] |
| 28. | Ding YL, Wang QS, Zhao WM, Xiang L. Expression of smoothened protein in colon cancer and its prognostic value for postoperative liver metastasis. Asian Pac J Cancer Prev. 2012;13:4001-4005. [PubMed] |
| 29. | Tao Y, Mao J, Zhang Q, Li L. Overexpression of Hedgehog signaling molecules and its involvement in triple-negative breast cancer. Oncol Lett. 2011;2:995-1001. [PubMed] |