修回日期: 2014-05-04
接受日期: 2014-05-06
在线出版日期: 2014-06-28
目的: 探讨黄连素(berberine, BER)对人结肠癌细胞株HT-29的作用及其机制.
方法: 将对数生长期HT-29细胞分成对照组和黄连素组. 对照组细胞常规培养, 黄连素组细胞培养体系中加入黄连素(3 μmol/L). 各组细胞培养72 h后, 利用MTT检测细胞增殖; 流式检测细胞凋亡, RT-PCR检测细胞JAK2、STAT3、Bax和Bcl-2基因表达; Western blot检测细胞中JAK2、STAT3、p-JAK2、p-STAT3、Bax和Bcl-2蛋白的变化, Caspase3活性试剂盒检测Caspase3活性.
结果: 黄连素组与对照组相比, HT-29细胞增殖率明显下降(P<0.05), 凋亡率明显升高(P<0.05), RT-PCR检测显示, 黄连素组与对照组相比Bax mRNA水平增高, Bcl-2 mRNA水平降低, 但JAK2和STAT3 mRNA表达无明显差异. Western blot检测显示, 黄连素组与对照组相比JAK2、STAT总蛋白无明显变化(P>0.05), 但p-JAK2、p-STAT3和Bcl-2表达水平明显降低, Bax增高(P<0.05), Caspase3活性试剂盒检测显示黄连素组与对照组相比Caspase3活性明显增加(P<0.05).
结论: 黄连素通过抑制JAK2/STAT3信号传导通路抑制HT-29细胞增殖和促进HT-29细胞凋亡.
核心提示: 本实验以结肠癌细胞系HT-29为靶细胞, 进一步证实了JAK2/STAT3信号通路是结肠癌发生的重要致病机制, 黄连素可通过抑制JAK2/STAT3信号通路激活而促进HT-29细胞凋亡, 抑制HT-29增殖, 从而达到抗肿瘤的效果.
引文著录: 李湘楚, 熊建光, 程正位, 程思, 刘启胜. 黄连素对结肠癌细胞系HT-29增殖和凋亡的影响. 世界华人消化杂志 2014; 22(18): 2572-2577
Revised: May 4, 2014
Accepted: May 6, 2014
Published online: June 28, 2014
AIM: To investigate the effect of berberine on cell proliferation in the human cancer cell line HT-29 and the underlying mechanisms.
METHODS: HT-29 cells in logarithmic growth phase were divided into a control group and a berberine group. The cells in the control group were normally cultured and cells in the berberine group were incubated with berberine (3 μmol/L). MTT assay and flow cytometry were used to examine cell proliferation and apoptotic changes in the two groups after incubation for 72 h. The mRNA expression of JAK2, STAT3, Bax and Bcl-2 was detected by RT-PCR. The changes in expression of JAK2, STAT3, p-JAK2, and p-STAT3 proteins were detected by Western blot. The activity of Caspase 3 was measured using a caspase 3 colorimetric assay kit.
RESULTS: Compared with the control group, the proliferation of HT-29 cells in the berberine group was significantly decreased (P < 0.05), but the apoptosis rate in the berberine group was significantly increased (P < 0.05). After treatment with berberine, the mRNA level of Bax was increased, the mRNA levels of Bcl-2 was decreased and the mRNA level sof JAK2 and STAT3 had no significant changes. Western blot results showed that the expression of total JAK2 and STAT3 proteins showed no significant changes (P < 0.05), the expression of p-JAK2, p-STAT3 and Bcl-2 was decreased, and the expression of Bcl-2 was increased (P < 0.05). Compared with the control group, the activity of Caspase 3 in the berberine group was significantly increased (P < 0.05).
CONCLUSION: Berberine can inhibit the proliferation and promote the apoptosis of HT-29 cells possibly through attenuating the activation of the JAK2/ STAT3 signaling pathway.
- Citation: Li XC, Xiong JG, Cheng ZW, Cheng S, Liu QS. Effect of berberine on proliferation and apoptosis of colon cancer HT-29 cells. Shijie Huaren Xiaohua Zazhi 2014; 22(18): 2572-2577
- URL: https://www.wjgnet.com/1009-3079/full/v22/i18/2572.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i18.2572
结肠癌是最常见的恶性肿瘤之一, 严重威胁人类身心健康. 手术被认为是目前治疗结肠癌的主要手段[1,2]. 但多数结肠癌发现时已是中晚期, 不适于手术. 临床上一般采取以化疗为主、放疗、生物免疫治疗等为辅的治疗手段[1,2]. 但化疗有巨大的不良反应, 因而采用中医药结合化疗治疗中晚期结肠癌越来越显出优势[3-7]. 黄连素是我国常用的一味中药, 可从黄连、黄柏、三颗针等植物中提取, 因其具有治疗腹泻的作用而被广泛应用于临床[8,9]. 目前研究发现黄连素素具有抑制细胞增殖和促进细胞凋亡的作用[10,11]. 结肠癌发生被认为是细胞凋亡与细胞增殖平衡失调的结果[8,9]. JAK2/STAT3信号通路在结肠癌增殖和凋亡中扮演重要角色[12,13]. 本研究以人结肠癌细胞株HT-29为靶细胞, 探讨黄连素对人结肠癌细胞株HT-92的作用及其作用机制.
人结肠癌细胞株HT-29, 中南大学湘雅医学院肿瘤研究所, 该细胞系由该所引自ATCC. 黄连素(美国Sigma公司产品)20 ℃下保存, 临用前以培养液稀释至所需浓度, RPMI 1640培养基, 美国Gibgo公司; 小牛血清, 杭州四季青公司; 12孔培养板, 美国Falcon公司; β-actin抗体(Abmart, China), p-JAK2抗体(CST, USA), JAK2抗体(CST, USA), p-STAT3抗体(CST, USA), STAT3抗体(CST, USA), Bax(CST, USA), Bcl-2(CST, USA), Caspase3活性检测试剂盒(Pharma Minger). TRIzol reagent(Invitrogen, USA), 逆转录试剂盒(GeneCopoeia, USA), SYBRgreen(Takara, Japan), RT-PCR仪(BIO-RAD), 蛋白裂解液RIPA(碧云天), 蛋白酶抑制剂cocktail及Western blot凝胶制备试剂盒购自武汉谷歌生物公司, BCA蛋白定量试剂盒(碧云天). qPCR引物(擎科生物技术有限公司), 酶标仪(Thermo Fisher). CO2细胞培养箱, 美国Forma scientific公司; 倒置显微镜、激光共聚焦显微镜, 日本Olympus公司; 酶标仪(Thermo Fisher). PVDF膜(Roche), ECL试剂盒(Bi-pech), 胶片及化学发光仪(Kodak), Q-PCR仪(BIO-RAD).
1.2.1 细胞培养: HT-29细胞置于含有10%胎牛血清的RPMI 1640培养液中, 加入青霉素(100 U/mL)和链霉素(100 U/mL), 在37 ℃、5%CO2饱和湿度培养箱中培养.
1.2.2 细胞增殖的MTT法检测: 取对数生长期HT-29细胞, 接种于12孔板内, 调整密度为1×105/mL, 每孔90 μL, 实验组加入黄连素(3 μmol/L), 剂量参考文献[12], 对照组(只加培养基, 不加细胞和药物), 每组均设3个复孔. 12孔板置于37 ℃、5%CO2培养箱培养72 h后, 加入5 mg/mL的MTT溶液20 μL/孔, 继续培养4 h, 然后加入三联裂解液[10%SDS+5%异丁醇+1%HCL(10 mol/L), 100 μL/孔], 37℃放置过夜后, 用酶标仪于波长570 nm处读取吸光度(A)值, 根据A值计算细胞增殖抑制率: 细胞增殖抑制率(%) = (对照孔A值-实验孔A值)/(对照孔A值-空白孔A值)×100%.
1.2.3 Annexin-V双染法检测细胞凋亡: 取对数生长期的HT-29细胞接种于6孔板中, 调整密度为1×105/mL. 实验分为2组: 对照组细胞常规培养; 黄连素组细胞培养体系中加入黄连素素, 终质量浓度为40 μmol/L. 细胞培养24 h后, 收集各组所有悬浮细胞, 调整细胞密度为1×105/mL, 取1 mL细胞悬液, 1000 r/min离心5 min, 去培养基, 加RNA酶, 37 ℃水浴1 h, 放入冰浴加入0.5 mg/L碘化丙啶(PI)及Annexin V, 流式细胞仪检测采用CELIQUEST 软件分析细胞凋亡率.
1.2.4 Western blot检测各组细胞JAK2、STAT3、p-JAK2、p-STAT3、Bax和Bcl-2表达: 将各组收集的细胞用预冷的PBS清洗后, 按照蛋白裂解液RIPA操作说明提取蛋白, BCA法进行蛋白定量, 将各组蛋白浓度调成一致, 沸水煮5 min, 待用. 取各组细胞总蛋白样品80 μg, 以样品中的β-actin为内参, 经SDS-PAGE凝胶电泳, 转膜, 然后用含5%脱脂奶粉的PBS封闭2 h, 分别加入适量含2%脱脂奶粉的PBS稀释JAK2抗体(1:1000), p-JAK2(1:500), STAT3(1:1000), p-STAT3(1:500), Bax(1:500), Bcl-2(1:1000), β-actin(1:3000)抗体, 4 ℃孵育过夜. PBS洗膜3次, 10 min/次, 根据一抗的来源, 再分别加入适量含2%脱脂奶粉的PBS稀释的HRP标记羊抗兔IgG(1:500)、HRP标记羊抗鼠IgG(1:5000)室温下作用2 h, PBS洗膜3次, 10 min/次, ECL化学发光显色、压片、显影、定影、胶片扫描保存. 用Ge-l Pro Analy zer(Ver3.0)软件测定蛋白条带灰度值JAK2、p-JAK2、STAT3、p-STAT3、Bax和Bcl-2条带灰度值与β-actin内参条带灰度值的比值分别将上述蛋白表达量化.
1.2.5 实时定量PCR(RT-PCR)检测JAK2和STAT3: 按照总RNA提取试剂盒(Takara)说明提取各组细胞总RNA, 紫外分光光度计测量浓度(Thermo Fisher), 逆转录以及扩增反应按试剂盒说明书(Takara)进行, 实时定量PCR(Bio-Rad). 引物均由Invitrogen公司合成. 管家基因β-actin作为内参对照基因, 用得到的各样本的Ct值按公式2-∆∆Ct计算相对表达量(表1).
| 基因 | 种属 | 正义链序列(5'-3') | 反义链序列(5'-3') |
| JAK2 | 人 | CTGAGTTGACTCCTACTGTGGA | TCTTCCCAGGGTCGATAAAGT |
| STAT3 | 人 | CTGAACTTCGGGGTGATCGG | GGCTTGTCACTCGAATTTGAGA |
| Bax | 人 | GCATCGCTTCGGGGTGAT | CGTAGCGAAGCCCACTA |
| Bcl-2 | 人 | AGAAGGGTCCCAGCTA | TTCGGGGTGATCGG |
| β-actin | 人 | AGAGGGAAATCGTGCGTGAC | CAATAGTGATGACCTGGCCGT |
1.2.6 Caspase3活性测定: 收集各组细胞1×105, PBS洗涤2次, 加入细胞裂解液0.5 mL, 充分振荡后, 室温作用30 min, 15000 g离心15 min; 取上清液100 μL, 转入另一EP管中, 加Hepes缓冲液1 mL, 再加入AC-DEVD-AMC 10 μg(1 μg/μL), 37 ℃水浴1 h后上机测定激发波长为380 nm、发散波长为460 nm处的荧光强度Caspase3活性测定.
统计学处理 采用SPSS12.0统计软件包进行资料分析, 实验结果采用mean±SD表示, 资料采用单因素方差分析(ANOVA), 多个样本之间的两两比较采用t检验, P<0.05为差异有统计学意义.
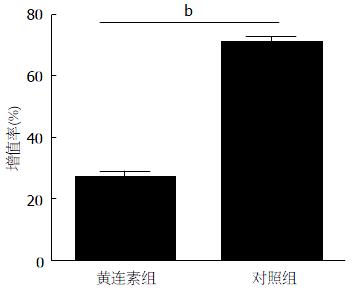
MTT检测实验结果显示, 与对照相比, 给予黄连素的实验组增值率明显降低(P<0.01). 增值率分别为(71%±4%和27%±3%)(图1).
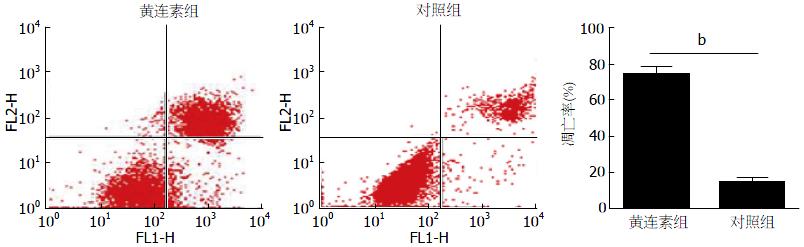
流式检测实验结果显示, 与对照相比, 给予黄连素的实验组凋亡率明显增高(P<0.001). 凋亡率分别为(76%±3%和15%±3%)(图2).
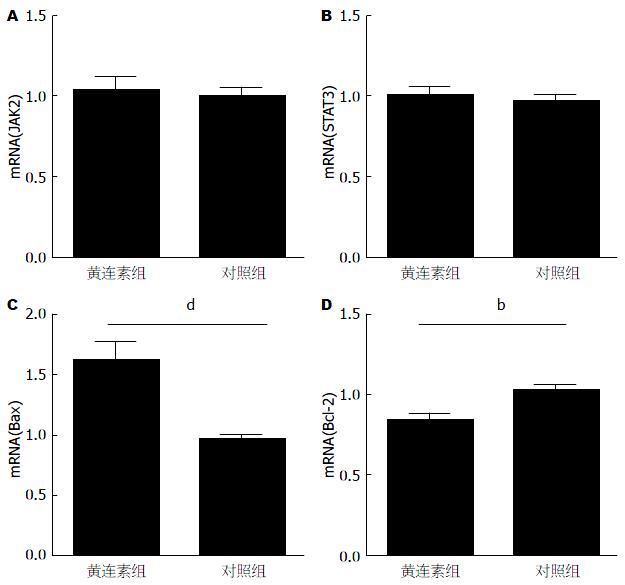
RT-PCR检测结果显示, 对照组JAK2、STAT3 mRNA的表达水平与黄连素素组相比无明显差异(P>0.05), 但黄连素组与对照组相比, Bax mRNA水平明显增高(P<0.001), Bcl-2 mRNA水平明显降低(P<0.05)(图3).
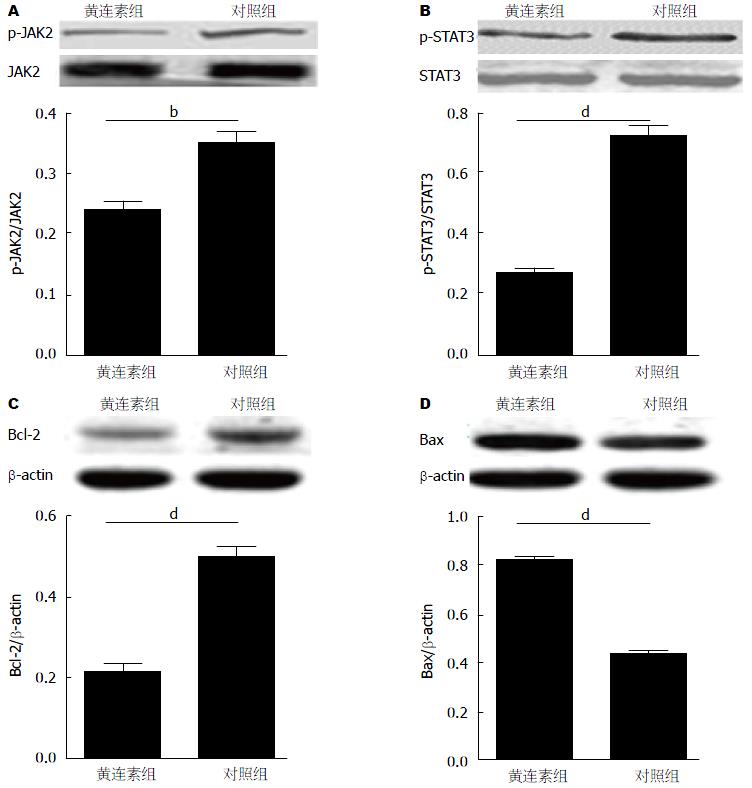
Western blot检测显示, 与对照组相比, 经黄连素作用HT-29细胞72 h后, JAK2、STAT3蛋白无明显变化(P>0.05), p-JAK2、p-STAT3和Bcl-2明显降低, Bax明显增高(P<0.05)(图4).
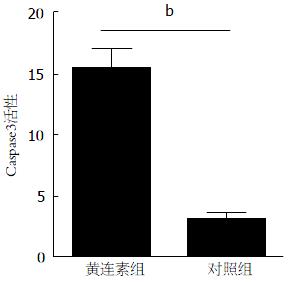
Caspase3活性试剂盒检测实验显示, 与对照相比, 黄连素组Caspase3活性明显增高(P<0.001)(图5).
结肠癌是消化系常见的肿瘤之一, 发病率占胃肠道肿瘤的第2位. 好发部位为直肠及直肠与乙状结肠交界处, 占60%. 发病多在40岁以后, 男女之比为2:1[1,2]. 手术被认为是目前治疗结肠癌的主要手段, 但由于结肠癌发病的隐蔽性和诊疗手段的局限性, 多数结肠癌发现时已进入结肠癌发病中晚期, 不适于手术治疗[3-7]. 目前临床上对胃癌一般采取以化疗为主、放疗、生物免疫治疗等为辅的治疗手段[1-6]. 但化疗有巨大的不良反应, 导致急性肝损伤和肾脏损伤等, 这就限制了化疗药物用量, 阻碍药物发挥功效, 此外放疗治疗容易导致放射性脑、脊髓损伤、放射性脑神经损伤、放射性唾液腺损伤以及放射性的后诱发癌等, 而采用中医药结合化疗治疗中晚期胃癌越来越显出优势[1-7]. 黄连素又称生物碱, 可从黄连、黄柏、三颗针等植物中提取, 临床广泛用于治疗腹泻[8,9]. 目前研究发现黄连素具有广泛的抗肿瘤活性, 如肺癌、肝癌等, 具有抑制细胞增殖、诱导细胞凋亡和提高肿瘤细胞对放疗的敏感性等多种生物学作用[12,13], 而结肠癌是肿瘤细胞增值和凋亡平衡失调的结果[1-3].
JAK2/STAT3是在多种细胞发挥介导作用的信号通路, 信号通路涉及细胞生长、细胞凋亡(促凋亡)、细胞周期进程、分化、转录、翻译和糖代谢[14]. 目前研究发现JAK2/STAT3信号通路可以调节肿瘤细胞增殖[13]、分化、凋亡, 尤其与结肠癌增殖和凋亡密切相关[12-15].
试验中我们通过MTT检测发现黄连素可以明显抑制人结肠癌细胞株HT-29细胞增殖和显著促进HT-29细胞凋亡. Western blot检测发现黄连素可以明显抑制JAK2和STAT3活化, 促进Bax表达增高和Bcl-2表达降低. 活性试剂盒检测显示黄连素可以促进Caspase3活性增高, 因此我们可以推测黄连素可以通过抑制JAK2/STAT3信号通路激活而下调HT-29增殖和促进HT-29凋亡, 从而达到治疗结肠癌的目的.
总之, 黄连素可通过抑制JAK2/STAT3信号通路激活来抑制HT-29细胞增殖和促进HT-29细胞凋亡. 黄连素是直接作用于JAK2信号分子还是通过调节其上游激酶和/或信号分子而间接发挥作用仍不清楚, 黄连素除通过调节JAK2/STAT3信号通路外, 是否还可调节其他信号通路促进HT-29细胞凋亡尚需进行更深入的研究.
结肠癌是最常见的恶性肿瘤之一, 严重威胁人类身心健康. 黄连素是一种用于临床的中药, 目前研究发现其具有广泛的抗肿瘤活性, 但黄连素对结肠癌的作用及其机制不明.
许剑民, 教授, 上海市复旦大学附属中山医院普外科
最近研究发现JAK2/STAT3信号通路在结肠癌的增殖和凋亡失衡中扮演重要角色, 在其他研究领域发现黄连素可调节JAK2/STAT3信号通路, 但在结肠癌中的具体机制和效果不明.
进一步证实了黄连素对结肠癌具有抗肿瘤的活性, 并首次探讨了其抗肿瘤活性是通过抑制JAK2/STAT3信号通路激活.
本实验阐述了黄连素可通过抑制JAK2/STAT3信号通路激活而压抑制结肠癌细胞增殖和促进肿瘤细胞凋亡, 为临床治疗结肠癌提供了一个新的选择.
本文设计新颖, 从传统医学中选取药物研究肿瘤的治疗和机制, 中西结合, 为治疗结肠癌提供了一个新的选择.
编辑: 田滢 电编:鲁亚静
| 1. | Gupta SC, Kim JH, Prasad S, Aggarwal BB. Regulation of survival, proliferation, invasion, angiogenesis, and metastasis of tumor cells through modulation of inflammatory pathways by nutraceuticals. Cancer Metastasis Rev. 2010;29:405-434. [PubMed] [DOI] |
| 2. | Schiller LR. Review article: anti-diarrhoeal pharmacology and therapeutics. Aliment Pharmacol Ther. 1995;9:87-106. [PubMed] |
| 3. | Menees S, Saad R, Chey WD. Agents that act luminally to treat diarrhoea and constipation. Nat Rev Gastroenterol Hepatol. 2012;9:661-674. [PubMed] [DOI] |
| 4. | Zou J, Mi L, Yu XF, Dong J. Interaction of 14-3-3σ with KCMF1 suppresses the proliferation and colony formation of human colon cancer stem cells. World J Gastroenterol. 2013;19:3770-3780. [PubMed] [DOI] |
| 5. | Zhang XL, Hu AB, Cui SZ, Wei HB. Thermotherapy enhances oxaliplatin-induced cytotoxicity in human colon carcinoma cells. World J Gastroenterol. 2012;18:646-653. [PubMed] [DOI] |
| 6. | Wang ZX, Cao JX, Liu ZP, Cui YX, Li CY, Li D, Zhang XY, Liu JL, Li JL. Combination of chemotherapy and immunotherapy for colon cancer in China: a meta-analysis. World J Gastroenterol. 2014;20:1095-1106. [PubMed] [DOI] |
| 7. | Mel'nikov PV, Achkasov EE, Alekperov SF, Aleksandrov LV, Kalachev OA, Ba MR. [The choice of treatment tactics by the tumor colon obturation]. Khirurgiia (Mosk). 2013;84-87. [PubMed] |
| 8. | Caini S, Boniol M, Botteri E, Tosti G, Bazolli B, Russell-Edu W, Giusti F, Testori A, Gandini S. The risk of developing a second primary cancer in melanoma patients: A comprehensive review of the literature and meta-analysis. J Dermatol Sci. 2014;75:3-9. [PubMed] [DOI] |
| 9. | Durko L, Malecka-Panas E. Lifestyle Modifications and Colorectal Cancer. Curr Colorectal Cancer Rep. 2014;10:45-54. [PubMed] |
| 10. | Lee K, Hwang H, Nam KT. Immune response and the tumor microenvironment: how they communicate to regulate gastric cancer. Gut Liver. 2014;8:131-139. [PubMed] |
| 11. | Singh IP, Mahajan S. Berberine and its derivatives: a patent review (2009 - 2012). Expert Opin Ther Pat. 2013;23:215-231. [PubMed] [DOI] |
| 12. | Xu JH, Zhang C, Tang B, Hao YX, Chen J, Liu T, Cui H. [Effect of JAK2/STAT3/vimentin signaling pathway on proliferation and migration of human colon cancer cells]. Zhonghua Weichang Waike Zazhi. 2010;13:282-285. [PubMed] |
| 13. | Nefedova Y, Huang M, Kusmartsev S, Bhattacharya R, Cheng P, Salup R, Jove R, Gabrilovich D. Hyperactivation of STAT3 is involved in abnormal differentiation of dendritic cells in cancer. J Immunol. 2004;172:464-474. [PubMed] |
| 15. | Chiba T, Yamada M, Aiso S. Targeting the JAK2/STAT3 axis in Alzheimer's disease. Expert Opin Ther Targets. 2009;13:1155-1167. [PubMed] [DOI] |