修回日期: 2014-06-11
接受日期: 2014-06-13
在线出版日期: 2014-06-28
目的: 构建携带星形胶质细胞升高基因-1(astrocyte elevated gene-1, AEG-1)的慢病毒载体并进行慢病毒包装, 感染结直肠癌SW1116细胞建立稳定株, 检测AEG-1改变后对血管生成相关因子缺氧诱导因子-1α(hypoxia-inducible factor-1α, HIF-1α)和miR-34a表达的影响.
方法: 采用Western blot方法筛选合适的结直肠癌细胞株; 构建携带AEG-1的慢病毒载体, 经PCR筛选阳性克隆及测序鉴定后, 用psPAX、pMD2.G慢病毒包装系统共转染包装细胞293FT, 包装产生慢病毒, 用以感染筛选出来的结肠癌细胞, 细胞提取mRNA和蛋白进行qRT-PCR和Western blot分析验证细胞模型建立是否成功. 分别采用qRT-PCR和Western blot检测miR-34a和HIF-1α在AEG-1转染前后的表达变化情况.
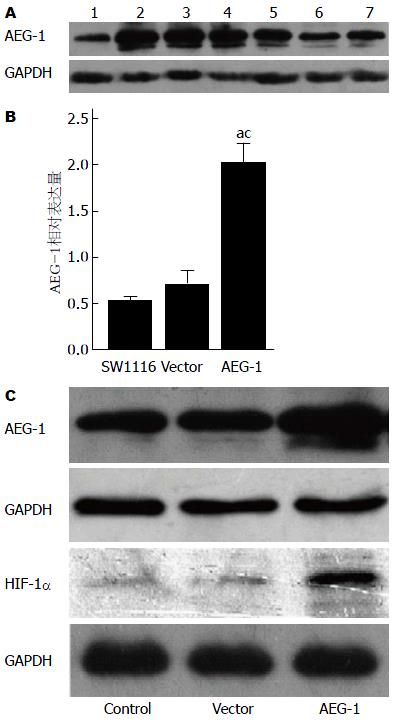
结果: 蛋白质印迹结果显示SW1116在7个结直肠癌中的表达量最低(P<0.05); 成功构建AEG-1的慢病毒载体, 对结肠癌SW1116细胞株AEG-1表达的上调作用显著(0.53±0.44 vs 2.02±0.22, P<0.05; 0.71±0.14 vs 2.02±0.22, P<0.05), 上调AEG-1的表达会抑制miR-34a(P<0.01)和促进HIF-1α(P<0.01)的表达.
结论: 成功构建AEG-1慢病毒载体, AEG-1在结直肠癌中可以抑制血管生成相关因子miR-34a和促进HIF-1α的表达, 我们推测AEG-1可能通过抑制miR-34a促进HIF-1α的表达, 从而发挥促进肿瘤血管新生的作用.
核心提示: 本文展示了成功构建星形胶质细胞升高基因-1(astrocyte elevated gene-1, AEG-1)慢病毒载体并转染结直肠癌细胞株的过程, 并采用qRT-PCR和Western blot证实了AEG-1可以抑制miR-34a和促进缺氧诱导因子-1α(hypoxia-inducible factor-1α, HIF-1α)的表达, 结合国外文献, 推测AEG-1在结直肠癌中可能通过抑制miR-34a, 促进HIF-1α, 从而发挥促进肿瘤血管新生的作用.
引文著录: 黄素军, 吴斌文, 李东风, 刘宝龙, 邓罡, 张凯军. 结直肠癌中AEG-1对血管生成相关因子HIF-1α和miR-34a的影响. 世界华人消化杂志 2014; 22(18): 2532-2538
Revised: June 11, 2014
Accepted: June 13, 2014
Published online: June 28, 2014
AIM: To construct a stable expression system for astrocyte elevated gene-1 (AEG-1) using lentiviral vector in colorectal cancer (CRC) cells and assess its relationship with miR-34a and hypoxia-inducible factor-1α (HIF-1α).
METHODS: AEG-1 expression in CRC cells was examined by Western blot analysis. A lentiviral vector carrying AEG-1 was constructed, identified by PCR and DNA sequencing, and then transfected into 293FT cells using lentiviral packaging systems. SW1116 cells were infected with the virus and analyzed by qRT-PCR and Western blot. Expression of miR-34a and HIF-1α was detected using qRT-PCR and Western blot.
RESULTS: Western blot analysis showed that AEG-1 expression was the lowest in SW1116 among 7 CRC cell lines (P < 0.05). AEG-1 lentiviral vector was constructed successfully as revealed by DNA sequencing. The stable expression of AEG-1 was validated by qRT-PCR and Western blot (0.53 ± 0.44 vs 2.02 ± 0.22, P < 0.05; 0.71 ± 0.14 vs 2.02 ± 0.22, P < 0.05). Up-regulation of AEG-1 inhibited miR-34a expression (P < 0.01) but increased HIF-1α expression (P < 0.01).
CONCLUSION: An AEG-1 lentiviral vector has been successfully constructed. AEG-1 can down-regulate the expression of miR-34a and up-regulate the expression of HIF-1α.
- Citation: Huang SJ, Wu BW, Li DF, Liu BL, Deng G, Zhang KJ. AEG-1 affects expression of HIF-1α and miR-34a in colorectal cancer cells. Shijie Huaren Xiaohua Zazhi 2014; 22(18): 2532-2538
- URL: https://www.wjgnet.com/1009-3079/full/v22/i18/2532.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i18.2532
星形胶质细胞升高基因-1(astrocyte elevated gene-1, AEG-1)也称为异黏蛋白(metadherin, MTDH), 是人免疫缺陷病毒(human immunodeficiency virus-1, HIV-1)[1]感染或肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)诱导胚胎星形细胞后导致表达升高的一种基因, 最初在2002年由Su等[2]通过快速消减杂交(rapid subtraction hybridization, RaSH)的方法克隆出来的, 位于人染色体8q22, 此位点是多种恶性肿瘤高度相关地带. AEG-1定位于核周和类内质网结构区, 目前已被证实与多种恶性肿瘤的发生发展有关, 包括神经母细胞瘤、乳腺癌、肝细胞癌、非小细胞肺癌、结直肠癌和前列腺癌等. 其中, AEG-1在结直肠癌中高表达, 且其表达水平与其UICC分级、TNM分期以及组织分化明显相关. AEG-1作为癌基因, 可以调节细胞的多种生理、病理过程, 包括增殖、侵袭、转移、血管新生和基因表达等[3,4]. 缺氧诱导因子1α(hypoxia-inducible factor-1α, HIF-1α)是与血管生成有关的分子, 他使细胞更容易适应低氧的环境, 促进血管生成. 而miR-34a是一个抑癌基因, 已知高表达miR-34a有抑制血管新生的作用. 大量实验通过在体内、外提高或抑制AEG-1表达以进一步探明AEG-1潜在功能和作用机制, 慢病毒转染因其高效性和稳定性有利于细胞模型的建立和研究的进一步开展而被广泛应用. 我们前期研究发现, AEG-1在结直肠癌组织和结直肠癌细胞株中均高表达, 其中在SW1116细胞株中的表达相对较低, 本实验通过慢病毒介导提高AEG-1在结直肠癌细胞株SW1116的表达, 旨在进一步研究其生物学功能及相关信号通路, 探讨其与miRNA及HIF-1α的关系, 为以AEG-1为靶点介入肿瘤治疗及相关后续研究奠定基础.
挑选了带绿色荧光蛋白(green fluorescent protein, GFP)报告基因的慢病毒载体pCDH-CMV-MCS-EF1-copGFP; 采用psPAX, pMD2.G慢病毒包装系统. QIAquick Gel Extraction Kit, QIAGEN, 货号: 28704; 质粒小提试剂盒, TIANGEN, 目录号: DP103-02; Taq DNA Polymerase, 美国Fermentas, 货号: EP0404; dNTP Mix, 美国Fermentas, 货号: R0192; GeneRuler™ 100 bp DNA Ladder, 美国Fermentas, 货号: SM0241; PrimeSTAR™ HS DNA Polymerase, Takara, 货号: DR010S; GeneRuler™ 1000 bp DNA Ladder, Fermentas, 货号: SM0311; T4 DNA Ligase, TAKARA, 货号: D2011A; Lipofectamine 2000. 293FT细胞和结肠癌SW1116细胞株, 分别培养于含10%FBS H-DMEM和10%FBS DMEM培养基中.
1.2.1 Western blot挑选结直肠癌细胞株: 培养Lovo、HT29、CaCO2、HCT116、SW1116、SW620和SW480共7种结直肠癌细胞株, 分别采用RIPA裂解细胞, 离心后收集上清, 进行蛋白质定量, 取50 µg总蛋白进行SDS-PAGE电泳, 电泳完毕, 采用PVDF膜进行转膜, 5%脱脂奶粉室温下封闭1 h后, 分别加入兔抗人AEG-1抗体(Invitrogen)1:1000, 4 ℃过夜, TBST洗涤3次, 每次10 min, 加入IgG/HRP鼠抗兔二抗1:3000, 室温孵育1 h, TBST洗涤3次, 每次5-10 min, ECL显色试剂盒显影, 以GAPDH为内参. 实验重复3次.
1.2.2 慢病毒载体构建: 根据实验需要挑选了带GFP报告基因的慢病毒载体pCDH-CMV-MCS-EF1-copGFP, 对载体进行EcoRⅠ/BamHⅠ酶切, 然后设计1对AEG-1的PCR引物, 并分别添加限制性酶切位点EcoRⅠ和BamHⅠ, 采用PCR扩增AEG-1基因, 回收片段, AEG-1产物酶切、载体酶切、连接、转化等, PCR筛选阳性克隆, 测序鉴定, 最后构建完成质粒pSIN-EF2-AEG-1 -IRES-GFP-puro. 采用CsCl法超速离心分离提取质粒.
1.2.3 病毒包装: 转染前26 h铺293FT细胞, 转染我们是采用psPAX, pMD2.G慢病毒包装系统. 转染的总质粒量为40 µg质粒的比例为慢病毒载体: psPAX:pMD2.G = 4:3:1. 293FT细胞转染后在荧光显微镜下观察细胞内GFP的表达. 转染24和36 h后收取病毒液, 过滤, 储存于-80 ℃冰箱.
1.2.4 病毒感染结肠癌细胞株及阳性细胞筛选: 将结肠癌细胞SW1116按40%细胞密度铺到培养皿中, 12 h后可以开始进行慢病毒感染, 将携带GFP基因的病毒液加入内含SW1116细胞的培养板孔内, 感染12 h后, 用相应培养基替换感染液, 重复感染2 d后, 可在荧光显微镜下观察GFP的细胞阳性率, 即为病毒的感染成功率. 转染48 h后, 用含终浓度为0.5 µg/mL嘌呤霉素的10%FBS DMEM培养基筛选出阳性细胞. 筛选过程一般为10 d左右. 中间出现漂浮死细胞需要经常更换培养基(含0.5 µg/mL嘌呤霉素的10%FBS DMEM).
1.2.5 miRNA微阵列杂交: 采用TRIzol试剂提取细胞的总RNA, 采用美国昂飞公司(Affymetrix)的微阵列芯片鉴定SW1116细胞株处理前后miRNA表达谱的全方位的改变, 采用2倍变化作为筛选的标准.
1.2.6 实时荧光定量PCR检测AEG-1和miR-34a的表达: 采用TRIzol试剂提取细胞的总RNA, 各取2 µg RNA, 以Oligo dT为引物反转录成cDNA, 用qPCR方法检测AEG-1基因的表达情况, 以β-actin为内参. PCR扩增条件: 94 ℃预变性2 min, 主循环94 ℃ 10 s、60 ℃ 20 s、72 ℃ 30 s, 所用引物序列为: FP: 5'-AAATGGGCGGACTGTTGAAGT-3'; RP: 5'-CTGTTTTGCACTGCTTTAGCAT-3'. 以上述RNA为模板, 采用Fermentas公司的RevertAid First Strand cDNA Synthesis Kit试剂盒进行cDNA第一链的合成. miR-34a的引物由锐博公司合成, 用qPCR方法检测miR-34a的表达情况, 以U6为内参. PCR扩增条件: 95 ℃预变性20 s, 主循环95 ℃ 10 s、60 ℃ 20 s、70 ℃ 10 s, miR-34a的序列为: 5'-UGGCAGUGUCUUAGCUGGUUGU-3'.
1.2.7 Western blot检测AEG-1和HIF-1α蛋白表达: 提取总蛋白进行电泳, 然后转膜、封闭, 具体方法同前, 分别采用兔抗人AEG-1抗体(Invitrogen)1:1000和鼠抗人HIF-1α(Novus)1:500, 4 ℃过夜, TBST洗涤, 分别加入IgG/HRP鼠抗兔二抗1:3000和羊抗鼠二抗1:5000, 室温孵育1 h, TBST洗涤, ECL显色试剂盒显影, 以GAPDH为内参. 实验重复3次.
统计学处理 所有数据以mean±SD表示, 符合正态分布且方差齐者采用两个独立样本t检验或ANOVA检验, 方差不齐采用Dunnett T3校正, 用SPSS13.0统计软件进行统计分析, P<0.05为差异有统计学意义.
采用Western blot检测AEG-1在7个结直肠癌细胞株包括Lovo、HT29、CaCO2、HCT116、SW1116、SW620和SW480中的表达. 在7个细胞株中均有AEG-1的表达, 其中, 在SW1116的表达量最低(如图1A), 我们选择他作为我们下一步实验的对象.
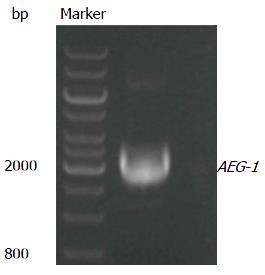
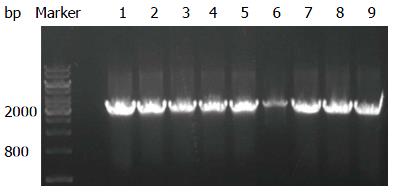
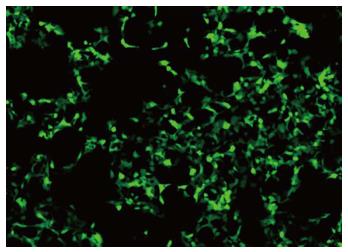
重组慢病毒载体用EcoRⅠ/BamHⅠ进行酶切反应, 利用PCR进行AEG-1克隆鉴定, 电泳图如图2, 挑选9个转化的细菌菌落, 利用PCR进行阳性菌落的鉴定, 实验结果证明9个菌落都是AEG-1阳性的(图3), 接着挑出阳性菌落1和2进行测序, 结果表明1和2菌落的序列都是正确的. 质粒pSIN-EF2-AEG-1-IRES-GFP-puro构建完成. 慢病毒载体与病毒包装质粒共转染293FT细胞, 24 h后, 在荧光显微镜下可见转染效率接近100%(图4).
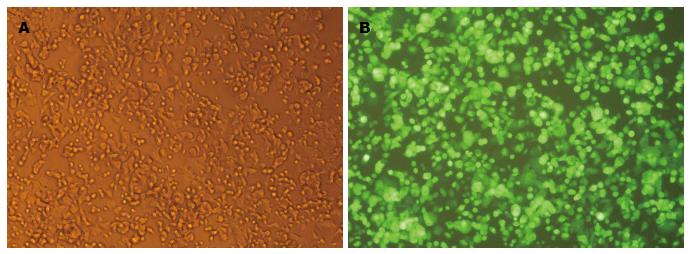
用携带GFP基因的病毒上清或浓缩的病毒感染SW1116细胞, 感染48 h后倒置荧光显微镜下观察, 可见绿色荧光, 表明慢病毒成功感染结肠癌细胞. 此外, 用含终浓度为0.5 µg/mL嘌呤霉素的10%DMEM筛选出阳性细胞, 然后对同一视野自然光和荧光下的图片进行比对(图5), 发现慢病毒高效率感染了结肠癌细胞.
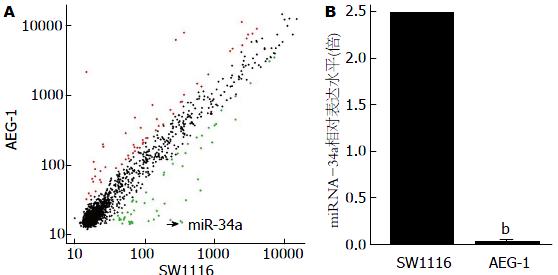
采用miRNA微阵列芯片鉴定SW1116细胞株处理前后miRNA表达谱的全方位的改变, 采用2倍变化作为筛选的标准. SW1116转染前后对比有显著性差异的miRNA有117个(图6A), 其中升高的有59个(红色散点), 降低的有58个(绿色散点). miR-34a是其中一个降低最为明显的miRNA.
qRT-PCR和Western blot检测SW1116细胞原始组、空载组和转染组的AEG-1表达水平, qRT-PCR检测SW1116细胞转染前后miR-34a表达水平的差异, Western blot检测各组HIF-1α的表达水平. 如图1B和图1C所示, 转染AEG-1后AEG-1 mRNA和蛋白表达水平明显升高, 可见模型建立成功. 而miR-34a的水平明显下降, 仅为原来的0.016倍(图6B), 同时, HIF-1α的蛋白表达水平明显升高(图1C). 表明成功构建过表达AEG-1的结肠癌细胞株, 且miR-34a和HIF-1α的表达受AEG-1的影响, 可能是其下游的靶基因.
AEG-1在多种肿瘤中都高表达, 包括乳腺癌、非小细胞肺癌、食管鳞癌、肝细胞癌、结直肠癌、神经胶质瘤、前列腺癌、宫颈癌等[5-12]. 大量研究证实, AEG-1在很多器官癌变的过程中起着致癌基因的作用, 如肝癌[13], 且在肿瘤发生发展中起着促进生长、转移, 增强肿瘤侵袭能力, 迁移能力, 逃避凋亡[14], 耐药以及促进肿瘤血管生成等的作用. 在结直肠癌中, 无论在mRNA水平还是在蛋白质水平, AEG-1在正常黏膜、原始肿瘤到淋巴结转移和肝转移的表达水平呈明显上升趋势[9]. AEG-1的表达水平与结直肠癌肿瘤患者的UICC分级、T、N、M分期和组织分化都是明显相关的, 此外, 高表达AEG-1的患者存活时间越短[15]. 有结直肠癌肝转移的患者相对于没有肝转移的患者AEG-1的表达水平更高, AEG-1的表达水平还和患者的年龄、Duke分期和远处转移均有关[16]. Zhang等[17]也证明了AEG-1在结直肠癌中担当着促进肿瘤转移和侵袭的重要作用, 这些都表明AEG-1与结直肠癌的发展和转移是密切相关的.
AEG-1有促进肿瘤血管新生的作用, 与AEG-1介导血管生成有关的因子包括磷脂酰肌醇3激酶(phosphatidylinositol-3-kinase, PI3K)/蛋白激酶B(protein kinase B, Akt)、血管生成素-1(angiopoietin-1, Ang1)/Tie2、H-ras、HIF-1α和血管内皮生长因子(vascular endothelial growth factor, VEGF)等[18-21]. Emdad等[22]发现在鼠胚胎成纤维细胞中, AEG-1的过度表达能提高瘤组织的微血管密度, 且可增加与血管生成有关的分子标志物的表达, 如血管生成素1、基质金属蛋白酶2和HIF-1α. 体外实验也证实AEG-1通过PI3K/Akt信号途径诱导Tie2和HIF-1α表达, 可促进脉管形成. 但是在结直肠癌中, AEG-1是否通过HIF-1α发挥促进血管生成的作用, 其与miRNA有什么关系, 还有待进一步验证. 我们通过miRNA阵列杂交, 筛选出在转染前后变化明显的miRNA, miR-34a是其中一个变化最明显的miRNA, 且已知miR-34a是一个抑癌基因, 高表达miR-34a有抑制血管新生的作用. 因此, 我们选取miR-34a和HIF-1α作为其中研究目标, 采用慢病毒介导过表达AEG-1后, 采用qRT-PCR验证miR-34a和蛋白质印迹验证HIF-1α的表达情况, 结果发现转染AEG-1后miR-34a的表达明显下降, 而HIF-1α的表达明显上升. 研究报道高表达的miR-34a可抑制沉默信息调节因子1(silent information regulator 1, SIRT1)损害内皮组细胞, 从而抑制血管新生[23]; 在头颈部鳞癌, miR-34a通过阻断VEGF的产物和直接抑制内皮细胞的功能来抑制肿瘤血管生成[24]; 在骨肉瘤中, miR-34a和miR-200b在调控Notch-1、VEGF、基质金属蛋白酶-2(matrix metalloproteinase 2, MMP-2)和MMP-9的表达发挥重要作用[25]. HIF-1α是促进癌细胞表达VEGF和促进血管生成的主要途径, HIF-1α在缺氧时高表达, 且转录活性增强, 是细胞对缺氧反应的最重要调节者, 是促进VEGF表达的根本因素. Long等[12]发现在宫颈癌中, 下调AEG-1的表达会明显降低血管生成相关因子HIF-1α、Tie2、VEGF和TEM1/CD248的表达. 这与我们在结直肠癌中发现上调AEG-1的表达会上调HIF-1α是一致的. 在恶性胶质瘤中, 缺氧可以诱导AEG-1的表达, 且诱导AEG-1的表达依赖于HIF-1α的稳定性, PI3K的抑制可以通过HIF-1α稳定性的丢失从而抑制AEG-1的表达[10]. 我们的实验结果显示过表达AEG-1的SW1116, miR-34a明显下降同时HIF-1α的表达也明显提高, 结合国外研究发现miR-34a可抑制VEGF, HIF-1α可促进VEGF表达, 我们猜想AEG-1在结直肠癌中通过抑制miR-34a, 促进HIF-1α的表达, 从而促进VEGF的表达, 发挥促进肿瘤血管新生的作用.
AEG-1参与很多传统的致癌信号通路, 包括Ha-Ras、myc、核因子-κB(nuclear factor-kappa B, NF-κB)[26]和PI3K/Akt等, 这些信号通路与肿瘤的增殖、转移、凋亡和药物敏感等都是密切相关的. Yang等[27]在小鼠模型通过阻塞胆管诱导胆管癌中发现, 阻塞胆管会抑制miR-34a和Let-7a的表达, 会上调HIF-1α、HIF-2α和miR-210的表达, 这个发现与我们在结直肠癌中的发现有相似之处, 上调AEG-1会抑制miR-34a及促进HIF-1α表达, 当中miR-34a与HIF-1α可能存在上下游基因或互相调控的关系, 这还有待进一步研究. 有报道AEG-1为RNA结合蛋白, 提示AEG-1有可能为药物敏感或耐药基因[28]. AEG-1调控药物抗性是通过增加多抗药性基因1(multidrug resistance gene-1, MDR1)的mRNA载入多聚核糖体, 从而促进MDR1蛋白的翻译. 而miR-34a与药物敏感性也有关, 有报道miR-34a与结肠癌细胞株DLD-1抗5-氟尿嘧啶(5-fluorouraeil, 5-FU)药性有关[29], miR-34a在实体肿瘤中可调控酪氨酸蛋白激酶受体Axl的表达可考虑用作抗转移的药物治疗[30]. 而AEG-1在结直肠癌中是否与化疗药物抗药性有关, AEG-1能否用于临床应用上, 如作为结直肠癌筛查、转移和复发的标志物, 作为基因治疗的靶点等, 值得我们进一步研究.
总之, AEG-1是一个重要的致癌基因, 在结直肠癌等多种恶性肿瘤中高表达, 是肿瘤恶性转化的一个生物学标记. 通过AEG-1过表达或敲低的方法, 详细了解AEG-l的生物学特性、分子机制和调控通路将有助于明确其在结直肠癌进展中的作用, 为结直肠癌的诊治提供更新、更有效和更全面的方法.
星形胶质细胞升高基因-1(astrocyte elevated gene-1, AEG-1), 是一个2002年新发现, 并在短期内得到广泛研究的基因, 目前发现其不仅在各种类型的肿瘤中均高表达, 而且和肿瘤的发生、增殖、侵袭、转移、耐药以及血管生成等多个方面均有密切关系.
许剑民, 教授, 上海市复旦大学附属中山医院普外科
AEG-1在各类恶性肿瘤的体内外细胞生物学功能和相关通路的研究是本领域研究的重点, 本研究主要集中在结直肠癌中AEG-1与肿瘤血管生成因子之间的关系.
有报道AEG-1在鼠胚胎成纤维细胞中能通过影响缺氧诱导因子1α(hypoxia-inducible factor-1α, HIF-1α)促进肿瘤血管的生成, HIF-1α有促进血管生成的作用, 而miR-34a有抑制血管新生的作用.
采用慢病毒转染制作细胞模型十分成功, 模型制备方法具有一定参考价值. 在结直肠癌中, AEG-1能否影响HIF-1α和miRNA-34a的表达在既往尚未有报道, 具有创新性.
了解AEG-1与HIF-1a和miR-34a的关系, 有利于下一步对血管生成相关通路深入研究, 抑制肿瘤血管生成有望成为肿瘤治疗的新靶点.
本文主要研究了已经证明和血管生成有关的HIF-1a和miRNA-34a在结直肠癌中是否受AEG-1的影响, 有一定的创新性, 主要表现在选择的AEG-1能否影响HIF-a和miRNA-34a在既往尚未得到证实. 在研究方法方面, 选用慢病毒转染等成熟的实验技术, 得出的结论比较可靠.
编辑: 郭鹏 电编:鲁亚静
| 1. | Kang DC, Su ZZ, Sarkar D, Emdad L, Volsky DJ, Fisher PB. Cloning and characterization of HIV-1-inducible astrocyte elevated gene-1, AEG-1. Gene. 2005;353:8-15. [PubMed] [DOI] |
| 2. | Su ZZ, Kang DC, Chen Y, Pekarskaya O, Chao W, Volsky DJ, Fisher PB. Identification and cloning of human astrocyte genes displaying elevated expression after infection with HIV-1 or exposure to HIV-1 envelope glycoprotein by rapid subtraction hybridization, RaSH. Oncogene. 2002;21:3592-3602. [PubMed] [DOI] |
| 3. | Emdad L, Sarkar D, Su ZZ, Lee SG, Kang DC, Bruce JN, Volsky DJ, Fisher PB. Astrocyte elevated gene-1: recent insights into a novel gene involved in tumor progression, metastasis and neurodegeneration. Pharmacol Ther. 2007;114:155-170. [PubMed] [DOI] |
| 5. | Li J, Zhang N, Song LB, Liao WT, Jiang LL, Gong LY, Wu J, Yuan J, Zhang HZ, Zeng MS. Astrocyte elevated gene-1 is a novel prognostic marker for breast cancer progression and overall patient survival. Clin Cancer Res. 2008;14:3319-3326. [PubMed] [DOI] |
| 6. | Song L, Li W, Zhang H, Liao W, Dai T, Yu C, Ding X, Zhang L, Li J. Over-expression of AEG-1 significantly associates with tumour aggressiveness and poor prognosis in human non-small cell lung cancer. J Pathol. 2009;219:317-326. [PubMed] [DOI] |
| 7. | Yu C, Chen K, Zheng H, Guo X, Jia W, Li M, Zeng M, Li J, Song L. Overexpression of astrocyte elevated gene-1 (AEG-1) is associated with esophageal squamous cell carcinoma (ESCC) progression and pathogenesis. Carcinogenesis. 2009;30:894-901. [PubMed] [DOI] |
| 8. | Yoo BK, Emdad L, Su ZZ, Villanueva A, Chiang DY, Mukhopadhyay ND, Mills AS, Waxman S, Fisher RA, Llovet JM. Astrocyte elevated gene-1 regulates hepatocellular carcinoma development and progression. J Clin Invest. 2009;119:465-477. [PubMed] [DOI] |
| 9. | Gnosa S, Shen YM, Wang CJ, Zhang H, Stratmann J, Arbman G, Sun XF. Expression of AEG-1 mRNA and protein in colorectal cancer patients and colon cancer cell lines. J Transl Med. 2012;10:109. [PubMed] [DOI] |
| 10. | Noch E, Bookland M, Khalili K. Astrocyte-elevated gene-1 (AEG-1) induction by hypoxia and glucose deprivation in glioblastoma. Cancer Biol Ther. 2011;11:32-39. [PubMed] |
| 11. | Kikuno N, Shiina H, Urakami S, Kawamoto K, Hirata H, Tanaka Y, Place RF, Pookot D, Majid S, Igawa M. Knockdown of astrocyte-elevated gene-1 inhibits prostate cancer progression through upregulation of FOXO3a activity. Oncogene. 2007;26:7647-7655. [PubMed] [DOI] |
| 12. | Long M, Dong K, Gao P, Wang X, Liu L, Yang S, Lin F, Wei J, Zhang H. Overexpression of astrocyte-elevated gene-1 is associated with cervical carcinoma progression and angiogenesis. Oncol Rep. 2013;30:1414-1422. [PubMed] [DOI] |
| 13. | Srivastava J, Siddiq A, Emdad L, Santhekadur PK, Chen D, Gredler R, Shen XN, Robertson CL, Dumur CI, Hylemon PB. Astrocyte elevated gene-1 promotes hepatocarcinogenesis: novel insights from a mouse model. Hepatology. 2012;56:1782-1791. [PubMed] [DOI] |
| 14. | 刘 海燕, 姜 玉杰, 孙 若鹏. siRNA下调astrocyte elevated gene-1对神经母细胞瘤细胞增殖和凋亡影响的体外研究. 中国病理生理杂志. 2011;27:705-710. |
| 15. | Song H, Li C, Li R, Geng J. Prognostic significance of AEG-1 expression in colorectal carcinoma. Int J Colorectal Dis. 2010;25:1201-1209. [PubMed] [DOI] |
| 16. | Jiang T, Zhu A, Zhu Y, Piao D. Clinical implications of AEG-1 in liver metastasis of colorectal cancer. Med Oncol. 2012;29:2858-2863. [PubMed] [DOI] |
| 17. | Zhang F, Yang Q, Meng F, Shi H, Li H, Liang Y, Han A. Astrocyte elevated gene-1 interacts with β-catenin and increases migration and invasion of colorectal carcinoma. Mol Carcinog. 2013;52:603-610. [PubMed] [DOI] |
| 18. | Lee SG, Su ZZ, Emdad L, Sarkar D, Fisher PB. Astrocyte elevated gene-1 (AEG-1) is a target gene of oncogenic Ha-ras requiring phosphatidylinositol 3-kinase and c-Myc. Proc Natl Acad Sci U S A. 2006;103:17390-17395. [PubMed] [DOI] |
| 19. | Lee SG, Su ZZ, Emdad L, Sarkar D, Franke TF, Fisher PB. Astrocyte elevated gene-1 activates cell survival pathways through PI3K-Akt signaling. Oncogene. 2008;27:1114-1121. [PubMed] [DOI] |
| 20. | Sakurai T, Kudo M. Signaling pathways governing tumor angiogenesis. Oncology. 2011;81 Suppl 1:24-29. [PubMed] [DOI] |
| 21. | Saharinen P, Eklund L, Pulkki K, Bono P, Alitalo K. VEGF and angiopoietin signaling in tumor angiogenesis and metastasis. Trends Mol Med. 2011;17:347-362. [PubMed] [DOI] |
| 22. | Emdad L, Lee SG, Su ZZ, Jeon HY, Boukerche H, Sarkar D, Fisher PB. Astrocyte elevated gene-1 (AEG-1) functions as an oncogene and regulates angiogenesis. Proc Natl Acad Sci U S A. 2009;106:21300-21305. [PubMed] [DOI] |
| 23. | Zhao T, Li J, Chen AF. MicroRNA-34a induces endothelial progenitor cell senescence and impedes its angiogenesis via suppressing silent information regulator 1. Am J Physiol Endocrinol Metab. 2010;299:E110-E116. [PubMed] [DOI] |
| 24. | Kumar B, Yadav A, Lang J, Teknos TN, Kumar P. Dysregulation of microRNA-34a expression in head and neck squamous cell carcinoma promotes tumor growth and tumor angiogenesis. PLoS One. 2012;7:e37601. [PubMed] [DOI] |
| 25. | Li Y, Zhang J, Zhang L, Si M, Yin H, Li J. Diallyl trisulfide inhibits proliferation, invasion and angiogenesis of osteosarcoma cells by switching on suppressor microRNAs and inactivating of Notch-1 signaling. Carcinogenesis. 2013;34:1601-1610. [PubMed] [DOI] |
| 26. | Sarkar D, Park ES, Emdad L, Lee SG, Su ZZ, Fisher PB. Molecular basis of nuclear factor-kappaB activation by astrocyte elevated gene-1. Cancer Res. 2008;68:1478-1484. [PubMed] [DOI] |
| 27. | Yang H, Li TW, Peng J, Tang X, Ko KS, Xia M, Aller MA. A mouse model of cholestasis-associated cholangiocarcinoma and transcription factors involved in progression. Gastroenterology. 2011;141:378-88, 388.e1-4. [PubMed] [DOI] |
| 28. | Meng X, Thiel KW, Leslie KK. Drug resistance mediated by AEG-1/MTDH/LYRIC. Adv Cancer Res. 2013;120:135-157. [PubMed] [DOI] |
| 29. | Akao Y, Noguchi S, Iio A, Kojima K, Takagi T, Naoe T. Dysregulation of microRNA-34a expression causes drug-resistance to 5-FU in human colon cancer DLD-1 cells. Cancer Lett. 2011;300:197-204. [PubMed] [DOI] |