修回日期: 2014-06-06
接受日期: 2014-06-16
在线出版日期: 2014-06-28
目的: 探讨外源性bcl6b基因表达对人食管癌细胞生物学行为的影响.
方法: 应用PCR方法扩增bcl6b基因编码区, 利用脂质体转染技术将真核表达重组体pcDNA-bcl6b质粒和空载体pcDNA3.1质粒分别导入KYSE180细胞, 经G418筛选后获得稳定转染细胞克隆, Western blot检测BCL6B和P53在KYSE180细胞中的表达变化. 通过流式细胞术(FCM)分析其细胞周期及其凋亡的变化, 绘制生长曲线和克隆形成试验检测重表达bcl6b基因后食管癌细胞的增殖变化.
结果: 成功获得了稳定表达外源性bcl6b基因的KYSE180细胞系, 与转染空白载体组比较, 转染bcl6b基因的细胞, 细胞周期中G1/G0期比例明显增加(BCL6B: 47.85%±1.53% vs Vector: 40.62%±1.07%, P<0.05), S期比例减少(BCL6B: 34.40%±1.30% vs Vector: 42.31%±0.66%, P<0.01), 细胞凋亡率升高(BCL6B: 11.74%±0.99% vs Vector: 2.43%±0.70%, P<0.01); 同时P53和P21蛋白的表达水平明显升高. 转染bcl6b基因的细胞的生长速度较空载组比明显减慢.
结论: BCL6B可能通过上调P53和P21蛋白的表达水平从而抑制KYSE180细胞的恶性生物学行为.
核心提示: 重表达bcl6b基因的细胞, 细胞周期中G1/G0期比例明显增加, S期比例减少, 细胞凋亡率升高; 转染bcl6b基因的细胞的生长速度较空载组明显减慢. 同时P53和P21蛋白的表达水平明显升高. 研究结果表明BCL6B可通过上调P53和P21蛋白的表达水平, 从而引起细胞G1/S期阻滞和诱导细胞凋亡而抑制食管癌细胞KYSE180细胞的恶性生物学行为.
引文著录: 胡随, 毛高平, 郭明洲. bcl6b基因转染对人食管癌细胞生物学行为的影响. 世界华人消化杂志 2014; 22(18): 2525-2531
Revised: June 6, 2014
Accepted: June 16, 2014
Published online: June 28, 2014
AIM: To determine the effect of exogenous bcl6b gene on biological behavior of human esophageal cancer cells.
METHODS: PCR was used to clone the bcl6b gene to construct the pcDNA-bcl6b vector. The pcDNA-bcl6b and pcDNA3.1 (empty vector) were introduced into KYSE180 cell line using Lipofectin, and the KYSE180 cells stably expressing the bcl6b gene were established by G418 selection. The expression of BCL6B, P53 and P21 proteins was detected by Western blot. Cell cycle and apoptosis were assayed by flow cytometry (FCM). Cell proliferation was observed by growth curve and colony formation assays.
RESULTS: KYSE180 cells stably expressing BCL6B protein were established. FCM showed that more BCL6B-transfected cells entered into G0/G1 phase (BCL6B: 47.85% ± 1.53% vs empty vector: 40.62% ± 1.07%, P < 0.05) and fewer cells entered into S phase (BCL6B: 34.40% ± 1.30% vs empty vector: 42.31% ± 0.66%, P < 0.01) compared with cells transfected with the empty vector. Moreover, there was a significant difference in the apoptosis rate between the two groups (BCL6B: 11.74% ± 0.99% vs empty vector: 2.43% ± 0.70%, P < 0.01), and P53 and P21 protein expression levels were significantly increased. Compared with the empty vector transfected cells, the BCL6B-transfected cells grew more slowly.
CONCLUSION: BCL6B protein might inhibit the malignant biological behavior of KYSE180 cells partly by up-regulating P53 and P21 protein expression.
- Citation: Hu S, Mao GP, Guo MZ. Effect of transfection with bcl6b on biological behavior of human esophageal cancer cells. Shijie Huaren Xiaohua Zazhi 2014; 22(18): 2525-2531
- URL: https://www.wjgnet.com/1009-3079/full/v22/i18/2525.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i18.2525
食管癌是消化系最常见的恶性肿瘤之一, 其恶性程度在所有肿瘤中居第5位, 但其在癌症相关死亡原因中居第4位[1]. 在中国北部和中部地区, 90%以上的食管癌的病理类型为鳞状细胞癌[2]. 近10年来, 随着外科手术和放化疗方案的进展, 食管癌的5年生存率依然低于20%[3]. 近年来越来越多的研究证据表明, 抑癌基因因启动子区域的高甲基化所导致的表达缺失, 在食管癌的发生和发展中起了至关重要作用[4-8]. 有文献报道bcl6b启动子区异常高甲基化而导致其在胃癌中出现表达的缺失, 在胃癌细胞系中恢复其的表达可以抑制细胞增殖, 促进细胞凋亡, 检测胃癌组织或血浆中bcl6b基因的甲基化可作为诊断胃癌的独立生物标志物[9,10]. 而在本实验室既往的研究中发现在食管癌中, bcl6b基因的启动子区域也普遍存在高甲基化, 且在食管癌的细胞实验中发现bcl6b基因的表达受启动子区域甲基化的调控[11]. 目前关于bcl6b在食管癌中的生物学功能未见报道. 本研究通过在BCL6B表达缺失的食管癌KYSE180细胞中恢复BCL6B的表达, 从而研究BCL6B在食管癌中的生物学功能, 及进一步探讨发挥功能的相关信号通路, 为食管癌的治疗提供新的思路.
TRIzol、cDNA第一链合成试剂盒、G418、胎牛血清、RPMI 1640/DMEM培养基、转染试剂Lipofectamine 2000购自美国Invitrogen公司; BCA法蛋白定量世纪盒、质粒提取试剂盒购自康为世纪; 蛋白裂解液、一抗稀释液购自碧云天; 限制性内切酶、预染蛋白质分子量标准、T4 DNA Ligase购自美国NewEngland Biolabs公司; 兔抗人β-actin抗体、羊抗鼠二抗、辣根过氧化物酶标记的羊抗鼠购自中杉金桥; 兔抗人P53多克隆抗体购自美国SantaCrus公司; 感受态大肠杆菌DH5α购自全式金生物公司; pcDNA3.1载体和食管癌细胞株KYSE180为301医院消化科实验室馈赠; PCR引物合成及序列测定为华大基因公司. 细胞周期、凋亡、增殖和细胞毒性检测试剂盒购自凯基生物.
1.2.1 bcl6b基因克隆与真核表达载体的构建: 本实验采用PCR技术, 以正常食管黏膜组织cDNA为模板, 行PCR扩增后获得bcl6b基因的编码区序列(1446 bp), 相应引物序列及PCR反应条件为: 上游引物5'-GAAGATCTATGTACCCATACGATGTTCCAGATTACGCT-3', 下游引物5'-CCGCTCGAGCTAGGGCCCCCCGAGAAT-3'. 10 g/L琼脂糖电泳鉴定PCR扩增产物. PCR产物纯化后用BglⅡ和XhoⅠ双酶切, pcDNA3.1质粒用BamHⅠ和XhoⅠ双酶切后纯化回收, 连接、转化DH5α感受态细胞, 挑菌测序.
1.2.2 表达外源性bcl6b基因食管癌细胞株的建立: pcDNA3.1-bcl6b和pcDNA3.1质粒提取纯化、定量后, 按照Lipofectamine 2000的说明书操作步骤进行细胞接种和转染KYSE180细胞. 转染48 h胰酶消化后计数, 将1×105个细胞接种于60 mm的培养皿中, 次日加入终浓度为400 mg/L的G418筛选阳性克隆, 每3-4 d更换1次培养液, 2-3 wk左右有克隆形成. 挑取单克隆进行扩大培养, 以终浓度为200 mg/L G418维持培养, 提取细胞总蛋白, 行Western blot检测bcl6b基因的表达.
1.2.3 Western blot检测BCL6B蛋白表达水平: 提取细胞总蛋白后BCA法行蛋白定量; 10%SDS-PAGE胶电泳分离蛋白样品, 电转移法将蛋白转移至PVDF膜. TBST配制的5%脱脂奶粉室温封闭2 h; 一抗稀释液稀释一抗(BCL6B 1:400、P53 1:500和P21 1:500), 4 ℃冰箱过夜; TBST洗膜4次, 每次5 min; TBST配制的5%脱脂奶粉稀释二抗室温45 min, 洗膜3次, 化学发光法曝光显影.
1.2.4 BCL6B生物学功能检测: (1)细胞周期检测: 胰酶消化空载组和BCL6B重表达组细胞, PBS洗3遍, 预冷的700 mL/L乙醇固定>4 h, 离心去除乙醇, PBS洗3遍, PI染色, 流式细胞仪检测细胞周期; (2)用无EDTA的胰酶消化空载组和BCL6B重表达组细胞, 预冷的PBS洗3次, 加入Annexin V染色吹打充分混匀后, 再加入PI染色, 流式细胞仪检测细胞凋亡; (3)胰酶消化空载组和BCL6B重表达组细胞并计数, 接种5000个细胞于96孔板中, 每列接种6个复孔, 共接种4组, 分别于接种1、2、3、4 d时加入50 µL的MTT, 继续培养4 h, 吸取培养基, 加入150 µL DMSO, 并震荡混匀, 酶标仪检测490 nm波长光吸收值, 根据吸光值绘制生长曲线; (4)胰酶消化细胞并计数, 分别取1500个空载组和BCL6B重表达组细胞接种于6孔板中, 每组设3个复孔, 继续培养2 wk后4%的多聚甲醛固定后结晶紫染色, 对细胞数>50个的克隆进行计数.
统计学处理 运用SPSS17.0统计学软件进行实验数据的分析, 计数资料结果用mean±SD表示, 两均数的比较用t检验, P<0.05为差异有统计学意义.
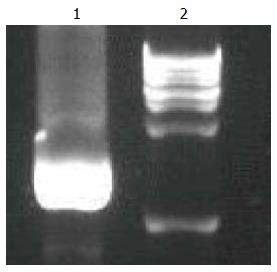
在进行PCR初次扩增时因杂带较多, 在1-2 kb之间条带进行切胶回收后, 用回收产物再次PCR扩增, 得出较明亮的目的条带, 如图1所示, 提示采用PCR成功扩增了bcl6b基因编码区片段.
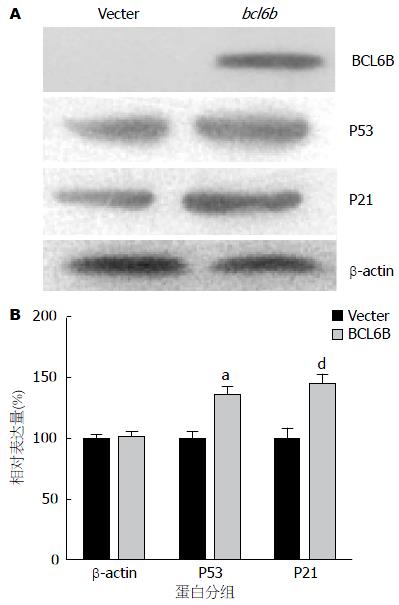
将pcDNA3.1-bcl6b质粒pcDNA3.1质粒转染KYSE180细胞, 经G418筛选后得到稳定表达的细胞株, Western blot检测恢复bcl6b基因表达组能稳定检测到蛋白的表达情况.
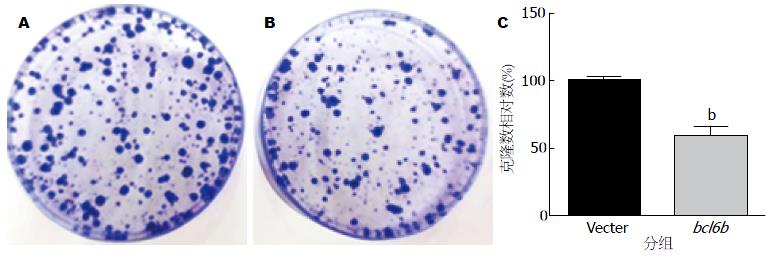
稳定转染pcDNA3.1-bcl6b的细胞克隆形成数目为237.00±28.37, 空载组为400.00±12.00, bcl6b组与空载组相比, 集落形成明显减少, 集落也明显较空载组比要小, 进行统计学分析, 两组之间有统计学差异(图2).
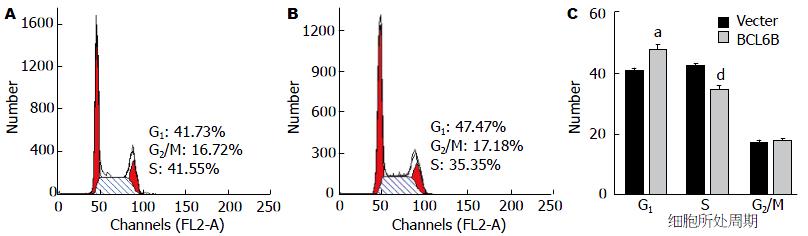
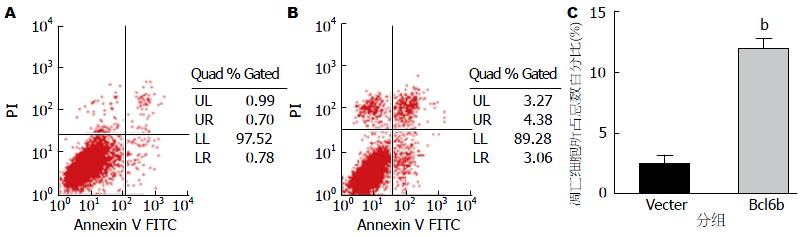
稳定转染pcDNA3.1-bcl6b后KYSE180细胞的G1和S期细胞比例分别为40.62%±1.07% vs 34.40%±1.30%, 空载组G1和S期细胞所占比例分别为47.85%±1.53% vs 42.31%±0.66%, pcDNA3.1-bcl6b组的G1期细胞的比例高于空载组, 而S期的细胞比例明显低于空载组, 两组之间差异有统计学意义(图3). 稳定转染pcDNA3.1-bcl6b后KYSE180凋亡细胞的比例为11.74%±0.99%, 空载组凋亡细胞的比例为2.43%±0.70%, pcDNA3.1-bcl6b组的细胞凋亡比例明显高于空载组, 两组之间差异有统计学意义(图4).
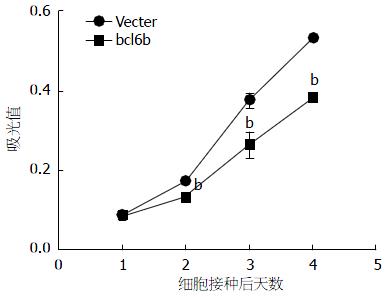
稳定转染pcDNA3.1-bcl6b质粒的细胞与空载组相比细胞的生长、增殖能力明显受到抑制, 两组间差异有统计学意义(图5).
Western blot结果显示, 重表达BCL6B后, P53和P21的蛋白表达水平是明显上升的(图6).
bcl6b基因又被称作bazf、zbtb28及znf62, 他位于17号染色体1区3带1亚带, 距p53基因800 kb[12], 该区域在很多肿瘤中发现不同基因的突变或缺失[13], 提示bcl6b可能为抑癌基因. 有文献报道BCL6B通过先与BCL6的broad-complex, tramtrack and bric-abrac/poxvirus and zinc finger(BTB/POZ)结构域或BCL6蛋白中间的17个高度保守的氨基酸序列相互结合后发挥转录抑制功能[12,14-17]. 另有文献报道BCL6B可以通过同时与CUL3(cullin 3)和CBF1(CRT-binding factor)结合, 从而导致CBF1的泛素化降解, 进而抑制Notch信号通路[18]. 关于bcl6b基因的生物学功能的研究, 有文献报道bcl6b基因敲出小鼠会出现CD8 T细胞分化障碍, 且小鼠在二次免疫应答时出现记忆CD8+ T细胞增殖能力明显减弱[19]. 另有研究发现BCL6B在幼稚CD4 T细胞的活化发挥重要作用[20]. 有文献报道BCL6B为神经胶质细胞源性的神经营养因子(glial cell line-derived neurotrophic factor, GDNF)下游的靶基因[21], 对于精原干细胞的自我更新至关重要[22,23], 目前关于BCL6B在肿瘤中的生物学功能报道很少. 2012年, Xu等[9]发现因为bcl6b启动子区异常高甲基化而导致的表观失活, 且进一步在体内和体外实验中证实bcl6b在胃癌中发挥抑癌功能.
本实验室前期[11]运用甲基化特异性PCR(methylation specific polymerase chain reaction, MSP)发现bcl6b在7株食管癌细胞系中均为甲基化的, 用去甲基化药物5-氮杂-2'-脱氧胞嘧啶核苷(5-aza-2-deoxy-cytidine, 5-Aza)处理食管癌细胞后能恢复bcl6b的表达, 说明了bcl6b在食管癌中的表达受启动子区域甲基化的调控, 运用MSP的方法检测了45例食管鳞癌组织, 发现甲基化率为77.8%, 提示在食管癌中bcl6b启动子区域是普遍甲基化的, 其启动子区域甲基化检测可作为食管癌诊断的分子标志物. 关于BCL6B在食管癌中的生物学功能目前未见报道. 众多的研究表明肿瘤的细胞周期不受正常生长调控系统的控制, 能持续的分裂与增殖. 有研究报道在肿瘤中恢复表达缺失或下调的抑癌基因可对肿瘤的增殖产生一定的抑制作用[24]. 本实验中我们以正常食管黏膜组织cDNA为模板, PCR的方法扩增了bcl6b基因的编码区序列, 并构建了稳定表达外源性BCL6B的食管癌细胞株, 经Western blot验证了BCL6B蛋白的表达是明显增强的. 本研究显示恢复bcl6b基因的表达能明显抑制KYSE180细胞的增殖. 运用流式细胞术分析发现, 恢复BCL6B的表达后G0/G1期的细胞的比例明显增加, S期比例减少, 同时凋亡细胞比例增加, 提示bcl6b基因可使细胞阻滞于G0/G1期, 并促进细胞的凋亡, 使细胞的增殖受到明显抑制. 有文献报道在细胞周期调控和DNA损伤修复过程中, P53蛋白可上调p21基因的表达, p21表达产物P21WAF1蛋白是一种依赖cyclin激酶(cyclin-dependent kinase, cdk)的抑制剂, 能够结合于G1期和S期的cyclin-cdk复合体, 抑制其活性, 进而阻滞细胞周期于G1期[25-29]. 有研究报道BCL6B可上调P53的表达[9]. 所以我们猜测BCL6B是否是通过上调P53的表达进而上调P21而诱导细胞G1/S期阻滞, 为了验证这一假设, 我们检测了重表达BCL6B前后P53和P21的蛋白表达水平, 发现重表达BCL6B后可明显上调P53和P21蛋白表达水平, 对于BCL6B通过何种途径来调节P53的表达还有待于进一步研究.
目前很多化疗药均可导致DNA的损伤, 有文献报道有的抑癌基因可通过上调P53和P21表达而使其化疗敏感性增加[30,31], BCL6B在食管癌中是否会引起肿瘤细胞化疗敏感性改变, 有待于进一步研究证实, 进而为肿瘤的个体化治疗提供一个新的思路.
bcl6b基因编码的mRNA在人体正常组织中均能检测到, 以心脏和胎盘表达量最高. 关于bcl6b基因的生物学功能的研究, 有文献报道bcl6b基因敲出小鼠会出现CD8 T细胞分化障碍, 且小鼠在二次免疫应答时出现记忆CD8+ T细胞增殖能力明显减弱. Jonathan等研究发现BCL6B对于精原干细胞的自我更新至关重要, 目前关于BCL6B在肿瘤中的生物学功能报道很少.
程英升, 教授, 上海交通大学附属第六人民医院放射科
关于食管癌的发病机制, 近年来越来越多的研究证据表明, 抑癌基因因启动子区域的高甲基化所导致的表达缺失, 在食管癌的发生和发展中起了至关重要作用, 检测基因启动子区甲基化状态可作为肿瘤的早期诊断、肿瘤分级、分期, 肿瘤侵袭、转移、复发和化疗敏感性的独立预测因子.
bcl6b启动子区异常高甲基化而导致其在胃癌中出现表达的缺失, 在胃癌细胞系中恢复其的表达可以抑制细胞增殖, 促进细胞凋亡, 检测胃癌组织或血浆中bcl6b基因的甲基化可作为诊断胃癌的独立生物标志物.
首次通过在表达缺失的食管癌细胞中重表达BCL6B并检测了其发挥的生物学功能, 得出BCL6B在食管癌通过上调P53和P21蛋白的表达水平从而引起细胞G1/S期阻滞和诱导细胞凋亡而抑制KYSE180细胞的恶性生物学行为.
研究BCL6B在食管癌中的生物学功能, 为食管癌的分子靶向治疗提供理论支持. 目前很多化疗药均可导致DNA的损伤, 有文献报道有的抑癌基因可通过上调P53和P21表达而使其化疗敏感性增加, BCL6B在食管癌中是否会引起肿瘤细胞化疗敏感性改变, 有待于进一步研究证实, 进而为肿瘤的个体化治疗提供一个新思路.
BCL6B通过上调P53和P21蛋白的表达水平从而抑制KYSE180细胞的恶性生物学行为. 研究设计科学, 结果可靠.
编辑: 郭鹏 电编:鲁亚静
| 1. | Chen W, Zheng R, Zhang S, Zhao P, Li G, Wu L, He J. The incidences and mortalities of major cancers in China, 2009. Chin J Cancer. 2013;32:106-112. [PubMed] [DOI] |
| 2. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 3. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA Cancer J Clin. 2012;62:10-29. [PubMed] [DOI] |
| 4. | Wu L, Herman JG, Brock MV, Wu K, Mao G, Yan W, Nie Y, Liang H, Zhan Q, Li W. Silencing DACH1 promotes esophageal cancer growth by inhibiting TGF-β signaling. PLoS One. 2014;9:e95509. [PubMed] [DOI] |
| 5. | Guo W, Zhang M, Shen S, Guo Y, Kuang G, Yang Z, Dong Z. Aberrant methylation and decreased expression of the TGF-β/Smad target gene FBXO32 in esophageal squamous cell carcinoma. Cancer. 2014; May 2. [Epub ahead of print]. [PubMed] [DOI] |
| 6. | Lu D, Ma J, Zhan Q, Li Y, Qin J, Guo M. Epigenetic silencing of RASSF10 promotes tumor growth in esophageal squamous cell carcinoma. Discov Med. 2014;17:169-178. [PubMed] |
| 7. | Wang Q, Peng D, Zhu S, Chen Z, Hu T, Soutto M, Saad R, Zhang S, Ei-Rifai W. Regulation of Desmocollin3 Expression by Promoter Hypermethylation is Associated with Advanced Esophageal Adenocarcinomas. J Cancer. 2014;5:457-464. [PubMed] [DOI] |
| 8. | Baba Y, Watanabe M, Murata A, Shigaki H, Miyake K, Ishimoto T, Iwatsuki M, Iwagami S, Yoshida N, Oki E. LINE-1 hypomethylation, DNA copy number alterations, and CDK6 amplification in esophageal squamous cell carcinoma. Clin Cancer Res. 2014;20:1114-1124. [PubMed] [DOI] |
| 9. | Xu L, Li X, Chu ES, Zhao G, Go MY, Tao Q, Jin H, Zeng Z, Sung JJ, Yu J. Epigenetic inactivation of BCL6B, a novel functional tumour suppressor for gastric cancer, is associated with poor survival. Gut. 2012;61:977-985. [PubMed] [DOI] |
| 10. | Yang Q, Gao J, Xu L, Zeng Z, Sung JJ, Yu J. Promoter hypermethylation of BCL6B gene is a potential plasma DNA biomarker for gastric cancer. Biomarkers. 2013;18:721-725. [PubMed] [DOI] |
| 11. | 董 腾慧. bcl6b基因启动子区异常高甲基化与食管癌的关系研究. 郑州: 郑州大学 2012; . |
| 12. | Sakashita C, Fukuda T, Okabe S, Kobayashi H, Hirosawa S, Tokuhisa T, Miyasaka N, Miura O, Miki T. Cloning and characterization of the human BAZF gene, a homologue of the BCL6 oncogene. Biochem Biophys Res Commun. 2002;291:567-573. [PubMed] |
| 13. | Greipp PT, Smoley SA, Viswanatha DS, Frederick LS, Rabe KG, Sharma RG, Slager SL, Van Dyke DL, Shanafelt TD, Tschumper RC. Patients with chronic lymphocytic leukaemia and clonal deletion of both 17p13.1 and 11q22.3 have a very poor prognosis. Br J Haematol. 2013;163:326-333. [PubMed] [DOI] |
| 14. | Okabe S, Fukuda T, Ishibashi K, Kojima S, Okada S, Hatano M, Ebara M, Saisho H, Tokuhisa T. BAZF, a novel Bcl6 homolog, functions as a transcriptional repressor. Mol Cell Biol. 1998;18:4235-4244. [PubMed] |
| 15. | Takenaga M, Hatano M, Takamori M, Yamashita Y, Okada S, Kuroda Y, Tokuhisa T. Bcl6-dependent transcriptional repression by BAZF. Biochem Biophys Res Commun. 2003;303:600-608. [PubMed] |
| 16. | Hartatik T, Okada S, Okabe S, Arima M, Hatano M, Tokuhisa T. Binding of BAZF and Bc16 to STAT6-binding DNA sequences. Biochem Biophys Res Commun. 2001;284:26-32. [PubMed] |
| 17. | Kim JE, Finlay GJ, Baguley BC. The role of the hippo pathway in melanocytes and melanoma. Front Oncol. 2013;3:123. [PubMed] [DOI] |
| 18. | Ohnuki H, Inoue H, Takemori N, Nakayama H, Sakaue T, Fukuda S, Miwa D, Nishiwaki E, Hatano M, Tokuhisa T. BAZF, a novel component of cullin3-based E3 ligase complex, mediates VEGFR and Notch cross-signaling in angiogenesis. Blood. 2012;119:2688-2698. [PubMed] [DOI] |
| 19. | Manders PM, Hunter PJ, Telaranta AI, Carr JM, Marshall JL, Carrasco M, Murakami Y, Palmowski MJ, Cerundolo V, Kaech SM. BCL6b mediates the enhanced magnitude of the secondary response of memory CD8+ T lymphocytes. Proc Natl Acad Sci U S A. 2005;102:7418-7425. [PubMed] |
| 20. | Takamori M, Hatano M, Arima M, Sakamoto A, Fujimura L, Hartatik T, Kuriyama T, Tokuhisa T. BAZF is required for activation of naive CD4 T cells by TCR triggering. Int Immunol. 2004;16:1439-1449. [PubMed] |
| 21. | Zhang X, Shi K, Li Y, Zhang H, Hao J. Lipopolysaccharide inhibits the self-renewal of spermatogonial stem cells in vitro via downregulation of GDNF expression in Sertoli cells. Reprod Toxicol. 2014;45:87-93. [PubMed] [DOI] |
| 22. | Ishii K, Kanatsu-Shinohara M, Toyokuni S, Shinohara T. FGF2 mediates mouse spermatogonial stem cell self-renewal via upregulation of Etv5 and Bcl6b through MAP2K1 activation. Development. 2012;139:1734-1743. [PubMed] [DOI] |
| 23. | Oatley JM, Avarbock MR, Brinster RL. Glial cell line-derived neurotrophic factor regulation of genes essential for self-renewal of mouse spermatogonial stem cells is dependent on Src family kinase signaling. J Biol Chem. 2007;282:25842-25851. [PubMed] |
| 24. | Yan W, Wu K, Herman JG, Brock MV, Fuks F, Yang L, Zhu H, Li Y, Yang Y, Guo M. Epigenetic regulation of DACH1, a novel Wnt signaling component in colorectal cancer. Epigenetics. 2013;8:1373-1383. [PubMed] [DOI] |
| 25. | Wu G, Lin N, Xu L, Liu B, Feitelson MA. UCN-01 induces S and G2/M cell cycle arrest through the p53/p21(waf1) or CHK2/CDC25C pathways and can suppress invasion in human hepatoma cell lines. BMC Cancer. 2013;13:167. [PubMed] [DOI] |
| 26. | Bialopiotrowicz E, Szybinska A, Kuzniewska B, Buizza L, Uberti D, Kuznicki J, Wojda U. Highly pathogenic Alzheimer's disease presenilin 1 P117R mutation causes a specific increase in p53 and p21 protein levels and cell cycle dysregulation in human lymphocytes. J Alzheimers Dis. 2012;32:397-415. [PubMed] [DOI] |
| 27. | Liu B, Gao YQ, Wang XM, Wang YC, Fu LQ. Germacrone inhibits the proliferation of glioma cells by promoting apoptosis and inducing cell cycle arrest. Mol Med Rep. 2014; May 30. [Epub ahead of print]. [PubMed] [DOI] |
| 28. | Xu H, Wang Z, Jin S, Hao H, Zheng L, Zhou B, Zhang W, Lv H, Yuan Y. Dux4 induces cell cycle arrest at G1 phase through upregulation of p21 expression. Biochem Biophys Res Commun. 2014;446:235-240. [PubMed] [DOI] |
| 29. | Liu W, Dai Q, Lu N, Wei L, Ha J, Rong J, Mu R, You Q, Li Z, Guo Q. LYG-202 inhibits the proliferation of human colorectal carcinoma HCT-116 cells through induction of G1/S cell cycle arrest and apoptosis via p53 and p21(WAF1/Cip1) expression. Biochem Cell Biol. 2011;89:287-298. [PubMed] [DOI] |
| 30. | Zhu H, Wu K, Yan W, Hu L, Yuan J, Dong Y, Li Y, Jing K, Yang Y, Guo M. Epigenetic silencing of DACH1 induces loss of transforming growth factor-β1 antiproliferative response in human hepatocellular carcinoma. Hepatology. 2013;58:2012-2022. [PubMed] [DOI] |
| 31. | Liang W, Lu C, Li J, Yin JQ, Zhao RC. p73alpha regulates the sensitivity of bone marrow mesenchymal stem cells to DNA damage agents. Toxicology. 2010;270:49-56. [PubMed] [DOI] |