修回日期: 2014-04-01
接受日期: 2014-04-20
在线出版日期: 2014-06-18
目的: 检测摄食调节肽nucleobindin-2(NUCB2)/nesfatin-1在正常人与单纯性肥胖人的胃底、胃体、胃窦和结肠黏膜的表达. 分析nesfatin-1免疫细胞在不同胃区和肠区的分布差异及其在胃肠道的作用.
方法: 对正常与肥胖(体质量指数>30)志愿者行胃镜或肠镜检查后, 取胃底、胃体、胃窦、结肠四个位置的活检标本共计191个组织标本, 采用RT-PCR方法检测NUCB2 mRNA的表达; 采用免疫组织化学化学方法检测48例胃癌术后及16例结肠癌术后切除的癌旁正常组织NUCB2/nesfatin-1蛋白的表达.
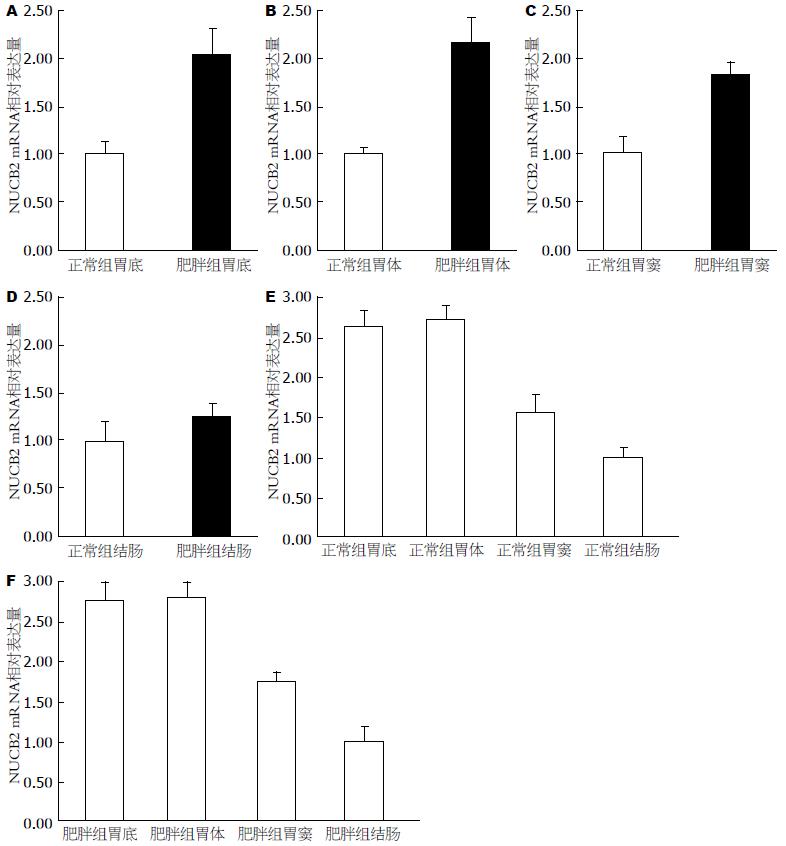
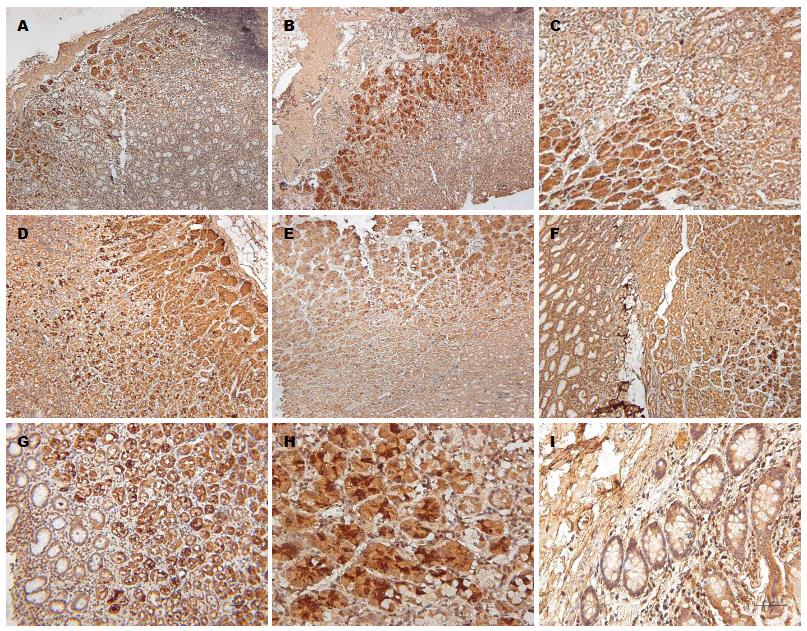
结果: (1)肥胖组人胃底、胃体、胃窦NUCB2 mRNA表达量分别是正常组的2.04, 2.17, 1.83倍, 差异具有统计学意义(P分别为0.015、0.006和0.009); 两组结肠NUCB2 mRNA表达无统计学意义(P = 0.069); (2)正常组人胃底、胃体、胃窦NUCB2 mRNA相对表达量分别是结肠的2.64、2.73和1.57倍, 差异具有统计学意义(P分别为0.013、0.005和0.018). 肥胖组人胃底、胃体、胃窦NUCB2 mRNA表达量分别是结肠的2.76倍、2.79倍、1.74倍, 差异具有统计学意义(P分别为0.015、 0.009和0.025). 正常组胃底、胃体组织之间和肥胖组胃底、胃体组织之间NUCB2 mRNA表达差异均无统计学意义(P分别为0.091, 0.078); (3)人胃底、胃体、胃窦黏膜下1/3至2/3处内分泌细胞内均可检测到NUCB2/nesfatin-1蛋白的表达, 且在单纯性肥胖组阳性表达明显高于正常组, 差异具有统计学意义(P分别为0.021、0.011和0.016).
结论: NUCB2 mRNA在人胃肠道中都有广泛分布, 肥胖者较正常者胃黏膜组织NUCB2 mRNA及NUCB2/nesfatin-1蛋白表达上调, 且胃底、胃体均较胃窦黏膜组织NUCB2 mRNA相对表达量增多.
核心提示: 本文通过研究单纯性肥胖和非肥胖正常人胃底、胃体、胃窦及结肠中nucleobindin-2(NUCB2) mRNA及NUCB2/nesfatin-1蛋白的分布特点及不同部位的表达差异, 为nesfatin-1与胃黏膜内分泌细胞相关性及其在胃肠道的作用提供理论依据.
引文著录: 杨博瑜, 田字彬, 单信芝, 李晓宇, 魏良洲, 赵清喜, 孙桂荣. Nucleobindin-2/nesfatin-1在人胃肠道组织中的表达. 世界华人消化杂志 2014; 22(17): 2486-2492
Revised: April 1, 2014
Accepted: April 20, 2014
Published online: June 18, 2014
AIM: To detect the expression of nucleobindin-2 (NUCB2)/nesfatin-1 protein in gastric fundus, body, antrum and colonic mucosa of simple obese people and normal-weight people, and to analyze the differences in the distribution of nesfatin-1 positive immune cells between different gastric areas and between gastric areas and the colon.
METHODS: A total of 191 specimens were obtained from 96 obese people and 95 normal-weight people without chronic diseases, who received gastroscopy or enteroscopy. The specimens were collected from gastric fundus, body, antrum and colonic mucosa. The expression of NUCB2 mRNA was detected by real-time RT-PCR. The expression of NUCB2/nesfatin-1 protein in the normal mucosa specimens from 48 patients with gastric cancer and 16 with colon cancer after surgical treatment was detected by immunohistochemistry.
RESULTS: The expression levels of NUCB2 mRNA in the gastric fundus, body and antrum of simple obese people were 2.04, 2.17, and 1.83 times higher than those in the normal controls (P = 0.015, 0.006, 0.009). However, the expression levels of NUCB2 mRNA in the colonic mucosa showed no significant difference between the two groups (P = 0.069). The expression levels of NUCB2 mRNA in the gastric fundus, body and antrum mucosa of normal people were 2.64, 2.73, and 1.57 times higher than those in the colonic mucosa (P = 0.013, 0.005, 0.018), while the expression levels of NUCB2 mRNA in the gastric fundus, body and antrum mucosa of simple obese people were 2.76, 2.79, and 1.74 times higher than those in the colonic mucosa (P = 0.015, 0.009, 0.025). However, the expression level of NUCB2 mRNA in the gastric fundus and body showed no significant differences between simple obese people and normal people. Immunohistochemical analysis revealed the similar distribution pattern of NUCB2/nesfatin-1 in the lower 1/3 to 2/3 of the gastric mucosal glands. The expression levels of NUCB2/nesfatin-1 protein in gastric fundus, body and antrum were significantly increased in simple obese people compared with normal people.
CONCLUSION: NUCB2/nesfatin-1 is widely expressed in gastrointestinal tissues of people, and the expression of NUCB2 mRNA and NUCB2/nesfatin-1 protein is up-regulated in simple obese people. The expression of NUCB2 mRNA in the gastric fundus and body is higher than that in the antrum.
- Citation: Yang BY, Tian ZB, Shan XZ, Li XY, Wei LZ, Zhao QX, Sun GR. Expression of nucleobindin-2/nesfatin-1 in gastrointestinal tissues of people. Shijie Huaren Xiaohua Zazhi 2014; 22(17): 2486-2492
- URL: https://www.wjgnet.com/1009-3079/full/v22/i17/2486.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i17.2486
肥胖是食物摄入过多或机体代谢改变而导致体内脂肪尤其是甘油三脂的过多积聚从而造成体重过度增长并引起机体生理、病理改变的慢性代谢性疾病, 严重影响人类健康, 引起广泛关注[1-3]. 近年来发现的摄食调节肽nesfatin-1, 其前体是NEFA基因编码的420个氨基酸组成的多肽nucleobindin-2(NUCB2)[4], 广泛分布于调节摄食的中枢核团上及参与食物消化的胃肠道系统
中[5,6], 特别在胃泌酸的内分泌细胞上有丰富的表达[7]. 实验研究表明在SD大鼠侧脑室中注射nesfatin-1能够减少其摄食和体质量, 禁食24 h后胃黏膜内分泌细胞NUCB2 mRNA表达减少[8]. 而NUCB2的氨基酸序列在人、大鼠和小鼠高度同源[9], 因此推测: (1)在肥胖和正常人消化系统中NUCB2 mRNA及NUCB2/nesfatin-1蛋白表达可能存在差异; (2)人胃黏膜中NUCB2 mRNA在不同胃区表达量可能不同. 本实验通过分子生物学及免疫组织化学的方法检测正常及肥胖人胃肠组织中NUCB2 mRNA及NUCB2/nesfatin-1蛋白的表达分布特点及不同部位的表达差异, 探讨nesfatin-1与机体体质量指数(body mass index, BMI)和身体脂肪的相关性及其在胃肠道的作用.
选取2012-11/2013-05于青岛大学附属医院行胃镜、结肠镜临床及病理诊断仅为慢性轻度浅表性胃炎、结肠未见明显异常、排除其他慢性疾病(甲状腺疾病、糖尿病、癌症及感染等)及相关基础疾病的体检志愿者191例研究对象, 其中男93例, 女98例, 年龄40岁±10岁, 分为非肥胖组95例, BMI 21.58 kg/m2±2.03 kg/m2, 年龄36岁±7岁; 肥胖组96例, BMI 32.07 kg/m2±1.46 kg/m2, 年龄40岁±10岁. 通过内镜活检钳取相对固定位置的黏膜组织(胃底、胃体、胃窦及结肠)标本(为避免对志愿者重复损伤,每位志愿者仅选取一个部位作为样本), 采用Rt-PCR方法检测NUCB2 mRNA的表达. 另选取同期住院的胃癌、结肠癌, 且尚未进行放化疗方案的64例患者, 男35例, 女29例, 年龄: 50岁±20岁, 分为非肥胖组32例, BMI: 21.58 kg/m2±2.15 kg/m2, 年龄50岁±18岁; 肥胖组32例, BMI: 32.07 kg/m2±2.09 kg/m2, 年龄50岁±20岁. 选取切除相对正常的黏膜组织(距离肿瘤距离≥5 cm), 采用免疫组织化学方法检测NUCB2/nesfatin-1蛋白的表达. 所有志愿者在实验前均知情所做检查及相关检测, 同意并签署知情同意书, 所进行实验操作遵守赫尔辛基宣传守则, 且通过青岛大学附属医院伦理委员会审批. 逆转录试剂盒(DRR047A)、荧光染料试剂盒(DRR081A)及引物的设计合成(上海生工生物工程股份有限公司); 兔抗人nesfatin-1多克隆抗体(bs-3552R, 北京奥博森生物技术有限公司); 二步法免疫组织化学检测试剂(PV-6000, 北京中杉金桥生物技术有限公司); 实时荧光定量PCR仪(Rotor Gene 3000, 澳大利亚Corbett Research公司); 紫外线分光光度仪(NanoDrop 2000c, 美国Thermo公司); 显微镜(BX51TPHD-J11型, 日本Olympus公司); 多功能真彩色细胞图象分析系统(Image-Pro Plus, 美国Media Cybernetics公司).
1.2.1 实时荧光定量RT-PCR检测NUCB2 mRNA的表达: 经内镜获取的胃底、胃体、胃窦及结肠黏膜取出后立即置于液氮冻存, 并迅速移至-80 ℃冰箱保存. 采用TRIzol常规方法分别取5 mg提取总RNA, 并于核酸定量仪对RNA进行定量分析, 根据A260/280测定所提取RNA的纯度. 取1 μg总RNA为模版, 按逆转录说明书反转录合成cDNA, 并以cDNA为模版进行实时荧光定量PCR, 内参序列如下: 5'-CACCAGGGCTGCTTTTAACTC-3'(上游), 5'-TGGAAGATGGTGATGGGATTT-3'(下游); 引物序列如下: 5'-CTAATCAAAGCGGCAACAAGT-3'(上游), 5'-TCCATCAGTCTCTTCCCATAC-3'(下游). 反应条件为: 95 ℃预变性30 s, 95 ℃变性5 s, 60 ℃退火30 s, 72 ℃延伸30 s, 共计40个循环. 反应结束后分析融解曲线, 由扩增曲线得到各产物Ct值, 以2-ΔΔCt表示样本中NUCB2 mRNA的相对表达量.
1.2.2 免疫组织化学检测NUCB2/nesfatin-1蛋白的表达: 术后迅速取病变远端正常组织经常规固定、包埋、切片、脱蜡、水化后, 用枸橼酸盐缓冲液(pH = 6.0)加热修复后, 经3%过氧化氢去离子水孵育5 min, 滴加一抗为兔抗人nesfatin-1多克隆抗体, 4 ℃孵育过夜, 滴加山羊抗兔二抗37 ℃孵育15 min, 并用PBS代替一抗做阴性对照试验, DAB显色后经蒸馏水冲洗、复染、脱水、透明封片后, 于显微镜下观察. 在组织切片中, NUCB2/nesfatin-1阳性细胞表现为染色为棕黄色. 按(1)按Image-Pro Plus图象分析系统计数阳性细胞的百分比记分: 阳性细胞数<5%计0分, 6%-24%计1分, 25%-49%计2分, 50%-74%计3分, ≥75%计4分; (2)按染色强度记分: 未染色或染色不清为0分, 淡黄色为1分, 棕黄色为2分, 深棕色或褐色为3分. 每张切片记分等于以上两项记分的乘积: 0分为阴性(-), l-3分为弱阳性(+), 4-7分为阳性(++), 8-12分为强阳性(+++).
统计学处理 采用SPSS19.0统计学软件进行数据分析. 计量资料经正态性及方差齐性检验, 采用非配对t检验分析各组间差异; 计数资料采用等级秩和检验(Mann-Whitney法); P<0.05为差异有统计学意义.
单纯性肥胖组人胃底、胃体及胃窦NUCB2 mRNA相对表达量增多, 均高于非肥胖正常组, 分别是正常组的2.04(0.86-3.87)倍、2.17(0.97-3.90)倍及1.83(0.87-3.10)倍, 差异具有统计学意义(P分别为0.015、0.006、0.009), 两组人结肠NUCB2 mRNA表达无统计学意义(P = 0.069)(图1A-D).
两组人胃底、胃体都较同组胃窦NUCB2 mRNA相对表达量增多, 结肠NUCB2 mRNA相对表达量最少. 非肥胖正常组人胃底、胃体及胃窦NUCB2 mRNA相对表达量分别是结肠的2.64(1.24-4.42)倍、2.73(1.40-4.41)倍及1.57(0.82-2.77)倍, 差异具有统计学意义(P分别为0.013、0.005、0.018). 肥胖组人胃底、胃体及胃窦NUCB2 mRNA表达量分别是结肠的2.76(1.51-4.42)倍、2.79(1.54-4.47)倍及1.74(0.85-2.86)倍, 差异具有统计学意义(P分别为0.015、0.009、0.025). 非肥胖正常组胃底、胃体组织之间NUCB2 mRNA表达差异与肥胖组胃底、胃体组织之间NUCB2 mRNA表达差异都无统计学意义(P分别为0.091、0.078)(图1E, F).
NUCB2/nesfatin-1免疫阳性物质为暗棕色颗粒,在正常组和单纯性肥胖组人胃黏膜下1/3至2/3处内分泌细胞内均可检测到NUCB2/nesfatin-1蛋白的表达, 其在肥胖组阳性表达明显高于正常组, 且在胃底、胃体、胃窦中阳性表达有统计学意义(P分别为0.021、0.011和0.016). 而在结肠中未检测到其分布(图2).
NUCB2是NEFA基因编码的420个氨基酸组成的多肽(nucleobindinⅡ), NUCB2上有与DNA和Ca2+结合的位点, 在激素原转换酶的作用下, NUCB2裂解为N-末端的82个氨基酸称之为nesfatin-1(除信号肽以外的第1-82位氨基酸), nesfatin-2(由79个氨基酸组成: 第85-163位氨基酸)和nesfatin-3(由231个氨基酸组成: 第166-396位氨基酸)三个片断[10], 在大鼠侧脑室中注入此三个片段, 结果显示只有nesfatin-1使大鼠摄食呈剂量依赖性减少并持续6 h, 而nesfatin-2和nesfatin-3均未见明显效应[4]. 另一项实验研究将nesfatin-1的特异性抗体Ab-24注入侧脑室后大鼠摄食量明显增多, 而注射nesfatin-3的特异性抗体Ab-301后大鼠摄食量未见明显改变. 另外, nesfatin-1分子量约为9.7 kDa. 比较人和大鼠的nesfatin-1只有11个氨基酸不相同. 由此可见, nesfatin-1是一种抑制食欲的多肽, 并且他的氨基酸序列在人类和鼠类之间有高度的保守性.
众所周知, 下丘脑室旁核、弓状核和下丘脑外侧区均是摄食调节中枢. 大多数摄食调节分子不仅存在于中枢也常分布于外周, 特别是消化系统[11]. 最新研究显示, nesfatin-1的神经元主要分布于下丘脑室旁核(paraventricular nucleus of hypothalamus, PVN)、视上核(supraoptic nucleus, SON)、下丘脑外侧区(lateral hypothalamic area, LHA)、弓状核(arcuatenucleus, ARC)和孤束核(nucleusofsolitarytract, NTS), 动眼神经副交感核、迷走神经背核、大鼠的尾脊核等, 而以室旁核NUCB2 mRNA表达最高, 其他位置的分布较少[7,12-14]. 由于nesfatin-1是可以自由通过血脑屏障的[15,16], 提示nesfatin-1在外周可能也有分布. Stengel等[6]研究发现, 大鼠胃黏膜NUCB2 mRNA含量较脑组织和心脏约高10倍, 主要分布于胃黏膜泌酸腺下1/3至中1/2的内分泌细胞, 胃窦部分布较少, 壁细胞基本不表达nesfatin-1, 且大部分存在于X/A细胞的囊泡中, 少部分与生长抑素或组氨酸脱羧酶共存, 而且胃黏膜NUCB2 mRNA的表达比脑组织高十几倍. 相关动物实验研究显示, 大鼠禁食24 h后, 胃内NUCB2 mRNA含量明显下降, 提示NUCB2及其相关肽可能参与胃肠功能的生理调节, 且NUCB2基因表达可能受营养状态的调控. 这些结果提示nesfatin-1不仅仅在下丘脑进行调节, 而且在食物抵达胃之后, 胃黏膜的nesfatin-1在调节摄食和能量稳态中可能具有生理性作用.
本实验证实人胃体、胃底、胃窦黏膜组织中NUCB2 mRNA及NUCB2/nesfatin-1蛋白均有表达, 且肥胖人群中上述部位中NUCB2 mRNA及NUCB2/nesfatin-1蛋白表达均增多, 推测nesfatin-1在人胃组织的表达与人营养状态关系密切. 当人摄食过多和营养过度时, 由于负反馈机制, 使饱食分子nesfatin-1反馈性的表达上调, 从而表现出抑制摄食和减轻体质量的作用. 但摄食这种复杂的生理活动涉及中枢核团、神经通路、外周胃肠道、多种内分泌因子、运动及周围环境的改变等因素的共同调节. 因此, nesfatin-1在人消化系组织中的表达量是否呈剂量依赖性抑制摄食活动影响食欲, 还需进一步研究NUCB2/nesfatin-1在中枢及外周的分布特点, 从而明确nesfatin-1影响摄食调节的作用通路及具体机制. 另有研究显示, 中枢注射α-促黑素细胞激素能提高下丘脑室旁核NUCB2/nesfatin-1的基因表达[8], 考虑nesfatin-1信号作用通路可能与下丘脑黑皮激素信号通路有相关联系. 已有研究证实, NUCB2/nesfatin-1及NUCB2 mRNA在肥胖大鼠胃组织表达增加, 并与大鼠Lee's指数呈正相关[17], 同时nesfatin-1水平在人血浆中也与BMI呈正相关[18-20], 这和单纯性肥胖人胃黏膜组织中表达增多基本一致, 从而可以进一步证实血浆中nesfatin-1来源于胃组织内分泌细胞. 而NUCB2/nesfatin-1可以通过血脑屏障, 可以考虑在中枢及外周产生的NUCB2/nesfatin-1同时对机体的摄食活动及食欲产生抑制作用从而调节机体体质量.
本次实验我们发现, NUCB2/nesfatin-1在正常及肥胖人的胃黏膜下1/3至2/3处内分泌细胞内, 而Wistar大鼠NUCB2/nesfatin-1表达于胃黏膜下2/3[20], ICR小鼠NUCB2/nesfatin-1表达于胃黏膜下1/3[5], 这种NUCB2/nesfatin-1在人、Wistar大鼠及ICR小鼠胃黏膜中的表达分布的细微差别, 提示其在胃的分布存在种属差异. 实验结果还发现NUCB2/nesfatin-1在人胃体、胃底的表达均多于胃窦, 考虑可能与内分泌细胞在胃黏膜的分布差异有关. 众所周知, 胃黏膜上皮、肠上皮及腺上皮弥散分布多种内分泌细胞, 协调胃肠运动及分泌功能, 但不同部位内分泌细胞的种类与数量也存在较为明显的区别, 胃泌酸区(体底)黏膜可见ECL细胞, P细胞, EC细胞, X细胞, 偶见D细胞; 胃窦黏膜可见G细胞, D细胞, EC细胞. 这些细胞的活动中绝大多数细胞(开放型)受胃腔内的食物和pH的刺激而分泌激素, 少数细胞(闭合性)受胃肠运动的机械刺激或其他激素调节而改变其内分泌活动[21]. 这也进一步证实了胃组织内分泌细胞中大量存在NUCB2/nesfatin-1的推论. 尽管在人结肠组织中检测到NUCB2 mRNA的表达, 但免疫组织化学方法并未检测到结肠组织NUCB2/nesfatin-1蛋白的表达, 这可能与结肠组织中NUCB2/nesfatin-1蛋白含量较低有关. Shimizu实验证实, 腹腔内注射nesfatin-1可延缓胃排空[22], 同时nesfatin-1可以抑制正常及肥胖大鼠在体及离体平滑肌的收缩[23,24]. 根据报道胃黏膜有大量的激素原转换酶(PC-1/3、PC-2)的mRNA[17], 提示存在NUCB2/nesfatin-1在胃组织中被进一步加工剪切处理形成nesfatin-1的可能性, 进而在外周组织中nesfatin-1可以直接通过胃肠道参与摄食行为、胃肠动力及胃酸分泌的调节.
此外, 本次实验采用实时荧光定量RT-PCR检测NUCB2 mRNA在胃底、胃体、胃窦及结肠的表达量中所取的样本是在内镜下活检钳取出的相对健康志愿者黏膜表面组织, 而免疫组织化学检测NUCB2/nesfatin-1蛋白在胃底、胃体、胃窦及结肠表达所取样本是有消化系肿瘤状态下无明显恶病质及代谢性疾病(糖尿病、甲亢)的志愿者手术切除后癌旁相对正常的全黏膜组织, 虽然有实验检测出禁食12 h下的正常人、消化系肿瘤患者血浆中nesfatin-1水平并无明显差异[25], 但NUCB2/nesfatin-1在相对健康的人与患有消化系统肿瘤患者的胃肠道组织中的表达差异有待进一步完善研究.
总之, 本实验研究显示NUCB2/nesfatin-1这种功能复杂的内分泌因子广泛分布在人消化系统, 其为摄食行为、能量平衡、糖脂代谢及胃肠动力的调节起到了重要作用, 并为其通过外周组织参与生理活动的调节提供了理论依据. 所以, NUCB2/nesfatin-1与人类某些疾病关系密切, 有待于进一步积极探索和研究.
当今社会肥胖引起广泛关注, 肥胖可以给机体带来生理、病理改变, 严重影响人类健康, 摄食调节肽在调节机体生理稳态上具有重要意义. Nesfatin-1作为一种新发现的摄食调节肽, 在调节摄食和能量稳态中具有生理性作用.
汤华, 研究员, 博士生导师, 重庆医科大学感染性疾病分子生物学重点实验室
Nesfatin-1在人胃底、胃体、胃窦及肠道表达研究较少, 尤其在不同胃区的表达差异的原因及其作用机制有待进一步研究.
Goebel等的实验显示nesfatin-1水平在人血浆中也与BMI呈正相关; Shimizu实验证实, 在小鼠腹腔内注射nesfatin-1可延缓胃排空.
本文首次从胃底、胃体及胃窦三个胃区研究nesfatin-1的表达差异, 提示nesfatin-1的表达量与胃内分泌细胞在胃黏膜的分布差异有关, 提示可能在外周组织中直接通过胃肠道参与摄食行为、胃肠动力及胃酸分泌的调节.
本文研究nesfatin-1在单纯性肥胖与非肥胖正常人胃肠道表达差异, 使nesfatin-1成为与肥胖相关的疾病在临床诊治提供理论依据.
本文具有一定临床指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Djärv T, Wikman A, Nordenstedt H, Johar A, Lagergren J, Lagergren P. Physical activity, obesity and gastroesophageal reflux disease in the general population. World J Gastroenterol. 2012;18:3710-3714. [PubMed] [DOI] |
| 2. | Kim MC, Kim CS, Chung TH, Park HO, Yoo CI. Metabolic syndrome, lifestyle risk factors, and distal colon adenoma: a retrospective cohort study. World J Gastroenterol. 2011;17:4031-4037. [PubMed] [DOI] |
| 3. | Pałasz A, Krzystanek M, Worthington J, Czajkowska B, Kostro K, Wiaderkiewicz R, Bajor G. Nesfatin-1, a unique regulatory neuropeptide of the brain. Neuropeptides. 2012;46:105-112. [PubMed] [DOI] |
| 4. | Oh-I S, Shimizu H, Satoh T, Okada S, Adachi S, Inoue K, Eguchi H, Yamamoto M, Imaki T, Hashimoto K. Identification of nesfatin-1 as a satiety molecule in the hypothalamus. Nature. 2006;443:709-712. [PubMed] [DOI] |
| 5. | Zhang AQ, Li XL, Jiang CY, Lin L, Shi RH, Chen JD, Oomura Y. Expression of nesfatin-1/NUCB2 in rodent digestive system. World J Gastroenterol. 2010;16:1735-1741. [PubMed] [DOI] |
| 6. | Stengel A, Goebel M, Yakubov I, Wang L, Witcher D, Coskun T, Taché Y, Sachs G, Lambrecht NW. Identification and characterization of nesfatin-1 immunoreactivity in endocrine cell types of the rat gastric oxyntic mucosa. Endocrinology. 2009;150:232-238. [PubMed] [DOI] |
| 7. | Kohno D, Nakata M, Maejima Y, Shimizu H, Sedbazar U, Yoshida N, Dezaki K, Onaka T, Mori M, Yada T. Nesfatin-1 neurons in paraventricular and supraoptic nuclei of the rat hypothalamus coexpress oxytocin and vasopressin and are activated by refeeding. Endocrinology. 2008;149:1295-1301. [PubMed] [DOI] |
| 8. | Shimizu H, Oh-I S, Hashimoto K, Nakata M, Yamamoto S, Yoshida N, Eguchi H, Kato I, Inoue K, Satoh T. Peripheral administration of nesfatin-1 reduces food intake in mice: the leptin-independent mechanism. Endocrinology. 2009;150:662-671. [PubMed] [DOI] |
| 9. | Fort P, Salvert D, Hanriot L, Jego S, Shimizu H, Hashimoto K, Mori M, Luppi PH. The satiety molecule nesfatin-1 is co-expressed with melanin concentrating hormone in tuberal hypothalamic neurons of the rat. Neuroscience. 2008;155:174-181. [PubMed] [DOI] |
| 10. | Stengel A, Taché Y. Nesfatin-1--role as possible new potent regulator of food intake. Regul Pept. 2010;163:18-23. [PubMed] [DOI] |
| 11. | Saper CB, Chou TC, Elmquist JK. The need to feed: homeostatic and hedonic control of eating. Neuron. 2002;36:199-211. [PubMed] |
| 12. | Inhoff T, Stengel A, Peter L, Goebel M, Taché Y, Bannert N, Wiedenmann B, Klapp BF, Mönnikes H, Kobelt P. Novel insight in distribution of nesfatin-1 and phospho-mTOR in the arcuate nucleus of the hypothalamus of rats. Peptides. 2010;31:257-262. [PubMed] [DOI] |
| 13. | Brailoiu GC, Dun SL, Brailoiu E, Inan S, Yang J, Chang JK, Dun NJ. Nesfatin-1: distribution and interaction with a G protein-coupled receptor in the rat brain. Endocrinology. 2007;148:5088-5094. [PubMed] |
| 14. | Skibicka KP, Dickson SL. Enteroendocrine hormones - central effects on behavior. Curr Opin Pharmacol. 2013;13:977-982. [PubMed] [DOI] |
| 15. | Pan W, Hsuchou H, Kastin AJ. Nesfatin-1 crosses the blood-brain barrier without saturation. Peptides. 2007;28:2223-2228. [PubMed] [DOI] |
| 16. | Price TO, Samson WK, Niehoff ML, Banks WA. Permeability of the blood-brain barrier to a novel satiety molecule nesfatin-1. Peptides. 2007;28:2372-2381. [PubMed] [DOI] |
| 17. | Atsuchi K, Asakawa A, Ushikai M, Ataka K, Tsai M, Koyama K, Sato Y, Kato I, Fujimiya M, Inui A. Centrally administered nesfatin-1 inhibits feeding behaviour and gastroduodenal motility in mice. Neuroreport. 2010;21:1008-1011. [PubMed] [DOI] |
| 18. | Gonzalez R, Kerbel B, Chun A, Unniappan S. Molecular, cellular and physiological evidences for the anorexigenic actions of nesfatin-1 in goldfish. PLoS One. 2010;5:e15201. [PubMed] [DOI] |
| 19. | Goebel M, Stengel A, Wang L, Lambrecht NW, Taché Y. Nesfatin-1 immunoreactivity in rat brain and spinal cord autonomic nuclei. Neurosci Lett. 2009;452:241-246. [PubMed] [DOI] |
| 20. | 李 伟娜, 田 字彬, 魏 良洲, 孙 桂荣, 张 翠萍, 葛 银林, 徐 珞. Nesfatin-1/NUCB2在肥胖大鼠胃肠道组织中的表达. 世界华人消化杂志. 2013;21:320-326. |
| 21. | 邹 仲之, 李 继承, 曾 园山, 周 莉. 组织学与胚胎学(第8版). 人民卫生出版社. 2013;145-148. |
| 22. | Shimizu H, Oh-I S, Okada S, Mori M. Nesfatin-1: an overview and future clinical application. Endocr J. 2009;56:537-543. [PubMed] |
| 24. | 李 娜, 田 字彬, 孙 桂荣, 魏 良洲, 徐 珞, 王 百惠, 孔 心涓, 丁 雪丽, 崔 铭娟. Nesfatin-1对肥胖大鼠胃排空及胃平滑肌条收缩性的影响. 世界华人消化杂志. 2012;20:631-637. |
| 25. | Macro JA, Dimaline R, Dockray GJ. Identification and expression of prohormone-converting enzymes in the rat stomach. Am J Physiol. 1996;270:G87-G93. [PubMed] |