修回日期: 2014-04-09
接受日期: 2014-04-28
在线出版日期: 2014-06-18
目的: 了解榄香烯乳干预治疗后人胰腺癌裸鼠移植瘤组织中PTEN、P53、Bcl-2蛋白的表达情况, 初步探讨榄香烯乳对胰腺癌凋亡的影响.
方法: 构建人胰腺癌裸鼠移植瘤模型, 随机分为阴性对照组、榄香烯乳小剂量组、榄香烯乳大剂量组、吉西他滨阳性对照组和联合用药组五组, 分别干预处理; 采用Western blot和免疫组织化学的方法检测榄香烯乳干预治疗后人胰腺癌移植瘤组织细胞中PTEN、P53、Bcl-2蛋白表达情况.
结果: Western blot结果显示榄香烯乳干预治疗后人胰腺癌移植瘤细胞中PTEN和P53蛋白表达均有升高趋势, 而Bcl-2蛋白表达有下降的趋势. 榄香烯乳大剂量组与阴性对照组相比, P53蛋白表达显著升高(P<0.01)而Bcl-2蛋白表达显著降低(P<0.01). 联合用药组与吉西他滨阳性对照组相比, P53蛋白表达显著升高(P<0.01), 而Bcl-2蛋白表达降低不明显(P = 0.985). 免疫组织化学结果显示与Western blot结果大致相同的变化趋势.
结论: 一定剂量的榄香烯乳可以增强胰腺癌裸鼠移植瘤组织中P53蛋白的表达而降低Bcl-2蛋白的表达, 从而起到促进胰腺癌细胞凋亡的作用.
核心提示: 本研究证实榄香烯在体内能够通过P53蛋白和Bcl-2蛋白家族相关的线粒体细胞凋亡途径诱导胰腺癌细胞的凋亡, 并且大剂量榄香烯乳抗胰腺癌作用显著. 所以, 榄香烯乳有望成为临床治疗胰腺癌的新的化疗药物. 当然, 榄香烯乳抗胰腺癌的作用机制及临床应用价值仍有待进一步的研究与评价.
引文著录: 张莉娜, 陈恳, 钱俐, 胡迎青, 许丽娜, 周国雄, 张弘. 榄香烯乳对人胰腺癌移植瘤组织中凋亡相关蛋白表达的影响. 世界华人消化杂志 2014; 22(17): 2385-2392
Revised: April 9, 2014
Accepted: April 28, 2014
Published online: June 18, 2014
AIM: To investigate the expression of PTEN, p53 and Bcl-2 proteins in pancreatic carcinoma xenografts in nude mice after treatment with elemene, and to explore the effect of elemene on the apoptosis of pancreatic cancer cells.
METHODS: Thirty mice with subcutaneous xenografts of a pancreatic cancer cell line (SW1990) were randomly divided into five groups: a negative control group, low- and high-dose elemene-treated groups, a gemcitabine-treated group, and an elemene plus gemcitabine group. Western blot and immunohistochemical staining were used to determine the expression of PTEN, p53 and Bcl-2 proteins in pancreatic carcinoma xenografts in nude mice after treatment with elemene.
RESULTS: The expression of PTEN and p53 proteins had a trend of up-regulation, while the expression of Bcl-2 protein had a trend of down-regulation in pancreatic carcinoma xenografts in nude mice after treatment with elemene. The results of immunohistochemical staining showed the same trend. Compared with the negative control group, the expression of p53 was significantly up-regulated, while Bcl-2 was down-regulated in the high-dose elemene group. Compared with the gemcitabine-treated group, the expression of p53 was significantly up-regulated, but Bcl-2 had no significant change in the combination treatment group. Immunohistochemical staining showed similar results to Western blot analysis.
CONCLUSION: Elemene can up-regulate the expression of PTEN and p53 proteins and down-regulate the expression of Bcl-2 protein in pancreatic cancer in a dose dependent manner, thereby inducing the apoptosis of pancreatic cancer cells.
- Citation: Zhang LN, Chen K, Qian L, Hu YQ, Xu LN, Zhou GX, Zhang H. Effect of treatment with elemene on expression of apoptosis-related proteins in pancreatic carcinoma xenografts in nude mice. Shijie Huaren Xiaohua Zazhi 2014; 22(17): 2385-2392
- URL: https://www.wjgnet.com/1009-3079/full/v22/i17/2385.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i17.2385
榄香烯(elemene)是从姜科植物莪术中提取出来的抗癌有效成分[1]. 大量的实验研究证实, 榄香烯能够促进肿瘤细胞凋亡、抑制肿瘤增殖[2,3]. 目前临床上常采用的榄香烯乳剂是以β-榄香烯为主要成分, 同时含有少量a-榄香烯及g-榄香烯. 榄香烯乳已广泛应用于临床多种肿瘤的治疗, 如肺癌、胶质母细胞瘤和前列腺癌等[4-7], 但较少应用于胰腺癌, 相关的实验研究也较少, 榄香烯在胰腺癌发生发展中的作用机制仍有待更深入的研究. 本课题组前期体外实验发现榄香烯乳对胰腺癌Panc-1细胞具有诱导凋亡、抑制增殖的作用[8], 但其诱导凋亡、抑制增殖的确切机制尤其是其调控的上游信号途径仍有待进一步研究. 本研究采用构建人胰腺癌裸鼠移植瘤模型, 检测榄香烯乳干预治疗后移植瘤内PTEN(phosphatase and tensin homologue deleted from chromosome 10又称为MMAC1, mutated in multiple advance cancers 1)、P53以及Bcl-2蛋白的表达情况, 旨在探讨榄香烯乳对胰腺癌凋亡作用的影响.
人胰腺癌SW1990细胞株. Balb/C裸鼠30只, 雌雄各半, 由南通大学医学院实验动物中心提供, 在南通大学医学院实验动物中心SPF级环境下饲养. 榄香烯乳注射液由大连华立金港药业有限公司提供; PTEN兔抗人单克隆抗体购自百奇生物科技(苏州)有限公司. P53鼠抗人单克隆抗体购自武汉博士德生物工程有限公司; Bcl-2兔抗人单克隆抗体购自武汉博士德生物工程有限公司; β-actin鼠抗人单克隆抗体购自百奇生物科技(苏州)有限公司.
1.2.1 细胞培养: SW1990细胞用含有10%胎牛血清的DMEM培养基, 于37 ℃及5%CO2的湿化培养箱中培养, 每2-3 d换液并传代, 将处于对数期的细胞用0.25%胰蛋白酶消化并收集, 细胞计数离心, 调整细胞浓度为1×107个/mL接种备用.
1.2.2 人胰腺癌移植瘤动物模型构建及药物干预: 按照要求在裸鼠左腋后接种胰腺癌细胞SW1990约1×106个后, 第10天移植瘤体积达约100 mm3时, 将裸鼠随机分为5组, 每组6只, 雌雄各半, 分组饲养. 阳性对照组: 腹腔注射吉西他滨25 mg/kg, 1次/3 d; 阴性对照组: 腹腔注射脂肪乳0.2 mL/只, 1次/d; 榄香烯乳低剂量组: 腹腔注射榄香烯20 mg/kg, 1次/d; 榄香烯乳高剂量组: 腹腔注射榄香烯60 mg/kg, 1次/d; 联合用药组: 榄香烯20 mg/kg, 1次/d, 腹腔注射吉西他滨25 mg/kg, 1次/d. 肿瘤细胞接种后第28日脱颈处死实验动物, 取皮下肿瘤组织, 每块肿瘤组织分为两部分: 一部分液氮冷冻后-80 ℃保存以备Western blot检测使用; 一部分40 g/L甲醛溶液固定, 石蜡包埋以备免疫组织化学检测使用.
1.2.3 Western blot方法检测PTEN、P53在各组肿瘤细胞中的表达: 预留的冻存组织用预冷的PBS缓冲液洗涤后放入预冷的组织匀浆器, 加入组织匀浆缓冲液(50 mmol/L Tis-Hcl pH 7.5, 150 mmol/L NaCl, 1 mmol/L phenylmethylsulfonyl fluoride, 4 mg/mL leupeptin, 1 mg/mL aprotinin), 在冰浴中匀浆, 4 ℃ 10000 r/min离心, 收集上清. BCA法测定蛋白浓度, 按照100 mg/孔蛋白量进行10%SDS-PAGE电泳并转膜, 转好的PVDF膜封闭孵抗体后ECL显影, Syngene GBOX凝胶成像仪扫描, Quantity one软件分析.
1.2.4 免疫组织化学方法检测PTEN、P53、Bcl-2在各组肿瘤组织中的表达: 免疫组织化学操作方法采用EnVision二步法, 试剂盒购自北京中山生物技术有限公司. 4 mm石蜡切片, 微波加热法抗原修复, 采用已知阳性细胞作阳性对照, 采用PBS液代替一抗作阴性对照. 免疫组织化学结果由两位高年资病理医师采用双盲法阅片以获得统一结果为准, 光镜下观察整个视野, 在良好组织结构和清晰的背景下, 以细胞核或细胞浆出现棕黄色或黄色颗粒作为阳性染色. 0分(-), 阳性细胞数<5%; 1分(+), 阳性细胞数5%-25%; 2分(++), 阳性细胞数25%-50%; 3分(+++), 阳性细胞数>50%. 评估目的组织中阳性细胞数占细胞总数的百分率.
统计学处理 所有数据采用SPSS19.0统计软件进行统计分析, 所得数据以mean±SD表示, 重复测量的方差分析进行5组裸鼠肿瘤体积的比较, Western blot结果采用One-way ANOVA单因素方差分析, 免疫组织化学结果采用Fisher's确切概率法, 以P<0.05为差异有统计学意义.
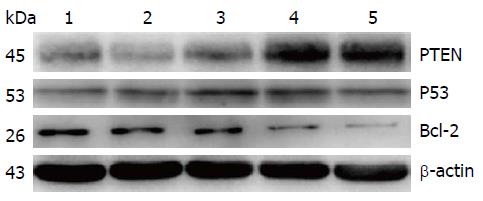
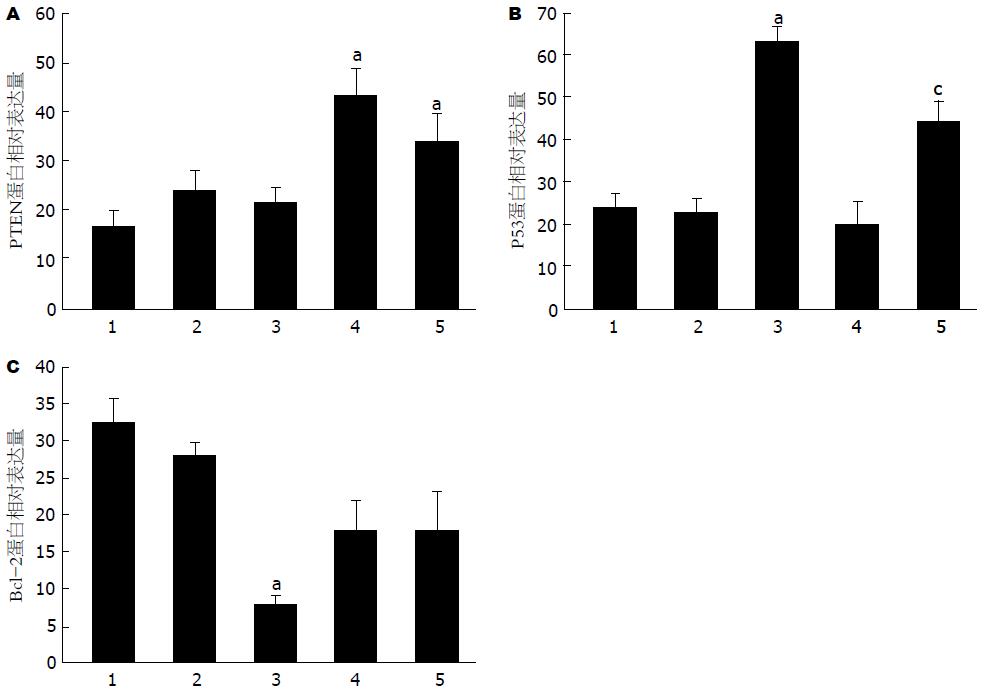
在各组肿瘤细胞中可检测到PTEN蛋白的54 kDa的条带、P53蛋白的53 kDa的条带、Bcl-2蛋白的26 kDa的条带以及内参β-actin蛋白的43 kDA的条带(图1). PTEN蛋白在各组间的表达经统计分析显示: 各组间差异有统计学意义(F = 6.358, P = 0.001), 组间多重比较显示榄香烯乳小剂量(P = 0.215)和大剂量组(P = 0.430)相比于阴性对照组虽然PTEN表达量升高, 但差异无统计学意义; 吉西他滨组(P = 0.000)和联合用药组(P = 0.006)相比于阴性对照组PTEN表达量显著升高; 并且联合用药组表达量低于吉西他滨阳性对照组, 但差异无统计学意义(P = 0.133). 其各组相对表达量(图2A).
P53蛋白表达在各组间的表达经统计分析显示: 各组间差异有统计学意义(F = 18.320, P = 0.001). 组间多重比较显示榄香烯乳大剂量组相比于阴性对照组P53蛋白表达显著升高(P = 0.001); 联合用药组P53蛋白表达量高于吉西他滨阳性相比对照组(P = 0.001), 其各组的相对表达量如图2B.
经统计分析, Bcl-2蛋白表达各组间差异有统计学意义(F = 4.87, P = 0.007). 组间多重比较显示榄香烯乳大剂量组相比于阴性对照组Bcl-2蛋白表达显著降低(P = 0.001); 联合用药组相比于吉西他滨阳性对照组Bcl-2蛋白表达差异无统计学意义(P = 0.985). 其各组相对表达量如图2C.
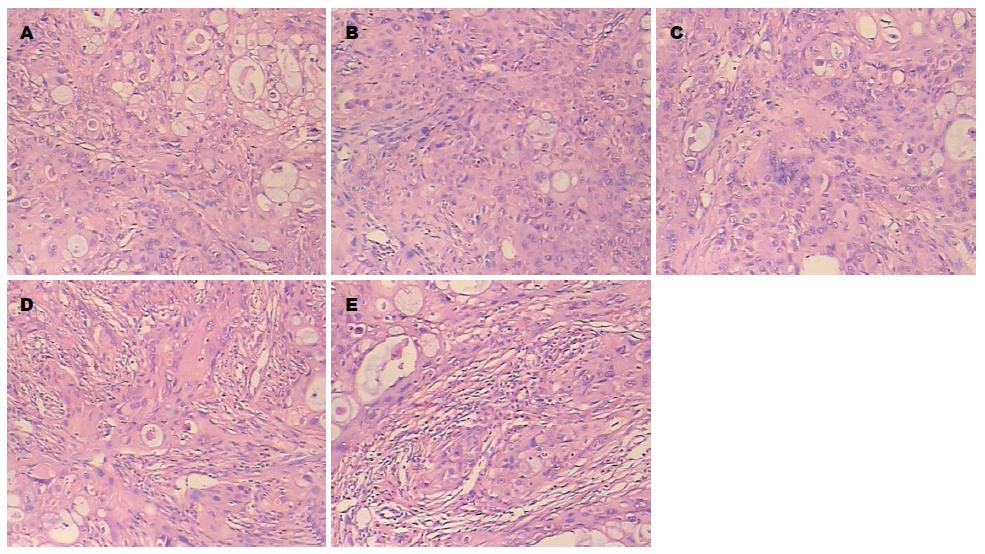
2.2.1移植瘤组织学的变化: 我们对各组移植瘤组织进行了常规染色(HE染色)观察, 各组癌组织呈现了不同的形态变化(图3). 阴性对照组腺癌组织部分呈巢状, 部分呈腺管状, 部分腔内见大量黏液潴留, 细胞核大小不一, 异型明显, 癌组织中及周围少量淋巴细胞浸润(图3A); 小剂量组腺癌组织部分腺管状腔内见黏液变少, 癌组织中及周围可见有较多的淋巴细胞浸润(图3B); 大剂量组和吉西他滨组在癌组织及癌周组织中可见有较多的急性炎细胞浸润(图3C, D); 联合用药组部分癌细胞呈变性坏死, 癌组织中分泌细胞减少, 癌组织及癌周组织中见大量急慢炎细胞浸润(图3E). 其他用药组组织形态呈过度状, 可见有急慢炎细胞浸润.
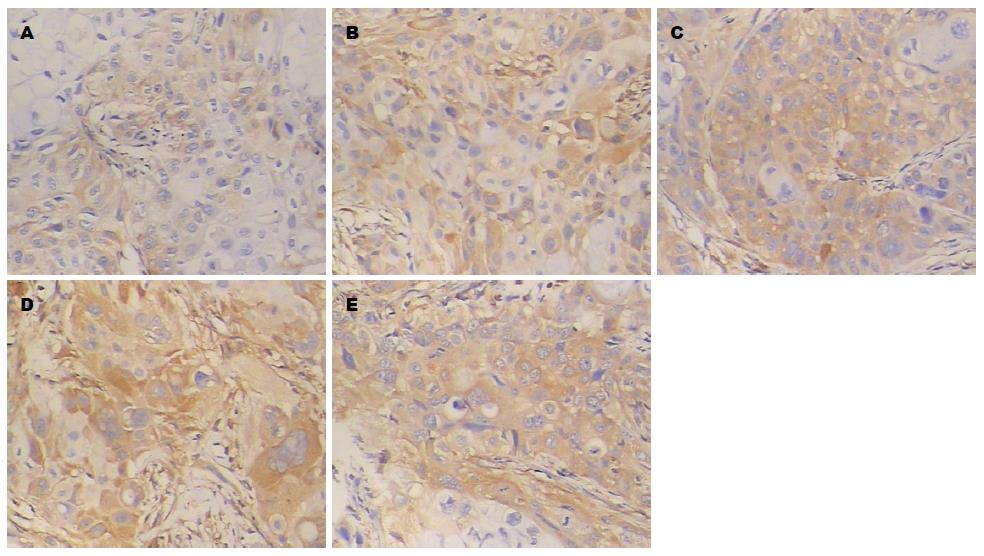
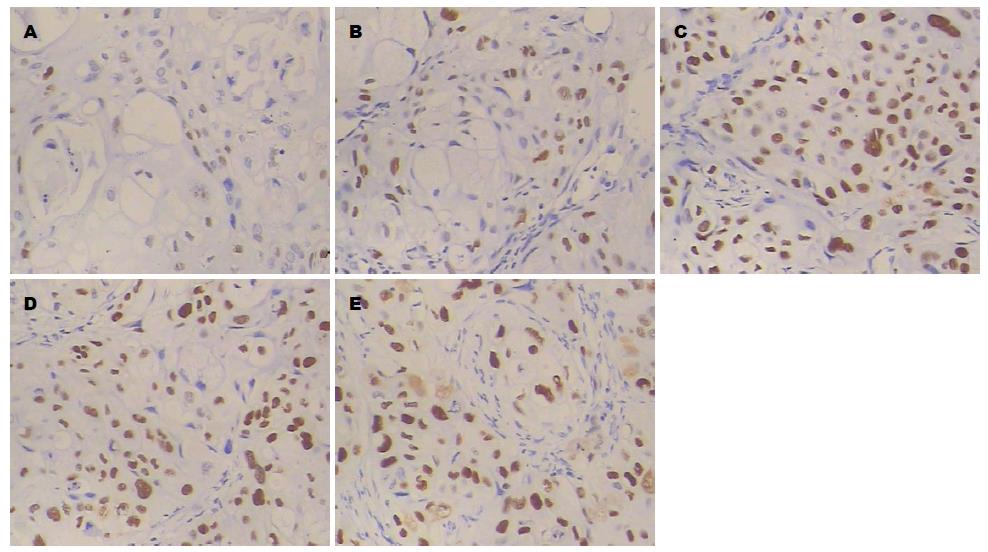
2.2.2 免疫组织化学检测移植瘤中PTEN的表达: 人胰腺癌裸鼠移植瘤组织中PTEN阳性表达产物呈棕黄色颗粒, 主要分布于细胞浆. 阴性对照组PTEN阳性表达产物较少, 榄香烯乳干预组PTEN阳性表达产物随着药物剂量的增大而增强, 吉西他滨阳性对照组和联合用药组表达更强(图4).
2.2.3 免疫组织化学检测移植瘤中P53的表达: 人胰腺癌裸鼠移植瘤组织中P53阳性表达产物呈棕黄色颗粒, 主要分布于细胞核. 阴性对照组细胞核P53阳性表达产物较少, 榄香烯乳干预组癌组织细胞核中P53阳性表达产物随着药物剂量的增大而增强, 细胞核深染, 吉西他滨阳性对照组和联合用药组表达更强(图5).
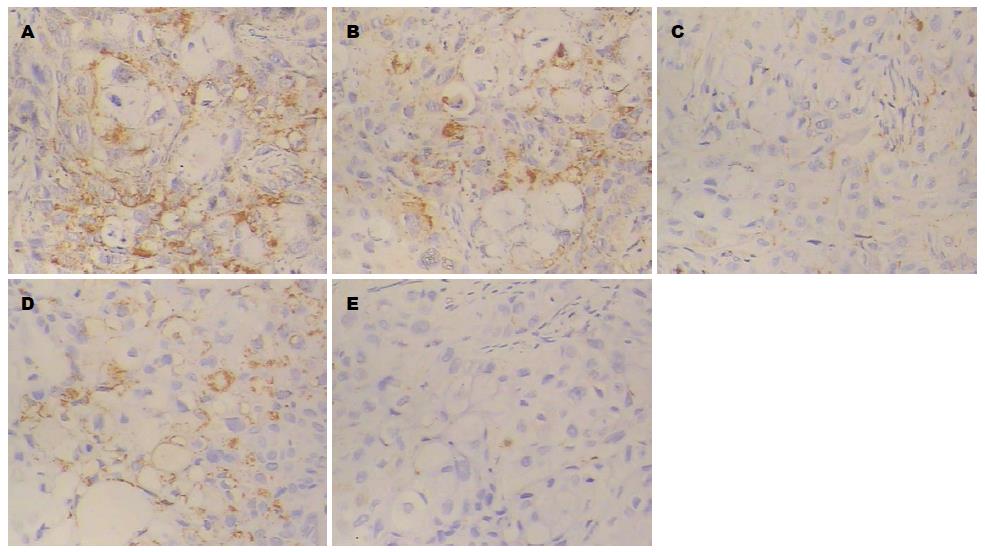
2.2.4 免疫组织化学检测移植瘤中Bcl-2的表达: 人胰腺癌裸鼠移植瘤组织中Bcl-2阳性表达产物呈棕黄色颗粒, 主要分布于细胞浆. 阴性对照组Bcl-2阳性表达产物较多, 榄香烯乳干预组Bcl-2阳性表达产物随着药物剂量的增大而减少, 吉西他滨阳性对照组和联合用药组Bcl-2阳性表达产物呈更少(图6).
胰腺癌是高度恶性的消化系肿瘤之一, 在美国是癌症相关死亡的第四大首要原因, 5年生存率只有6%[9]. 在世界范围内在所有新发现的肿瘤患者中有超过2%的胰腺癌患者[10]. 我国胰腺癌发病率逐年上升, 且有年轻化的趋势. 虽然放疗和化疗等手段对于延长患者生存期起到了一定的作用, 但是患者总体生存期仍不足24 mo[11,12]. 且胰腺癌对于常规化疗药物吉西他滨有一定的抵抗性, 治疗效果有限[13,14], 因此, 迫切需要寻找新的有效的治疗药物和治疗策略. 本课题组前期体外实验研究发现, 榄香烯乳能够显著抑制胰腺癌Panc-1细胞株增殖并促进其凋亡[8]. 本研究通过构建人胰腺癌裸鼠移植瘤模型, 研究榄香烯乳干预治疗以后与肿瘤细胞凋亡相关的蛋白如PTEN、P53和Bcl-2的表达情况, 发现榄香烯乳能够促进肿瘤细胞中P53的表达而抑制Bcl-2的表达, 但对PTEN无明显的促进作用.
PTEN蛋白由抑癌基因PTEN基因编码, 是一种对偶的特异性的磷酸酶, 能够将磷脂酰肌醇-3,4,5-三磷酸(phosphatidylinositol-3,4,5-triphosphare, PIP3)去磷酸化为磷脂酰肌醇-4,5-二磷脂(phosphatidylinositol-4,5-bisphosphate, PIP2). 因此, 他是磷酸肌醇3激酶/ATP-依赖的络氨酸激酶(PI3K/Akt)信号途径的有效阻滞剂[15,16], 从而调控多种细胞功能, 包括细胞增殖、分化、凋亡等[17,18]. 有研究证实在体外实验中β-榄香烯能通过抑制MAPK/ERK和PI3K/Akt/mTOR信号途径诱导人肾细胞癌786-0细胞凋亡, 说明PI3K/Akt信号途径是β-榄香烯诱导肿瘤细胞凋亡的途径之一[19]. 而PTEN是PI3K/Akt信号途径重要的上游调控因子, β-榄香烯是否直接作用于PTEN来调控PI3K/Akt信号途径以诱导凋亡的. 本研究中Western blot和免疫组织化学结果均显示榄香烯乳干预后胰腺癌组织中的PTEN蛋白有升高的趋势, 但差异无统计学意义(P>0.05), 这说明PTEN可能不是榄香烯乳引起胰腺癌细胞凋亡、发挥抑癌作用的直接作用因子, 也可能是因为榄香烯的抗癌作用具有肿瘤细胞特异性[20].
Bcl-2蛋白家族是参与调控细胞凋亡的重要调控分子, 其分为两类: 一类是抗凋亡蛋白, 如Bcl-2; 一类是促凋亡蛋白, 如Bax. 细胞对凋亡刺激的敏感性取决于抗凋亡蛋白与促凋亡蛋白两者的比例[21-23]. P53蛋白由抑癌基因TP53基因编码, 可通过P53-Bax线粒体途径调控细胞凋亡[23-25]. 且研究证实β-榄香烯是通过线粒体介导的Caspase活性途径来诱导细胞凋亡[5], 并且β-榄香烯能够降低肺癌和前列腺癌中Bcl-2的表达而增加细胞色素C、ADP核糖聚合酶(ADP-ribose polymerase; PARP)以及Caspase3、Caspase7和Caspase9的表达[26], β-榄香烯在体内的抗癌作用具有浓度剂量依赖性, 半抑制浓度值(50% inhibiting concentration, IC50)达数百微摩尔, 并且取决于肿瘤细胞的类型[27].
本研究中结果显示榄香烯乳干预治疗后, 大剂量组胰腺癌组织中P53蛋白表达量显著说升高, 而Bcl-2蛋白表达量显著降低, 但小剂量组中P53蛋白和Bcl-2蛋白表达有升高或降低的趋势, 但差异无统计学意义, 从而提示胰腺癌对P53蛋白和Bcl-2蛋白表达的调控有一定的剂量依赖关系; 联合用药组与吉西他滨阳性对照组相比, 胰腺癌组织中P53蛋白和Bcl-2蛋白表达的改变差异并无统计学意义, 可能是因为联合用药组中榄香烯乳用量为小剂量, 不能与吉西他滨起到很好的协同作用, 同样提示榄香烯乳对P53蛋白和Bcl-2蛋白表达的调控有一定的剂量依赖关系; 榄香烯乳大剂量能组与吉西他滨阳性对照组相比, P53蛋白表达明显升高而Bcl-2蛋白表达明显降低, 说明大剂量榄香烯乳对于诱导胰腺癌凋亡相关蛋白表达方面可能发挥与吉西他滨相似甚至更显著的作用. 结合前述结果分析可知, 榄香烯乳促进胰腺癌细胞凋亡的作用主要是通过调控与P53蛋白和Bcl-2蛋白家族相关的线粒体细胞凋亡途径实现的, 并且具有剂量依赖性, 与其他榄香烯相关研究结果相一致.
本研究证实榄香烯在体内能够通过P53蛋白和Bcl-2蛋白家族相关的线粒体细胞凋亡途径诱导胰腺癌细胞的凋亡, 并且大剂量榄香烯乳抗胰腺癌作用显著. 因为榄香烯细胞毒性小[20,28], 高浓度的榄香烯的抗癌作用在部分肿瘤中要优于某些肿瘤化疗药物, 如多柔比星、紫杉醇、喜树碱和长春新碱等[29,30], 所以, 榄香烯乳有望成为临床治疗胰腺癌的新的化疗药物. 当然, 榄香烯乳抗胰腺癌的作用机制及临床应用价值仍有待进一步的研究与评价.
胰腺癌是一种高度侵袭性的恶性肿瘤, 5年生存率不到5%. 吉西他滨是治疗胰腺癌的常用一线化疗药物, 然而单用吉西他滨作用有限, 肿瘤敏感性只有12%, 显然需要新的不同类型的治疗方法来治疗胰腺癌. 榄香烯已被国内证明在肺癌、白血病、肝癌、膀胱癌、胃癌、癌性腹水等治疗中是行之有效的. 榄香烯是否能在胰腺癌的治疗中达到很好的疗效仍有待进一步研究.
杜奕奇, 副教授, 中国人民解放军第二军医大学长海医院
目前榄香烯乳抗肿瘤的研究主要着重于基础研究, 包括体内外实验研究榄香烯乳本身以及联合其他抗肿瘤药物后诱导凋亡、抑制增殖的作用, 榄香烯仍未在临床得到广泛应用, 尚缺乏临床研究.
本课题组前期体外实验发现榄香烯乳对胰腺癌Panc-1细胞具有诱导凋亡、抑制增殖的作用, 但其诱导凋亡、抑制增殖的确切机制尤其是其调控的上游信号途径仍有待进一步研究.
本研究采用构建人胰腺癌裸鼠移植瘤模型, 检测榄香烯乳干预治疗后移植瘤内PTEN、P53以及Bcl-2蛋白的表达情况, 探讨了榄香烯乳对胰腺癌凋亡作用的影响.
本研究探讨榄香烯乳干预治疗后人胰腺癌裸鼠移植瘤组织中凋亡相关蛋白的表达, 以证实榄香烯乳是否能诱导胰腺癌凋亡以达到治疗目的, 为胰腺癌临床治疗提供新的思路与方法.
本文设计合理, 具有一定临床指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Zhang R, Tian A, Zhang H, Zhou Z, Yu H, Chen L. Amelioration of experimental autoimmune encephalomyelitis by β-elemene treatment is associated with Th17 and Treg cell balance. J Mol Neurosci. 2011;44:31-40. [PubMed] [DOI] |
| 2. | Li QQ, Wang G, Zhang M, Cuff CF, Huang L, Reed E. beta-Elemene, a novel plant-derived antineoplastic agent, increases cisplatin chemosensitivity of lung tumor cells by triggering apoptosis. Oncol Rep. 2009;22:161-170. [PubMed] |
| 3. | Dai ZJ, Tang W, Lu WF, Gao J, Kang HF, Ma XB, Min WL, Wang XJ, Wu WY. Antiproliferative and apoptotic effects of β-elemene on human hepatoma HepG2 cells. Cancer Cell Int. 2013;13:27. [PubMed] [DOI] |
| 4. | Yao CC, Tu YR, Jiang J, Ye SF, Du HX, Zhang Y. β-elemene reverses the drug resistance of lung cancer A549/DDP cells via the mitochondrial apoptosis pathway. Oncol Rep. 2014;31:2131-2138. [PubMed] [DOI] |
| 5. | Yao YQ, Ding X, Jia YC, Huang CX, Wang YZ, Xu YH. Anti-tumor effect of beta-elemene in glioblastoma cells depends on p38 MAPK activation. Cancer Lett. 2008;264:127-134. [PubMed] [DOI] |
| 6. | Li QQ, Wang G, Reed E, Huang L, Cuff CF. Evaluation of cisplatin in combination with β-elemene as a regimen for prostate cancer chemotherapy. Basic Clin Pharmacol Toxicol. 2010;107:868-876. [PubMed] [DOI] |
| 7. | Cai DY, Gao X, Wu XH, Hong TT. [Synergistic effect of beta-elemene injection combined paclitaxel injection on human breast cancer MB-468 cells: an in vitro study]. Zhongguo Zhong Xi Yi Jie He Za Zhi. 2013;33:978-982. [PubMed] |
| 9. | Jemal A, Siegel R, Xu J, Ward E. Cancer statistics 2010. CA Cancer J Clin. 2010;60:277-300. [PubMed] [DOI] |
| 10. | Braat H, Bruno M, Kuipers EJ, Peppelenbosch MP. Pancreatic cancer: promise for personalised medicine? Cancer Lett. 2012;318:1-8. [PubMed] [DOI] |
| 11. | Yu CK, Yu SN, Lu ZH, Chen J. [Research advances in microRNA in pancreatic ductal adenocarcinoma]. Zhongguo Yi Xue Ke Xue Yuan Xue Bao. 2011;33:575-581. [PubMed] |
| 12. | Riediger H, Keck T, Wellner U, zur Hausen A, Adam U, Hopt UT, Makowiec F. The lymph node ratio is the strongest prognostic factor after resection of pancreatic cancer. J Gastrointest Surg. 2009;13:1337-1344. [PubMed] [DOI] |
| 13. | Shi S, Yao W, Xu J, Long J, Liu C, Yu X. Combinational therapy: new hope for pancreatic cancer? Cancer Lett. 2012;317:127-135. [PubMed] [DOI] |
| 14. | Thota R, Pauff JM, Berlin JD. Treatment of metastatic pancreatic adenocarcinoma: a review. Oncology (Williston Park). 2014;28:70-74. [PubMed] |
| 15. | Krausch M, Raffel A, Anlauf M, Schott M, Willenberg H, Lehwald N, Hafner D, Cupisti K, Eisenberger CF, Knoefel WT. Loss of PTEN expression in neuroendocrine pancreatic tumors. Horm Metab Res. 2011;43:865-871. [PubMed] [DOI] |
| 16. | Ma J, Sawai H, Ochi N, Matsuo Y, Xu D, Yasuda A, Takahashi H, Wakasugi T, Takeyama H. PTEN regulates angiogenesis through PI3K/Akt/VEGF signaling pathway in human pancreatic cancer cells. Mol Cell Biochem. 2009;331:161-171. [PubMed] [DOI] |
| 17. | Ma J, Sawai H, Matsuo Y, Ochi N, Yasuda A, Takahashi H, Wakasugi T, Funahashi H, Sato M, Takeyama H. IGF-1 mediates PTEN suppression and enhances cell invasion and proliferation via activation of the IGF-1/PI3K/Akt signaling pathway in pancreatic cancer cells. J Surg Res. 2010;160:90-101. [PubMed] [DOI] |
| 18. | Shroff S, Overman MJ, Rashid A, Shroff RT, Wang H, Chatterjee D, Katz MH, Lee JE, Wolff RA, Abbruzzese JL. The expression of PTEN is associated with improved prognosis in patients with ampullary adenocarcinoma after pancreaticoduodenectomy. Arch Pathol Lab Med. 2013;137:1619-1626. [PubMed] [DOI] |
| 19. | Zhan YH, Liu J, Qu XJ, Hou KZ, Wang KF, Liu YP, Wu B. β-Elemene induces apoptosis in human renal-cell carcinoma 786-0 cells through inhibition of MAPK/ERK and PI3K/Akt/ mTOR signalling pathways. Asian Pac J Cancer Prev. 2012;13:2739-2744. [PubMed] |
| 20. | Chen W, Lu Y, Wu J, Gao M, Wang A, Xu B. Beta-elemene inhibits melanoma growth and metastasis via suppressing vascular endothelial growth factor-mediated angiogenesis. Cancer Chemother Pharmacol. 2011;67:799-808. [PubMed] [DOI] |
| 21. | Youle RJ, Strasser A. The BCL-2 protein family: opposing activities that mediate cell death. Nat Rev Mol Cell Biol. 2008;9:47-59. [PubMed] |
| 22. | Chen D, Zheng X, Kang D, Yan B, Liu X, Gao Y, Zhang K. Apoptosis and expression of the Bcl-2 family of proteins and P53 in human pancreatic ductal adenocarcinoma. Med Princ Pract. 2012;21:68-73. [PubMed] [DOI] |
| 23. | Liu ZH, Wang MH, Ren HJ, Qu W, Sun LM, Zhang QF, Qiu XS, Wang EH. Interleukin 7 signaling prevents apoptosis by regulating bcl-2 and bax via the p53 pathway in human non-small cell lung cancer cells. Int J Clin Exp Pathol. 2014;7:870-881. [PubMed] |
| 24. | Li J, Lee B, Lee AS. Endoplasmic reticulum stress-induced apoptosis: multiple pathways and activation of p53-up-regulated modulator of apoptosis (PUMA) and NOXA by p53. J Biol Chem. 2006;281:7260-7270. [PubMed] |
| 25. | Liu XF, Jiang H, Zhang CS, Yu SP, Wang ZQ, Su HL. Targeted drug regulation on methylation of p53-BAX mitochondrial apoptosis pathway affects the growth of cholangiocarcinoma cells. J Int Med Res. 2012;40:67-75. [PubMed] |
| 26. | Wang G, Li X, Huang F, Zhao J, Ding H, Cunningham C, Coad JE, Flynn DC, Reed E, Li QQ. Antitumor effect of beta-elemene in non-small-cell lung cancer cells is mediated via induction of cell cycle arrest and apoptotic cell death. Cell Mol Life Sci. 2005;62:881-893. [PubMed] |
| 27. | Li QQ, Wang G, Huang F, Banda M, Reed E. Antineoplastic effect of beta-elemene on prostate cancer cells and other types of solid tumour cells. J Pharm Pharmacol. 2010;62:1018-1027. [PubMed] [DOI] |
| 28. | Li X, Wang G, Zhao J, Ding H, Cunningham C, Chen F, Flynn DC, Reed E, Li QQ. Antiproliferative effect of beta-elemene in chemoresistant ovarian carcinoma cells is mediated through arrest of the cell cycle at the G2-M phase. Cell Mol Life Sci. 2005;62:894-904. [PubMed] |
| 29. | Grott M, Karakaya S, Mayer F, Baertling F, Beyer C, Kipp M, Kopp HG. Progesterone and estrogen prevent cisplatin-induced apoptosis of lung cancer cells. Anticancer Res. 2013;33:791-800. [PubMed] |
| 30. | Li L, Xu L, Qu X, Zhao M, Yu P, Kang J, Liu Y, Hu X. Cbl-regulated Akt and ERK signals are involved in β-elemene-induced cell apoptosis in lung cancer cells. Mol Med Rep. 2011;4:1243-1246. [PubMed] [DOI] |