修回日期: 2014-04-09
接受日期: 2014-04-28
在线出版日期: 2014-06-08
目的: 探讨基质金属蛋白酶-14(matrix mettalloproteinase 14, MMP-14)和环氧合酶2(cyclooxygenase 2, COX-2)蛋白在胃癌侵袭转移过程中的表达和相互关系, 从而进一步揭示胃癌的发病机制.
方法: 采用免疫组织化学法检测人胃癌组织和正常胃组织中MMP-14和COX-2的蛋白表达情况, 进一步分析二者与胃癌临床病理参数的关系, 并探讨MMP-14在胃癌组织不同TNM分期中的表达特点.
结果: 胃癌组织中MMP-14和COX-2的阳性表达率明显高于正常胃组织(P<0.01); MMP-14的表达与胃癌分化程度、区域淋巴结转移程度、浸润深度、TNM分期相关(P<0.01), COX-2的表达与浸润深度、TNM分期相关(P<0.05), 胃癌组织中MMP-14与COX-2蛋白表达呈正相关(P<0.01); 随着TNM分期的增加, MMP-14表达增加且有从胞浆向胞膜转位的趋势.
结论: COX-2蛋白可能通过诱导MMP-14蛋白表达上调及胞内转位, 从而增加胃癌细胞的侵袭及转移能力.
核心提示: 本研究发现胃癌组织中基质金属蛋白酶家族(matrix metalloproteinase, MMPs)-14和环氧合酶(cyclooxygenase, COX)-2的蛋白表达均明显高于癌旁正常组织且二者的蛋白表达呈正相关, MMP-14和COX-2的蛋白表达均与胃癌浸润深度、TNM分期相关, 随着TNM分期的增加, MMP-14的蛋白表达增加且有从胞浆向胞膜转位的趋势.
引文著录: 谷倬宇, 李思源, 李军, 肖智伟, 周婷. MMP-14和COX-2蛋白在胃癌侵袭转移过程中的表达和关系. 世界华人消化杂志 2014; 22(16): 2300-2305
Revised: April 9, 2014
Accepted: April 28, 2014
Published online: June 8, 2014
AIM: To investigate the protein expression of MMP-14 and COX-2 in gastric cancer to further reveal the pathogenesis of gastric cancer.
METHODS: The protein expression of MMP-14 and COX-2 was examined by immunohistochemistry in human gastric cancer tissues and normal gastric tissues, and the relationship between the protein expression and clinicopathological features was analyzed. The protein expression of MMP-14 in human gastric cancer tissues at different TNM stages was also explored.
RESULTS: The expression rates of MMP-14 and COX-2 in gastric cancer tissues were significantly higher than those in normal tissues (P < 0.01). The expression of MMP-14 was significantly correlated with the degree of differentiation, lymph node metastasis, invasion depth and TNM stage of gastric cancer (P < 0.01). The expression of COX-2 was correlated with invasion depth and TNM stage of gastric cancer (P < 0.05). MMP-14 expression was positively correlated with COX-2 expression in gastric cancer tissues (P < 0.01). MMP-14 expression increased with the elevation of TNM stage and showed a tendency from the cytoplasm to cell membrane.
CONCLUSION: Stimulating overexpression and intracellular translocation of MMP-14 may be one of mechanisms for COX-2 protein to contribute to the invasion and metastasis of human gastric cancer.
- Citation: Gu ZY, Li SY, Li J, Xiao ZW, Zhou T. Expression of MMP-14 and COX-2 in gastric cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(16): 2300-2305
- URL: https://www.wjgnet.com/1009-3079/full/v22/i16/2300.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i16.2300
胃癌是世界上最常见的恶性肿瘤之一, 其恶性程度在男性和女性中分别排在第2位和第4位[1]. 在中国, 胃癌同样也是最常见的恶性肿瘤之一[2]. 大多数胃癌患者死于胃癌的侵袭转移和术后复发, 且过程十分复杂, 此过程的关键事件是降解周围基质, 而基质金属蛋白酶家族(matrix metalloproteinase, MMPs)是对细胞外基质进行溶解的重要酶类, 他可降解细胞外基质和基底膜, 是恶性肿瘤发生转移与浸润的重要介质, 特别是其中跨膜的MMP-14蛋白, 是肿瘤细胞入侵的关键酶[3,4]. 环氧合酶(cyclooxygenase, COX)是花生四烯酸转化为前列腺素过程的关键限速酶, 其最重要的亚型COX-2在多种肿瘤组织中表达, 与肿瘤的侵袭和转移的关系也已受到越来越多的关注[5]. 本实验通过对胃癌和正常胃黏膜组织的MMP-14和COX-2表达进行免疫组织化学检测, 分析他们与胃癌临床病理特征的关系, 并初步探讨他们之间的相互关系及MMP-14在不同TNM分期中的表达, 旨在为以后研究胃癌浸润转移机制提供新的思路.
选取2012-01/2013-05我院病理科经40 g/L甲醛固定和石蜡包埋的胃癌组织标本59例, 对照组为经病理证实距肿块边缘5 cm的正常组织, 具体临床病理资料如表1. 病例纳入标准: 符合WHO分类中胃癌的诊断标准, 由至少两位病理科专业技术人员共同阅片明确诊断. 患者术前均未行放化疗和生物免疫治疗. 临床资料齐全. MMP-14和COX-2兔抗人单克隆抗体购自英国Abcam公司, SP免疫组织化学试剂盒和DAB显色剂购自北京中杉金桥生物技术有限公司.
| 临床病理特征 | n(%) |
| 年龄(岁) | |
| <60 | 26(44.1) |
| ≥60 | 33(55.9) |
| 性别 | |
| 男 | 44(74.6) |
| 女 | 15(25.4) |
| 分化程度 | |
| 高、中 | 22(37.3) |
| 低 | 37(62.7) |
| 浸润深度 | |
| T1-T2 | 20(33.9) |
| T3-T4 | 39(66.1) |
| 区域淋巴结转移 | |
| N0 | 24(40.7) |
| N1-N3 | 35(59.3) |
| TNM分期 | |
| Ⅰ/Ⅱ | 30(50.8) |
| Ⅲ/Ⅳ | 29(49.2) |
1.2.1 免疫组织化学染色: 将4 μm的贴邻切片脱蜡水化后, 用新鲜配制的3%双氧水室温封闭10 min, PBS洗后滴加正常的山羊血清封闭液室温20 min, 甩去多余液体. 4 ℃滴加一抗过夜, 一抗稀释1:100的比例, 37 ℃复温45 min, 室温下滴加生物素化二抗30 min, 辣根过氧化物酶标记的链酶亲和素工作液在室温下滴加, 20 min后镜下控制DAB显色, 后用自来水清洗, 苏木素染色、脱水、透明树胶封片. 实验以PBS代替一抗作为阴性对照.
1.2.2 结果判定: 染色判定标准采用半定量分析方法, 在高倍镜(×400)下随机挑选5个视野(每个观察视野范围内的细胞数量≥200个), 根据样本阳性细胞百分比和染色强度综合评分. (1)根据细胞染色强度计分: 不着色为0分; 1分为浅棕黄色; 2分为棕黄色; 3分为棕褐色; (2)根据阳性细胞百分比计分: 阳性细胞<5%记为0分; 阳性细胞占6%-25%为1分; 阳性细胞占26%-50%为2分; 阳性细胞占51%-75%为3分; 阳性细胞占76%-100%为4分. 根据阳性细胞百分比和染色强度的乘积评分分为: 0-1分为阴性结果, 2-12为阳性结果, 其中2-4分为弱阳性(+), 5-8分为阳性(++), 9-12分为强阳性(+++). 在未知病理资料情况下, 由两名病理科医生判定, 结果一致可判断为阳性.
1.2.3 免疫组织化学图像分析: 采用Image Pro Plus 6.0图像分析系统, 对采集细胞图像中细胞的染色结果进行系统性分析, 每个TNM分期随机选取10个不同的视野, 用平均光密度表示细胞中MMP-14染色强度.
统计学处理 资料采用SPSS18.0软件进行数据处理, MMP-14和COX-2与临床病理特征的关系采用χ2检验. MMP-14和COX-2的相互关系采用Spearman秩相关分析. 不同TNM分期的平均光密度值以mean±SD表示, 数据比较采用方差分析. P<0.05为差异有统计学意义.
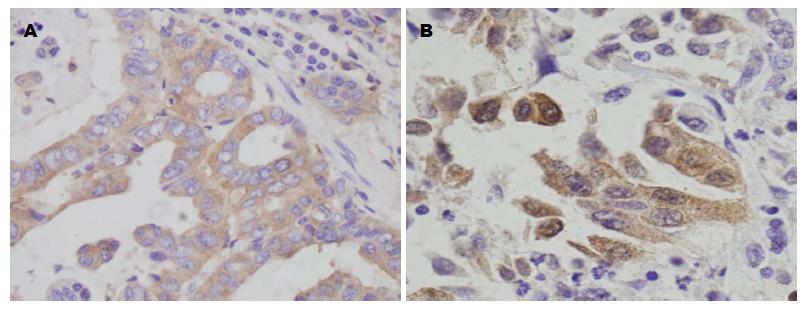
MMP-14及COX-2在胃癌组织中的表达主要位于胞浆(图1). MMP-14及COX-2在胃癌组织中的阳性表达显著高于他们在癌旁正常胃组织中的表达(MMP-14: χ2 = 21.009, P = 0.000; COX-2: χ2 = 13.510, P = 0.000)(表2).
| 组织类型 | n | MMP-14表达 | COX-2表达 | ||||
| 阳性 | χ2值 | P值 | 阳性 | χ2值 | P值 | ||
| 正常组织 | 45 | 3(6.7) | 21.009 | 0.000 | 6(13.3) | 13.510 | 0.000 |
| 胃癌组织 | 59 | 30(50.8) | 28(47.5) | ||||
肿瘤分化程度越低(χ2 = 12.966, P = 0.000)、浸润越深(χ2 = 8.088, P = 0.004)、区域淋巴结转移越严重(χ2 = 7.609, P = 0.006)、TNM分期越晚(χ2 = 7.491, P = 0.006), 则MMP-14表达的阳性率越高; 浸润越深(χ2 = 6.120, P = 0.013)、TNM分期越晚(χ2 = 4.883, P = 0.027), 则COX-2表达的阳性率越高(表3).
| 临床病理特征 | n | MMP-14表达 | COX-2表达 | ||||
| 阳性 | χ2值 | P值 | 阳性 | χ2值 | P值 | ||
| 分化程度 | 12.966 | 0.000 | 3.441 | 0.064 | |||
| 高、中 | 22 | 4(18.2) | 7(31.8) | ||||
| 低 | 37 | 26(70.3) | 21(56.8) | ||||
| 浸润深度 | 8.088 | 0.004 | 6.120 | 0.013 | |||
| T1-T2 | 20 | 5(25.0) | 5(25.0) | ||||
| T3-T4 | 39 | 25(64.1) | 23(59.0) | ||||
| 区域淋巴结转移 | 7.609 | 0.006 | 3.237 | 0.072 | |||
| N0 | 24 | 7(29.2) | 8(33.3) | ||||
| N1-N3 | 35 | 23(65.7) | 20(57.1) | ||||
| TNM分期 | 7.491 | 0.006 | 4.883 | 0.027 | |||
| Ⅰ/Ⅱ | 30 | 10(33.3) | 10(33.3) | ||||
| Ⅲ/Ⅳ | 29 | 20(68.9) | 18(62.1) | ||||
Spearman秩相关分析表明胃癌组织中MMP-14和COX-2表达具有显著正相关性(r = 0.391, P = 0.002)(表4).
| COX-2 | MMP-14 | 合计 | r值 | P值 | ||
| 阳性 | 阴性 | |||||
| 阳性 | 20 | 8 | 28 | 0.391 | 0.002 | |
| 阴性 | 10 | 21 | 31 | |||
| 合计 | 30 | 29 | 59 | |||
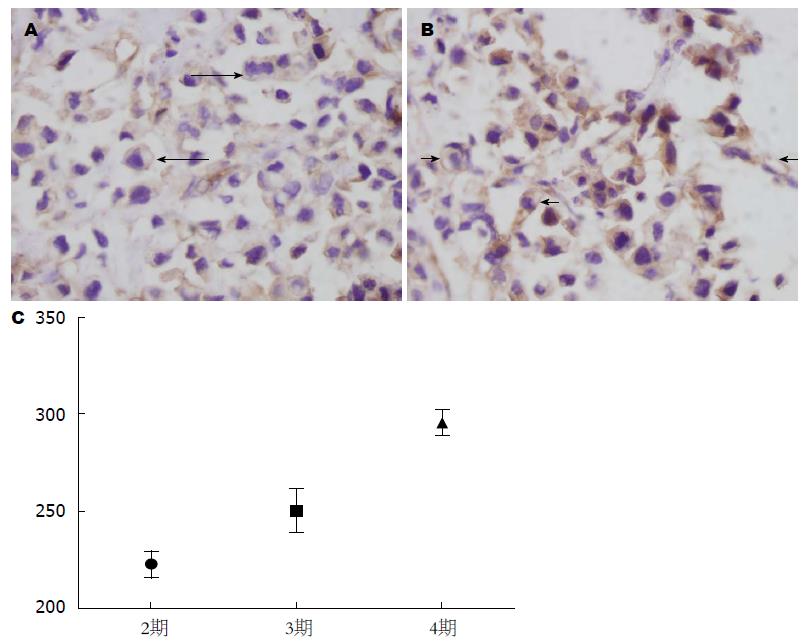
MMP-14在胃癌组织中的表达主要位于胞浆, 但随着TNM分期的增加, 开始出现胞膜表达, 红色箭头为膜阳性, 免疫组织化学切片的平均光密度值统计分析显示, Ⅱ期222.64±6.73, Ⅲ期250.22±11.41, Ⅳ期295.63±6.88, 不同TNM分期的MMP-14表达强度具有显著差异(ANOVA: F = 73.233, P<0.01), 两两比较也具有显著差异(均数差分别为27.58、45.42、72.99, P<0.01)(图2).
COX是催化花生四烯酸转化成前列腺素过程中的一种重要限速酶类, COX-2作为最重要的亚型在大多数组织在生理状态下不表达, 但是在细胞因子、内毒素、肿瘤促进剂、癌基因等一些刺激物的作用下会迅速产生. 大量研究表明COX-2在胃癌组织中存在过度表达, 阳性率很高[6], 本实验胃癌组织中COX-2蛋白表达阳性率为47.5%, 这一结果与文献报道相近, 同时胃癌原发灶中COX-2的阳性表达与胃癌的浸润深度及TNM分期密切相关. 研究发现, COX-2过度表达可降低介导细胞间黏附的E-钙黏蛋白(E-cadherin)活性, 提高细胞与细胞外基质蛋白黏附能力, 增加肿瘤细胞的侵袭力, 相反使用COX-2抑制剂却能增加钙粘蛋白活性[7]. 与此同时, 在COX-2高表达的肿瘤细胞可伴有MMPs表达的显著增高, 并发现其转移侵袭活性较不伴有MMPs表达者增强[8].
MMPs的高表达也和多种肿瘤的发生发展密切相关[9-11], MMP-14是其重要成员, 又称膜型基质金属蛋白酶-1(MT1-MMP), 他可以通过激活MMP-2来降解细胞外基质的成分, 包括各种胶原、蛋白多糖和糖蛋白等, 参与肿瘤进展过程中的多种生物事件, 比如肿瘤细胞的浸润、侵袭和转移[12]. 国内江州华等[13]报道, MMP-14在胃癌组织中有很高的阳性表达率, 并且MMP-14表达阳性组与阴性组相比具有更高的淋巴结转移率. 国外的研究[14]表明胃癌细胞中MMP-14表达下调后发生转移的概率降低, 侵袭性高、血管生成能力强的胃癌细胞MMP-14的表达明显升高. 我们的实验结果也表明, 胃癌原发灶中MMP-14的阳性表达与胃癌的分化程度、浸润深度、区域淋巴结转移、TNM分期存在着一定关系. MMP-14在肿瘤细胞的侵袭转移过程中, 与细胞外基质相互作用, 会逐渐向侵入性伪足处聚集, 该伪足处富含肌动蛋白调节蛋白、黏附分子和水解酶, 是水解基质的关键部位[15]. 我们的实验结果表明随着TNM分期增加, MMP-14表达增加并开始出现膜阳性, 这不仅提示我们侵袭性强的胃癌细胞MMP-14表达水平高于侵袭性弱的胃癌细胞, 而且MMP-14在胞内确实存在某种转运机制, 使MMP-14逐渐向胞膜定向移动, 参与肿瘤入侵.
为了进一步探讨COX-2是通过何种途径促进肿瘤的浸润、转移及其与MMP-14之间的相互关系, 本实验观察了59例胃癌组织中COX-2 及MMP-14蛋白的表达, 结果表明胃癌组织中COX-2及MMP-14高表达之间呈正相关关系(r = 0.391, P<0.01), 因此这可能提示COX-2可能通过促进MMPs表达上调, 尤其是MMP-14的表达显著增高可能成为其促进肿瘤细胞的浸润、转移的可能途径之一. Hu等[16]研究发现, 在乳腺癌中COX-2的过度表达可以上调MMP-14的表达, 而用COX-2抑制剂塞来昔布作用肿瘤细胞后, 细胞的侵袭能力相对于对照组明显降低. Annabi等[17]在恶性胶质瘤细胞中发现, NF-kB介导的COX-2的表达可能是MMP-14的一个重要调控点, 两者之间存在着一定的相互作用关系. 而Akla等[18]在间充质干细胞中也同样证实了COX-2可通过调控MMP-14参与细胞内的各种炎症反应的发生. 这也再次证实了COX-2和MMP-14之间确实存在着某种关联, 但是二者之间存在的确切分子机制尚有待于进一步的研究.
总之, 胃癌组织中存在COX-2、MMP-14的高表达, 且两者之间的表达强度呈正相关, COX-2促进胃癌浸润、转移的途径之一可能是通过诱导MMPs的释放, 尤其是MMP-14表达上调而增加胃癌的侵袭力. 因此阐明COX-2和MMP-14在胃癌侵袭和转移中的作用显得十分重要, 对COX-2和MMP-14的深入研究有助于进一步揭示胃癌的发病机制, 并对胃癌的诊治提供依据.
大多数胃癌患者死于胃癌的侵袭转移和术后复发, 此过程十分复杂, 而基质金属蛋白酶家族(matrix metalloproteinase, MMPs)中跨膜的MMP-14蛋白是肿瘤细胞入侵的关键酶; 环氧合酶(cyclooxygenase, COX)是花生四烯酸转化为前列腺素过程的关键限速酶, 其最重要的亚型COX-2在多种肿瘤组织中表达, 与肿瘤的侵袭和转移的关系也已受到越来越多的关注.
郭炜, 教授, 河北医科大学第四医院河北省肿瘤研究所病理研究室
胃癌侵袭转移的发生机制是近几年的研究热点, MMP-14蛋白作为肿瘤细胞入侵的关键酶, 与COX-2蛋白是否共同参与胃癌的侵袭转移过程进而促进胃癌的发生发展亟待研究, 阐明MMP-14蛋白和COX-2蛋白在胃癌侵袭和转移中的作用显得十分重要.
Hu等在乳腺癌细胞中证实COX-2的过度表达可以上调MMP-14的表达, 而用COX-2抑制剂作用肿瘤细胞后, 细胞的侵袭能力相对于对照组明显降低, Annabi等在恶性胶质瘤细胞中再次证实COX-2和MMP-14之间确实存在着某种关联, NF-κB通路介导的COX-2的表达可能是MMP-14的一个重要调控点, 但是在胃癌中两者的相互关系尚有待于进一步的研究.
已有研究证实COX-2高表达的肿瘤细胞可伴有MMPs表达的显著增高. 目前关于MMP-14和COX-2在胃癌侵袭转移机制中的研究尚未见报道. 我们的研究证实了胃癌组织中存在COX-2、MMP-14的高表达且呈正相关关系, MMP-14和COX-2的蛋白表达与胃癌浸润深度、TNM分期相关, 并且随着TNM分期的增加, MMP-14表达增加且有从胞浆向胞膜转位的趋势.
COX-2促进胃癌浸润、转移的途径之一可能是通过诱导MMPs的释放, 尤其是MMP-14表达上调而增加胃癌的侵袭力. 依据本实验的研究结果, 对COX-2和MMP-14的深入研究有助于进一步揭示胃癌的发生发展机制, 并对胃癌的诊治提供依据.
本文选题新颖, 统计合理, 方法科学, 结论可靠, 具有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Lin Y, Ueda J, Kikuchi S, Totsuka Y, Wei WQ, Qiao YL, Inoue M. Comparative epidemiology of gastric cancer between Japan and China. World J Gastroenterol. 2011;17:4421-4428. [PubMed] [DOI] |
| 3. | Shi F, Sottile J. MT1-MMP regulates the turnover and endocytosis of extracellular matrix fibronectin. J Cell Sci. 2011;124:4039-4050. [PubMed] [DOI] |
| 4. | Curran S, Murray GI. Matrix metalloproteinases: molecular aspects of their roles in tumour invasion and metastasis. Eur J Cancer. 2000;36:1621-1630. [PubMed] [DOI] |
| 5. | Cheng J, Fan XM. Role of cyclooxygenase-2 in gastric cancer development and progression. World J Gastroenterol. 2013;19:7361-7368. [PubMed] [DOI] |
| 6. | Almeida PR, Ferreira FV, Santos CC, Rocha-Filho FD, Feitosa RR, Falcão EA, Cavada BK, Lima-Júnior RC, Ribeiro RA. Immunoexpression of cyclooxygenase-2 in primary gastric carcinomas and lymph node metastases. World J Gastroenterol. 2012;18:778-784. [PubMed] [DOI] |
| 7. | Rao DS, Gui D, Koski ME, Popoviciu LM, Wang H, Reiter RE, Said JW. An inverse relation between COX-2 and E-cadherin expression correlates with aggressive histologic features in prostate cancer. Appl Immunohistochem Mol Morphol. 2006;14:375-383. [PubMed] [DOI] |
| 8. | Dicken BJ, Graham K, Hamilton SM, Andrews S, Lai R, Listgarten J, Jhangri GS, Saunders LD, Damaraju S, Cass C. Lymphovascular invasion is associated with poor survival in gastric cancer: an application of gene-expression and tissue array techniques. Ann Surg. 2006;243:64-73. [PubMed] [DOI] |
| 9. | Aalinkeel R, Nair BB, Reynolds JL, Sykes DE, Mahajan SD, Chadha KC, Schwartz SA. Overexpression of MMP-9 contributes to invasiveness of prostate cancer cell line LNCaP. Immunol Invest. 2011;40:447-464. [PubMed] [DOI] |
| 10. | Kumar B, Koul S, Petersen J, Khandrika L, Hwa JS, Meacham RB, Wilson S, Koul HK. p38 mitogen-activated protein kinase-driven MAPKAPK2 regulates invasion of bladder cancer by modulation of MMP-2 and MMP-9 activity. Cancer Res. 2010;70:832-841. [PubMed] [DOI] |
| 11. | Joergensen MT, Brünner N, De Muckadell OB. Comparison of circulating MMP-9, TIMP-1 and CA19-9 in the detection of pancreatic cancer. Anticancer Res. 2010;30:587-592. [PubMed] |
| 12. | Zarrabi K, Dufour A, Li J, Kuscu C, Pulkoski-Gross A, Zhi J, Hu Y, Sampson NS, Zucker S, Cao J. Inhibition of matrix metalloproteinase 14 (MMP-14)-mediated cancer cell migration. J Biol Chem. 2011;286:33167-33177. [PubMed] [DOI] |
| 13. | 江 州华, 吴 生华, 李 小强, 俞 继卫, 姜 波健. Wnt5a、MMP2和MMP14在胃癌中的表达及其对临床病理特征的影响. 中国普外基础与临床杂志. 2010;17:1077-1082. |
| 14. | Zheng L, Li D, Xiang X, Tong L, Qi M, Pu J, Huang K, Tong Q. Methyl jasmonate abolishes the migration, invasion and angiogenesis of gastric cancer cells through down-regulation of matrix metalloproteinase 14. BMC Cancer. 2013;13:74. [PubMed] [DOI] |
| 15. | Poincloux R, Lizárraga F, Chavrier P. Matrix invasion by tumour cells: a focus on MT1-MMP trafficking to invadopodia. J Cell Sci. 2009;122:3015-3024. [PubMed] [DOI] |
| 16. | Hu M, Peluffo G, Chen H, Gelman R, Schnitt S, Polyak K. Role of COX-2 in epithelial-stromal cell interactions and progression of ductal carcinoma in situ of the breast. Proc Natl Acad Sci U S A. 2009;106:3372-3377. [PubMed] [DOI] |
| 17. | Annabi B, Laflamme C, Sina A, Lachambre MP, Béliveau R. A MT1-MMP/NF-kappaB signaling axis as a checkpoint controller of COX-2 expression in CD133+ U87 glioblastoma cells. J Neuroinflammation. 2009;6:8. [PubMed] [DOI] |
| 18. | Akla N, Pratt J, Annabi B. Concanavalin-A triggers inflammatory response through JAK/STAT3 signalling and modulates MT1-MMP regulation of COX-2 in mesenchymal stromal cells. Exp Cell Res. 2012;318:2498-2506. [PubMed] [DOI] |