修回日期: 2014-04-03
接受日期: 2014-04-09
在线出版日期: 2014-05-28
目的: 探讨肝细胞癌(hepatocellular carcinoma, HCC)组织内及体外细胞培养中磷脂酰肌醇蛋白聚糖-3(glypican-3, GPC3)与细胞增殖的关系.
方法: 采用免疫组织化学方法检测54例HCC组织中GPC3的表达, 并对比其与Ki-67标记指数及各种临床病理参数的关系. 使用shRNA抑制SMMC7721肝癌细胞系中GPC3的表达, MTT检测肝癌细胞的增殖变化.
结果: 在HCC组织中, GPC3与Ki-67指数有关(r = 0.521, P = 0.000), 也与分化程度、血管浸润情况具有相关性(r = 0.287, 0.289; P = 0.035, 0.034). 体外实验结果显示, 抑制GPC3表达后, 实验组细胞增殖活性明显低于阴性对照组和空白对照组(F = 45.38, P = 0.000).
结论: GPC3在HCC的发生、发展和浸润过程中起重要作用, 主要与影响肝癌细胞增殖有关.
核心提示: Ki-67在肝细胞癌(hepatocellular carcinoma, HCC)中表达越高, 预后越差. 磷脂酰肌醇蛋白聚糖-3(glypican-3, GPC3)的表达强度与分化程度有关, 且与Ki-67有明显正相关关系. 通过抑制GPC3基因在SMMC7721细胞系的表达, 对肝癌细胞系的增殖有明显抑制作用, GPC3过表达在肝细胞癌增殖过程中起直接促进作用.
引文著录: 李海荣, 黄兰姗, 陈罡, 陆会平, 冯振博. GPC3与肝癌细胞增殖的相关性. 世界华人消化杂志 2014; 22(15): 2108-2115
Revised: April 3, 2014
Accepted: April 9, 2014
Published online: May 28, 2014
AIM: To investigate the relationship between GPC3 expression and proliferative ability of hepatocellular carcinoma (HCC) cells.
METHODS: Immunohistochemistry was employed to detect the expression of GPC3 in 54 HCC tissues. The correlation between GPC3 expression and Ki-67 labeling index and other clinicopathologic characteristics was studied. An shRNA targeting the GPC3 gene was transfected into SMMC7721 cells to silence GPC3 expression. MTT assay was performed to determine the effect of GPC3 knockdown on the growth of HCC SMMC7721 cells.
RESULTS: GPC3 expression was significantly correlated with Ki-67 Li (r = 0.521, P = 0.000). GPC3 expression was related to differentiation degree and vessel invasion of HCC (r = 0.287, 0.289; P = 0.035, 0.034). The cell proliferative activity was significantly reduced in the GPC3-shRNA group compared with the negative control group and blank control group (F = 45.38, P = 0.000).
CONCLUSION: GPC3 may play an important role in the occurrence, development and invasion of HCC, mainly due to the effect on the proliferation of HCC cells.
- Citation: Li HR, Huang LS, Chen G, Lu HP, Feng ZB. Correlation between GPC3 expression and proliferation of hepatocellular carcinoma cells. Shijie Huaren Xiaohua Zazhi 2014; 22(15): 2108-2115
- URL: https://www.wjgnet.com/1009-3079/full/v22/i15/2108.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i15.2108
磷脂酰肌醇蛋白聚糖-3(glypican-3, GPC3)是一种膜性硫酸乙酰肝素蛋白多糖, 通过磷脂酰肌醇锚定在细胞膜上, 并通过结合多种细胞表面生长因子来调控细胞生长、增殖、分化、黏附和迁移等行为. 近年来, 研究发现, GPC3可成为肝细胞癌(hepatocellular carcinoma, HCC)的一个新的肿瘤标志物[1]. 因此, 深入研究GPC3在肝癌发生、发展中的作用, 对于揭示肝癌形成及发展的机制具有重要意义.
细胞生长各个阶段的变化是肿瘤发生发展的重要因素, 细胞增殖失控的结果是肿瘤细胞数量的增多, 导致肿瘤的生长, 进而引发肿瘤细胞的转移. 肿瘤细胞的增殖状态及增殖能力是评判肿瘤生物学行为的重要指标. Ki-67是一种抗核增殖细胞核蛋白的单克隆抗体, 其表达于细胞周期的各个活跃时期, 而在静止期表达消失, 被认为是细胞增殖活性的标志物[2]. 本研究采用免疫组织化学方法检测HCC组织中GPC3的表达, 对比其与Ki-67标记指数及各种临床病理参数的关系; 并进一步在体外实验中使用RNA干扰技术抑制SMMC7721肝癌细胞GPC3的表达, 检测干扰后HCC细胞的增殖变化, 探索GPC3与肿瘤细胞增殖的关系, 为HCC的预防和治疗提供新的思路.
收集2010-01/2011-12广西医科大学第一附属医院病理科HCC及相应癌旁肝组织蜡块标本54例, 其中男性47例, 女性7例, 年龄24-74岁, 平均年龄48岁. 参照WHO肿瘤分类与诊断标准2010版进行分级, 将分化程度分高、中、低分化3组. 所有病例病理资料完整, 患者术前均未行放、化疗及免疫治疗. GPC3、血管内皮生长因子(vascular endothelial growth factor, VEGF)、Ki-67、nm23即用型抗体、DAB显色剂购自中杉金桥生物技术有限公司. SMMC7721肝癌细胞系购自中国科学院上海生科院细胞资源中心细胞库; 质粒的构建和包装购自上海吉凯公司; 1640培养基、胎牛血清购自WISENT公司; Lipofectime 2000转染试剂购自Invitrogen公司; 细胞总RNA提取试剂盒购自Axygen公司; 逆转录试剂盒购自Fermentas公司.
1.2.1 免疫组织化学法: 采用免疫组织化学SP法: 操作步骤按照试剂盒说明书进行. 用经预实验证明阳性表达的胃癌组织作为阳性对照, PBS代替一抗作为阴性对照.
1.2.2 结果判断: 采用双评分半定量方法, 细胞核和/细胞质出现淡黄色、棕黄色或棕褐色染色为阳性细胞. 每张切片随机选取5个高倍视野(×400), 每个视野数100个细胞, 按阳性细胞所占百分比评分[3]: ≤5%为0; 6%-25%为1; 26%-50%为2; 51%-75%为3; ≥76%为4. 其次染色强度评分: 不着色为0; 淡黄色为1; 棕黄色为2; 棕褐色为3. 最后将染色强度与阳性细胞所占百分比计分乘积定为每1例染色的综合评分, 0-2分为(-), 3-5分为(+), 6-9分为(++), 10-12分为(+++), 所有-、+、++、+++分别对应阴性、弱阳性、中等阳性、强阳性.
1.2.3 细胞培养和转染: 人肝癌细胞系SMMC7721培养于含10%胎牛血清的1640培养基, 37 ℃、50 mL/L CO2条件下培养. 将shRNA转染至人肝癌细胞系SMMC7721, 于转染前24 h将对数生长期细胞接种于24孔板, 细胞数为5×104个/孔; 用opti-mem减血清培养基培养24 h后, 细胞融合率达到80%即进行转染; 转染6 h后换含10%胎牛血清1640培养基继续培养. 细胞分3组: 空白对照组(未转染组)、阴性对照组(空载质粒组)和实验组(GPC3-shRNA转染组)于荧光显微镜下观察24、48、72 h转染效果.
1.2.4 RT-PCR检测基因表达: 应用Primer 5.0设计软件设计引物, (1)GPC3: 上游, TCCGCTCCTTCTTCCAGAGA; 下游, ATGTTGGGCCCTTAGGGAGA; (2)β-actin: 上游, GCACCACACCTTCTACAATGAGC; 下游, GGATAGCACAGCCTGGATAGCAAC; PCR反应条件为: 95 ℃预变性3 min, 95 ℃变性30 s, 54 ℃退火30 s, 72 ℃延伸1 min, 72 ℃再延伸7 min, 4 ℃ ∞; GPC3为35个循环; β-actin为28个循环. 引物均由美国Invitrogen公司合成. 细胞总RNA提取按照Axygen提取试剂盒说明书完成, 各取总RNA 0.8 µg逆转录获得cDNA, 以β-actin为内参, 进行PCR反应. PCR产物以18 g/L琼脂糖凝胶电泳, 核酸染料染色. 应用Bio-Rad凝胶成像系统分析, PCR产物量以光密度/面积表示, 以GPC3产物量/β-actin产物量的比值为最终结果, 重复3次.
1.2.5 MTT法检测细胞增殖: 取对数生长期的各组细胞接种于96孔板, 计数1.5×103个细胞/孔, 每组细胞做5个复孔; 分别于种板后24、48、72、96 h加入10 µL MTT溶液; 培养箱中孵育4 h后, 小心吸尽培养液, 每孔加入150 µL DMSO; 酶标仪检测570 nm处吸光度(A)值, 绘制生长曲线.
统计学处理 采用SPSS16.0统计软件对数据进行分析. 计量资料采用方差分析, GPC3与临床参数关系采用χ2检验或Fisher确切概率法, 相关性分析用Spearman等级相关分析, 检验水准α = 0.05. P<0.05为差异有统计学意义.
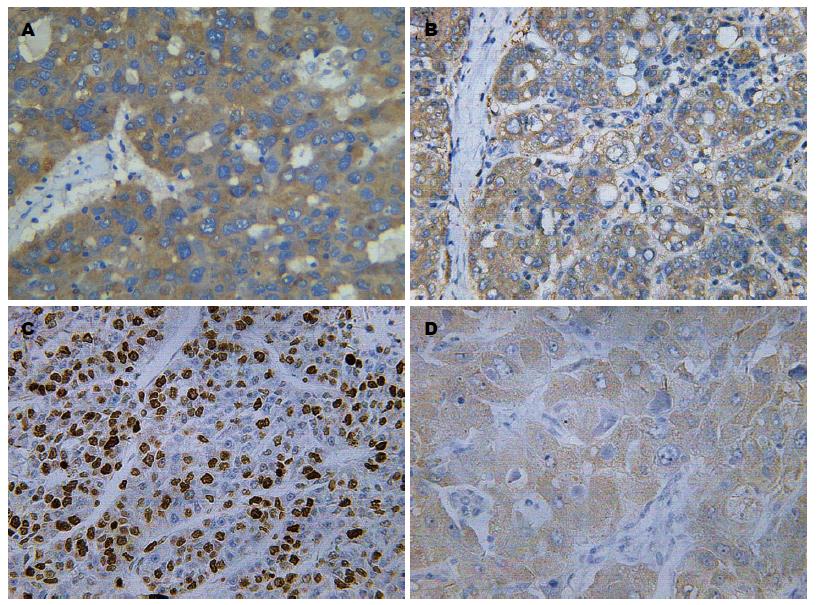
GPC3在HCC组织中表达定位于细胞质中(图1A), 其阳性率为72%(39/54)明显高于癌旁组织(5%, 3/54, P = 0.000). 经χ2检验或Fisher确切概率法分析GPC3的表达水平在HCC组织分化程度、血管癌栓中的表达差异显著(表1). 经Spearman相关性分析GPC3与其二者有关(r = 0.287, 0.289; P = 0.035, 0.034), 与患者性别、年龄、是否有肝硬化、肿瘤大小、肿瘤数目、AFP、HBsAg、nm23的表达无关(P>0.05).
| 分组 | GPC3 | χ2 | P值 | |||
| - | + | ++ | +++ | |||
| 性别 | 0.770 | 0.950 | ||||
| 男 | 13 | 10 | 12 | 12 | ||
| 女 | 2 | 2 | 2 | 1 | ||
| 年龄(岁) | 1.794 | 0.616 | ||||
| <50 | 10 | 7 | 10 | 9 | ||
| ≥50 | 5 | 5 | 4 | 4 | ||
| 肿瘤大小(cm) | 0.779 | 0.914 | ||||
| <5 | 5 | 4 | 3 | 4 | ||
| ≥5 | 10 | 8 | 11 | 9 | ||
| 肿瘤数目 | 5.411 | 0.146 | ||||
| 多发 | 6 | 1 | 7 | 3 | ||
| 单发 | 9 | 11 | 7 | 10 | ||
| 分化程度 | 10.289 | 0.049 | ||||
| 高分化 | 14 | 8 | 6 | 8 | ||
| 中分化 | 1 | 3 | 7 | 5 | ||
| 低分化 | 0 | 1 | 1 | 0 | ||
| 血管癌栓 | 4.418 | 0.023 | ||||
| 有 | 7 | 5 | 5 | 1 | ||
| 无 | 8 | 7 | 9 | 12 | ||
| 肝硬化 | 1.327 | 0.275 | ||||
| 有 | 7 | 6 | 4 | 4 | ||
| 无 | 8 | 6 | 10 | 9 | ||
| 组织分型 | 8.500 | 0.470 | ||||
| 混合细胞型 | 3 | 2 | 3 | 4 | ||
| 梁索型 | 9 | 10 | 7 | 4 | ||
| 腺样型 | 1 | 0 | 2 | 2 | ||
| 透明细胞型 | 2 | 0 | 2 | 3 | ||
| 肝硬化 | 1.993 | 0.574 | ||||
| 无 | 8 | 6 | 10 | 9 | ||
| 有 | 7 | 6 | 4 | 4 | ||
| AFP | 1.523 | 0.677 | ||||
| (-) | 7 | 4 | 7 | 4 | ||
| (+) | 8 | 8 | 7 | 9 | ||
| HBsAg | 4.097 | 0.251 | ||||
| (-) | 8 | 6 | 3 | 4 | ||
| (+) | 7 | 6 | 11 | 9 | ||
| nm23 | 6.986 | 0.645 | ||||
| - | 1 | 0 | 1 | 0 | ||
| + | 4 | 5 | 5 | 9 | ||
| ++ | 6 | 4 | 4 | 2 | ||
| +++ | 4 | 3 | 4 | 2 | ||
| VEGF | 5.011 | 0.843 | ||||
| - | 3 | 1 | 1 | 2 | ||
| + | 4 | 5 | 3 | 4 | ||
| ++ | 4 | 4 | 7 | 6 | ||
| +++ | 4 | 2 | 3 | 1 | ||
HCC组织中GPC3的表达水平与Ki-67呈明显相关性(r = 0.521, P = 0.000); HCC组织中nm23的表达水平与Ki-67、VEGF表达均无相关性(P>0.05). Ki-67表达强度与VEGF表达呈显著正相关(r = 0.353, P = 0.009)(表2).
| GPC3 | P值 | VEGF | P值 | nm23 | P值 | ||||||||||
| - | + | ++ | +++ | - | + | ++ | +++ | - | + | ++ | +++ | ||||
| Ki-67 | 0.000 | 0.009 | 0.518 | ||||||||||||
| - | 8 | 2 | 0 | 2 | 5 | 4 | 0 | 3 | 0 | 5 | 4 | 3 | |||
| + | 2 | 9 | 1 | 2 | 0 | 9 | 3 | 2 | 0 | 7 | 4 | 3 | |||
| ++ | 5 | 1 | 12 | 4 | 1 | 2 | 16 | 3 | 2 | 6 | 8 | 6 | |||
| +++ | 0 | 0 | 1 | 5 | 1 | 1 | 2 | 2 | 0 | 5 | 0 | 1 | |||
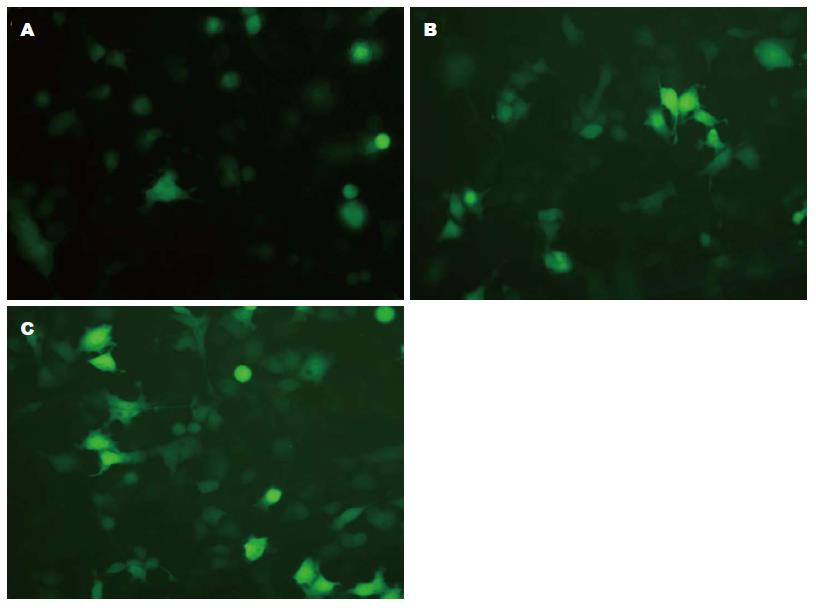
2.3.1 细胞转染效率: SMMC7721细胞转染荧光阴性对照质粒后, 在荧光显微镜下观察发现24、48、72 h荧光表达逐渐增多(图2).
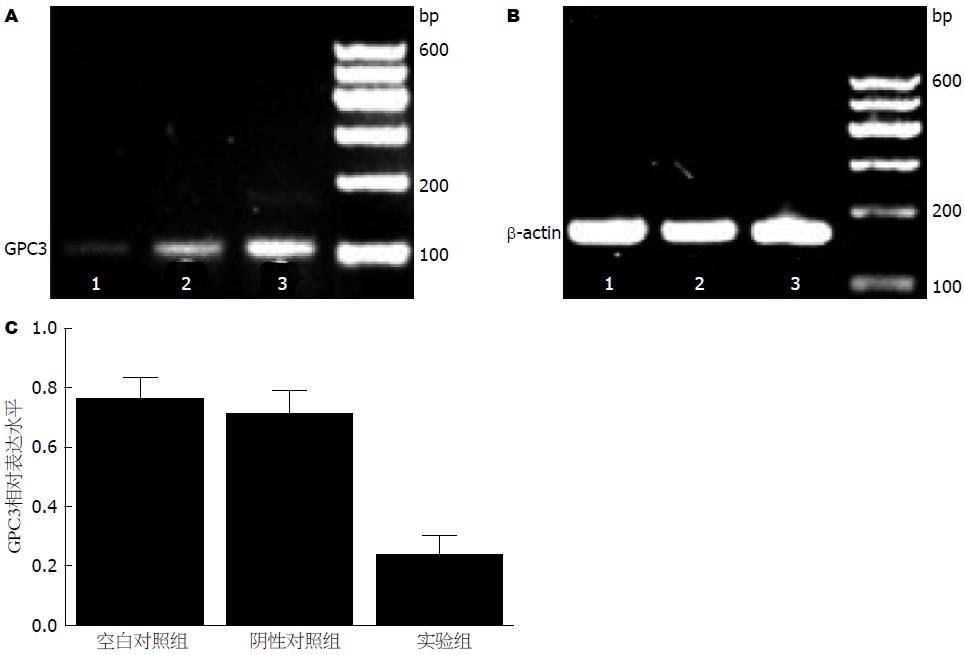
2.3.2 RT-PCR检测GPC3 mRNA表达量: 相对空白对照组和阴性对照组, 实验组GPC3 mRNA表达受到抑制(0.233±0.066 vs 0.760±0.072, 0.707±0.083, F = 45.38, P = 0.000)(图3).
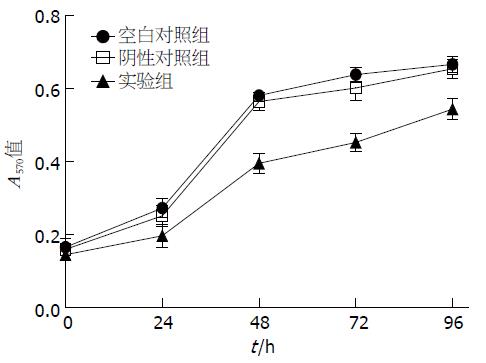
2.3.3 细胞增殖活性判定: 与空白对照组和阴性对照组相比, 实验组细胞570 nm处的A值在转染24、48、72、96 h时的差异均具有统计学意义(P<0.01). 由此可见, 实验组细胞生长受到明显抑制(表3, 图4).
| 分组 | 空白对照组 | 阴性对照组 | 实验组 | F值 | P值 | |
| 24 h | 0.273±0.027 | 0.252±0.029 | 0.197±0.032 | 6.195 | 0.004 | |
| 48 h | 0.581±0.016 | 0.565±0.026 | 0.396±0.027 | 96.239 | 0.000 | |
| 72 h | 0.639±0.018 | 0.603±0.036 | 0.453±0.025 | 65.318 | 0.000 | |
| 96 h | 0.667±0.022 | 0.655±0.027 | 0.544±0.029 | 33.731 | 0.000 | |
目前, GPC3与肝癌临床病理关系已成为研究的热点[4,5]. 在生理状态下, GPC3多在胚胎、胎儿时期表达, 出生后仅少数器官低表达, 并且与多种恶性肿瘤的发生发展密切相关[6,7], 在肺癌[8]、乳腺癌[9]、胃癌[10]等的表达下降, 而在HCC、黑色素瘤等组织中高表达. Abdul-Al等[11]发现在原发性肝癌患者中阳性率为72%. Ligato等[12]认为GPC3是一个高度敏感的肿瘤标志物, 可用于区别原发性肝癌与其他良恶性肝肿瘤和转移灶. 本研究结果显示, HCC组织中GPC3的表达明显高于癌旁肝组织(P = 0.000), 阳性率为72%(39/54), 与患者性别、年龄、肝硬化、肿瘤大小、肿瘤数目、AFP、HBsAg无关. 在影响预后因素的研究中[13], 血管癌栓被认为是反映术后复发和转移的最准确的预后指标. 本研究发现, GPC3的表达强度与血管癌栓有关, 提示GPC3在肝细胞癌侵袭、转移过程中发挥重要作用. 并且在肝细胞癌的预后研究中, 有报道[14]指出GPC3是肝癌术后早期复发的独立危险因子, 而且Shirakawa等[15]指出GPC3表达强度越高, 其促进肝细胞癌增殖、复发转移的可能性越大.
肿瘤细胞异常增殖、转移的产生总是与多种基因的协同表达有关[16]. 因此, 为了完成转移, 肿瘤细胞的每一步都会由不同的基因调控. nm23是第一个发现与转移抑制相关的基因[17], 其表达水平的下降和胃癌[18]、黑色素瘤[19]、乳腺癌[20]的转移与不良预后有密切关系. Nakayama等[21]也提出nm23与肝癌转移有关. nm23基因产物主要表达于细胞浆, 细胞膜少量表达, 其数量的变化影响肿瘤细胞对周围组织及基质的附着能力, 从而影响癌转移过程. GPC3主要由癌细胞合成、分泌, 而本研究结果显示nm23蛋白主要定位于细胞浆, 这可能提示二者在调节肿瘤转移方面存在某种内在联系. 但本研究显示, GPC3表达强度与nm23表达强度之间并无相关性, 故不能确切地证明GPC3和nm23在HCC中表达的相关性, 也说明二者在控制癌细胞转移方面可能不存在直接的相互调节. 对于GPC3和nm23之间无直接相互作用调节HCC转移复发的现象, 可以用他们不同的生化机制来解释. GPC3过表达可致β-catenin显著增高, 与MMP及增殖信号结合, 促进HCC发展[22]. 关于nm23的作用机制, 多数学者认为nm23蛋白可通过与GAP蛋白相互作用[23], 从而调节细胞信号传递、细胞分化和转移等过程中发挥作用, 且与NDPK具有同源性, 可使NTP变成NDP.
增殖细胞核抗原Ki-67的表达被认为控制细胞的增殖周期, 利用Ki-67标记指数可以检测肿瘤细胞的增殖能力. 其抗原表达仅分布在细胞核内, 被认为与有丝分裂密切相关, 能全面反映细胞群体的增殖活性[24]. Ki-67在HCC中的表达情况还与预后有关[25], 表达越高, 预后越差. 实验证实, GPC3的表达强度与分化程度有关, GPC3在低分化HCC组的阳性率高于高分化HCC组的阳性率, 表明GPC3与肿瘤的恶性程度有关; 另外, 本实验通过检测GPC3在组织中的表达情况及细胞功能学实验的结果显示, GPC3在HCC中的表达强度与Ki-67有明显正相关关系, GPC3高表达组Ki-67指数明显增高(P<0.01). 通过抑制GPC3基因在SMMC7721细胞系的表达情况后, 我们发现, 对肝细胞癌增殖具有明显抑制作用(P<0.01), 提示GPC3的过表达在肝细胞癌增殖过程中起直接促进作用.
肿瘤细胞的增殖、转移依赖肿瘤的血管新生过程. 研究显示, 当越多的微血管在肿瘤组织内形成, 肿瘤细胞的增殖能力越强就越有可能进入血液循环[26]. 目前, VEGF为血管内皮细胞特异的标志物, 在肝细胞癌血管生成中起促进作用[27]. 本研究中VEGF的阳性率为87%(47/54), 提示有大量的新血管生成, 为快速生长的癌细胞提供足够的营养, 对癌细胞在血管中的转移起重要作用. 本研究结果表明, GPC3在HCC中的表达与VEGF无相关性, 而Ki-67的表达水平与VEGF相关, 提示GPC3可能并不是直接影响VEGF促进血管生成, 导致肝癌细胞增殖、转移; 可能通过调节胰岛素样生长因子2(insulin-like growth factor-Ⅱ, IGF2)[28]、Wnt[29]等信号通路来调节HCC细胞的增殖、分化、黏附和转移, 间接引起大量血管新生, 影响肝癌细胞的转移. 因此, GPC3促进HCC的转移今后可能应更多从信号通路方面进行探讨.
原发性肝癌的致死率主要就在肝癌术后复发转移上, GPC3的过表达在HCC发生、发展及术后复发转移[30]过程中具有重要作用, 其作为分子治疗的靶点[31]在进入临床治疗阶段之前依然需要更多基础及临床实验支持, 相信对GPC3的进一步研究能有助于我们对肝癌更深层的认识, 为肝癌的诊断、治疗提供更多手段.
磷脂酰肌醇蛋白聚糖-3(glypican-3, GPC3)肝细胞癌(hepatocellular carcinoma, HCC)患者过度表达的癌抗原之一, 初步展示出作为新的肝癌蛋白类标志物的临床应用价值. 然而, GPC3对肝癌细胞生长的作用及具体机制报道不一, 本研究采用检测临床组织表达和体外功能实验的方法深入研究GPC3促进HCC发生发展的分子机制, 探讨GPC3在肝细胞癌增殖中的价值具有重要的意义.
潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院干细胞与组织器官工程研究中心
GPC3是glypican家族的一员, 通过磷脂酰肌醇锚定在细胞膜上, 通过结合多种细胞表面生长因子而调控细胞生长、增殖、分化、黏附和迁移等行为. 目前其研究的热点主要为调控基因表达的机制以及肿瘤靶向基因治疗的作用, 但关于GPC3在肝细胞癌增殖、转移及复发中的作用及具体机制报道不一, 组织标本检测与体外实验的联合能够比较系统的为GPC3在肝细胞癌增殖、转移的作用提供新的实验证据.
Ligato等认为GPC3可用于区别原发性肝癌与其他良恶性肝肿瘤和转移灶, Shirakawa等指出GPC3表达强度与肝细胞癌增殖复发相关. 但杜经丽等对185例肝癌患者中临床病理情况进行生存分析, 发现GPC3与术后复发无明显关系.
关于GPC3与肝细胞癌的作用研究较多, 而关于GPC3与Ki-67、VEGF、nm23等临床病理参数之间的关系报道较少, 本研究通过组织标本检测与体外实验的联合对GPC3促进肝细胞癌增殖、转移提供更多实验依据.
GPC3的过表达在HCC增殖、转移及术后复发过程中具有重要作用, 其作为分子治疗的靶点在进入临床治疗阶段之前依然需要更多基础及临床实验的支持.
该论文通过组织标本检测与体外实验证明了GPC3与肝癌细胞增殖的关系, 对阐明GPC3在肝细胞癌生长中的作用提出了新证据.
编辑: 田滢 电编:鲁亚静
| 1. | Wang XY, Degos F, Dubois S, Tessiore S, Allegretta M, Guttmann RD, Jothy S, Belghiti J, Bedossa P, Paradis V. Glypican-3 expression in hepatocellular tumors: diagnostic value for preneoplastic lesions and hepatocellular carcinomas. Hum Pathol. 2006;37:1435-1441. [PubMed] [DOI] |
| 2. | Persico M, Perrotta S, Persico E, Terracciano L, Folgori A, Ruggeri L, Nicosia A, Vecchione R, Mura VL, Masarone M. Hepatitis C virus carriers with persistently normal ALT levels: biological peculiarities and update of the natural history of liver disease at 10 years. J Viral Hepat. 2006;13:290-296. [PubMed] [DOI] |
| 3. | Hao XP, Willis JE, Pretlow TG, Rao JS, MacLennan GT, Talbot IC, Pretlow TP. Loss of fragile histidine triad expression in colorectal carcinomas and premalignant lesions. Cancer Res. 2000;60:18-21. [PubMed] |
| 4. | Llovet JM, Chen Y, Wurmbach E, Roayaie S, Fiel MI, Schwartz M, Thung SN, Khitrov G, Zhang W, Villanueva A. A molecular signature to discriminate dysplastic nodules from early hepatocellular carcinoma in HCV cirrhosis. Gastroenterology. 2006;131:1758-1767. [PubMed] [DOI] |
| 5. | Sun CK, Chua MS, He J, So SK. Suppression of glypican 3 inhibits growth of hepatocellular carcinoma cells through up-regulation of TGF-β2. Neoplasia. 2011;13:735-747. [PubMed] |
| 6. | Iglesias BV, Centeno G, Pascuccelli H, Ward F, Peters MG, Filmus J, Puricelli L, de Kier Joffé EB. Expression pattern of glypican-3 (GPC3) during human embryonic and fetal development. Histol Histopathol. 2008;23:1333-1340. [PubMed] |
| 7. | Baumhoer D, Tornillo L, Stadlmann S, Roncalli M, Diamantis EK, Terracciano LM. Glypican 3 expression in human nonneoplastic, preneoplastic, and neoplastic tissues: a tissue microarray analysis of 4,387 tissue samples. Am J Clin Pathol. 2008;129:899-906. [PubMed] [DOI] |
| 8. | Kim H, Xu GL, Borczuk AC, Busch S, Filmus J, Capurro M, Brody JS, Lange J, D'Armiento JM, Rothman PB. The heparan sulfate proteoglycan GPC3 is a potential lung tumor suppressor. Am J Respir Cell Mol Biol. 2003;29:694-701. [PubMed] |
| 9. | Xiang YY, Ladeda V, Filmus J. Glypican-3 expression is silenced in human breast cancer. Oncogene. 2001;20:7408-7412. [PubMed] [DOI] |
| 10. | Zhu Z, Friess H, Kleeff J, Wang L, Wirtz M, Zimmermann A, Korc M, Büchler MW. Glypican-3 expression is markedly decreased in human gastric cancer but not in esophageal cancer. Am J Surg. 2002;184:78-83. [PubMed] [DOI] |
| 11. | Abdul-Al HM, Makhlouf HR, Wang G, Goodman ZD. Glypican-3 expression in benign liver tissue with active hepatitis C: implications for the diagnosis of hepatocellular carcinoma. Hum Pathol. 2008;39:209-212. [PubMed] [DOI] |
| 12. | Ligato S, Mandich D, Cartun RW. Utility of glypican-3 in differentiating hepatocellular carcinoma from other primary and metastatic lesions in FNA of the liver: an immunocytochemical study. Mod Pathol. 2008;21:626-631. [PubMed] [DOI] |
| 15. | Shirakawa H, Suzuki H, Shimomura M, Kojima M, Gotohda N, Takahashi S, Nakagohri T, Konishi M, Kobayashi N, Kinoshita T. Glypican-3 expression is correlated with poor prognosis in hepatocellular carcinoma. Cancer Sci. 2009;100:1403-1407. [PubMed] [DOI] |
| 16. | Song HY, Liu YK, Feng JT, Cui JF, Dai Z, Zhang LJ, Feng JX, Shen HL, Tang ZY. Proteomic analysis on metastasis-associated proteins of human hepatocellular carcinoma tissues. J Cancer Res Clin Oncol. 2006;132:92-98. [PubMed] [DOI] |
| 17. | de la Rosa A, Williams RL, Steeg PS. Nm23/nucleoside diphosphate kinase: toward a structural and biochemical understanding of its biological functions. Bioessays. 1995;17:53-62. [PubMed] [DOI] |
| 18. | Radović S, Dorić M, Hukić A, Babić M, Kuskunović S, Spahović N. Immunohistochemical expression and significance of NM23 suppressor protein in primary gastric adenocarcinoma. Bosn J Basic Med Sci. 2013;13:72-77. [PubMed] |
| 19. | Jarrett SG, Novak M, Harris N, Merlino G, Slominski A, Kaetzel DM. NM23 deficiency promotes metastasis in a UV radiation-induced mouse model of human melanoma. Clin Exp Metastasis. 2013;30:25-36. [PubMed] [DOI] |
| 20. | Terasaki-Fukuzawa Y, Kijima H, Suto A, Takeshita T, Iezumi K, Sato S, Yoshida H, Sato T, Shimbori M, Shiina Y. Decreased nm23 expression, but not Ki-67 labeling index, is significantly correlated with lymph node metastasis of breast invasive ductal carcinoma. Int J Mol Med. 2002;9:25-29. [PubMed] [DOI] |
| 21. | Nakayama T, Ohtsuru A, Nakao K, Shima M, Nakata K, Watanabe K, Ishii N, Kimura N, Nagataki S. Expression in human hepatocellular carcinoma of nucleoside diphosphate kinase, a homologue of the nm23 gene product. J Natl Cancer Inst. 1992;84:1349-1354. [PubMed] [DOI] |
| 22. | Akutsu N, Yamamoto H, Sasaki S, Taniguchi H, Arimura Y, Imai K, Shinomura Y. Association of glypican-3 expression with growth signaling molecules in hepatocellular carcinoma. World J Gastroenterol. 2010;16:3521-3528. [PubMed] [DOI] |
| 23. | Zhu J, Tseng YH, Kantor JD, Rhodes CJ, Zetter BR, Moyers JS, Kahn CR. Interaction of the Ras-related protein associated with diabetes rad and the putative tumor metastasis suppressor NM23 provides a novel mechanism of GTPase regulation. Proc Natl Acad Sci U S A. 1999;96:14911-14918. [PubMed] [DOI] |
| 24. | Pizem J, Marolt VF, Luzar B, Cör A. Proliferative and apoptotic activity in hepatocellular carcinoma and surrounding non-neoplastic liver tissue. Pflugers Arch. 2001;442:R174-R176. [PubMed] |
| 25. | Zheng Y, Wang L, Zhang JP, Yang JY, Zhao ZM, Zhang XY. Expression of p53, c-erbB-2 and Ki67 in intestinal metaplasia and gastric carcinoma. World J Gastroenterol. 2010;16:339-344. [PubMed] [DOI] |
| 26. | Yao DF, Zhu Y, Wu XH, Wu W, Qiu LW. [Clinical values of vascular endothelial growth factor expression and microvascular density analysis in liver cancer specimens]. Zhonghua Gan Zang Bing Za Zhi. 2004;12:92-94. [PubMed] |
| 27. | Zhang L, Wang JN, Tang JM, Kong X, Yang JY, Zheng F, Guo LY, Huang YZ, Zhang L, Tian L. VEGF is essential for the growth and migration of human hepatocellular carcinoma cells. Mol Biol Rep. 2012;39:5085-5093. [PubMed] [DOI] |
| 28. | Weichert J, Schröer A, Amari F, Siebert R, Caliebe A, Nagel I, Gillessen-Kaesbach G, Mohrmann I, Hellenbroich Y. A 1 Mb-sized microdeletion Xq26.2 encompassing the GPC3 gene in a fetus with Simpson-Golabi-Behmel syndrome Report, antenatal findings and review. Eur J Med Genet. 2011;54:343-347. [PubMed] |
| 29. | De Cat B, Muyldermans SY, Coomans C, Degeest G, Vanderschueren B, Creemers J, Biemar F, Peers B, David G. Processing by proprotein convertases is required for glypican-3 modulation of cell survival, Wnt signaling, and gastrulation movements. J Cell Biol. 2003;163:625-635. [PubMed] [DOI] |
| 30. | 姚 敏, 杨 君伶, 蔚 丹丹, 严 晓娣, 陈 洁, 姚 登福. sICAM-1和GPC-3 mRNA对肝癌诊断与转移监测的临床价值. 世界华人消化杂志. 2012;21:1927-1932. |
| 31. | Ishiguro T, Sugimoto M, Kinoshita Y, Miyazaki Y, Nakano K, Tsunoda H, Sugo I, Ohizumi I, Aburatani H, Hamakubo T. Anti-glypican 3 antibody as a potential antitumor agent for human liver cancer. Cancer Res. 2008;68:9832-9838. [PubMed] [DOI] |