Copyright
©The Author(s) 2014. Published by Baishideng Publishing Group Inc. All rights reserved.
质子泵抑制剂与酸相关性疾病
李浩, 施芳红, 刘菲, 陈浩, 王永庆, 龚晓健, 魏继福
李浩, 刘菲, 陈浩, 王永庆, 魏继福, 江苏省人民医院药学部临床药理实验室 江苏省南京市 210029
李浩, 上海交通大学医学院附属上海儿童医学中心药剂科 上海市 200127
施芳红, 上海交通大学医学院附属上海仁济医院药剂科 上海市 200127
龚晓健, 中国药科大学药理教研室 江苏省南京市 210009
魏继福, 研究员, 博士生导师, 主要从事药学与分子生物学研究及药物一期临床研究.
ORCID number: $[AuthorORCIDs]
基金项目: 国家自然科学基金资助项目, Nos. 30972822, 81273274, 81273593; 科技重大专项"呼吸病新药临床评价研究技术平台建设"基金资助项目, No. 2011ZX09302-003-02.
作者贡献分布: 李浩与施芳红主要完成论文的写作; 刘菲与陈浩提供文献的检索和筛选; 王永庆与龚晓健对论文进行审校; 魏继福设计论文的整体结构和思路.
电话: 025-68136984
收稿日期: 2013-12-13
修回日期: 2014-04-10
接受日期: 2013-04-17
在线出版日期: 2014-05-28
质子泵抑制剂主要作用于胃H+/K+-ATP酶, 从而达到抑制胃酸的目的. 临床上主要用于治疗胃酸分泌过多而引发的疾病, 如胃溃疡、十二指肠溃疡、功能性消化不良和胃食管反流病等. 本文针对质子泵抑制剂的研究进展及其在酸相关性疾病治疗中的应用进行综述.
关键词: 质子泵抑制剂; 酸相关性疾病
核心提示: 新一代质子泵抑制剂较第一代质子泵抑制剂起效快, 个体差异少, 在治疗酸相关性疾病中具有良好的应用前景. 钾竞争性酸阻滞剂虽然还未在国内广泛用于临床, 但其良好的稳定性和快速的体内作用使其具有良好的开发前景.
引文著录: 李浩, 施芳红, 刘菲, 陈浩, 王永庆, 龚晓健, 魏继福. 质子泵抑制剂与酸相关性疾病. 世界华人消化杂志 2014; 22(15): 2073-2080
H+/K+-ATPase inhibitors and acid-related disorders
Hao Li, Fang-Hong Shi, Fei Liu, Hao Chen, Yong-Qing Wang, Xiao-Jian Gong, Ji-Fu Wei
Hao Li, Fei Liu, Hao Chen, Yong-Qing Wang, Ji-Fu Wei, Research Division of Clinical Pharmacology, the First Affiliated Hospital of Nanjing Medical University, Nanjing 210029, Jiangsu Province, China
Hao Li, Department of Pharmacy, Shanghai Children's Medical Center, Shanghai Jiaotong University School of Medicine, Shanghai 200127, China
Fang-Hong Shi, Department of Pharmacy, Renji Hospital, Shanghai Jiaotong University School of Medicine, Shanghai 200127, China
Xiao-Jian Gong, Department of Pharmacology, China Pharmaceutical University, Nanjing 210009, Jiangsu Province, China
Supported by: National Natural Science Foundation of China, Nos. 30972822, 81273274 and 81273593; National Major Scientific, Technological Special Project for "Significant New Drugs Development", No. 2011ZX09302-003-02
Correspondence to: Ji-Fu Wei, Researcher, Research Division of Clinical Pharmacology, the First Affiliated Hospital of Nanjing Medical University, 300 Guangzhou Road, Gulou District, Nanjing 210029, Jiangsu Province, China. weijifu@hotmail.com
Received: December 13, 2013
Revised: April 10, 2014
Accepted: April 17, 2013
Published online: May 28, 2014
0 引言
质子泵(proton pump), 即H+/K+-ATP酶(H+/K+-ATPase), 是一种结合在细胞膜表面的, 利用ATP水解产生的能量驱动细胞膜两侧离子交换(质子、氯离子和钾离子)的P型阳离子转运体[1]. 质子泵主要存在于胃壁细胞和肾脏, 其功能各不相同. 肾脏的质子泵主要负责酸化尿液和重吸收钾[2]. 而人体内主要的质子泵存在于胃壁细胞分泌小管的细胞膜上, 其借助ATP降解提供的能量进行H+、K+交换, 特异性地将H+泵入胃腔, 酸化胃内容物, 形成胃内高酸状态[3].
质子泵抑制剂(H+/K+-ATPase inhibitors, proton pump inhibitors, PPIs), 包括不可逆性抑制质子泵的药物如替莫拉唑(timoprazole, TMZ)、奥美拉唑(omeprazole, OMZ)、兰索拉唑(lansoprazole, LSZ)、雷贝拉唑(rabeprazole, RBZ)等和可逆性抑制质子泵的钾离子竞争性拮抗剂(the K+-competitive acid pump antagonists, P-CABs/APAs). 目前, 质子泵抑制剂主要用于治疗与胃酸分泌过多有关的疾病.
1 质子泵抑制剂的种类及其发展
20世纪初, 消化性溃疡和幽门螺杆菌(Helicobactor pylori, H. pylori)的致病作用与胃酸分泌过多之间的关系被得到证实. 在组胺2受体阻断剂如西咪替丁上市前, 胃酸分泌过多一直无法得到有效地治疗. 组胺2受体阻断剂虽然可以有效的抑制胃酸分泌, 但此类药物无法防止溃疡复发, 使得患者需长期维持药物治疗, 造成绝大多数患者产生药物耐受. 20世纪初期, 胃食管反流病(gastroesophogeal reflux disease, GERD)的发病率急剧增加. 此类疾病的发病机制与胃酸分泌过多密切相关. 然而组胺受体拮抗剂并不能有效的治疗此类疾病. 1975年, 第一个以H+/K+-ATP酶为作用靶点的化合物问世. 其利用胃酸激活成活性化合物后, 与H+/K+-ATP酶共价结合, 抑制胃酸分泌. 1983年, 由TMZ修饰后得到的衍生物OMZ, 率先应用于临床研究中, 并取得了惊人的疗效. 1989年后, OMZ被广泛的用于治疗胃酸相关性疾病. 随之而来的是其他几个质子泵抑制剂包括LSZ、泮托拉唑、RBZ等[1]. 然而, 这些化合物血浆半衰期相对较短, 且需要在酸性条件下激活, 存在一定的局限性. 因此, 一种全新的质子泵抑制剂, K+竞争性质子泵拮抗剂面世. 此类化合物不依赖于酸活化, 直接与质子泵结合, 更加快速有效的抑制胃酸分泌. 虽然此类药物与不可逆抑制的质子泵抑制剂相比, 作用时间较短, 与质子泵结合是可逆的, 需在血浆中维持一定的浓度, 才能确保其有效的作用于质子泵[1]. 但是其在酸性环境中稳定, 可以制成缓释制剂延长药物的释放时间, 以减少每日的给药次数, 因此有良好的应用前景.
1.1 不可逆性质子泵抑制剂
TMZ及其衍生物吡考拉唑(picoprazole)于1978年问世. 其高度特异的作用于质子泵, 且不受细胞外分泌物(如组胺、胃泌素或乙酰胆碱)或细胞内分泌物(如双丁酰环磷腺苷)的影响[4]. 替莫拉唑除具有良好的抑制胃酸分泌的作用外, 还可抑制甲状腺中的碘化物的积累[5]. 由于替莫拉唑有引发甲状腺相关不良反应发生的风险, 替莫拉唑并没有在临床上得到广泛的应用.
第一代质子泵抑制剂包括OMZ、LSZ和泮托拉唑. OMZ为单烷氧基吡啶化合物, 是由美国食品和药物管理局(Food and Drugs Administration, FDA)批准的第一个用于临床的苯并咪唑类衍生物. 其口服生物利用度为30%-40%左右[6]. 与OMZ相比, LSZ在吡啶环4位侧链导入氟原子(F3)后, 以三氟乙氧基为取代基, 其口服生物利用度较OMZ提高了30%左右[7]. 但Krupa等[8]研究表明, 老年患者使用LSZ可能出现低镁血症, 存在一定的安全隐患. 泮托拉唑吡啶环的4-甲氧基和3-甲氧基使其在中性pH环境中更加稳定, 且与质子泵结合具有更高的选择性[9]. 但Binnetoğlu等[10]研究发现, 泮托拉唑在治疗上消化道出血的过程中会导致血小板的减少, 不建议长期使用. 第一代PPI主要通过肝脏内的细胞色素P450(cytochrome P450, CYP450)的同工酶CYP2C19和CYP3A4代谢[4]. 根据人体内CYP2C19和CYP3A4基因分型及其表达酶活性的高低, 不同个体之间存在超快代谢者(ultra metabolizers, URMs)、纯合子强代谢者(homozygote extensive metabolizers, HomEMs)、杂合子强代谢者(heterozygous extensive metabolizers, HetEMs)和弱代谢者(poor metabolizers, PMs)四种类型[11,12]. 由于第一代质子泵抑制剂的代谢与CYP2C19基因分型及其表达酶活性的高低密切相关, 导致临床上不同患者使用质子泵抑制剂后其血药浓度存在巨大差异, 致使患者间抑酸效果不一, 且容易导致药物相互作用. 此外, 第一代质子泵抑制剂不能持续性的抑制胃酸, 需要在多次给药后才能发挥最大抑酸作用, 且易出现夜间"酸突破". 因此第一代质子泵抑制剂有待进一步改善.
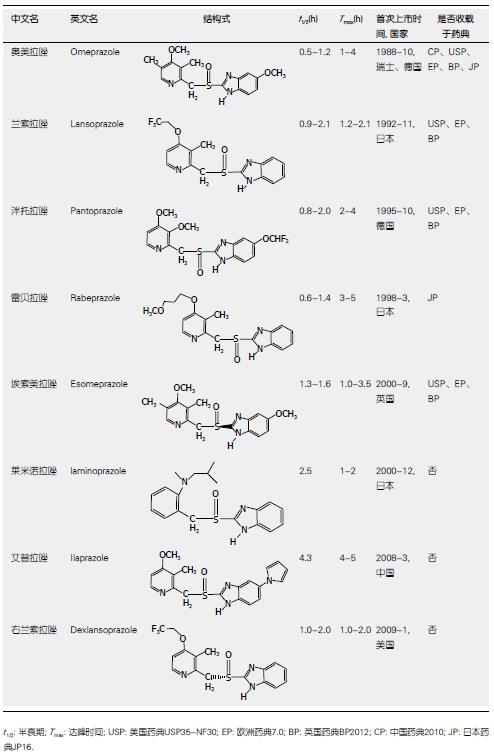
新一代质子泵抑制剂在不同程度上克服了第一代质子泵抑制剂的某些缺陷, 具有抑酸作用起效快、昼夜均可维持较高的抑酸水平、个体差异小、不良反应少且与其他药物之间较少发生相互影响. 雷贝拉唑作为新一代质子泵抑制剂的代表药, 可作用于H+/K+-ATP酶的4个部位, 具有起效快、作用持久、抑酸强度高等特点[13]. 埃索美拉唑是第一个具有单一S型异构体的光学特异的质子泵抑制剂. 由于其特殊的光学特性, 其更多地由CYP3A4代谢, 对CYP2C19依赖性小, 且半衰期较混合型长, 故血浆中活性药物浓度高而持久, 药物之间相互影响小, 具有良好的药效学特征[14]. Cardile等[15]证实, 埃索美拉唑可以安全有效地用于儿童GERD的治疗, 良好的控制反酸情况的发生, 但埃索美拉唑并不能显著改善新生儿GERD患者的体征和症状[16]. 之后上市的右兰索拉唑同样具有单一的光学特异性, 并较兰索拉唑有更为良好的药效学特征. Wu等[17]研究发现, 右兰索拉唑30 mg治疗GERD的疗效优于埃索美拉唑20 mg或40 mg, 且可以同时缓解胃灼热和酸反流症状[18]. 莱米诺拉唑除具有抗胃酸作用外, 还具有良好的胃黏膜保护作用[19]. 艾普拉唑对CYP2C19的依赖性小, 起效快, 且半衰期更长, 可持续抑酸及控制夜间酸分泌[20,21]. 临床上常用的几种不可逆质子泵抑制剂的作用特点如图1[22-25].
1.2 可逆性质子泵抑制剂
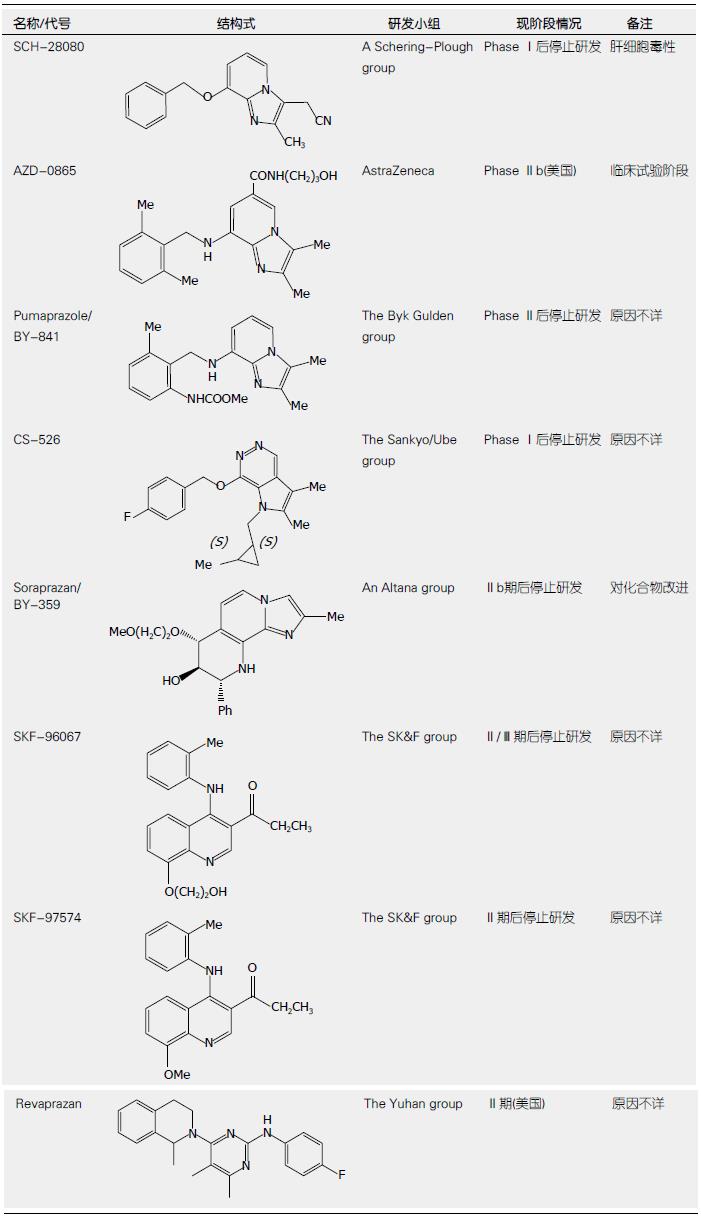
钾竞争性酸阻滞剂是一类新型质子泵抑制剂, 其通过竞争性抑制K+进入壁细胞, 进而抑制H+/K+交换. 钾竞争性酸阻滞剂是一类亲脂性的弱碱性化合物, 且在酸性条件下有良好的稳定性, 解离常数较高(pKa约等于6.0), 与质子泵以非共价键结合, 属于可逆性质子泵抑制剂[26]. 目前, 钾竞争性酸阻滞剂主要包括咪唑吡啶(如SCH28080、AZD0865、BY841)和邻苯二甲酰磺胺嘧啶或喹啉衍生物(如SKF-96067、SKF-97574). 钾竞争性酸阻滞剂不依赖于酸活化, 可以直接作用于质子泵, 因此能够快速起效, 且在1 h内就能达到最大效果. 通过药代动力学研究发现, 该类药物血药浓度与口服给药剂量线性相关, 表明该类药物可以比较容易地达到最佳抑酸状态[27]. SCH28080是首个钾竞争性酸阻滞剂, 由于其存在严重的肝细胞毒性而终止了临床试验. 虽然soraprazan较埃索美拉唑抑酸作用强大持久[28], 但在经过二期临床研究后, soraprazan相关研究于2007年被终止. 目前, AZD-0865和Revaprazan等[29]已进入临床研究阶段, 且Revaprazan已在韩国获准上市. Lee等[30]研究证实, Revaprazan除具有良好的抑酸效果外, 还可以抑制H. pylori引起的环氧合酶-2(cyclooxygenase-2, COX-2)表达而达到良好的抗炎作用(图2).
2 质子泵抑制在酸相关疾病中的应用
酸相关疾病(acid related disorders, ARDs)是指由于胃酸分泌过多或与胃酸敏感有关的胃肠道疾病, 其主要包括消化性溃疡(peptic ulcer diseas, PUD)、GERD和功能性消化不良(functional dyspepsia, FD)[31,32]. 胃酸分泌由壁细胞分泌小管膜上的H+/K+-ATP酶(质子泵)参与完成[1]. H. pylori感染、十二指肠液反流、胃排空迟缓、长期服用非甾体抗炎药、不良生活习惯如吸烟、嗜酒等因素可使胃酸分泌增加, 从而导致食管、胃及十二指肠黏膜的损害[33]. 其中, H. pylori感染是消化性溃疡、慢性胃炎及胃癌的主要致病因素. H. pylori感染后, 可通过多重途径导致患者胃酸分泌量增加. H. pylori尿素酶分解尿素产生氨, 致使局部pH升高, 导致胃酸对胃泌素的反馈抑制作用受到干扰[33]. H. pylori感染使得D细胞旁分泌生长抑素减少, 减弱由生长抑素对G细胞产生的抑制作用, 致使G细胞敏感性增强[33]. 因此, H. pylori感染后患者血清胃泌素水平升高, 从而促进胃酸分泌. 胃酸在局部组织集聚使得pH值降低, 影响细胞内许多代谢酶的功能, 引起能量生成障碍, 细胞膜的主动转运过程失常, 致使细胞变性坏死. 此外, H+过多, 还能刺激肥大细胞, 引起组胺分泌, 组胺通过旁分泌作用于壁细胞使胃酸分泌进一步增高, 且组胺还可刺激局部组织, 引起毛细血管扩张, 通透性增加, 最终导致黏膜充血水肿、出血、糜烂甚至溃疡的发生.
目前, 酸相关性疾病的治疗主要包括祛除病因、保护胃黏膜及抗酸治疗3个方面[33,34]. 减少服用胃黏膜刺激性药物、养成良好的生活习惯、戒除烟酒等可以减少酸相关性疾病的发生. 对于由H. pylori感染而导致的酸相关性疾病, 应当根除感染的H. pylori. 目前, 临床上治疗H. pylori多采用PPIs联合两种抗生素或铋剂联合两种抗生素方法治疗. 而非H. pylori感染而导致的酸相关性疾病主要采用抗酸治疗[35]. 根据抗酸药物作用机制的不同, 抗酸药物主要包括制酸剂和抑酸剂两类. 制酸剂主要是指能够中和胃酸的碱性药物, 如氢氧化铝凝胶、胃达喜、小苏打等. 应用后可迅速升高胃内pH值以减轻临床症状. 但这类药物不能有效地阻断胃酸分泌, 需长期服用, 顾临床应用有限[36]. 抑酸剂主要包括胃泌素受体抑制剂、胆碱能受体抑制剂、H2受体抑制剂和PPI[1]. 胃泌素受体抑制剂如丙谷胺, 直接作用于胃泌素受体, 但其与受体结合的特异性不强, 抑酸作用较弱, 临床上很少应用. 胆碱能受体抑制剂能够抑制壁细胞膜上的M受体结合有效地抑制胃酸分泌, 且可阻断消化系平滑肌M受体, 解除平滑肌痉挛, 缓解疼痛. 但其对受体所在组织器官的选择性不强, 因而可导致较多的不良反应. 新一代胆碱能受体抑制剂哌仑西平(prenzepine)可选择性作用于胃肠平滑肌M受体, 因而不良反应相对较少, 具有较好的临床应用前景. H2受体抑制剂, 如尼替丁、法莫替丁、尼扎替丁及罗沙替丁等, 仅阻断组胺驱动的酸分泌, 抑酸作用因其他酸分泌刺激通路的存在而被削弱, 容易产生耐受性, 且由于其对组织胺其他型受体也有一定的作用, 故可引起较多的不良反应[33]. PPI是目前抑酸作用最强的一类药物. 自1988年第一个PPI OMZ问世以来, PPI已在临床上得到了广泛的应用. PPI是一类弱碱性的脂溶性药物, 在酸性环境下与H+结合成离子状态并得以活化, 其次磺酰基团与质子泵的巯基进行不可逆的结合, 形成二硫键, 从而使质子泵永久性的失活, 达到强大的抑酸效果[1]. 第一代PPI如OMZ、泮托拉唑及LSZ主要通过肝脏CYP2C19代谢, 常出现用药的个体差异, 且与其他药物有交互影响[11]. 新一代PPI雷贝拉唑少依赖CYP2C19酶代谢, 因而个体差异较少, 与其他药物极少发生相互作用. 且在高酸和低酸环境下都能快速起效, 作用更稳定, 不良反应少, 且具有体外抗H. pylori活性, 直接攻击H. pylori, 非竞争的不可逆地抑制H. pylori尿素酶. 故具有良好的临床应用前景[1]. Haddad等[37]通过对1-11岁的GERD患儿给予RBZ研究发现, RBZ可以在24 wk内安全有效地用于儿童GERD的治疗.
质子泵抑制剂在治疗十二指肠溃疡[38]、胃部H. pylori感染[39]、GERD[40]、胃炎[41]、上消化道出血[42]等疾病中均有应用. 对于由H. pylori感染而引发的ARDs, 临床上推荐的治疗方法包括: (1)以质子泵抑制剂为主加用抗生素的联合疗法, 如采用PPI、阿莫西林、克拉霉素治疗2 wk, 之后连续服用PPI 4 wk, 总疗程为6 wk的治疗方案[43]; (2)以质子泵抑制剂、铋剂连用抗生素的三联疗法; (3)以质子泵抑制剂、铋剂、甲硝唑加抗生素的四联疗法. 其中, 四联疗法中常用的抗生素有阿莫西林、克拉霉素、左氧氟沙星、甲硝唑、四环素和呋喃唑酮6种, 根据患者自身情况可以结合不同的PPI给予诊疗方案[44]. Ren等[45]通过对PPI结合5-HT二联疗法与单独使用PPI治疗GERD的研究结果表明, 二联疗法产生不良反应的几率高于单独使用PPI, 且疗效与单独使用PPI并没有显著的提高. López-Alvarenga等[46]研究表明, 泮托拉唑-镁制剂可以安全有效的缓解GERD引起的食管内外症状. 对于患有PUD和GERD的老年患者, Haddad等[37]研究结果建议采用埃索美拉唑治疗.
3 结论
H+/K+-ATP酶是调节胃酸分泌的关键酶. 质子泵抑制剂可作用于H+/K+-ATP酶而达到抑制胃酸分泌的作用. 质子泵抑制剂在临床上使用时间长达20年, 且不良反应相对较少[47], 长期使用不会对胃部产生刺激而引起胃萎缩等情况的发生[48], 但长期使用质子泵抑制剂可能引起如骨折、呼吸系统感染、自发性腹膜炎、艰难梭杆菌感染等情况的发生[49,50]. 其相对良好的安全性和强大的抑制胃酸分泌的作用使其成为治疗酸相关性疾病最常使用的药物. 相信随着研究的深入, 质子泵抑制剂将具有更加广泛的应用前景.
评论
背景资料
质子泵抑制剂是一类作用于胃H+/K+-ATP酶, 抑制胃酸分泌的药物. 其在临床上主要用于酸相关性疾病的治疗.
同行评议者
刘占举, 教授, 同济大学附属上海市第十人民医院; 汤静, 主管药师, 上海交通大学附属第一人民医院药学部
研发前沿
目前研究热点集中在新一代质子泵抑制剂如具有光学特异性或受代谢酶影响较小的新型药物. 钾竞争性酸阻滞剂随表现出良好的抑酸效果, 但尚缺乏足够的临床数据.
相关报道
张培培等在《质子泵抑制剂研究新进展》一文中对质子泵抑制剂的分子作用机制、药理作用和药动学特性及其影响因素做系统的综述.
创新盘点
本文系统地介绍了质子泵抑制剂的发展史、目前的研究状况及临床上最新的试验结果.
应用要点
本文可以对临床用药给予一定的参考价值, 对于刚入门的读者也有很好的帮助.