修回日期: 2014-02-23
接受日期: 2014-02-28
在线出版日期: 2014-05-18
目的: 观察射波刀联合经肝动脉化疗栓塞术(transarterial chemoembolization, TACE)治疗原发性肝癌的近期临床疗效和不良反应.
方法: 回顾性分析2012-01/2013-05采用TACE及射波刀联合治疗的108例肝癌患者的临床资料, 并对其疗效和不良反应进行分析.
结果: 纳入本组分析的108例患者中男性96例, 女性12例, 男女比例8:1; 患者年龄32-85岁(平均年龄52.6岁). 所有患者在射波刀治疗前接受过1-11次TACE治疗(平均2.3次), 末次TACE与射波刀治疗间隔14-84 d(平均32 d); 射波刀治疗剂量: DT 35-60 Gy/3-6 Fraction 3-7 d; 随访时间3-19 mo(平均12.8 mo). 随访期内, 完全缓解(complete response, CR)20例、部分缓解(partial response, PR) 70例、病灶稳定(stable disease, SD) 18例, 治疗近期有效率(CR+PR)83.3%, 临床受益率(CR+PR+SD) 100%; 108例患者中65例射波刀治疗前血清AFP>400 μg/L的病例治疗后1-12 wk AFP值
下降>50%者42例, 其中降至正常范围者28例, 治疗过程中及治疗后无3级以上不良反应.
结论: 射波刀联合TACE术治疗原发性肝癌近期疗效明确, 且不良反应较轻, 是肝癌综合治疗的安全、有效模式, 其长期疗效及副反应需要进一步研究.
核心提示: 经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)是治疗肝脏恶性肿瘤的常用手段之一, 但单纯采用TACE只能使很少一部分肝癌得到根治, 而多数情况下肿瘤很难完全坏死或治疗后一段时间后便出现复发, 射波刀可以利用软件和硬件的优势有效地提高部分肝癌患者的综合治疗效果.
引文著录: 陈樱, 朱俊, 张火俊, 张晓青, 居小萍, 卢明智, 刘永明, 曹洋森, 于春山, 王晓艳. 射波刀联合TACE治疗原发性肝癌108例. 世界华人消化杂志 2014; 22(14): 2039-2044
Revised: February 23, 2014
Accepted: February 28, 2014
Published online: May 18, 2014
AIM: To evaluate the short-term clinical effects and adverse reactions of cyberknife combined with transarterial chemoembolization (TACE) for the treatment of primary liver cancer.
METHODS: The medical records for 108 patients with primary liver cancer who received cyberknife and TACE between January 2012 and May 2013 were retrospectively reviewed. Patient demographics, tumor characteristics, treatment details and post-treatment complications were recorded for each patient.
RESULTS: There were 96 males and 12 females. Intra-arterial chemoembolization and cyberknife (DT 35-60 Gy/3-6 fraction/3-7 d) were performed successfully, resulting in a substantial reduction or complete disappearance of tumors in nearly all patients, with a total effective rate (CR + PR + SD) of 100%. No major complications were encountered.
CONCLUSION: Cyberknife combined with TACE for the treatment of primary liver cancer is effective with mild adverse reactions.
- Citation: Chen Y, Zhu J, Zhang HJ, Zhang XQ, Ju XP, Lu MZ, Liu YM, Cao YS, Yu CS, Wang XY. Short-term effects of cyberknife combined with TACE for treatment of primary liver cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(14): 2039-2044
- URL: https://www.wjgnet.com/1009-3079/full/v22/i14/2039.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i14.2039
我国是原发性肝癌(primary liver cancer, PLC)的高发区, 全球约一半以上的肝癌患者在中国. 早期肝癌的治疗以手术为主, 中晚期患者或术后复发的患者则有赖于其他一些综合治疗. 经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)是肝癌综合治疗的重要手段之一并得到了广泛应用, 但TACE仍然存在治疗不彻底、容易复发等不足[1,2]. 因此, 将其他一些治疗方法与TACE相结合以提高肝癌综合治疗疗效得到越来越多的重视. TACE联合放疗是临床探索的方向之一[3,4]. 近年来, 射波刀做为体部立体定向放疗的先进技术在临床得到逐步推广, 但其与TACE联合治疗肝癌的研究尚少有报道[5,6]. 本文回顾性分析了射波刀联合TACE治疗原发性肝癌的临床价值, 报告如下.
选择2012-01/2013-05在长海医院放疗科(射波刀中心)行射波刀治疗的原发性肝癌患者108例. 入组对象: 符合以下条件者纳入本文回顾性分析: (1)经病理或临床诊断为原发性肝癌并且影像学表现为结节型或块型. 临床诊断标准为: AFP≥400 μg/L, 能排除妊娠、生殖系统胚胎源性肿瘤、活动性肝病、转移性肝癌, CT或MRI检查中一种有肝癌特征的占位性病变者; AFP<400 μg/L, 能排除妊娠、生殖系统胚胎源性肿瘤、活动性肝病及转移性肝癌, 并有两种影像学检查有肝癌特征的占位性病变; (2)在射波刀治疗前至少进行过1次TACE治疗, 包括因TACE效果欠理想或TACE后患者及家属要求行射波刀治疗者; (3)射波刀治疗后随访期不低于3 mo, 随访期内至少有一次可评估的影像学检查(CT或MR); (4)射波刀治疗后未再采取手术、射频等可能局部根治的治疗方案, 也未口服疗效明确的分子靶向药物如索拉非尼等. 完全缓解(complete response, CR)20例、部分缓解(partial response, PR)70例、病灶稳定(stable disease, SD).
1.2.1 分析内容: 包括一般临床资料、TACE治疗具体方法、射波刀治疗具体参数、临床实验室检查、影像学检查、治疗后不良反应及并发症等.
1.2.2 评价标准: 参照WHO制定的实体瘤疗效评价标准. 射波刀治疗后1-6 mo, CT或MR复查, 肿瘤完全消失者为CR, 肿瘤最大直径乘积缩小>50%者为PR, 缩小<50%、增大<25%为SD, 较治疗前肿瘤增大>25%为进展(progressive disease, PD). 射波刀治疗前影像学富血供病灶部分采用2008年美国肝病研究会及国家癌症协会杂志(AASLD-JNCI)修订版RECIST(mRECIST)标准判断疗效. 安全性评价参照WHO制定的不良反应分级标准.
2012-01/2013-05在长海医院放疗科接受射波刀治疗的各类原发性肝癌患者136例, 符合本研究纳入条件进行回顾性分析的患者108例. 其中男性96例、女性12例, 男女比例为8:1; 年龄32-85岁, 平均52.6岁; 射波刀治疗前接受TACE治疗1-11次(平均2.3次); 接受射波刀治疗时肝功能Child分级A级100例, B级8例; 影像学分型均为结节型或肿块型, 可评估病灶数量1-3个; 所有患者在接受放疗时KPS评分均不低于70分.
2.2.1 TACE术: 腹股沟穿刺点区消毒、局部麻醉后采用Seldinger技术经皮穿刺股动脉插管至腹腔动脉, 行腹腔干造影, 了解血管解剖和肿瘤供血等情况后超选至肿瘤供血动脉(其中29例患者采用3 F微导管进行荷瘤动脉超选择性插管) 行灌注化疗和栓塞术. 化疗药物(2-3种联合用药): 吡柔比星20-40 mg, 5-氟尿嘧啶500-1500 mg, 羟基喜树碱10-30 mg, 奥沙利铂50-150 mg. 栓塞剂为超液化碘油5-14 mL(部分肿块型病例加用适量明胶海绵补充栓塞). 相邻两次TACE间隔时间为6-9 wk. 末次TACE与射波刀治疗间隔14-84 d, 平均32 d.
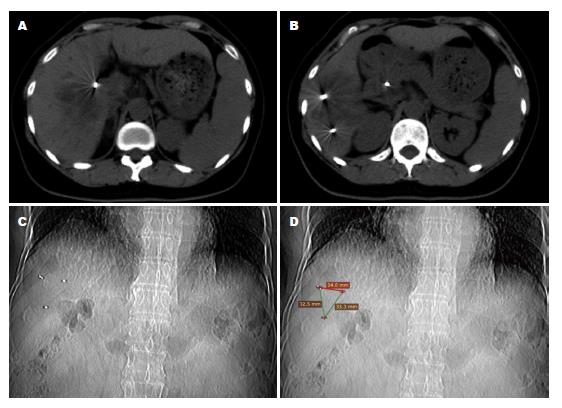
2.2.2 射波刀治疗: 108例患者中有76例在治疗前7-14 d于CT引导下在肝肿瘤附近3 cm范围内植入1-4枚金标(平均2.2枚)(图1), 治疗前CT平扫及增强定位, 层距1.5 mm, 使用G4型射波刀, TPS 4.0.2版本设计治疗计划, 治疗剂量: 35-60 Gy/3-6 Fx/3-7 d(其中96例采用5次分割), 处方剂量线范围为68.1%-82.3%. 植入金标的患者采用呼吸同步及金标追踪技术, 其余32例患者中12例采用脊柱追踪技术, 20例膈下病灶者采用XSIGHT-LUNG追踪方法.
2.2.3 临床其他治疗: 射波刀治疗期间针对不同患者予止吐、保肝、抑酸及胃黏膜保护剂等处理.
2.3.1 疗效观察: 射波刀治疗前65例患者血清AFP>400 μg/L, 治疗后1-12 wk AFP值
下降>50%者42例, 其中降至正常范围者28例, AFP值
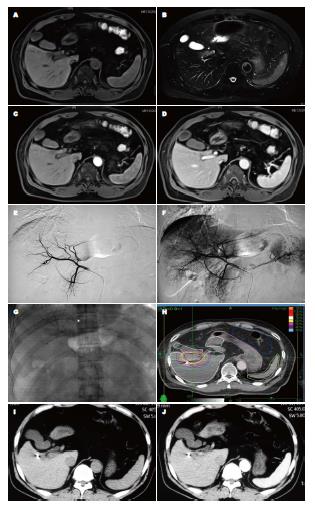
下降20%-50%者21例. 治疗后1-6 mo复查动态增强CT或MR, 按照疗效评价标准标准, 全组108例患者CR 20例, 其中包括经1-2次TACE治疗后因相对乏血供而介入效果欠佳的小肝癌5例(图2); PR 70例; SD 18例, 治疗CR+PR 83.3%, 临床受益率(CR+PR+SD)100%.
2.3.2 不良反应: 治疗期间54例(50%)患者出现一过性乏力, 63例(58.3%)出现1-2级胃肠道反应(恶心、呕吐、纳差、腹泻等), 经对症及支持治疗后症状在1-2 wk内明显缓解或消失; 39例患者出现Ⅰ-Ⅱ度骨髓抑制, 经口服或皮下应用升白药后恢复正常. 除5例患者因上述不良反应强烈要求暂停1-2 d治疗外其余病例均未影响正常治疗. 射波刀治疗后除11例患者肝功能一过性升高(8例转氨酶升高、3例总胆红素升高)外其余患者肝功能治疗前后无显著变化, 无上消化道穿孔、出血或肝功能衰竭等严重并发症发生.
原发性肝癌在我国是常见恶性肿瘤之一, 自1976年Goldstein首先报道TACE治疗肝脏恶性肿瘤后逐步成为治疗肝癌的常用手段之一, 对部分中晚期患者及术后复发的患者采用TACE治疗已得到广泛的认可[7]. 但是, 单纯采用TACE只能使很少一部分肝癌得到根治, 而多数情况下肿瘤很难完全坏死或治疗后一段时间后便出现复发, 主要原因有: (1)肝癌供血动脉经TACE治疗后部分病灶易形成侧枝循环从而导致局部控制失败; (2)部分病灶栓塞剂(比如碘化油)用量不足, 经血流冲刷后肿瘤血管栓塞不彻底从而致局部活性残留或复发, 这种现象在肿瘤周边更常见; (3)部分病灶为相对乏血供, 即使采用微导管超选后加压栓塞的技术亦很难使碘化油在肿瘤内得到很好的聚集; (4)TACE治疗后会刺激EGFR的分泌从而导致肿瘤新生血管的形成[8].
鉴于TACE治疗的局限性, 越来越多的学者近年来在积极探讨其他方法联合TACE以提高肝癌综合治疗效果, 比如TACE联合射频治疗、冷冻治疗、电化学治疗、放疗(包括外照射及内照射)、无水乙醇消融等等, 取得了较好的临床效果[9,10].
射波刀, 又称"立体定位射波手术平台", 曾被称为"网络刀"或"电脑刀", 是一种新型的立体定向放射外科治疗系统, 由美国斯坦福大学John Alder教授发明, 属于影像引导下精确放射治疗, 于2001年获得FDA认证后逐步在世界各大医疗中心或医院得到推广应用. 射波刀是目前为止世界上唯一一套整合机器人技术和影像引导自动摆位的治疗系统, 他在影像引导系统的实时监控下, 将质量仅150 kg、能发出6 MV X线的微型医用直线加速器与具有六个自由度关节的机械手臂相结合, 根据立体定向原理, 使用大剂量、低分割(通常为1-5次)、窄束高能X射线准确聚焦照射靶区, 使之产生强烈局部放射生物学反应, 达到肿瘤消融的目的. 射波刀产生的X线能以12种不同直径(5-60 mm)、从100个节点、1200个方向中选择最合适的100-250个方向的射束聚焦照射肿瘤. 由于射束精准、分散, 高剂量的分布按肿瘤轮廓高度适形和高度均匀地涵盖治疗靶区, 并且靶区附近的射线剂量急速下降, 可以起到最大程度消灭肿瘤和最大限度保护周围正常组织(或危及器官)的作用, 具有很高的治疗增益比. 具有"三无"(无创、无痛、无血)、"三非"(非等中心、非共面、非聚焦)、"三精"(精确定位、精确引导、精确治疗)的特点, 安全、有效, 患者容易接受. 自射波刀应用临床后, 其优异的性能在很多实质性器官恶性肿瘤的治疗中得到了验证[11].
由于肝脏肿瘤随呼吸运动移位明显, 普通的放疗很难进行精确的定位和出束治疗, 而射波刀独有的呼吸同步追踪功能与金标植入相结合可以对肿瘤和治疗区进行准确定位追踪, 治疗过程中可以按照设定的频率自动对靶区移位作修正, 总体临床治疗精度可达0.95 mm[12]. 为了定位精确, 最好在肝脏肿瘤周围植入金标不少于3枚并且相互之间的距离不少于2 cm.
目前, 射波刀在原发性肝癌及转移性肝癌的治疗已得到认可, 但射波刀联合TACE治疗肝癌的成果尚少有报道[5]. 本研究表面, 射波刀和TACE联合能够起到优势互补的作用从而提升肝癌的综合治疗效能. 可能的主要原因是: (1)TACE治疗通过栓塞化疗可使肿瘤缩小、负荷下降, 缩小放疗范围; (2)TACE后由于碘油的沉积使得肿瘤靶区的边缘更加清晰, 靶区勾画更加精确. 对于发生肝内播散的肝癌患者, 由于播散病灶小, 在放射治疗时模拟CT机扫描很难发现, TACE后由于碘油沉积可避免在勾画靶区时遗漏这些病灶, 从而提高治疗效果, 当然对多个(3个以上)病灶进行射波刀治疗的临床经验尚很有限, 需要进一步探讨, 本组病例肝内病灶均在3个以内; (3)TACE治疗时通常将化疗药物与碘油混合振荡形成悬液后注入肿瘤供血动脉, 化疗药物能较长时间滞留于肿瘤中, 这一方面能持续发挥化疗药物的抗肿瘤作用, 同时介入治疗时常用的化疗药物如氟尿嘧啶类化疗药等能对放射治疗起增敏作用; 而化疗也可以使肿瘤细胞周期同步化, 有利于射线对肿瘤的杀灭[13]; (4)由于正常肝组织放疗耐受性差, 过量射线照射后易导致肝功能损害甚至肝纤维化, 常规外照射很难给予肝癌根治剂量, 仅能起到抑制肿瘤作用, 疗效不明显, 而射波刀由于具有在线校位、实时跟踪的特点, 对周围肝组织的影响小, 可以在充分保护肿瘤周围正常肝组织的前提下增加肿瘤的照射剂量, 提高治疗效果, 本组病例肿瘤照射的生物有效剂量BED除个别患者外均在80 Gy以上; (5)射波刀可以破坏肿瘤血管, 或可以降低TACE后门静脉供血及代偿性供血的几率从而降低TACE后复发概率; (6)虽然原发性肝癌尤其是肝细胞肝癌多为富血供肿瘤但仍有一部分病例相对乏血供而使介入治疗时碘油充盈不良影响疗效, 射波刀在这部分的病例应用可以明显提高肿瘤局部控制率[14-16], 本组有5例BCLC-I期的相对乏血供肝癌1-2次TACE后发现碘油沉积不理想及时联合射波刀取得了良好的效果; (7)肝癌的综合治疗有利于提高效果, 射波刀由于单次剂量大、治疗时间短(本组最长治疗时间为7 d, 绝大多数在5 d内), 一般不会在时间上影响其他治疗手段的应用; (8)射波刀治疗肝癌每次治疗时间在30-90 min之间, 治疗中采用真空垫等无创伤体位固定装置, 患者无特殊不适, 治疗依从性高, 不会对患者心理产生过大压力; (9)短期内反复多次进行TACE治疗无疑会对肝功能造成较大影响, 对一些多次TACE治疗后效果欠佳的结节性肝癌患者及时联合射波刀治疗可以避免不必要的肝功能损伤. 为了有利于肝功能恢复. 当然, TACE治疗后需要一段时间待肝功能恢复后再行射波刀治疗, 本组患者多在末次TACE结束后4 wk左右进行射波刀治疗.
本回顾性研究发现, 射波刀做为一种先进的立体定向放疗技术联合TACE可以提高原发性肝癌的疗效, 部分患者中短期可以达CR的治疗效果, 而不良反应较轻, 说明射波刀联合TACE是治疗肝癌的有效手段, 但其长期疗效及联合治疗后可能产生的远期并发症尚需要进一步研究.
我国是肝癌的高发区, 不适合手术治疗的中晚期患者或术后复发的患者需依靠综合治疗. 经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)是肝癌综合治疗的重要手段之一并得到了广泛应用, 但TACE仍然存在治疗不彻底、容易复发等不足. 近年来, 临床研究的方向之一是将其他一些治疗方法与TACE相结合以提高肝癌综合治疗疗效.
麻勇, 副研究员, 哈尔滨医科大学附属第一医院肝脏外科
TACE联合放疗以提高疗效近年来得到逐步地重视, 但普通放疗疗程长、定位欠精确、对肝功能的可能影响较大. 射波刀是一种新型的立体定向放射外科治疗系统, 其独有的呼吸同步追踪功能与金标植入相结合可以对肿瘤和治疗区进行准确定位追踪, 有效地克服了其他放疗技术的不足. 由于射波刀应用于临床的时间尚不长, 其联合TACE治疗肝癌的优缺点值得临床深入研究.
鉴于TACE治疗肝癌很难达到彻底控制肿瘤的效果, 很多学者近年来在积极尝试其他方法联合TACE以进一步提高肝癌综合治疗疗效, 比如TACE联合射频治疗、冷冻治疗、电化学治疗、无水乙醇消融等等, 取得了较好的临床效果. 放疗作为可能的手段之一与TACE联合治疗肝癌也得到了初步的研究, 调强放疗能提高肝癌的综合治疗疗效已得到初步肯定, 但近年来出现的以影像引导下精确放疗为代表的先进放疗技术如射波刀等在肝癌综合治疗过程中的作用尚未得到应有的充分研究.
本回顾性研究基于较多病例数(108例)的随访发现射波刀做为一种先进的立体定向放疗技术联合TACE可以提高原发性肝癌的疗效, 部分患者中短期可以达CR的治疗效果, 而不良反应较轻, 说明射波刀联合TACE是治疗肝癌的有效手段, 但相关研究较少, 其长期疗效及联合治疗后可能产生的远期并发症尚需要进一步的研究.
本文的研究结果对肝癌综合治疗提供了一个新的选择, 对一些TACE术后活性残留或乏血供肝癌患者可以有效提高治疗效果, 但射波刀设备昂贵、治疗费用亦较高, 在一定程度会影响其临床推广. 在实际治疗过程中, 适应症的掌握、治疗参数的优化、严重并发症的预防是需要高度注意的内容.
本文对肝癌综合治疗有一定临床指导意义.
编辑 田滢 电编 鲁亚静
| 3. | Zhao JD, Liu J, Ren ZG, Gu K, Zhou ZH, Li WT, Chen Z, Xu ZY, Liu LM, Jiang GL. Maintenance of Sorafenib following combined therapy of three-dimensional conformal radiation therapy/intensity-modulated radiation therapy and transcatheter arterial chemoembolization in patients with locally advanced hepatocellular carcinoma: a phase I/II study. Radiat Oncol. 2010;5:12. [PubMed] [DOI] |
| 4. | Kong M, Hong SE, Choi WS, Choi J, Kim Y. Treatment outcomes of helical intensity-modulated radiotherapy for unresectable hepatocellular carcinoma. Gut Liver. 2013;7:343-351. [PubMed] [DOI] |
| 5. | Dewas S, Bibault JE, Mirabel X, Fumagalli I, Kramar A, Jarraya H, Lacornerie T, Dewas-Vautravers C, Lartigau E. Prognostic factors affecting local control of hepatic tumors treated by Stereotactic Body Radiation Therapy. Radiat Oncol. 2012;7:166. [PubMed] [DOI] |
| 6. | Shen ZT, Wu XH, Li B, Wang L, Zhu XX. Preliminary efficacy of CyberKnife radiosurgery for locally advanced pancreatic cancer. Chin J Cancer. 2010;29:802-809. [PubMed] [DOI] |
| 7. | Si Y, Hu X, Du H, Lou W, Zhang H, Cao F, Yu W, Wang W, Jin K. Transarterial chemoembolization for patients with unresectable hepatocellular carcinoma: a retrospective study of a 5-year experience in a single institution. Hepatogastroenterology. 2013;60:1405-1408. [PubMed] |
| 9. | Liao M, Huang J, Zhang T, Wu H. Transarterial chemoembolization in combination with local therapies for hepatocellular carcinoma: a meta-analysis. PLoS One. 2013;8:e68453. [PubMed] [DOI] |
| 10. | Ni JY, Liu SS, Xu LF, Sun HL, Chen YT. Meta-analysis of radiofrequency ablation in combination with transarterial chemoembolization for hepatocellular carcinoma. World J Gastroenterol. 2013;19:3872-3882. [PubMed] [DOI] |
| 11. | Ding C, Solberg TD, Hrycushko B, Xing L, Heinzerling J, Timmerman RD. Optimization of normalized prescription isodose selection for stereotactic body radiation therapy: conventional vs robotic linac. Med Phys. 2013;40:051705. [PubMed] [DOI] |
| 12. | Ozhasoglu C, Saw CB, Chen H, Burton S, Komanduri K, Yue NJ, Huq SM, Heron DE. Synchrony--cyberknife respiratory compensation technology. Med Dosim. 2008;33:117-123. [PubMed] [DOI] |
| 13. | Seong J, Kim SH, Suh CO. Enhancement of tumor radioresponse by combined chemotherapy in murine hepatocarcinoma. J Gastroenterol Hepatol. 2001;16:883-889. [PubMed] [DOI] |
| 16. | Zhou ZH, Liu LM, Chen WW, Men ZQ, Lin JH, Chen Z, Zhang XJ, Jiang GL. Combined therapy of transcatheter arterial chemoembolisation and three-dimensional conformal radiotherapy for hepatocellular carcinoma. Br J Radiol. 2007;80:194-201. [PubMed] [DOI] |