修回日期: 2014-02-11
接受日期: 2014-02-18
在线出版日期: 2014-05-18
目的: 探讨血清Stathmin的表达水平对食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)的诊断价值及临床意义.
方法: 采用酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA)检测74例ESCC与81例健康对照血清Stathmin含量; 采用ELISA检测34例食管鳞癌与40例健康对照血清角蛋白19片段抗原21-1(cytokeratin 19 fragment antigen 21-1, Cyfra21-1)的水平; 采用化学发光法检测血清癌胚抗原(carcinoembryonic antigen, CEA)、癌抗原19-9(cancer antigens 19-9, CA19-9)、癌抗原72-4(cancer antigens 72-4, CA72-4)水平; 统计学分析血清中Stathmin浓度与临床参数的相关性.
结果: ESCC组血清Stathmin水平显著高于健康对照组(P<0.001), ESCC组血清Stathmin水平与伴有淋巴结转移相关(P = 0.036), 血清Stathmin水平与患者性别、年龄、分化程度、TNM分期和肿瘤大小无显著相关. 比较Stathmin和Cyfra21-1的受试者工作特性曲线(receiver operating characteristic curve, ROC曲线), 提示Stathmin的灵敏度和特异性均优于Cyfra21-1, 血清Stathmin水平对ESCC的诊断灵敏度可达94.6%.
结论: 血清Stathmin升高在食管鳞癌的发生发展中起重要作用, 食管癌患者血清的Stathmin检测, 对ESCC的诊断和预后判定具有一定意义. Stathmin可作为食管鳞癌诊断、治疗和判断预后的一个新的血清标志物, 辅助临床诊断.
核心提示: 本研究发现Stathmin在食管鳞癌患者血清中浓度升高, 血清Stathmin水平与食管癌淋巴结转移相关, Stathmin的灵敏度和特异性均显著优于目前已有肿瘤标志物, 提示Stathmin可作为食管鳞癌诊断、治疗和判断预后的一个新的血清标志物, 辅助临床诊断.
引文著录: 赵楠, 韩波, 吴宗勇, 周兰萍, 刘芳, 颜露, 赵晓航, 许杨. 食管鳞癌患者血清Stathmin的表达及临床意义. 世界华人消化杂志 2014; 22(14): 2016-2022
Revised: February 11, 2014
Accepted: February 18, 2014
Published online: May 18, 2014
AIM: To detect serum Stathmin in patients with esophageal squamous cell carcinoma (ESCC) and evaluate its correlation with clinicopathological parameters in ESCC.
METHODS: Serum levels of Stathmin were measured by enzyme-linked immunosorbent assay (ELISA) in 74 patients with ESCC and 81 healthy individuals. Serum levels of Cyfra21-1 were measured by ELISA, and those of CEA, CA19-9 and CA72-4 were measured by chemiluminescence.
RESULTS: Serum levels of Stathmin in ESCC patients were significantly higher than those in healthy controls (P < 0.001). Serum levels of Stathmin were correlated with lymph node metastasis (P = 0.036), but not with age, gender, tumor differentiation, TNM stage or tumor size. According to the ROC curve, the sensitivity and specificity of serum Stathmin were significantly higher than those of Cyfra21-1 for diagnosis of esophageal squamous cell carcinoma. The sensitivity of serum Stathmin for diagnosis of ESCC was 94.6%.
CONCLUSION: Serum Stathmin levels increase in ESCC patients. Detection of serum Stathmin is helpful for diagnosis and prognostic evaluation of esophageal cancer. Stathmin may serve as a new potential serum tumor marker for clinical detection, therapy and prognostic evaluation of ESCC.
- Citation: Zhao N, Han B, Wu ZY, Zhou LP, Liu F, Yan L, Zhao XH, Xu Y. Clinical significance of serum Stathmin in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(14): 2016-2022
- URL: https://www.wjgnet.com/1009-3079/full/v22/i14/2016.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i14.2016
食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)是我国常见的消化系恶性肿瘤, 食管癌的早期症状不明显, 诊断时多为中晚期, 5年生存率低[1,2]. 目前, 已发现和可用于食管癌的血清标志物包括癌胚抗原(carcinoembryonic antigen, CEA)、癌抗原19-9(cancer antigens 19-9, CA19-9)、癌抗原72-4(cancer antigens 72-4, CA72-4)和角蛋白19片段抗原21-1(cytokeratin 19 fragment antigen 21-1, Cyfra21-1). 用免疫分析方法检测这些标志物, 4种标志物的敏感性分别为: CEA 11.9%; CA19-9 4.9%; CA72-4 7.0%; Cyfra21-1 33%[3,4], 可见在多种标志物中Cyfra21-1灵敏度相对较好. Brockmann等[5]报道Cyfra21-1在食管癌诊断中的灵敏度达45.5%. 可见上述用于食管癌检测的标志物敏感性偏低, 单独应用于食管癌的诊断价值不大. 因此, 临床上仍然缺乏食管鳞癌特异的诊断标志物, 应用蛋白质组学技术筛选用于诊断和监测的食管鳞癌特异标志物成为研究热点. 本实验室前期工作采用二维电泳(two dimensional electrophoresis, 2DE)分离-基质辅助激光解吸离子化飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry, MALDI-TOF-MS)的常规蛋白质组分析技术, 分析了8对伴随淋巴结转移和无淋巴结转移ESCC组织的差异蛋白质组表达谱, 提示Stathmin是一种在食管鳞癌中高表达的蛋白[6]. Stathmin(STMN1)是近年来研究较多的一个微管解聚蛋白, 通过磷酸化调节自身活性从而影响细胞内微管系统动力平衡, 对细胞周期的变化起着重要作用. 研究发现在多种人类恶性肿瘤中Stathmin过表达, 亦称为癌蛋白18(Op18)[7]. 本研究探讨血清Stathmin对食管鳞癌的临床诊断价值, ELISA检测74例食管鳞癌患者以及81例正常人血清Stathmin水平, 统计学分析血清中Stathmin浓度与临床参数的相关性. 并采用ELISA检测34例食管鳞癌与40例健康对照血清Cyfra21-1的水平. 探讨血清Stathmin水平对食管鳞癌诊断和判断预后的意义.
食管鳞癌血清样本取自中国医学科学院肿瘤医院检验科, 患者经病理证实. 正常对照血清样本来自北京煤炭总医院的健康体检中心. 其中ESCC样本共74例, 其中男性63例, 女性11例, 平均年龄60岁±9.8岁. 健康对照血清样本81例, 其中男性51例, 女性30例, 平均年龄42岁±14.6岁. ESCC诊断按照2007年世界卫生组织(World Health Organization, WHO)分类标准分为高分化15例, 中分化28例, 低分化20例, 11例信息不详. ESCC临床分期按照2013美国国家综合癌症网络(National Comprehensive Cancer Network, NCCN)指南[8]分为Ⅰ期16例, Ⅱ期20例, Ⅲ期25例, 13例信息不详. 所有受试者均获得知情同意.
1.2.1 ELISA检测血清Stathmin和Cyfra21-1浓度: 血清取材后迅速离心, 冰上分离血清, 干冰上分装后转入-80 ℃冰箱保存备用. 血清样本各100 µL用于Stathmin和Cyfra21-1检测, ELISA试剂盒均购自美国Cloud-Clone公司, 货号分别为SEC892Hu和SEB246Hu, 各项操作均严格按照说明进行. 血清样品及标准品分别稀释后加至反应孔, 37 ℃孵育2 h. 将孔板中液体去除, 每孔加入100 µL反应液A的工作液, 37 ℃孵育1 h吸出液体, 清洗3次. 加入100 µL/孔反应液B, 封膜后37 ℃ 30 min. 清洗5次. 加入底物溶液90 µL/孔, 避光37 ℃ 20 min. 每孔加入50 µL的终止液, 混合均匀, 液体由蓝变黄. 酶标仪(Bio-rad公司)上读取A450. 根据试剂盒标准品的浓度和A值绘制标准曲线. 根据样品A450值, 计算血清样品中Stathmin浓度并进行统计学分析. 每个样本重复3次, 取平均值作为该样本的血清Stathmin浓度.
1.2.2 化学发光法检测血清CEA、CA19-9和CA72-4浓度: 化学发光试剂盒购自罗氏(Roche), 经罗氏Cobas-601全自动化学发光免疫分析系统检测, 实验步骤严格按照试剂盒说明书进行, 将血清加入相应的样品杯中, 设定程序, 为我院检验科仪器自动进行定量检测. 按试剂盒提供的参考值, 确定CEA、CA19-9和CA72-4阳性界值分别为5 ng/mL、37 U/mL和9.8 U/mL.
统计学处理 应用SPSS16.0统计软件对计量资料采用秩和检验, 计量资料选择Student's t检验、Kruskal-Wallis nonparametric检验和Mann-Whitney检验, P<0.05为差异有统计学意义. 特异性、灵敏度、阳性预测值、Youden指数作为诊断价值的评价指标.
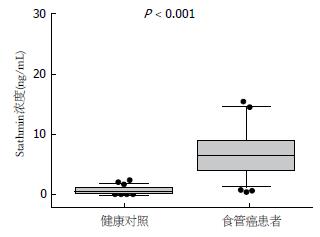
在74例食管鳞癌和81例健康对照血清样本中, 食管癌血清Stathmin浓度中位值为6.9 ng/mL(浓度范围是0.72-24.41 ng/mL), 对照血清Stathmin浓度中位值为0.73 ng/mL(浓度范围是0-2.41 ng/mL), 经Mann-Whitney检验分析, 食管鳞癌患者血清Stathmin水平显著高于正常对照组, 两组具有极显著性差异(P<0.001, 表1, 图1).
| 临床病理参数 | n | 血清Stathmin浓度(ng/mL) | P值 | |
| mean±SD | 范围 | |||
| 年龄(岁) | 0.587 | |||
| <50 | 9 | 6.25±0.90 | 3.29-11.74 | |
| ≥50 | 65 | 6.99±0.49 | 0.72-24.41 | |
| 性别 | 0.500 | |||
| 男性 | 11 | 7.02±0.48 | 0.72-24.41 | |
| 女性 | 63 | 6.18±1.13 | 1.48-14.47 | |
| 分化程度 | 0.219 | |||
| 高分化 | 15 | 7.58±0.72 | 3.16-14.37 | |
| 中分化 | 27 | 7.05±0.70 | 1.48-13.96 | |
| 低分化 | 20 | 6.48±1.12 | 0.72-24.41 | |
| 肿瘤大小(cm) | 0.225 | |||
| <5 | 22 | 6.00±0.74 | 0.72-14.47 | |
| ≥5 | 45 | 7.23±0.60 | 1.48-24.41 | |
| TNM分期(期) | 0.101 | |||
| Ⅰ | 16 | 6.04±0.65 | 0.72-10.05 | |
| Ⅱ | 20 | 6.02±0.60 | 1.65-10.11 | |
| Ⅲ | 25 | 8.68±0.99 | 1.47-24.41 | |
| 淋巴结转移情况 | 0.036 | |||
| 是 | 34 | 7.92±0.81 | 1.48-24.41 | |
| 否 | 31 | 5.94±0.42 | 0.72-10.05 | |
| ESCC患者 | 74 | 6.90±0.44 | 0.72-24.41 | <0.001 |
| 健康对照 | 81 | 0.73±0.06 | 0.00-2.41 | |
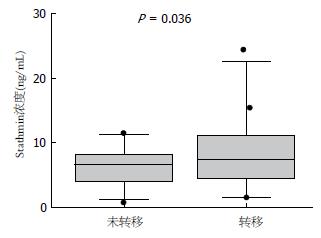
74例食管鳞癌患者中, 其中34例为淋巴结转移, 31例为无淋巴结转移, 9例信息不详. 食管癌淋巴结转移患者血清Stathmin浓度中位值为7.92 ng/mL, 无淋巴结转移样本Stathmin浓度中位值为5.94 ng/mL, 经Mann-Whitney相关分析, 食管癌淋巴结转移患者血清Stathmin水平显著高于无转移组(P = 0.036), 提示血清中Stathmin浓度与淋巴结转移相关(表1, 图2).
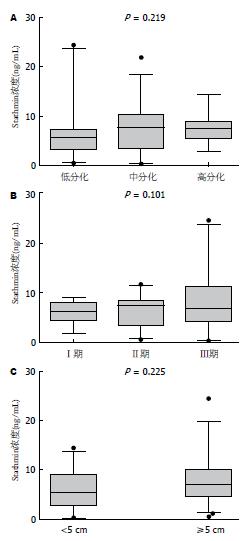
为了比较Stathmin表达水平与临床参数的相关性, 统计学分析结果提示食管鳞癌患者血清Stathmin浓度与性别、年龄、TNM分期与分化程度以及肿瘤大小等因素无关(表1, 图3), (P>0.05).
基于上述74例食管鳞癌及81例健康对照血清样本随机选择34例ESCC血清样本和40例健康对照血清样本, 应用ELISA检测Cyfra21-1浓度, 其中位值分别是3.45 ng/mL和1.1 ng/mL. 经ROC曲线分析, Stathmin与Cyfra21-1的曲线下面积(area under curve, AUC)分别为0.968和0.817, Stathmin确定阳性界值为1.77 ng/mL, Cyfra21-1确定阳性界值为3.4 ng/mL, 基于阳性界值确定Stathmin与Cyfra21-1单项检测对食管鳞癌诊断的灵敏度分别为94.6%和73.5%, 特异性分别为97.5%和80%. 提示Stathmin和Cyfra21-1在食管癌的血清诊断中都具有一定诊断价值, Stathmin的检测结果优于Cyfra21-1, 更灵敏有效. 联合检测的灵敏度, 特异性和Youden指数未见显著上升(表2, 3), 提示单独Stathmin检测具有较高的有效性和准确性.
| 标志物 | 灵敏度(%) | 特异性(%) | Youden指数 |
| Stathmin | 94.6 | 97.5 | 92.1 |
| Cyfra21-1 | 73.5 | 80 | 53.5 |
| Stathmin+Cyfra21-1 | 94.6 | 97.5 | 92.1 |
| 标志物 | n | 临界值 | 阳性率[n(%)] |
| Stathmin(ng/mL) | 74 | 1.77 | 94.6(70) |
| Cyfra21-1(ng/mL) | 34 | 3.4 | 73.5(25) |
| CEA(ng/mL) | 58 | 5.0 | 6.9(4) |
| CA72-4 (U/mL) | 56 | 9.8 | 1.8(2) |
| CA19-9 (U/mL) | 56 | 37.0 | 1.8(2) |
为了比较Stathmin与目前临床所有肿瘤标志物的诊断效果, 计算各种肿瘤标志物检测食管鳞癌的灵敏度, 如表3所示, 经ROC曲线分析, Stathmin确定阳性界值为1.77 ng/mL, 基于阳性界值确定Stathmin的灵敏度为94.6%, Cyfra21-1确定阳性界值为3.4 ng/mL, 基于阳性界值确定灵敏度为73.5%, 基于本院CEA、CA72-4和CA19-9的阳性界值, 确定灵敏度分别为6.9%、1.8%和1.8%. 提示Stathmin的灵敏度显著优于CEA、Cyfra21-1、CA19-9、CA72-4.
Stathmin是由149个氨基酸组成的分子量为19 kDa微管解聚蛋白, 包含2个不同的亚型a和β. 结构上可分成3部分: N端的结构调节域、中心区和C端的蛋白相互作用结构域. 蛋白水解后的中心区包括4个结构域(Ⅰ-Ⅳ), 其核心区域(第42-126位氨基酸)连接N端和C端, 可构成与微管蛋白相互作用的最小片段[9]. N端包含4个丝氨酸磷酸化位点, 分别为Serl6、Ser25、Ser38和Ser63, 经磷酸化后Stathmin与微管蛋白异二聚体之间亲和力的下降从而失去微管解聚活性, 其中Ser16、Ser63磷酸化显著影响微管稳定性. C端的功能区域, 包括了一个α螺旋结构, 与微管的α/β异源二聚体螯合形成紧密的复合物从而抑制微管聚合[10]. Stathmin通过磷酸化调节自身活性影响细胞内微管系统的动力平衡影响细胞增殖, Stathmin磷酸化导致活性降低, 微管蛋白得以聚合; Stathmin去磷酸化, 促进微管蛋白解聚[11]. 在多种肿瘤包括子宫内膜癌、骨肉瘤、乳腺癌、非激素依赖性的前列腺癌的体外模型研究发现, 敲除Stathmin可诱导细胞周期停滞及细胞凋亡[7,12].
Stathmin作为微管解聚蛋白, 主要定位于细胞浆[11]. 近年来研究发现Stathmin在口腔鳞癌、肺癌、乳腺癌、前列腺癌、白血病、头颈癌、结肠癌、肝癌、淋巴瘤等多种恶性肿瘤组织表达增高[13]. 王峰等[14]应用免疫组织化学和原位杂交的方法分析了75例食管鳞癌组织、25例癌旁不典型增生组织和正常食管黏膜组织中Stathmin mRNA和蛋白的表达, 发现在食管鳞癌组织、癌旁不典型增生组织和正常食管黏膜组织中Stathmin蛋白的阳性率分别为81.3%、48.0%和30.0%, 组间比较有显著性差异(P<0.01), Stathmin mRNA和蛋白的阳性表达率分别为82.7%和90.2%, 与癌旁不典型增生组织及正常食管黏膜组织比较有显著性差异(P<0.01). 提示食管鳞癌组织中Stathmin蛋白高表达, Stathmin表达与食管癌的发生发展相关. Yousefi等[15]采用二维电泳与液相质谱联用的方法对两种肺癌细胞系的分泌蛋白进行研究发现Stathmin在分泌上清中特异性高表达, 说明Stathmin能够分泌到细胞外, 进入血循环中, 可从血清中检测Stathmin的水平. Bhagirath等[16]用ELISA的方法对30例移型性膀胱上皮癌, 15例健康对照和15例良性前列腺增生的血清和尿液进行检测, 结果显示在肿瘤患者中Stathmin表达显著升高(P<0.001), ROC曲线下面积为0.984, 灵敏度为93.3%, 特异性为86.7%, 临界值为0.7 ng/mL. 提示其可能作为一种肿瘤标志物用于移型性膀胱癌的检测.
在肿瘤细胞中Stathmin过表达与侵袭转移相关, 研究发现微管蛋白解聚与细胞的迁移、运动有关, 研究证实Stathmin具有促进细胞运动的功能, Jin等[17]发现Stathmin敲降可降低小鼠再生神经元的运动能力. Borghese等[18]在果蝇中发现Stathmin减少使胚胎细胞和边缘细胞的运动能力降低. Gan等[19]发现Stathmin在肝癌特别是高转移性的肝癌组织中高表达. siRNAs敲降人高转移肝癌细胞(human highly potentially metastatic liver cancer cell line, HCCLM3)的Stathmin后, 明显抑制了细胞的黏附能力, 抑制细胞的迁移和侵袭能力, 提示Stathmin的表达与肝癌癌变和转移有很大的关联. Trovik等[20]采用免疫组织化学染色的方法对1067例子宫内膜癌组织样本检测发现Stathmin的表达与不良预后和淋巴结转移具有显著相关性. 我们进一步将食管癌患者分为淋巴结转移和未转移两组, ESCC伴有淋巴结转移组Stathmin在血清中浓度中位值为7.92 ng/mL, 显著高于ESCC未发生转移的中位值(5.94 ng/mL), 提示Stathmin的表达与食管癌的转移密切相关与文献报道一致. 本课题组前期研究也发现Stathmin在食管癌组织中表达强度显著高于癌旁组织, 临床病理参数分析显示Stathmin表达与分化程度相关, 在低分化程度的组织中表达较强, 高分化组织中表达较弱[6]. 本研究中血清学的Stathmin检测未见其与肿瘤分化的相关性, 但与淋巴结转移显著相关. 吴彬等[21]对470例食管癌患者进行回顾性分析显示随着细胞分化程度的降低, 区域淋巴结转移数显著增高(P<0.01), 与高分化食管癌相比中分化癌淋巴结转移度增加3倍, 中低分化癌增加4.5倍, 低分化癌增加6倍, 提示食管癌分化程度越低, 发生淋巴结转移的可能性越高. 而本研究的Stathmin与淋巴结转移显著相关, 与前期研究的Stathmin在低分化程度的食管癌组织中表达高具有一致性, 进一步说明Stathmin与食管癌的转移密切相关.
目前食管癌缺乏特异诊断标志物, 我院检测食管癌相关标志物为CEA、CA19-9、CA72-4和Cyfra21-1等常规肿瘤标志物. CEA是一种具有人类胚胎抗原特异性的酸性糖蛋白, 主要作为监测结、直肠癌标志物, 最新研究其在肺腺癌诊断中也有显著作用[22]. CA19-9是来自结直肠癌细胞系的单抗, 在消化系恶性肿瘤中和胰腺癌中有良好的应用价值, CA72-4对于胃癌的检测特异性较高. Chen等[23]研究发现将CA19-9与CA72-4联合使用对中国人群的胃癌检测具有更好的效果. 提示CEA、CA19-9和CA72-4都不是食管癌特异性标志物. Cyfra21-1是一种上皮来源的抗原, 作为肺癌标志物被广泛应用. 研究发现其在食管癌中也发挥一定作用, Wakatsuki等[24]检测51例食管癌患者放疗前后血清Cyfra21-1含量, 化疗后Cyfra21-1浓度低于临界值的患者不易复发, 结果显示血清Cyfra21-1具有评估和监测放疗效果的作用; Yi等[25,26]研究提示血清中Cyfra21-1的浓度可以作为预测食管癌放化疗效果的敏感性指标; Yan等[27]对192例食管癌患者血清Cyfra21-1的检测发现血清Cyfra21-1浓度低的患者在接受放化疗后具有更高的存活率. 本研究发现血清Stathmin水平在食管癌中表达显著升高, 其灵敏度和特异性分别达到94.6%和97.5%, 显著高于Cyfra21-1、CEA、CA72-4、CA19-9等标志物. Stathmin与Cyfra21-1联合检测与Stathmin单项检测相比, 其联合检测的灵敏度未见提高. 说明Stathmin可成为辅助食管癌诊断的重要血清学指标.
总之, 食管癌患者血清Stathmin水平升高, 与肿瘤转移代表肿瘤恶性生物学行为的因素相关, 可作为一种食管癌特异的肿瘤标志物用于早期诊断、转移和复发监测. 同时充分认识到上述结果仍有待于进一步扩大样本和多中心验证. 今后进一步检测高危人群的Stathmin的水平, 同时联合腔镜和食管拉网筛查、诊断和判断预后具有重要的意义.
食管鳞癌是我国常见的消化系恶性肿瘤, 其早期症状不明显, 大部分食管癌患者确诊时已属中晚期, 以手术为主治疗后的五年生存率一直徘徊在25%-30%. 近年已有众多研究者正在努力寻找食管癌的各种标志物以用于食管癌的诊断、治疗效果评价和术后随访.
姜春萌, 教授, 主任, 大连医科大学附属第二医院消化科
Stathmin在多种肿瘤中表达异常, 目前发现, 食管鳞状细胞癌患者组织中Stathmin表达显著高于癌旁组织, 临床病理参数分析显示Stathmin表达与分化程度相关. 但Stathmin在食管癌患者血清水平及与临床参数的相关性尚无深入研究.
以往研究发现Stathmin在多种恶性肿瘤中升高, 可作为恶性肿瘤诊断、治疗和判断预后一个新参数.
本研究采用ELISA方法研究食管癌患者血清中Stathmin表达水平, 分析血清Stathmin水平与食管癌各临床病理参数的关系, 发现食管鳞癌患者血清Stathmin显著高于健康人, 且Stathmin检测灵敏度显著优于目前已有食管癌肿瘤标志物, 提示Stathmin可作为一种食管癌潜在的肿瘤标志物.
食管癌患者血清Stathmin水平较正常人明显升高, 且与肿瘤的生长、侵袭和转移等肿瘤恶性生物学行为相关, 因此, 通过检测食管癌患者血清中的Stathmin水平, 可有助于食管癌的诊断、判断预后及术后随访.
论文研究内容较新, 具有临床潜在应用前景, 具有转化医学价值.
编辑 郭鹏 电编 鲁亚静
| 1. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-249. [PubMed] [DOI] |
| 2. | Lin DC, Du XL, Wang MR. Protein alterations in ESCC and clinical implications: a review. Dis Esophagus. 2009;22:9-20. [PubMed] [DOI] |
| 3. | Shimada Y, Watanabe G, Kawamura J, Soma T, Okabe M, Ito T, Inoue H, Kondo M, Mori Y, Tanaka E. Clinical significance of osteopontin in esophageal squamous cell carcinoma: comparison with common tumor markers. Oncology. 2005;68:285-292. [PubMed] [DOI] |
| 4. | Wang XB, Jiang XR, Yu XY, Wang L, He S, Feng FY, Guo LP, Jiang W, Lu SH. Macrophage inhibitory factor 1 acts as a potential biomarker in patients with esophageal squamous cell carcinoma and is a target for antibody-based therapy. Cancer Sci. 2014;105:176-185. [PubMed] [DOI] |
| 5. | Brockmann JG, St Nottberg H, Glodny B, Heinecke A, Senninger NJ. CYFRA 21-1 serum analysis in patients with esophageal cancer. Clin Cancer Res. 2000;6:4249-4252. [PubMed] |
| 6. | Liu F, Sun YL, Xu Y, Liu F, Wang LS, Zhao XH. Expression and phosphorylation of stathmin correlate with cell migration in esophageal squamous cell carcinoma. Oncol Rep. 2013;29:419-424. [PubMed] [DOI] |
| 7. | Belletti B, Baldassarre G. Stathmin: a protein with many tasks. New biomarker and potential target in cancer. Expert Opin Ther Targets. 2011;15:1249-1266. [PubMed] [DOI] |
| 8. | NCCN Guidelines(R) Updates. J Natl Compr Canc Netw. 2013;11:xxxii-xxxvi. [PubMed] |
| 9. | Cassimeris L. The oncoprotein 18/stathmin family of microtubule destabilizers. Curr Opin Cell Biol. 2002;14:18-24. [PubMed] |
| 10. | Charbaut E, Curmi PA, Ozon S, Lachkar S, Redeker V, Sobel A. Stathmin family proteins display specific molecular and tubulin binding properties. J Biol Chem. 2001;276:16146-16154. [PubMed] [DOI] |
| 11. | Ringhoff DN, Cassimeris L. Stathmin regulates centrosomal nucleation of microtubules and tubulin dimer/polymer partitioning. Mol Biol Cell. 2009;20:3451-3458. [PubMed] [DOI] |
| 12. | Nemunaitis J. Stathmin 1: a protein with many tasks. New biomarker and potential target in cancer. Expert Opin Ther Targets. 2012;16:631-634. [PubMed] [DOI] |
| 13. | Ying L, Su D, Zhu J, Ma S, Katsaros D, Yu H. Genotyping of stathmin and its association with clinical factors and survival in patients with ovarian cancer. Oncol Lett. 2013;5:1315-1320. [PubMed] [DOI] |
| 15. | Yousefi Z, Sarvari J, Nakamura K, Kuramitsu Y, Ghaderi A, Mojtahedi Z. Secretomic analysis of large cell lung cancer cell lines using two-dimensional gel electrophoresis coupled to mass spectrometry. Folia Histochem Cytobiol. 2012;50:368-374. [PubMed] [DOI] |
| 16. | Bhagirath D, Abrol N, Khan R, Sharma M, Seth A, Sharma A. Expression of CD147, BIGH3 and Stathmin and their potential role as diagnostic marker in patients with urothelial carcinoma of the bladder. Clin Chim Acta. 2012;413:1641-1646. [PubMed] [DOI] |
| 17. | Jin K, Mao XO, Cottrell B, Schilling B, Xie L, Row RH, Sun Y, Peel A, Childs J, Gendeh G. Proteomic and immunochemical characterization of a role for stathmin in adult neurogenesis. FASEB J. 2004;18:287-299. [PubMed] [DOI] |
| 18. | Borghese L, Fletcher G, Mathieu J, Atzberger A, Eades WC, Cagan RL, Rørth P. Systematic analysis of the transcriptional switch inducing migration of border cells. Dev Cell. 2006;10:497-508. [PubMed] [DOI] |
| 19. | Gan L, Guo K, Li Y, Kang X, Sun L, Shu H, Liu Y. Up-regulated expression of stathmin may be associated with hepatocarcinogenesis. Oncol Rep. 2010;23:1037-1043. [PubMed] |
| 20. | Trovik J, Wik E, Stefansson IM, Marcickiewicz J, Tingulstad S, Staff AC, Njolstad TS, Vandenput I, Amant F, Akslen LA. Stathmin overexpression identifies high-risk patients and lymph node metastasis in endometrial cancer. Clin Cancer Res. 2011;17:3368-3377. [PubMed] [DOI] |
| 22. | Yamao T, Kai S, Kazami A, Koizumi K, Handa T, Takemoto N, Maruyama M. Tumor markers CEA, CA19-9 and CA125 in monitoring of response to systemic chemotherapy in patients with advanced gastric cancer. Jpn J Clin Oncol. 1999;29:550-555. [PubMed] |
| 23. | Chen XZ, Zhang WK, Yang K, Wang LL, Liu J, Wang L, Hu JK, Zhang B, Chen ZX, Chen JP. Correlation between serum CA724 and gastric cancer: multiple analyses based on Chinese population. Mol Biol Rep. 2012;39:9031-9039. [PubMed] [DOI] |
| 24. | Wakatsuki M, Suzuki Y, Nakamoto S, Ohno T, Ishikawa H, Kiyohara H, Kiyozuka M, Shirai K, Nakayama Y, Nakano T. Clinical usefulness of CYFRA 21-1 for esophageal squamous cell carcinoma in radiation therapy. J Gastroenterol Hepatol. 2007;22:715-719. [PubMed] [DOI] |
| 25. | Yi Y, Li B, Wang Z, Sun H, Gong H, Zhang Z. CYFRA21-1 and CEA are useful markers for predicting the sensitivity to chemoradiotherapy of esophageal squamous cell carcinoma. Biomarkers. 2009;14:480-485. [PubMed] [DOI] |
| 26. | Yi Y, Li B, Sun H, Zhang Z, Gong H, Li H, Huang W, Wang Z. Predictors of sensitivity to chemoradiotherapy of esophageal squamous cell carcinoma. Tumour Biol. 2010;31:333-340. [PubMed] [DOI] |
| 27. | Yan HJ, Wang RB, Zhu KL, Jiang SM, Zhao W, Xu XQ, Feng R. Cytokeratin 19 fragment antigen 21-1 as an independent predictor for definitive chemoradiotherapy sensitivity in esophageal squamous cell carcinoma. Chin Med J (Engl). 2012;125:1410-1415. [PubMed] |