修回日期: 2014-04-02
接受日期: 2014-04-09
在线出版日期: 2014-05-18
目的: 探讨不同比例ω-3/ω-6多不饱和脂肪酸对葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导大鼠急性结肠炎影响及其可能的作用机制.
方法: 32只1月龄♂SD大鼠随机分为4组, 每组8只, A: 普通饲料对照组, B: ω-3/ω-6 PUFA 1:1组、C: ω-3/ω-6 PUFA 1:3组, D: ω-3/ω-6 PUFA 1:30组. 4组大鼠不同饲料喂养6 wk; 随后B、C、D组大鼠自由饮用3%DSS溶液7 d, 诱发急性结肠炎模型; A组大鼠自由引用普通水7 d. 比较各组大鼠结肠炎症状评分、病理炎症评分和结肠组织前列腺素E2(prostaglandin E2, PGE2)、核因子-κB(nuclear factor-κB, NF-κB)、肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、血清白介素-6(interleukin- 6, IL-6)的含量.
结果: B组大鼠结肠炎症程度积分显著低于C、D组, 分别为2.8±1.2、4.3±1.1、5.6±1.3(P<0.05, P<0.01). B组大鼠结肠炎病理学评分显著低于C、D组, 分别为3.2±2.0、35.0±28. 8、27.0±25.8(P<0.01, P<0.01). B、C组大鼠结肠组织中PGE2含量低于D组, 分别为443.4ng/100g组织±67.3 ng/100g组织、419.5 ng/100g组织±52.6 ng/100 g组织、541.2±68.5(ng/100 g组织)(P<0.05, P<0.01). B、C组大鼠结肠组织中TNF-α含量低于D组, 分别为189.2 ng/100g组织±27.0 ng/100 g组织、173.2 ng/100g组织±50.2 ng/100 g组织、270.3 ng/100g组织±49.1 ng/100 g组织(P<0.01, P<0.01). B组大鼠血清中IL-6含量低于C、D组, 分别为97.1 ng/L±8.2 ng/L、129.1 ng/L±5.5 ng/L、125.4 ng/L±19.6 ng/L(P<0.01, P<0.05). B、C、D大鼠结肠组织中NF-κB含量分别为497.9 ng/100 g组织±50.7 ng/100 g组织、569.1 ng/100 g组织±121.2 ng/100 g组织、582.5 ng/100 g组织±123.1 ng/100 g组织, 无统计学差异.
结论: 提高以ω-3/ω-6 PUFA的比例对于DSS诱导的大鼠急性结肠炎症具有保护作用, 尤其是当ω-3/ω-6 PUFA比例提高到1:1保护作用最明显. 随着ω-3 PUFA的比例升高, ω-3/ω-6 PUFA1:1组较ω-3/ω-6 PUFA1:30组大鼠的炎症评分、病理评分以及相关的炎症因子如PGE2、TNF-a、IL-6都有所下降. 向饮食中添加适量ω-6 PUFA或可成为治疗炎症性肠病新方向.
核心提示: 提高ω-3/ω-6 PUFA的比例对于葡聚糖硫酸钠(dextran sulfate sodium)诱导的大鼠急性结肠炎症可能具有保护作用, 提高膳食中ω-3 PUFA的比例可能成为炎症性肠病(inflammatory bowel disease)新的治疗手段.
引文著录: 田玉玲, 王化虹, 田雨, 张维, 滕贵根, 何群. 不同比例ω-3/ω-6多不饱和脂肪酸对DSS诱导大鼠急性结肠炎的影响. 世界华人消化杂志 2014; 22(14): 2008-2015
Revised: April 2, 2014
Accepted: April 9, 2014
Published online: May 18, 2014
AIM: To investigate the effect of different ratios of ω-3/ω-6 of polyunsaturated fatty acids (PUFAs) on acute colitis induced with dextran sulfate sodium (DSS) in rats and explore the possible mechanisms.
METHODS: Thirty-two male SD rats were randomly divided into four groups (n = 8 for each): A (control), B (ω-3/ω-6, 1:1), C (ω-3/ω-6, 1:3) and D (ω-3/ω-6, 1:30). After six weeks of feeding with different diets, acute colitis in rats in groups B, C and D were induced by giving 3% DSS in drinking water for seven days. Then all the rats were sacrificed. Overall inflammatory severity score and histological damage score were calculated. The levels of prostaglandin E2 (PGE2), tumor necrosis factor-α (TNF-a), nuclear transcription factor kappa B (NF-kB) in the colon, and the level of interleukin-6 (IL-6) in serum were measured by ELISA.
RESULTS: The overall inflammatory severity score in group B was significantly lower than those in groups C and D (2.8 ± 1.2 vs 4.3 ± 1.1, 5.6 ± 1.3, P < 0.05, P < 0.01). The histological damage score in group B was also significantly lower than those in groups C and D (3.2 ± 2.0 vs 35.0 ± 28.8, 27.0 ± 25.8, P < 0.01 for both). The levels of PGE2 and TNF-a in the colon were significantly lower in groups B and C than in group D [443.4 ± 67.3 (ng/100 g tissue), 419.5 ± 52.6 (ng/100 g tissue) vs 541.2 ± 68.5 (ng/100 g tissue), P < 0.05, P < 0.01; 189.2 ± 27.0 (ng/100 g tissue), 173.2 ± 50.2 (ng/100 g tissue) vs 270.3 ± 49.1 (ng/100 g tissue), P < 0.01 for both). The level of IL-6 in serum was significantly lower in group B than in groups C and D (97.1 ng/L ± 8.2 ng/L vs 129.1 ng/L ± 5.5 ng/L, 125.4 ng/L ± 19.6 ng/L, P < 0.01, P < 0.05). There were no statistical differences in the level of nuclear NF-kB between groups B, C and D [497.9 ± 50.7 (ng/100 g tissue), 569.1 ± 121.2 (ng/100 g tissue), 582.5 ± 123.1 (ng/100 g tissue)].
CONCLUSION: Higher ratios of ω-3/ω-6 PUFAs have a more significant protective effect against acute colitis, especially when the ratio is 1:1. The overall inflammatory severity score, histological damage score, the levels of PGE2 and TNF-a in colon and the level of IL-6 in serum are significantly lower in the 1:1 (ω-3/ω-6) group than in the 1:30 group. Adding moderate amount of ω-3 PUFA may be a new way to treat IBD.
- Citation: Tian YL, Wang HH, Tian Y, Zhang W, Teng GG, He Q. Effects of different ratios of ω-3/ω-6 polyunsaturated fatty acids on experimental acute colitis in rats. Shijie Huaren Xiaohua Zazhi 2014; 22(14): 2008-2015
- URL: https://www.wjgnet.com/1009-3079/full/v22/i14/2008.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i14.2008
大规模流行病学调查发现西方经济发达国家炎症性肠病(inflammatory bowel disease, IBD)的发病率明显高于经济欠发达国家[1,2]. 近年来IBD在世界范围内区域性发病率的增高与"西方化饮食"的传播相平行的现象提示, 该病的发病可能和饮食结构变化相关[2]. 观察饮食中脂肪成分明显变化, 即随着植物油脂的摄入增加多不饱和脂肪酸(polyunsaturated fatty acid, PUFA)的构成发生了明显的改变. ω-3 PUFA与ω-6 PUFA的摄入比例从70年代的1:1变为90年代的大约1:15-1:20[3,4]. 2009年欧洲一项大型前瞻性调查发现, 摄入高含量ω-6 PUFA和溃疡性结肠炎的发病具有相关性[5]. 虽然针对ω-3 PUFA对炎症性肠病的作用开展了许多研究, 但目前尚无定论. Cabre等[6]一项关于ω-3 PUFA和炎症性肠病系统综述得出结论: 目前的相关研究数据不能为ω-3 PUFA对于活动性或非活性炎症性肠病患者有益提供肯定性依据. 究其原因可能和目前大多数研究没有调整ω-3 PUFA和ω-6 PUFA比例相关. 而且目前大多数研究主要是关于多不饱和脂肪酸和慢性结肠炎症的关系, 对于其对急性炎症研究甚少. 目前ω-3 PUFA与ω-6 PUFA比例失衡导致的肠道炎症免疫反应的变化机制还存在很多未知领域. 深入研究相关方面的机制有利于我们对炎症性肠病肠道急性炎症发生机制的理解, 也有利于对患者进行合理的健康指导.
♂SPF级SD大鼠32只, 4周龄, 体质量95-117 g. 动物于北京大学第一医院动物中心SPF级实验室饲养, 昼夜节律12 h/12 h. 购入后供应正常饲料和饮水饲养4 d, 习惯环境后进行实验. 本研究经北京大学第一医院实验动物福利伦理委员会审查通过. 葡聚糖硫酸钠(dextran sulfate sodium, DSS)36000-50000购自北京毕特博生物科技有限公司. 前列腺素E2(prostaglandin E2, PGE2)、核因子-κB(nuclear factor-κB, NF-κB)、肿瘤坏死因子-a(tumor necrosis factor a, TNF-a)、血清白介素-6(interleukin- 6, IL-6)酶联免疫检测试剂盒购自北京方程生物公司.
1.2.1 饲料改造: 基础饲料中总油脂含量约4%-5%, 其中ω-3 PUFA含量约1.5 g/kg, ω-6 PUFA含量约23.5 g/kg, ω-3/ω-6 PUFA比例为1:15. 向基础纯饲料按比例添加鱼油和亚麻油改造饲料, 3种改造后的饲料总油脂含量均增至约5%-10%. 其中鱼油购自海洋恒昌集团每1 g含DHA和EPA 210 mg. 亚油酸购自安庆市中创生物工程有限公司, 纯度为95%.
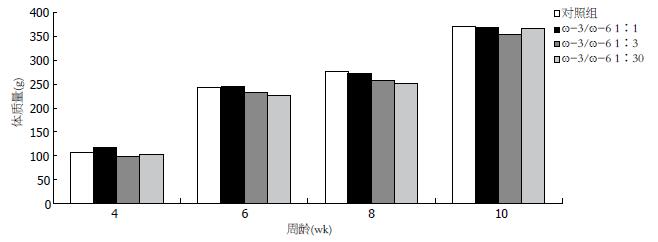
1.2.2 大鼠实验分组及结肠炎模型建立: 第一阶段(诱发结肠炎前期), 32只大鼠随机分为A、B、C、D 4组, 每组8只. B、C、D组分别给予ω-3/ω-6 PUFA为1:1、1:3及1:30的改造饲料进行饲养; A组给予普通饲料饲养, 共喂养6 wk, 其他饲养条件均相同. 每周称量各组大鼠体质量, 记录大便、一般情况. 第二阶段(诱发结肠炎期), B、C、D组大鼠给予3%DSS做自由饮用诱发结肠炎. DSS诱发大鼠结肠炎参考文献[7,8]具体方案: 3%DSS水溶液给大鼠自由饮用7 d, 制造急性期结肠炎动物模型. A组大鼠自由引用普通用水7 d.
1.2.3 实验动物处理及相关指标测定: 各组实验大鼠于急性结肠炎造模结束后(对照组亦在同时)12%乌拉坦过量麻醉处死. 解剖分离出全部结肠, 自肛门至盲肠测量长度后, 沿肠系膜缘剪开肠管, 生理盐水清洗去除肠腔内容物, 采取标本. 结肠炎症症状评分, 根据参考文献[7,8]按表1从3方面评价, 以总分计算. 结肠炎组织学评分按表2进行, 用炎症、病变深度、隐窝破坏、病变范围评分的乘积表示[9]. 距肛门4 cm处取结肠组织, 迅速置于液氮中冷冻, -80℃保存. 剪出1.0 cm×0.5 cm大小的结肠组织, 称质量标本后按照检测试剂盒说明书进行检测结肠组织中PGE2、TNF-a、NF-kB. 迅速经大鼠腹主动脉取血, 按照检测试剂盒说明书进行检测血清中IL-6.
| 评分 | 粪便性状 | 便血情况 | 体质量 |
| 0 | 干球或干条形 | 便潜血试验阴性 | 增加或维持原有体质量 |
| 1 | 成型软便 | 便潜血试验阳性 | 下降<5% |
| 2 | 不成形软便 | 附着新鲜血迹, 肛门口无血迹 | 下降≥5%且<10% |
| 3 | 水样便 | 肛门口大量血迹 | 下降≥10% |
| 评分 | 炎症 | 病变深度 | 隐窝破坏 | 病变范围(%) |
| 0 | 无 | 无 | 无 | 无 |
| 1 | 轻 | 黏膜下层 | 基底1/3破坏 | 1-25 |
| 2 | 重 | 肌层 | 基底2/3破坏 | 26-50 |
| 3 | 浆膜层 | 仅有完整上皮 | 51-75 | |
| 4 | 全部破坏 | 76-100 |
统计学处理 采用SPSS17.0统计软件, 计量资料以mean±SD表示, 组间比较采用单因素方差分析, P<0.05为差异有统计学意义.
3组大鼠自由饮用3%DSS诱发结肠炎, 饮用第2天大便开始变软, 第3天大便潜血出现阳性, 第4天开始出现懒动、竖毛、毛色变差. 至第5天出现可见血便, 肛门附着血迹, 第6天体质量开始下降. 结肠炎造模结束时B组大鼠较C、D大鼠血便评分显著性降低, 分别为1.0±0. 5、 2.4±0. 7、 2.8±0.5(均P<0.01); C组和D组之间无统计学差异; B组大鼠较C、D大鼠总积分显著性降低, 分别为2.8±1.2、4.3±1.1、5.6±1.3(均P<0.01), C组和D组之间无统计学差异(表3).
| 分组 | 体质量变化积分 | 粪质积分 | 血便积分 | 总积分 |
| B | 0.38±0.74 | 1.38±0.52 | 1.00±0.53 | 2.75±1.16 |
| C | 0.50±0.53 | 1.75±0.46 | 2.38±0.74 | 4.26±1.13 |
| D | 1.13±0.83 | 1.75±0.46 | 2.75±0.46 | 5.62±1.30 |
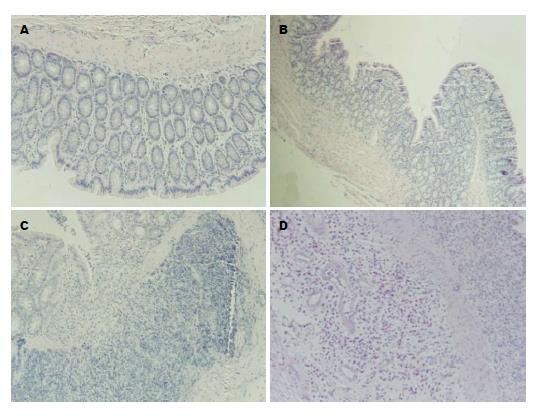
大体观察A组大鼠结肠黏膜光滑; B组大鼠肠壁轻度水肿, 黏膜糜烂及溃疡少见; C、D组大鼠结肠黏膜水肿明显, 可见较多糜烂, 部分可见深大溃疡, 结肠壁变薄. 光镜下观察A大鼠结肠完全正常; B、C、D组结肠炎模型大鼠不同程度远段肠上皮损伤, 可见糜烂及溃疡形成, 腺体变形, 排列紊乱, 甚至消失, 隐窝破坏, 黏膜及黏膜下层可见淋巴细胞、单核细胞、嗜酸性粒细胞浸润, 并可见中性粒细胞浸润及淋巴小结形成(图2A). 其中B组大鼠镜下观察病变较轻, 仅有1只大鼠形成小溃疡. B组大鼠肠黏膜炎症评分显著低于C、D组, 分别为3.2±2.0、35.0±28.8、27.0±25.8, 具有统计学差异(均P<0.05); C、D两组无统计学意义.
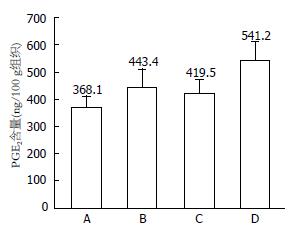
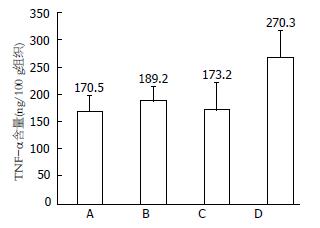
3组结肠炎模型大鼠结肠组织中PGE2较对照组均有升高, 其中B、C组大鼠结肠组织中PGE2含量低于D组, 分别为443.4 ng/100 g组织±67.3 ng/100 g组织、419.5 ng/100 g组织±52.6 ng/100 g组织、541.2 ng/100 g组织±68.5 ng/100 g组织(P<0.05, P<0.01)(图3, 表4). 3组结肠炎大鼠结肠TNF-α与对照组相比均有不同程度的升高, D组大鼠升高显著. B、C组大鼠结肠组织中TNF-α含量低于D组, 分别为189.2 ng/100 g组织±27.0 ng/100 g组织、173.2 ng/100 g组织±50.2 ng/100 g组织、270.3 ng/100 g组织±49.1 ng/100 g组织(P<0.01, P<0.01)(图4, 表4). B组大鼠血清中IL-6含量低于C、D组, 分别为97.1 ng/L±8.2 ng/L、129.1 ng/L±5.5 ng/L、125.4 ng/L±19.6 ng/L (P<0.01, P<0.05). 具有统计学差异. B、C、D大鼠结肠组织中NF-κB含量分别为497.9 ng/100 g组织±50.7 ng/100 g组织、569.1 ng/100 g组织±121.2 ng/100 g组织、582.5 ng/100 g组织±123.1 ng/100 g组织, 不具有统计学差异.
| A | B | C | D | P值 | |
| PGE2 | 368.1±43.9 | 443.4±67.3 | 419.5±52.6 | 541.2±68.5 | <0.01 |
| TNF-α | 170.5±29.5 | 189.2±27.0 | 173.2±50.2 | 270.3±49.1 | <0.01 |
| NF-κB | 555.1±83.8 | 497.9±50.7 | 569.1±121.2 | 582.5±123.1 | >0.05 |
IBD是一种慢性非特异性肠道炎症, 发病机制尚不明确. 近年来大规模研究发现"西方化"饮食的传播和炎症性病在以前非高发地区发病率升高有关系[10]. 有研究发现ω-3/ω-6 PUFA摄入比例的变化与IBD的发病有重要关系[11]. 还有研究发现与ω-3 PUFA和ω-6 PUFA的含量相比, 两者的比例更能影响肠道的炎症过程[12,13]. 针对IBD的营养治疗因为其不良反应低、花费相对低成为治疗新方向. 其中ω-3 PUFA又成为关键点之一. 目前针对ω-3 PUFA对IBD炎症过程的影响尚无定论. 大部分临床及试验研究认为补充ω-3 PUFA对于炎症性肠病具有保护作用[14,15]. 然而也有不少研究认为ω-3 PUFA对于炎症性肠病没有保护作用, 甚至有害[16,17]. 既往动物实验中少有调整ω-3/ω-6 PUFA比例, 而且大多针对慢性炎症. 本实验研究的目的就是设立不同比例ω-3和ω-6 PUFA, 观察各组对急性结肠炎模型大鼠的影响.
本实验通过改造饲料, 设定ω-3/ω-6 PUFA 1:1组、1:3组、1:30组, 观察不同比例ω-3 PUFA和ω-6 PUFA对急性结肠炎作用. Feagan等[17]认为ω-3/ω-6 PUFA在1:1至1:4对于炎症性疾病有益. 我们实验室曾对比ω-3/ω-6 PUFA 1:3, 1:15, 1:30组对于DSS诱导大鼠溃疡性结肠炎慢性期影响, 未发现ω-3/ω-6 PUFA 1:3对炎症有改善作用, 所以提高ω-3 PUFA剂量, 设立1:1组观察对肠道炎症影响.
从本研究结果可以明显看出ω-3/ω-6 PUFA为1:1组大鼠的结肠炎从症状评分到病理改变均较ω-3/ω-6 PUFA 1:3及1:30组大鼠有所改善, 提示高比例ω-3/ω-6对于溃疡性结肠炎急性期可能有保护作用, ω-3 PUFA的补充可以减轻肠道炎症, 适量补充ω-3 PUFA可能能够预防或者减轻肠道炎症, ω-3/ω-6 PUFA为1:1组作用效果明显.
通过对炎症因子的影响观察, 本实验发现ω-3/ω-6 PUFA为1:1组和1:3组大鼠结肠组织中PGE2、TNF-a含量明显低于1:30组(P<0.01), 结果提示提高ω-3/ω-6 PUFA的比例可以通过减少结肠组织中PGE2、TNF-a含量, 达到抑制急性结肠炎炎症过程. ω-3/ω-6 PUFA 1:1组大鼠血浆中IL-6含量低于其余两组, P值分别为<0.05、<0.01, 结果提示高比例ω-3/ω-6 PUFA可以通过影响循环中炎症因子如IL-6减轻炎症反应.
早期研究认为由Cox-1途径介导产生的前列腺素对于肠道黏膜损伤所致炎症具有保护作用[18], PGE2可以促进肝细胞生长[19], 抑制T细胞的增殖、细胞间黏附因子、细胞因子产生等[20,21]. 然而亦有研究表明PGE2可以通过促进T细胞分化、炎症因子受体表达等达到促炎作用[22,23]. 本研究发现ω-3/ω-6 PUFA高比例组(1:1, 1:3)大鼠结肠中PGE2含量较1:30组明显下降, 与炎症程度有平行趋势. 说明提高ω-3/ω-6 PUFA比例到1:1至1:3可以通过抑制局部组织中PGE2产生, 而达到抑制急性结肠炎的炎症过程. 这与Mbodji等[24]研究补充ω-3 PUFA可以减少肠道局部PGE2的产生的结果一致. 有研究表明ω-3 PUFA可以与ω-6 PUFA竞争性结合细胞膜磷脂, 从而抑制花生四烯酸进入细胞膜, 抑制花生四烯酸向类花生酸的代谢. 推测结肠上皮细胞膜上的ω-3/ω-6 PUFA比例变化改变了细胞膜的生物物理化学特性, 导致下游信号传导、细胞因子分泌和转录调解发生变化, 是影响炎症轻重程度的核心机制[28]. 目前ω-3 PUFA对于PGE2影响及其如何通过PGE2调节炎症过程的机制尚不明确, 需要进一步研究.
另外有研究认为ω-3 PUFA可以通过监控促炎因子如TNF-a、IL-6、IL-1a、IL-8以及参与NF-kB途径等抑制炎症的过程[6]. 本实验发现ω-3/ω-6 PUFA为1:1组和1:3组大鼠结肠组织中TNF-a含量明显低于1:30组. ω-3/ω-6 PUFA 1:1组大鼠血浆中IL-6含量低于其余两组目前对于ω-3 PUFA. 该结果表明提高ω-3 PUFA在饮食中的比例可以降低TNF-a、IL-6等促炎因子, 从而达到降低急性期溃疡性结肠炎炎症反应. 本实验发现各组大鼠结肠NF-kB的含量有随着ω-6 PUFA比例升高而升高的趋势, 但没有统计学差异. 有研究报道ω-3可以通过降低NF-kB而起到抗炎作用[6,13,24,27,28]. 文献报道多通过电泳迁移率改变法测定NF-kB活性, 本实验采用ELISA检测, 有可能影响结果.
从本研究可以看出, 提高ω-3/ω-6 PUFA的比例对于DSS诱导的大鼠急性结肠炎症具有保护作用, 大鼠的炎症评分、病理评分以及相关的炎症因子PGE2、TNF-a、IL-6都有所下降, 其中ω-3/ω-6 PUFA 1:1组效果最佳. 提示我们对于炎症性肠病治疗过程中, 提高膳食中ω-3 PUFA的比例可能成为新的治疗手段. 但该实验仍然有待于进一步研究: (1)该试验设立的模型是急性结肠炎, 并没有模拟炎症性典型慢性、反复发作的临床过程, 这可能影响ω-3 PUFA对于IBD的疗效更加明确的影响. 进一步研究应该设置慢性期溃疡性结肠炎, 以观察疗效; (2)ω-3 PUFA对于肠道炎症过程作用机制尚不明确, 是如何调节PGE2、IL等炎症因子需要进一步探讨. ω-3 PUFA作为一种重要的营养物质, 不良反应少, 相对于传统药物花费低, 应该加强其对IBD的作用及其作用机制的研究, 为IBD患者的治疗提供一种新选择.
炎症性肠病(inflammatory bowel disease, IBD)是一种慢性非特异性肠道炎症, 发病机制尚不明确. 近年来大规模研究发现"西方化"饮食的传播和炎症性病在以前非高发地区发病率升高有关系. 有研究发现ω-3/ω-6多不饱和脂肪酸(polyunsaturated fatty acid, PUFA)摄入比例的变化与IBD的发病有重要关系.还有研究发现与ω-3PUFA和ω-6 PUFA的含量相比, 两者的比例更能影响肠道的炎症过程.
江学良, 教授, 主任医师, 中国人民解放军济南军区总医院消化科; 杨柏霖, 副主任医师, 南京中医药大学附属医院; 张庆瑜, 教授, 主任医师, 天津医科大学总医院科研处
目前ω-3 PUFA与ω-6 PUFA比例失衡导致的肠道炎症免疫反应的变化机制还存在很多未知领域. 深入研究相关方面的机制有利于我们对炎症性肠病肠道急性炎症发生机制的理解, 也有利于对患者进行合理的健康指导.
研究发现ω-3/ω-6 PUFA摄入比例的变化与IBD的发病有重要关系, 又有研究认为ω-3 PUFA可以通过监控促炎因子如肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、血清白介素-6(interleukin-6, IL-6)、IL-1a、IL-8以及参与核因子-κB(nuclear factor-κB, NF-κB)途径等抑制炎症的过程. 目前针对w-3 PUFA对IBD炎症过程的影响尚无定论. 大部分临床及试验研究认为补充w-3 PUFA对于炎症性肠病具有保护作用. 然而也有不少研究认为w-3 PUFA对于炎症性肠病没有保护作用.
本研究可以看出, 提高ω-3/ω-6 PUFA的比例对于DSS诱导的大鼠急性结肠炎症具有保护作用, 其中ω-3/ω-6 PUFA 1:1组效果最佳. 提示我们对于炎症性肠病治疗过程中, 提高膳食中ω-3 PUFA的比例可能成为新的治疗手段.
本文对阐明溃疡性结肠炎发病机制有一定意义, 并且对临床营养治疗也有一定启示.
编辑 田滢 电编 鲁亚静
| 1. | Cosnes J, Gower-Rousseau C, Seksik P, Cortot A. Epidemiology and natural history of inflammatory bowel diseases. Gastroenterology. 2011;140:1785-1794. [PubMed] [DOI] |
| 2. | Bernstein CN. New insights into IBD epidemiology: Are there any lessons for treatment? Dig Dis. 2010;28:406-410. [PubMed] [DOI] |
| 3. | Eaton SB, Konner M. Paleolithic nutrition. A consideration of its nature and current implications. N Engl J Med. 1985;312:283-289. [PubMed] [DOI] |
| 4. | Eaton SB, Eaton SB, Sinclair AJ, Cordain L, Mann NJ. Dietary intake of long-chain polyunsaturated fatty acids during the paleolithic. World Rev Nutr Diet. 1998;83:12-23. [PubMed] [DOI] |
| 5. | Tjonneland A, Overvad K, Bergmann MM, Nagel G, Linseisen J, Hallmans G, Palmqvist R, Sjodin H, Hagglund G, Berglund G. Linoleic acid, a dietary n-6 polyunsaturated fatty acid, and the aetiology of ulcerative colitis: a nested case-control study within a European prospective cohort study. Gut. 2009;58:1606-1611. [PubMed] [DOI] |
| 6. | Cabré E, Mañosa M, Gassull MA. Omega-3 fatty acids and inflammatory bowel diseases - a systematic review. Br J Nutr. 2012;107 Suppl 2:S240-S252. [PubMed] [DOI] |
| 7. | Kwon HS, Oh SM, Kim JK. Glabridin, a functional compound of liquorice, attenuates colonic inflammation in mice with dextran sulphate sodium-induced colitis. Clin Exp Immunol. 2008;151:165-173. [PubMed] [DOI] |
| 8. | Gaudio E, Taddei G, Vetuschi A, Sferra R, Frieri G, Ricciardi G, Caprilli R. Dextran sulfate sodium (DSS) colitis in rats: clinical, structural, and ultrastructural aspects. Dig Dis Sci. 1999;44:1458-1475. [PubMed] |
| 9. | Dieleman LA, Palmen MJ, Akol H, Bloemena E, Peña AS, Meuwissen SG, Van Rees EP. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines. Clin Exp Immunol. 1998;114:385-391. [PubMed] |
| 10. | Hou JK, Abraham B, El-Serag H. Dietary intake and risk of developing inflammatory bowel disease: a systematic review of the literature. Am J Gastroenterol. 2011;106:563-573. [PubMed] [DOI] |
| 11. | Andersen V, Olsen A, Carbonnel F, Tjønneland A, Vogel U. Diet and risk of inflammatory bowel disease. Dig Liver Dis. 2012;44:185-194. [PubMed] [DOI] |
| 12. | Simopoulos AP. Evolutionary aspects of diet, the omega-6/omega-3 ratio and genetic variation: nutritional implications for chronic diseases. Biomed Pharmacother. 2006;60:502-507. [PubMed] [DOI] |
| 13. | Gravaghi C, La Perle KM, Ogrodwski P, Kang JX, Quimby F, Lipkin M, Lamprecht SA. Cox-2 expression, PGE(2) and cytokines production are inhibited by endogenously synthesized n-3 PUFAs in inflamed colon of fat-1 mice. J Nutr Biochem. 2011;22:360-365. [PubMed] [DOI] |
| 14. | Kono H, Fujii H, Ogiku M, Tsuchiya M, Ishii K, Hara M. Enteral diets enriched with medium-chain triglycerides and N-3 fatty acids prevent chemically induced experimental colitis in rats. Transl Res. 2010;156:282-291. [PubMed] [DOI] |
| 15. | Bogolepov NN, Pushkin AS. [Structural basis of cerebral plasticity]. Vestn Akad Med Nauk SSSR. 1978;21-29. [PubMed] |
| 16. | Middleton SJ, Naylor S, Woolner J, Hunter JO. A double-blind, randomized, placebo-controlled trial of essential fatty acid supplementation in the maintenance of remission of ulcerative colitis. Aliment Pharmacol Ther. 2002;16:1131-1135. [PubMed] |
| 17. | Feagan BG, Sandborn WJ, Mittmann U, Bar-Meir S, D'Haens G, Bradette M, Cohen A, Dallaire C, Ponich TP, McDonald JW. Omega-3 free fatty acids for the maintenance of remission in Crohn disease: the EPIC Randomized Controlled Trials. JAMA. 2008;299:1690-1697. [PubMed] [DOI] |
| 18. | Wang D, Mann JR, DuBois RN. The role of prostaglandins and other eicosanoids in the gastrointestinal tract. Gastroenterology. 2005;128:1445-1461. [PubMed] |
| 19. | Kimura M, Osumi S, Ogihara M. Stimulation of DNA synthesis and proliferation by prostaglandins in primary cultures of adult rat hepatocytes. Eur J Pharmacol. 2000;404:259-271. [PubMed] |
| 20. | Ruggeri P, Nicocia G, Venza I, Venza M, Valenti A, Teti D. Polyamine metabolism in prostaglandin E2-treated human T lymphocytes. Immunopharmacol Immunotoxicol. 2000;22:117-129. [PubMed] [DOI] |
| 21. | Harris SG, Padilla J, Koumas L, Ray D, Phipps RP. Prostaglandins as modulators of immunity. Trends Immunol. 2002;23:144-150. [PubMed] |
| 22. | Bonta IL, Parnham MJ. Prostaglandins and chronic inflammation. Biochem Pharmacol. 1978;27:1611-1623. [PubMed] |
| 23. | Napolitani G, Acosta-Rodriguez EV, Lanzavecchia A, Sallusto F. Prostaglandin E2 enhances Th17 responses via modulation of IL-17 and IFN-gamma production by memory CD4+ T cells. Eur J Immunol. 2009;39:1301-1312. [PubMed] [DOI] |
| 24. | Mbodji K, Charpentier C, Guérin C, Querec C, Bole-Feysot C, Aziz M, Savoye G, Déchelotte P, Marion-Letellier R. Adjunct therapy of n-3 fatty acids to 5-ASA ameliorates inflammatory score and decreases NF-κB in rats with TNBS-induced colitis. J Nutr Biochem. 2013;24:700-705. [PubMed] |
| 25. | Melgar S, Drmotova M, Rehnström E, Jansson L, Michaëlsson E. Local production of chemokines and prostaglandin E2 in the acute, chronic and recovery phase of murine experimental colitis. Cytokine. 2006;35:275-283. [PubMed] [DOI] |
| 26. | Calder PC. Polyunsaturated fatty acids, inflammatory processes and inflammatory bowel diseases. Mol Nutr Food Res. 2008;52:885-897. [PubMed] [DOI] |